Interciencia
versión impresa ISSN 0378-1844
INCI v.31 n.4 Caracas abr. 2006
PROPUESTA PARA LA FORMULACIÓN DE SOLUCIONES NUTRITIVAS EN ESTUDIOS DE NUTRICIÓN VEGETAL
Ma. De Jesús Juárez Hernández, Gustavo A. Baca Castillo, Lorenzo A. Aceves Navarro, Prometeo Sánchez García, Juan Luis Tirado Torres, Jaime Sahagún Castellanos y María Teresa Colinas De León
Ma. de Jesús Juárez Hernández. Ingeniero Agrónomo, Universidad Autónoma de Chapingo (UACh), México. M.Cs. y Candidato a D.Cs. en Edafología, CPM, México. Dirección: Departamento de Fitotecnia, Universidad Autónoma Chapingo. Km 38.5, Carretera México-Texcoco, CP 56230, Chapingo, Texcoco, México. e-mail: juarezhma@yahoo.com.mx
Gustavo A. Baca Castillo. Ingeniero Agrónomo, Escuela Nacional de Agricultura (ENA), Chapingo, México. M.Cs. y D.Cs., CPM, México. Profesor, Investigador, Instituto de Recursos Naturales (IRENAT-CPM), México.
Lorenzo A. Aceves Navarro. Ingeniero Agrónomo, ENA, Chapingo, México. M.Sc. y Ph.D., University of Nebraska, EEUU. Profesor, Investigador, IRENAT-CPM, México. e-mail: laceves@colpos.mx
Prometeo Sánchez García. Ph.D., Universidad Michoacana de San Nicolás de Hidalgo, Uruapan Michoacán, México. M.Cs. y Doctorado, Universidad Rusa de la Amistad de los Pueblos, Moscú, URSS. Profesor Investigador, IRENAT-CPM, México.
Juan Luis Tirado Torres. Ingeniero Agrónomo, ENA, Chapingo, México. M.Cs. en Edafología, Colegio de Postgraduados de Chapingo, México. Docteur D'Etat, Université de Sciences et Techniques de Languedoc, Montpellier, Francia. Profesor Investigador, IRENAT-CPM, México.
Jaime Sahagún Castellanos. Ingeniero Agrónomo, ENA, Chapingo, México. M.Cs. en Estadística, CPM, México. Ph.D. en Fitomejoramiento y Citogenética, Iowa State University, EEUU. Profesor Investigador, UACh, México. e-mail: jsahagun@taurus1.chapingo.mx
María Teresa Colinas De León. Licenciada en Biología, Universidad Nacional Autónoma de México. M.Cs. En Botánica, CPM, México. Ph.D. en Botánica, University of California, Riverside, EEUU. Profesor Investigador, UACh, México. e-mail: mtcolina@taurus1.chapingo.mx
Resumen
Para evaluar el efecto de uno o más nutrientes de las soluciones nutritivas en el crecimiento, desarrollo, rendimiento, calidad del producto y absorción de los nutrientes por los cultivos se han llevado a cabo numerosas investigaciones, sin que exista una técnica con aceptación general. Lo más común es que se modifique la concentración del nutriente en cuestión (anión o catión) y, en el mejor de los casos, se controle que los demás nutrientes restantes mantengan una concentración constante. El uso de soluciones nutritivas que contienen N-NH4+ y N-NO3- son un buen ejemplo de soluciones con cambios simultáneos en los nutrientes del tipo anión y catión. Por otra parte, con base en algunos estudios sistemáticos acerca de las características químicas de las soluciones nutritivas, y cómo éstas afectan a su vez dichas características de los cultivos, se analizó un número de estudios acerca del uso del N-NH4+ y/o del N-NO3-. Se encontró que dichos estudios no permiten hacer inferencias sobre los efectos directos del N-NH4+, o del N-NO3-, así como de su interacción. Se propone el empleo de soluciones nutritivas que correspondan, por su estructura, al diseño experimental factorial completo; con combinaciones de soluciones nutritivas (tratamientos) de un grupo de relaciones de concentración NH4+:cationes, con otro grupo de relaciones similares NO3-:aniones. Dichos tratamientos permiten evaluar los efectos directos del N-NH4+ y el N-NO3- y de su interacción, sin interferencias de otra índole (eg., presión osmótica y pH de la solución nutritiva).
FORMULATION OF NUTRIENT SOLUTIONS FOR PLANT NUTRITION STUDIES. A PROPOSAL
Ma. De Jesús Juárez Hernández, Gustavo A. Baca Castillo, Lorenzo A. Aceves Navarro, Prometeo Sánchez García, Juan Luis Tirado Torres, Jaime Sahagún Castellanos and María Teresa Colinas De León
Summary
Several studies in plant nutrition have been done in the past using nutrient formulations. In order to evaluate the effect of one or more nutrients on crop growth, development, yield, quality product as well as nutrient uptake, numerous studies have been carried out, without there being a generally accepted technique for this purpose. Commonly, the main nutrient concentration (anion or cation) is modified, whereas the other nutrients remain at a constant level. Nutrient solutions containing N-NH4+ and N-NO3- are good examples of solutions with parallel changes on the anion and cation nutrient. A number of papers with systematic studies on the chemical characteristics of nutrient solutions and their effect on crops has been analyzed regarding the use of N-NH4+ and/or N-NO3-. These studies did not allow to conclude either about the N-NH4+ or N-NO3- direct effect or on their interaction. A nutrient solution formulation is herein proposed which, according to its factorial design structure based on the combinations of N-NH4+:cations groups with others of similar characteristics of N-NO3-:anions, permits the elaboration of several nutrient solutions (treatments). The treatments allow the direct evaluation of N-NH4+ and N-NO3- effects as well as their interaction, without interference of nutrient solution osmotic pressure or pH.
PROPOSTA PARA A FORMULAÇÃO DE SOLUÇÕES NUTRITIVAS EM ESTUDOS DE NUTRIÇÃO VEGETAL
Ma. De Jesús Juárez Hernández, Gustavo A. Baca Castillo, Lorenzo A. Aceves Navarro, Prometeo Sánchez García, Juan Luis Tirado Torres, Jaime Sahagún Castellanos e María Teresa Colinas De León
Resumo
Para avaliar o efeito de um ou mais nutrientes das soluções nutritivas no crescimento, desenvolvimento, rendimento, qualidade do produto e absorção dos nutrientes pelos cultivos tem-se realizado numerosas investigações, sem que exista uma técnica com aceitação geral. O mais comum é que se modifique a concentração do nutriente em questão (ânion ou cátion) e, no melhor dos casos, se controle que os nutrientes restantes mantenham uma concentração constante. O uso de soluções nutritivas que contêm N-NH4+ e N-NO3- são um bom exemplo de soluções com mudanças simultâneas nos nutrientes do tipo ânion e cátion. Por outra parte, baseado em alguns estudos sistemáticos acerca das características químicas das soluções nutritivas, e como estas afetam por sua vez ditas características dos cultivos, se analisou um número de estudos acerca do uso do N-NH4+ e/ou do N-NO3-. Encontrou-se que ditos estudos não permitem fazer inferências sobre os efeitos diretos do N-NH4+, ou do N-NO3-, assim como de sua interação. Propõe-se o emprego de soluções nutritivas que correspondam, por sua estrutura, ao desenho experimental fatorial completo; com combinações de soluções nutritivas (tratamentos) de um grupo de relações de concentração NH4+:cátions, com outro grupo de relações similares NO3-:ânions. Ditos tratamentos permitem avaliar os efeitos diretos do N-NH4+ e o N-NO3- e de sua interação, sem interferências de outra índole (eg., pressão osmótica e pH da solução nutritiva).
PALABRAS CLAVE / Hidroponía / Relación N-NH4+/N-NO3- / Relación NH4+:cationes / Relación NO3-:aniones /
Recibido: 14/09/2004. Modificado: 10/02/2006. Aceptado: 14/02/2006.
Con el objeto de investigar, entre otros aspectos, la influencia de una amplia variación de la composición de la solución nutritiva sobre el crecimiento, desarrollo, comportamiento y absorción de nutrientes en solución de diferentes cultivos y utilizando diversos substratos, se han llevado a cabo numerosos experimentos de fisiología y de nutrición vegetal. Estos estudios tienen en común tanto el uso de soluciones nutritivas, como el planteamiento y la formulación adecuados de éstas, permitiendo la interpretación real de los resultados obtenidos.
De acuerdo con Steiner (1961, 1966, 1984) y De RijcK y Schrevens (1998a), la composición química de una solución nutritiva está determinada por i) una relación catiónica mutua, ii) una relación aniónica mutua, iii) la concentración iónica total, y iv) el pH. Varios autores (Steiner, 1961, 1966, 1968, 1984; Bugarin et al., 1998; Flores, 1999; Martínez, 1999; Preciado, 2001) indican que entre las características que influyen de manera determinante en la respuesta de las plantas a la solución nutritiva, la más importante es la presión osmótica.
De Rijck y Schrevens (1998b, 1999) compararon la composición química de 12 soluciones nutritivas, determinaron sus relaciones mutuas de aniones y de cationes, su presión osmótica, su pH y la presencia de amonio. Van Labeke et al. (1995), por otro lado, estudiaron la respuesta de Eustoma grandiflorum a la relación relativa de cationes y aniones de 7 soluciones nutritivas, todas ellas con la misma presión osmótica y el mismo pH.
En el presente trabajo se discuten diversas investigaciones relacionadas con la nutrición nitrogenada de las plantas, específicamente las que incluyen al N2 de nitratos, N-NO3-, y/o al N2 amoniacal, N-NH4+, dado que constituyen ejemplos de una relación mutua de aniones y de cationes en forma simultánea. Mediante un análisis comparativo con la propuesta de Steiner se delimitan los alcances de dichas investigaciones, incluyendo la presente.
Por otra parte, se propone la formulación de soluciones nutritivas que permitan determinar los efectos directos del N-NO3- y del N-NH4+ y el efecto interactivo de ambos, sin que interfieran la presión osmótica y el pH de las soluciones nutritivas.
La Solución Nutritiva
Numerosas soluciones nutritivas han sido formuladas para hacer crecer plantas en cultivo sin suelo, y su composición química varía ampliamente (Smith et al., 1983). Estas soluciones fueron desarrolladas empíricamente y la mayor parte sin consultar, previamente información precisa, con respecto a las concentraciones de nutrientes, las fuentes de N2 y su concentración total, para lograr el crecimiento óptimo de diversas especies vegetales. Dichos autores enfatizan que las concentraciones de nutrientes requeridos para satisfacer las demandas internas de las plantas difieren de acuerdo con la especie. Por lo tanto, no puede haber una solución nutritiva única con que se tendrían resultados satisfactorios para todas ellas. Sin embargo algunas soluciones, tales como la Hoagland han sido ampliamente usadas y consideradas suficientemente útiles en las investigaciones realizadas, lo que a juicio de dichos autores, ha limitado el desarrollo de las investigaciones al respecto.
Mientras que para Steiner (1961, 1984) la composición química de una solución nutritiva está determinada por las proporciones relativas de aniones y cationes, la concentración iónica total y el pH, para De Rijck y Schrevens (1997) una vez determinadas relaciones y concentraciones iónicas, el pH es a su vez fijado. Esto significa que el pH es una propiedad inherente de la composición mineral de la solución nutritiva que no puede ser variado independientemente.
Presión osmótica
La respuesta de las plantas en crecimiento y desarrollo a la solución nutritiva del cultivo hidropónico (Steiner, 1966) depende de varios factores, el más importante de éstos es la concentración total de iones, expresada como presión osmótica de la solución nutritiva, que es una propiedad fisicoquímica de las soluciones que depende de la cantidad de partículas, o solutos disueltos (Segal, 1989).
Un aumento de la presión osmótica debido al incremento en el contenido de nutrientes o de otros iones en la solución nutritiva provoca que la planta realice un esfuerzo mayor para absorber agua y algunos nutrientes (Asher y Edwards, 1983; Marschner, 1995) y por consiguiente un desgaste de energía metabólica.
Las características químicas de la solución nutritiva se reflejan en la respuesta de las plantas, siendo la presión osmótica la más importante de estas características. Según Steiner (1961, 1966, 1968, 1969, 1984), diferencias de presión osmótica de la solución nutritiva en el orden de 0,2atm, provocan discrepancias considerables en el rendimiento de los cultivos.
Relación de aniones y relación de cationes
Steiner (1961) estableció el concepto de relación mutua entre los aniones NO3-, H2PO4- y SO42-, y entre los cationes K+, Ca2+ y Mg2+. Se basó en que una solución nutritiva debe estar regulada en sus macronutrientes contenidos en los iones mencionados (i.e., N, P, K, Ca, etc.). La regulación nutritiva consiste no solo en la cantidad absoluta de cada elemento aportado sino, además, en la relación cuantitativa que se establece entre los aniones por una parte y los cationes por la otra.
Steiner (1961) indicó que cuando se aplica la solución nutritiva en forma continua, las plantas pueden absorber iones a muy bajas concentraciones. Sin embargo, es probable que a una concentración demasiado baja, la demanda mínima de determinados nutrientes no sea cubierta.
En el otro extremo de concentración, el consumo excesivo puede conducir a efectos tóxicos. El punto de discusión es la existencia de concentraciones óptimas de determinados nutrientes en solución para un cierto cultivo, bajo particulares condiciones ambientales, o si sus proporciones relativas y no sus concentraciones absolutas son los factores determinantes. Bajo el supuesto que las concentraciones absolutas son decisivas y que éstas fueron determinadas experimentalmente, se tienen: ammol·l-1 de K+, bmmol·l-1 de Ca2+ y cmmol·l-1 de Mg2+, lo que da una relación de K+:Ca2+:Mg2+, como a:b:c; sin embargo, esta relación también puede ser expresada como a/n, b/n y c/n, donde n= a+b+c. Así, la composición obtenida puede ser expresada simultáneamente en términos de una suma y de una razón. Esta última forma de expresión tiene la ventaja de que comprende a ambas propuestas; es decir, que si las concentraciones absolutas se evaluaron como factores determinantes, también las proporciones relativas de los diferentes iones pueden ser consideradas, si la concentración iónica total está incluida.
Steiner (1968) señaló, en relación a la concentración de cualquier ión, que el problema más importante es la relación que se establece con respecto a los demás iones de su misma carga eléctrica, lo que se denomina relación mutua aniónica, si se trata de aniones y relación mutua catiónica, al referirse a los cationes.
pH de la solución nutritiva
Steiner (1968) menciona que en una verdadera solución nutritiva se tienen todos los iones en forma libre y activa y que el pH es importante para determinar la disponibilidad de algunos iones; así por ejemplo, en un pH alto no es posible tener un contenido alto de iones Ca y PO4, debido a la posible coprecipitación de ambos en forma de compuestos poco solubles del tipo del CaHPO4.
El pH es importante para favorecer la presencia de la forma química H2PO4-, que es la forma del fósforo más fácilmente absorbida por las plantas (Marschner, 1995). A pH 5,0, 100% del P está en esta forma y al aumentar el pH, dicha forma pasa a HPO42- (pKa2=7,3), alcanzando el 100% a pH 10. El intervalo de pH en el que predomina el ion H2PO4- sobre el HPO42- es entre 5 y 6. Precisamente entre estos límites se tiene la mejor difusión de H2PO4- en el espacio libre aparente radical y aumenta su absorción por parte de las plantas desarrolladas en hidroponía (De Rijck y Schrevens, 1997).
En las soluciones nutritivas se pueden presentar problemas por precipitación de P cuando el pH es mayor de 7,5. Cuando el producto de sus contenidos de Ca2+ y HPO42- (en mM·l-1) presentes en la solución nutritiva es >2,2 ocurre precipitación de CaHPO4 (Steiner, 1984).
Steiner (1968) generalmente usa valores de pH de 6,0-6,5 y considera que en este intervalo el equilibrio de disociación de los fosfatos y de los carbonatos da la mayor capacidad amortiguadora con respecto al pH. Se puede concluir que el pH apropiado de una solución para el desarrollo de un cultivo en hidroponía varía entre 5 y 6. Sin embargo, el pH de una solución nutritiva no es estático, sino que varía en función de la diferencia en la magnitud de absorción de nutrientes por las plantas, en términos del balance de aniones respecto a los cationes. Cuando los aniones son absorbidos en mayor magnitud, por ejemplo cuando la fuente de N2 en la solución nutritiva es únicamente NO3-, la planta excreta aniones OH- o HCO3- para contrarrestar las cargas eléctricas en su interior (Marschner, 1995), lo que genera un pH alcalino. A este proceso se le llama alcalinidad fisiológica. La solución Steiner es de este tipo. Dicho de otra manera, en la medida que la planta absorbe una proporción mayor de aniones que de cationes, se incrementa el pH de la solución.
Solución Nutritiva Universal de Steiner
En los cultivos sin suelo se puede dar o establecer cualquier relación de iones y cualquier concentración total de sales, siempre que no supere los límites de precipitación para ciertas combinaciones de iones. Así, la selección de la concentración de una solución nutritiva debe ser tal que el agua y los iones totales sean absorbidos por la planta en la misma proporción en la cual están presentes en la solución (Steiner, 1968).
Steiner (1961) desarrolló un método para calcular una fórmula para la composición de una solución nutritiva, la cual satisface ciertos requerimientos. Coic (1973) y Steiner (1973, 1980) indican que la composición y concentración de una solución nutritiva depende de la clase de cultivo, de la fase de desarrollo, del medio ambiente, del tipo de hidroponía (frecuencia de renovación de soluciones). Añaden que las plantas poseen una cierta elasticidad con relación al ambiente nutritivo; es decir, que la planta absorbe los iones en su propia relación mutua, dentro de amplios límites, independientemente de la relación mutua entre los iones de la solución nutritiva.
Steiner (1968, 1984) elaboró una solución nutritiva universal, que se distingue por sus relaciones mutuas entre aniones y cationes, expresadas en porciento del total de mM·l-1. Este autor indica que el uso de su solución nutritiva universal demanda únicamente que se determine la presión osmótica requerida para un cultivo en particular en una cierta época del año. Las relaciones mutuas entre los iones en la Solución Nutritiva Universal de Steiner en porcentaje del total de mM·l-1 es de 60:5:35 para NO3-: H2PO4-: SO42- y 35:45:20 para K+: Ca2+: Mg2+.
Relaciones N-NH4+/N-NO3- en Estudios de Nutrición Vegetal
Los estudios sobre la absorción de algún o algunos nutrimentos, en particular, comprenden el efecto de un anión (tal es el caso del N2 nítrico N-NO3-), o de un catión (como el N2 amoniacal, N-NH4+), o se estudia el efecto simultáneo de un catión y un anión. Se considera que los estudios de la relación N-NH4+/N-NO3- constituyen un ejemplo de estos casos, por lo que se revisó la literatura correspondiente.
De los trabajos acerca de la respuesta de los cultivos a soluciones nutritivas en hidroponía, o directamente al suelo, con concentraciones diferentes de N-NO3- y/o N-NH4+, se tomó en cuenta el efecto en las plantas de la presión osmótica de las soluciones. Con base en los tratamientos experimentales utilizados, el conjunto de artículos se agrupó en la Tabla I. Algunos trabajos están clasificados en más de una categoría debido a que comprenden dos o más experimentos.

La tecnología propuesta por Steiner para el estudio comparativo de soluciones nutritivas comprende los requisitos i) que las soluciones nutritivas tengan la misma relación mutua de aniones, ii) la misma relación mutua de cationes, iii) la misma presión osmótica, y iv) el mismo pH. Más adelante, en el inciso denominado Propuesta, se dan ejemplos al respecto). Los experimentos incluidos en el grupo A de la Tabla I, no cumplen con ninguno de los requisitos indicados, aunque tal vez la intención haya sido hacerlo de manera aproximada con respecto a los requisitos i) o ii), según el caso. Esta situación podría tener diversas implicaciones, como, por ejemplo, si mediante un cierto experimento se comparan dos soluciones nutritivas que difieren entre sí en 4mM de NO3-, suministrados a partir de NaNO3-, esta concentración equivale a un aumento en la solución de su presión osmótica de 0,19atm. De acuerdo con Steiner, la presión osmótica de una solución nutritiva es el factor más importante en el rendimiento de la planta, y basta que la diferencia entre dos soluciones sea del orden de 0,2atm, para que sea estadísticamente significativa; en el ejemplo, podría ocurrir que la solución con NO3- extra, propicie que con el aumento de la presión osmótica de 0,19atm, la presión osmótica total satisfaga en forma óptima la demanda al respecto de dicha planta, lo que a su vez determine que el rendimiento aumente significativamente; sin embargo, el investigador en cuestión, podría atribuir erróneamente dicho resultado al incremento de NO3- de la solución nutritiva. Este ejemplo podría hacerse extensivo al caso contrario, cuando debido al aumento de la presión de la solución, la presión total de la misma la aleje 0,19atm, de la óptima requerida por la planta, lo que a su vez causará que el rendimiento de la planta disminuya, y dicho resultado podría ser atribuido erróneamente, al incremento de NO3- de la solución nutritiva. En forma similar se podría analizar lo que ocurriría en otros casos. Por ejemplo, con cambios en la relación mutua de cationes o cuando se comparan cambios en las soluciones nutritivas, que incluyeran ambas relaciones mutuas. En todos los casos deben tomarse en cuenta las condiciones ambientales en las cuales se encuentra la planta con relación a las que demanda, tal como se indicó en los ejemplos anteriores. Los errores de interpretación que se cometen cuando no se siguen los lineamientos indicados, varían en su grado de importancia e inclusive algunos de ellos podrían ser insignificantes.
Los experimentos del grupo B tampoco cumplen con ninguno de los requisitos antes indicados, aunque tal vez la intención haya sido la de cumplir simultáneamente con lo indicado en i) y ii). Los experimentos en el grupo C tampoco satisfacen ninguno de los requisitos, tal vez la intención fue cumplir con i) y ii) y comparar sus efectos entre sí. El experimento del grupo D tampoco cumple con los requisitos indicados; aparentemente puede incluir a los incisos i) y ii), sin embargo no fue posible comprobarlo, porque la información es incompleta. En el grupo E se tienen experimentos que comparan soluciones nutritivas preparadas en la forma más de acuerdo con lo indicado por Steiner. Al respecto, más adelante se toma un ejemplo y se discute detalladamente.
Composición química de las soluciones nutritivas
Como se indicó anteriormente, varios investigadores han realizado estudios para determinar la respuesta de las plantas a las relaciones N-NH4+/N-NO3-. El estudio de Cao y Tibbitts (1993), para determinar los efectos de diferentes porcentuales de N-NH4+/N-NO3- sobre el crecimiento y concentración mineral de la planta de papa (Solanum tuberosum), es de los más completos, ya que presenta la composición química de sus soluciones nutritivas (Tabla II). Dicha composición se analiza para determinar la forma en que se afecta la respuesta de la planta, aplicando los lineamientos establecidos por Steiner (1961, 1966, 1968, 1984).

Para determinar el efecto de la composición química de las soluciones nutritivas en las plantas, Steiner (1984) sugiere presentar dicha composición en términos de mM de aniones y cationes y determinar la presión osmótica. La información que se presenta en la Tabla II en mM fue transformada a mmol(±)·l-1 y se refiere a cada uno de los macronutrientes, como se muestra en la Tabla III. En esta tabla se observa que las soluciones nutritivas presentan diferentes presiones osmóticas (PO); la diferencia entre el mayor valor y el menor es 0,11atm. Steiner (1961, 1966, 1968, 1984) indica que en los cultivos por él estudiados, la concentración iónica total en términos de presión osmótica es el determinante mayor del crecimiento, desarrollo y producción de la planta y que la presión osmótica óptima depende de la clase de planta (cultivo) y de las condiciones climáticas.
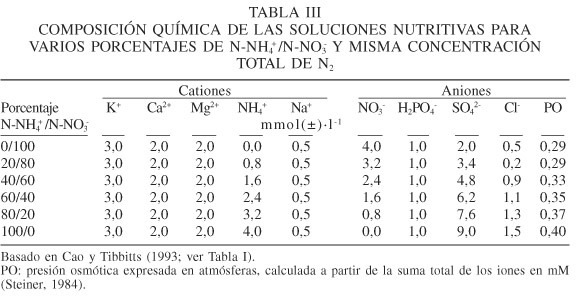
Esta situación de cambios en la relación N-NH4+/N-NO3- y simultáneamente de diferencias en la presión osmótica de las soluciones nutritivas, puede conducir a un sesgo en la interpretación de la respuesta fisiológica de los cultivos a estas soluciones; es decir, un efecto adjudicado a cambios en la relación N-NH4+/N-NO3- puede ser debido a diferencias en la presión osmótica de la solución nutritiva, ya que ésta no se mantiene constante en las soluciones probadas.
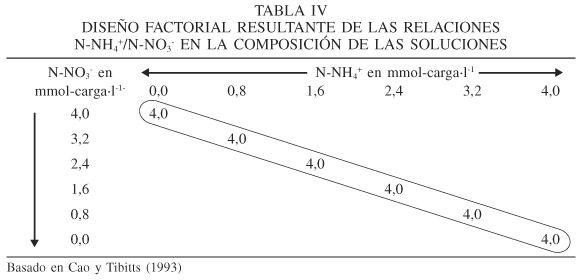
En la Tabla IV se observa que el estudio de Cao y Tibbitts (1993) únicamente contempla bajo experimentación la composición de las soluciones nutritivas que se encuentran en la diagonal del cuadro; es decir, aquellas donde el N2 total es igual a 4mmol-carga·l-1. Por otra parte, solamente permite determinar cuando el efecto fue debido específicamente al N-NO3-, o al N-NH4+, cuando la respuesta se manifesta ante las soluciones que tienen las relaciones N-NH4+/N-NO3- de 0/100 o 100/0. Además, como se observó en la Tabla III, la presión osmótica es diferente en cada una de las soluciones, lo que provoca que los resultados obtenidos sean interpretados con cierto grado de sesgo, como se señaló anteriormente.
Propuesta
Relaciones N-NO3-:aniones y N-NH4+: cationes
Steiner (1966) realizó un estudio para evaluar diferentes soluciones nutritivas en plantas de jitomate (Licopersicon esculentumm L). Determinó el efecto de diferentes relaciones NO3-:aniones (NO3-+H2PO4-+SO42-) y de relaciones K+:cationes (K++Ca2++Mg2+); además, combinó los dos grupos de soluciones (los de las relaciones de aniones con los de las relaciones de cationes) de manera que resultó en un diseño factorial completo, y además cuidó que las soluciones tuvieran la misma presión osmótica y el mismo pH.
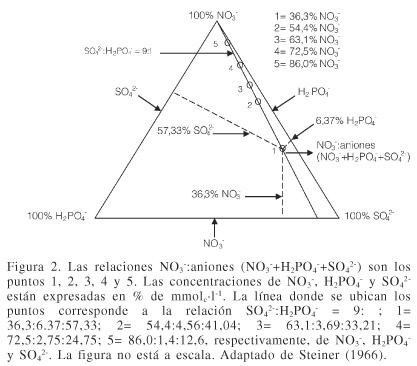
En un sistema triangular, las relaciones K+:cationes y NO3- :aniones propuestas por Steiner, están representadas en la Figura 1 (tres relaciones de cationes) y en la Figura 2 (cinco relaciones de aniones).
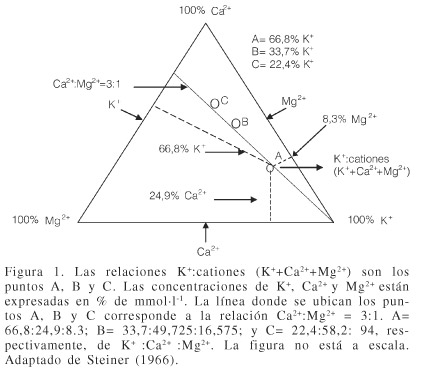
Los puntos de las relaciones de K+:cationes (K++Ca2++Mg2+, cuya suma 100%, en mmol-carga·l-1), se encuentran en una misma línea representados por A, B y C, en los que la concentración relativa de K+ es diferente; cuando ésta aumenta, lo hace a expensas de las concentraciones de Ca2+ y Mg2+. Además, la relación (3:1) entre Ca2+ y Mg2+ es constante.
En forma similar, los puntos de las relaciones NO3-:aniones (NO3-+H2PO4-+SO42-, que igualmente suman 100%), se encuentran en una misma línea representados por los puntos 1, 2, 3, 4 y 5, en los cuales es constante la relación H2PO4-: SO42- (1:9) y donde los incrementos o disminuciones del NO3- son a costa de las concentraciones de H2PO4- y SO42-.
Steiner propuso tres relaciones de cationes y cinco relaciones de aniones debido a que encontró que los cultivos responden a intervalos de concentraciones mayores de cationes que de aniones.
La combinación de las tres relaciones catiónicas y las cinco relaciones aniónicas equivalen a un total de 15 diferentes soluciones nutritivas. De estas, las combinaciones B1, C1 y C2 resultaron inaprovechables por precipitación; es decir, no son soluciones nutritivas verdaderas.
Steiner (1961) y De Rijck y Schrevens (1997) han considerado que en una solución verdadera la determinación química analítica de sus componentes debe coincidir con la correspondiente de su fórmula química. Otros estudios realizados por Steiner (1961, 1966) demuestran que, independientemente del pH, ninguna combinación donde el producto de sus contenidos de Ca2+ y SO42- expresados en mmol·l-1 sea igual o mayor de 60 es una solución nutritiva verdadera, pues habrá precipitación de CaSO4. Además, aquellas soluciones donde el producto de sus contenidos de Ca2+ y HPO42- también expresados en mmol·l-1 sea igual o mayor a 2,2 tampoco serán verdaderas, pues habrá precipitación de CaHPO4, en este caso con dependencia del pH (Steiner, 1961, 1966; De Rijck y Schrevens, 1997). Cabe aclarar que éstas «reglas» no corresponden estrictamente al concepto químico de producto de solubilidad. Cuando se realizan estudios con soluciones nutritivas en las cuales se forman precipitados, principalmente los mencionados, la interpretación que se da a los resultados resulta irreal, ya que los iones que constituyen dichos precipitados no están disponibles para ser absorbidos por la planta y, además, se alteran las características químicas de la solución nutritiva antes señaladas.
La metodología propuesta por Steiner (1966) para formular soluciones nutritivas, implica modificar las proporciones relativas de aniones, las de cationes y las interacciones de ambas. En la misma forma en que Steiner (1966) propuso el manejo de las proporciones relativas NO3-:aniones y K+:cationes, es también factible formular soluciones nutritivas con distintas relaciones NO3-:aniones y NH4+:cationes (Steiner, 1984).
En la Tabla V se muestra un ejemplo acerca de las proporciones porcentuales de las relaciones NO3-:aniones y NH4+:cationes en las soluciones nutritivas. En principio, se propone añadir N-NH4+ al N-NO3- propio de la solución nutritiva de Steiner, puesto que ésta se considera universal y por lo tanto la hipótesis es que cubra las necesidades de N2 de cualquier cultivo. Sin embargo, para verificar esta hipótesis se consideran también concentraciones de N-NO3- menores o mayores a la de dicha solución. En la solución Steiner la relación de aniones en % de mmolc·l-1 es 60:5:35 = NO3-:H2PO4-:SO42- y a dicha relación se le aumenta y disminuye la concentración de NO3- en 10%, en la forma indicada en la Figura 1. Las tres relaciones resultantes se combinan con tres relaciones de cationes provenientes de modificar la relación original de cationes de la solución Steiner, de 35:45:20 = K+:Ca2+:Mg2+, a la que se le añade NH4+ en tres concentraciones, de 0, 10 y 20, en % de mmolc·l-1 en la misma forma en que se modificó el K+ en la Figura 2. Las 9 soluciones nutritivas obtenidas integran un diseño factorial completo de tratamientos, que permite determinar el efecto del N-NO3-, el del N-NH4+ y el de la interacción entre ambos, en las variables respuesta que se evalúen, tales como rendimiento, materia seca, concentración de nutrimentos, etc.

En la Tabla VI se presenta la composición química de las 9 soluciones nutritivas de la Tabla V, una vez que fueron calculadas y ajustadas a un potencial osmótico de -0,072 MPa. De acuerdo con Steiner (1984) al multiplicar la suma total de los nutrimentos de una solución, expresada en mM, por el factor 0,024 se obtiene la presión osmótica en atmósferas, misma que se transforma a potencial osmótico, mediante el factor -0,101. Cabe enfatizar que todas las soluciones nutritivas deben tener el mismo potencial osmótico y pH, para que la comparación entre ellas sea adecuada. También es necesario determinar experimentalmente, antes de establecer el experimento correspondiente para evaluar la respuesta de la planta en cuestión a las soluciones nutritivas integrantes de la propuesta, cuál es el potencial osmótico que deben tener dichas soluciones, y en el caso de que este resulte diferente al que se indicó en este ejemplo, hacer el cambio correspondiente. El potencial osmótico elegido para la propuesta (-0,072MPa) es, probablemente, el que ha resultado ventajoso para la mayoría de los cultivos que se establecen en el ciclo de primavera-verano en las regiones de clima templado.
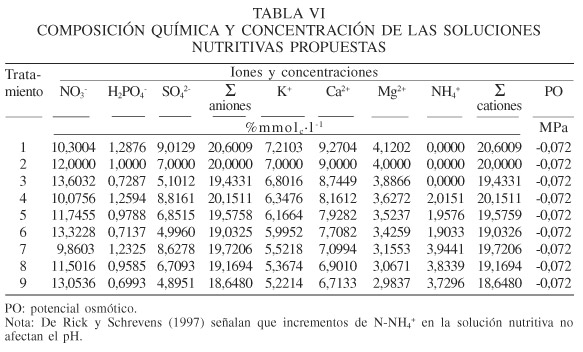
Los tratamientos integrantes de la propuesta están diseñados con el propósito de que estadísticamente, la respuesta óptima de la planta, particularmente en su rendimiento, tanto para el efecto principal del N-NO3- como para el de N-NH4+, se manifieste entre las concentraciones correspondientes de los tratamientos en estudio. Lo ideal sería que dicha respuesta coincida con la concentración intermedia correspondiente. En estas condiciones, si de acuerdo con los resultados se obtuvo que estadísticamente fue significativo el efecto principal de N-NO3-, que el mayor rendimiento correspondió a la concentración media de N-NO3- y que fue estadísticamente mayor al obtenido con la concentración menor de N-NO3-, la implicación correspondiente es que se determinó la concentración óptima de N-NO3- de la solución nutritiva. En forma similar, las mismas consideraciones se harían para la respuesta a las concentraciones de N-NH4+ de la solución nutritiva. En el caso de que se manifieste estadísticamente significativa la interacción entre ambos factores principales, podría implicar que la respuesta de la planta difiere de las implicaciones derivadas solamente de los efectos principales.
Es necesario señalar que el tipo de planta también debe ser tomado en cuenta en estos experimentos. Por ejemplo, con plantas que demandan mayores concentraciones de N2 que el promedio, se requerirá aumentar su nivel y las diferencias correspondientes entre tratamientos adyacentes. La separación de las respuestas entre los efectos principales y su interacción puede ser de gran utilidad en la interpretación de fenómenos o mecanismos que tienen lugar en estudios de nutrición y fisiología vegetal. Por otra parte, la propuesta en cuestión tiene la desventaja de requerir un mayor número de tratamientos con respecto a los estudios habituales de la relación N-NO3-:N-NH4+.
Conclusiones
En la revisión y análisis de los estudios realizados sobre la respuesta de las plantas a las relaciones N-NH4+/N-NO3- se encontró en todos los casos, que los tratamientos para investigar los efectos de las formas químicas: N-NH4+ y/o N-NO3- no permiten hacer inferencias reales sobre el efecto directo de cada una de las formas nitrogenadas en las variables-respuesta, ni tampoco acerca de la interacción de ambas formas. Además, no se tuvo cuidado de que todas las presiones osmóticas de las soluciones nutritivas fueran similares.
Con base en la metodología propuesta por Steiner, fundamentada en el estudio de las relaciones verdaderas generadas con cationes y aniones (NH4+:K++Ca2++Mg2++NH4+ y NO3-:H2PO4-+SO42-+NO3-) se planteó un ejemplo de un conjunto de soluciones nutritivas en un arreglo estructural de diseño factorial completo, que permite determinar mediante las variables respuesta, los efectos directos e interacciones de dichas formas químicas del nitrógeno, cuidando además que todas las soluciones presenten igual presión osmótica y pH.
REFERENCIAS
1. Anghinoni Magalhães JR, Barber SA (1988) Enzyme Activity, Nitrogen Uptake and Corn Growth as Affected by Ammonium Concentration in Soil Solution. J. Plant Nutr. 11: 131-144. [ Links ]
2. Asher CJ, Edwards DG (1983) Modern solution culture techniques. En Pirson A, Zimmermand MH (Eds). Encyclopedia of Plant Physiology. Vol. 15-A. pp 94-119. [ Links ]
3. Arnozis PA, Barneix AJ (1989) PEP-Carboxylase Activity During Ammonium-Assimilation in Wheat Plants. J. Plant Nutr., 12(1): 85-94. [ Links ]
4. Barber KLl, Pierzynski GM, Vanderlip RL (1994) Ammonium/nitrate Ratio Effects on Dry Matter Partitioning and Radiation Use Efficiency of Corn. J. Plant Nutr. 17: 869-882. [ Links ]
5. Bugarin MR, Baca CGA, Martínez HJ, Tirado TJL, Martínez GA (1998) Amonio/nitrato y concentración iónica total de la solución nutritiva en crisantemo. I. Crecimiento y floración. Terra 16: 113-124. [ Links ]
6. Cao W, Tibbitts TW (1993) Study of Various NH4/NO3 Mixtures for Enhancing Growth of Potatoes. J. Plant Nutr. 16: 1691-1704. [ Links ]
7. Cao W, Tibbitts TW (1994) Responses of Potatoes to Solution pH Levels with Different Forms of Nitrogen. J. Plant Nutr. 17: 109-126. [ Links ]
8. Cao W, Tibbitts TW (1998) Response of Potatoes to Nitrogen Concentrations Differ with Nitrogen Forms. J. Plant Nutr. 21: 615-623. [ Links ]
9. Coic Y (1973) Les problèmes de composition et de concentration des solutions nutritives en culture sans sol. En Proc. 3rd Int. Cong. Soilless Cult. Sassari, Italy. pp.: 158-164. [ Links ]
10. De Rijck G, Schrevens E (1997) pH Influenced by the Elemental Composition of Nutrient Solutions. J. Plant Nutr.20: 911-923. [ Links ]
11. De Rijck G, Schrevens E (1998a) Cation Speciation in Nutrient Solutions as a Function of pH. J. Plant Nutr. 21: 861-870. [ Links ]
12. De Rijck G, Schrevens E (1998b) Comparison of the Mineral Composition of Twelve Standard Nutrient Solutions. J. Plant Nutr. 21: 2115-2125. [ Links ]
13. De Rijck G, Schrevens E (1999) Anion Speciation in Nutrient Solutions as a Function of pH. J. Plant Nutr. 22: 269-279. [ Links ]
14. Fenn LB, Taylor RM, Burks CM (1993) Influence of Plant Age on Calcium Stimulated Ammonium Absorption by Radish and Onion. J. Plant Nutr. 16: 1161-1177. [ Links ]
15. Flores RJS (1999) Concentración total de sales y de magnesio en el cultivo hidropónico del rosal. Tesis. Colegio de Postgraduados. Montecillo, México. 222 pp. [ Links ]
16. Griffith SM, Streeter DJ (1994) Nitrate and Ammonium Nutrition in Ryegrass: Changes in Growth and Chemical Composition under Hydroponic Conditions. J. Plant Nutr. 17: 71-81. [ Links ]
17. Hammer PA, Tibbitts TW, Langhans RW, MacFarlane JC (1978) Baseline growth studies of Grand Rapids lettuce in controlled environments. J. Amer. Soc. Hort. Sci. 103: 649-655. [ Links ]
18. Kafkafi U, Ganmore-Neumann R (1997) Ammonium in Plant Tissue: Real or Artifact? J. Plant Nutr. 20: 107-118. [ Links ]
19. Magalhães JR, Huber DM (1989) Maize Growth and Ammonium Assimilation Enzyme Activity in Response to Nitrogen Forms and pH Control. J. Plant Nutr. 12: 985-996. [ Links ]
20. Marschner H (1995) Mineral Nutrition of Higher Plants. 2a ed. Academic Press. San Diego, CA, EEUU. 889 pp. [ Links ]
21. Martínez BN (1999) Estudio nutrimental de Alstroemeria híbrida en hidroponía. Tesis. Colegio de Postgraduados. Montecillo, México. 106 pp. [ Links ]
22. Martínez V, Cerdá A (1989) Influence of N Source on Rate of Cl, N, Na and K Uptake by Cucumber Seedlings Grown in Saline Condition. J. Plant Nutr. 12: 971-983. [ Links ]
23. Merhaut DJ, Darnell RL (1995) Ammonium and Nitrate Accumulation in Containerized Southern Highbush Blueberry Plants. Hortscience 30:1378-1381. [ Links ]
24. Parchomchuk P, Neilsen GH, Hogue EJ (1993) Effects of Drip Fertigation of NH4-N and P on Soil pH and Cation Leaching. Can. J. Soil Sci. 73: 157-164. [ Links ]
25. Preciado RP (2001) Fertigación nitrogenada, fosfórica y programa de riego en la producción del cultivo de melón. Tesis. Colegio de Posgraduados. Montecillo, México. 99 pp. [ Links ]
26. Rideout JW, Raper CDJr (1994) Dry Matter and Nitrogen Accumulation Are not Affected by Superoptimal Concentration of Ammonium in Flowing Solution Culture with pH Control. J. Plant Nutr. 17: 219-228. [ Links ]
27. Sandoval VM, Tirado TJL, Baca CGA, Santizo RJA (1994) Amonio y carbonato de calcio para la substitución parcial de nitrato en condiciones hidropónicas en trigo. Terra 12:283-288. [ Links ]
28. Sandoval VM, Alcantar GG, Tirado TJL (1995) Use of Ammonium in Nutrient Solutions. J. Plant Nutr. 18: 1449-1457. [ Links ]
29. Segal BG (1989) Chemistry: Experiment and Theory. Wiley. Nueva York, EEUU. 1008 pp. [ Links ]
30. Smith GS, Johnston CM, Cornforth IS (1983) Comparison of Nutrient Solutions for Growth of Plants in Sand Culture. New Phytol. 94: 537-548. [ Links ]
31. Steiner AA (1961) A Universal Method for Preparing Nutrient Solutions of a Certain Desired Composition. Plant Soil. 15: 134-154. [ Links ]
32. Steiner AA (1966) The Influence of the Chemical Composition of a Nutrient Solution on the Production of Tomato Plants. Plant Soil. 24: 434-466 [ Links ]
33. Steiner AA (1968) Soilless culture. En Proc. 6th Colloq. Int. Potash Inst. Florence, Italy. pp. 324-341. [ Links ]
34. Steiner AA (1973) The Selective Capacity of Tomato Plants for Ions in a Nutrient Solution. En Proc. 3rd Int. Cong. Soilless Cult. Sassari, Italy. pp. 43-54. [ Links ]
35. Steiner AA (1980) The Selective Capacity of Plants for Ions and its Importance for the Composition and Treatment of the Nutrient Solution. En Proc. 5th Int. Cong. Soilless Cult.. Wageningen, Holanda. pp. 83-94. [ Links ]
36. Steiner AA (1984) The Universal Nutrient Solution. En Proc 6th Int. Cong. Soilless Cult. pp. 633-649. [ Links ]
37. Van Labeke MC, Dambre P, Schrevens E, De Rijck G (1995) Optimisation of the Nutrient Solution for Eustoma glandiflorum in Soilless Culture. Acta Horticult. 401: 401-408. [ Links ]
38. Xie RJ, O'halloran IP, Mackenzie AF, Fyles JW (1993) Phosphate Sorption and Desorption as Affected by Addition Sequences of Ammonium Lignosulphonate and Diammonium Phosphate in a Clay Soil. Can. J. Soil Sci. 73: 275-285. [ Links ]












 uBio
uBio 
