Interciencia
versión impresa ISSN 0378-1844
INCI v.32 n.1 Caracas ene. 2007
Caracterización y evaluacion de virulencia en aislamientos de rhizoctonia solani kühn, causante de la mancha bandeada en maíz
Rosaura Perdomo, Alexander Hernández, Alex González, Juan Pineda y Jesús Alezones
Rosaura D. Perdomo R. Ingeniero Agrónomo, Universidad Centroccidental Lisandro Alvarado (UCLA), Venezuela. Asistente de Investigación, Fundación Agrícola Danac (DANAC), Venezuela.
Alexander J. Hernández J. Ingeniero Agrónomo, Universidad de Oriente (UDO), Venezuela. M.Sc. en Mejoramiento Genético de Plantas, Universidad Central de Venezuela (UCV). Profesor, UCLA, Venezuela, e Investigador, DANAC, Venezuela. Dirección: Post-grado de Fitopatología. Decanato de Agronomía, UCLA. Cabudare, Lara, Venezuela. e-mail: alexander.hernandez@danac.org.ve
Juan Bautista Pineda P. Ingeniero Agrónomo y M.Sc. en Fitopatología, UCLA, Venezuela. Profesor, UCLA, Venezuela.
Alex D. González V. M.Sc. en Agronomía y Estudiante de Doctorado, UCV, Venezuela. Investigador, Danac, Venezuela.
Jesús M. Alezones G. Ingeniero Agrónomo y Estudiante de Maestría, UCV, Venezuela. Investigador, DANAC, Venezuela.
RESUMEN
En Venezuela la mancha bandeada del maíz, causada por Rhizoctonia solani Kühn, tiene una alta incidencia y distribución en las principales zonas maiceras, causando disminución de los rendimientos. En 2004 se condujeron ensayos con el objetivo de caracterizar y evaluar la virulencia de 25 aislamientos de R. solani. Para la caracterización se realizaron evaluaciones culturales, microscópicas y moleculares, estas últimas utilizando una secuencia de amplificación específica de la transcrita región espaciadora interna del ADN ribosomal (rADN-ITS). Para la evaluación de la virulencia se realizaron pruebas de inoculación en las líneas de maíz CML-254 y L-82201-22-1-1, tanto en laboratorio, usando una solución de cinetina (6- furfuril-amino-purina), como en invernadero, inoculando plántulas. Las pruebas de caracterización demostraron que los aislamientos efectivamente correspondían a R. solani, aun cuando hubo diferencias en el color de las colonias, crecimiento micelial y tamaño de esclerocios, entre otras. El análisis molecular demostró que los aislamientos pertenecen al grupo de anastomosis AG1-IA. En la prueba de inoculación en laboratorio los aislamientos G1SOM1 y P2TUR3 tuvieron mayor índice de virulencia. En invernadero los aislamientos más virulentos fueron B1TOR1, P2TUR6 y B2SAB1. La línea CML-254 mostró el mayor nivel de resistencia a la enfermedad en ambas pruebas de virulencia. Los resultados permitieron identificar y caracterizar aislamientos que pueden ser utilizados en programas de mejoramiento genético para la identificación de posibles fuentes de resistencia y en la evaluación del germoplasma mejorado.
Characterization and evaluation of virulence in rhizoctonia solani kühn isolates, causal agent of leaf banded spot on maize
SUMMARY
In Venezuela, banded leaf spot caused by Rhizoctonia solani Kühn is a widely distributed disease in the most important maize growing areas, causing important yield losses. In 2004, experiments were conducted with the purpose of characterizing and evaluating the virulence of 25 isolates of R. solani. Characterization tests were performed throughout cultural, microscopic, and molecular evaluations, the latter using a specific ribosomal internal transcribed spacer region (rADN-ITS). Virulence tests were performed on the maize inbred lines CML-254 y L-82201-22-1-1, both in the laboratory using KIN solution (6-furfurilaminopurine), and in a greenhouse inoculating seedlings. Characterization tests demonstrated that all isolates belong to R. solani, although differences were observed in colony color, mycelial growth and sclerotia size, among others. Molecular analysis classified all isolates within the R. solani anastomosis group AG1-IA. Virulence tests performed in the laboratory showed that the isolates G1SOM1 and P2TUR3 had the highest virulence index. In greenhouse tests B1TOR1, P2TUR6, and B2SAB1 resulted more virulent. In both virulence tests, the line CML-254 showed the highest level of resistance to disease. The isolates identified and characterized in this study may be used by maize breeding programs looking for resistant sources and improved cultivars.
Caracterização e avaliação de virulência em isolamentos de rhizoctonia solani kühn, causante da mancha bandeada no milho
RESUMO
Na Venezuela a mancha bandeada do milho, causada por Rhizoctonia solani Kühn, tem uma alta incidência e distribuição nas principais áreas de plantio de milho, causando diminuição do rendimento. Em 2004 foram conduzidos ensaios com o objetivo de caracterizar e avaliar a virulência de 25 isolamentos de R. solani. Para a caracterização se realizaram avaliações culturais, microscópicas e moleculares, estas últimas utilizando uma seqüência de amplificação específica da região espaçadora transcrita interna do DNA ribossomal (rDNA-ITS). Para a avaliação da virulência se realizaram provas de inoculação nas línhas de milho CML-254 e L-82201-22-1-1, tanto em laboratório, usando uma solução de cinetina (6- furfuril-amino-purina), como em estufa, inoculando plântulas. As provas de caracterização demonstraram que os isolamentos efetivamente correspondiam a R. solani, ainda quando houve diferenças na cor das colônias, crescimento micelial e tamanho de esclerócios, entre outras. A análise molecular demonstrou que os isolamentos pertencem ao grupo de anastomosis AG1-IA. Na prova de inoculação em laboratório os isolamentos G1SOM1 e P2TUR3 tiveram maior índice de virulência. Em estufa, os isolamentos mais virulentos foram B1TOR1, P2TUR6 e B2SAB1. A linha CML-254 mostrou o maior nível de resistência à enfermidade em ambas provas de virulência. Os resultados permitiram identificar e caracterizar isolamentos que podem ser utilizados em programas de melhoramento genético para a identificação de possíveis fontes de resistência e na avaliação do germoplasma melhorado.
PALABRAS CLAVE / Grupo de Anastomosis / Maíz / Mancha Bandeada / Rhizoctonia solana / Virulencia / Zea mays /
Recibido: 03/10/2005. Modificado: 13/12/2006. Aceptado: 14/12/2006.
Introducción
En el ámbito mundial el cultivo de maíz ocupa el tercer lugar de producción después del arroz y el trigo. En Venezuela el maíz se encuentra ubicado en segundo lugar después del arroz y, debido a su alto valor nutritivo y el gran impacto socioeconómico, es considerado de gran importancia como alimento estratégico en la población y como subproducto en la elaboración de alimentos concentrados para animales (Bastidas, 2003).
La planta de maíz, aunque de reconocida adaptabilidad, frecuentemente sufre enfermedades que alteran su funcionamiento normal, modificando su desarrollo y reduciendo o anulando su producción (Fontana y González, 2000). Durante los últimos años se han agudizado los problemas ocasionados por el hongo Rhizoctonia solani Kühn en plantaciones de maíz, provocando reducciones importantes en los niveles de productividad. En Venezuela la enfermedad se ha señalado desde el año 1995, afectando severamente hojas, tallos y mazorcas en estado de madurez en siembras de maíz en la colonia agrícola de Turén, estado Portuguesa (Cardona et al., 1999).
Este problema ha ganado la atención de investigadores en diferentes áreas del cultivo, así como también de los productores, quienes demandan una respuesta rápida para superarlo, llegando incluso a considerarse potencialmente más importante que las limitantes abióticas y de manejo agronómico, por la dificultad en encontrar a corto plazo medidas culturales, controles químicos o resistencia genética para combatir el patógeno (Cabrera y García, 2000).
R. solani, estado anamorfo de Thanatephorus cucumeris (Frank) Donk., es un usual habitante del suelo con un amplio rango de hospedantes, características que lo convierten en un enemigo peligroso y difícil de controlar, porque además sobrevive como saprófito y año tras año su presencia se incrementa (Cabrera, 2002; Bastidas, 2003). Se ha establecido que las cepas de R. solani que afectan al maíz, pertenecen al grupo de anastomosis AG1-IA (Hernández et al., 2003a).
El objetivo del presente estudio fue caracterizar y evaluar la virulencia de 25 aislamientos de R. solani AG1-IA, obtenidos de plantaciones de maíz en diferentes localidades de Venezuela, a fin de identificar los aislamientos más virulentos para posteriormente orientar programas de mejoramiento dirigidos hacia la búsqueda de cultivares de maíz resistentes al patógeno.
Materiales y Métodos
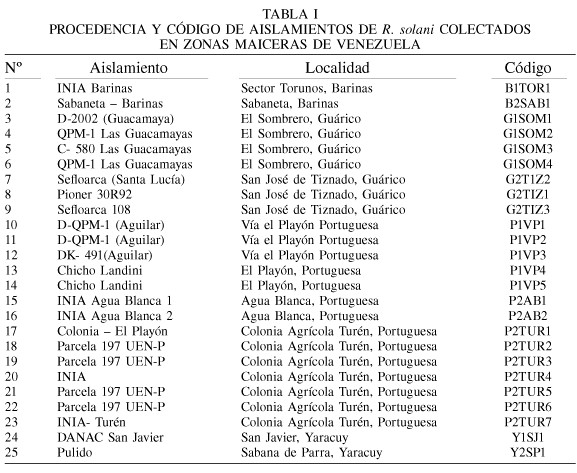
Origen de los aislamientos. Los 25 aislamientos de R. solani fueron obtenidos de una selección de esclerocios tomados de materiales infectados que fueron colectados durante los años 2002 y 2003 por investigadores de la Fundación Agrícola DANAC, en diferentes localidades de los estados venezolanos de Portuguesa, Guárico, Yaracuy y Barinas (Tabla I). El cultivo patrón del grupo de anastomosis AGI-IA de R. solani fue donado por Nelly Delgado, del Instituto Nacional de Investigaciones Agrícolas (INIA), Portuguesa, Venezuela.
Obtención de los aislamientos. Para la desinfección de los esclerocios, éstos fueron sumergidos por 3min en solución de cloro al 1%; luego fueron lavados con agua destilada estéril, secados en papel absorbente, sembrados asépticamente en placas con agar-agua (AA) y colocados en condiciones de laboratorio (22-24ºC). Cada aislado se purificó por transferencia de ápices hifales a placas de Petri con agar-papa-dextrosa (PDA). Los aislamientos fueron caracterizados en función de la morfología hifal y la condición nuclear. Los inóculos utilizados en todas las pruebas fueron discos de agar-micelio (6mm diámetro) extraídos del margen de cultivos de 4-5 días en placas con PDA incubadas en condiciones de laboratorio.
Caracterización nuclear. Se utilizaron cultivos producidos durante 4-5 días en placas de Petri que contenían 15ml de AA, bajo condiciones de laboratorio. Se extrajeron círculos delgados de agar-micelio (12mm diámetro) que fueron colocados sobre portaobjetos y teñidos con safranina O y azul de anilina al 0,5%, para contabilizar el número de núcleos por célula y medir el grosor de las hifas (Johansen, 1940).
Crecimiento y caracterización hifal. Los aislamientos fueron subcultivados en placas con PDA y mantenidos incubados en condiciones de laboratorio. Por cada tratamiento (25 cepas) se usaron tres repeticiones en un diseño aleatorio. Se medió el crecimiento micelial en cm2 a las 48h. La caracterización se hizo durante cuatro semanas, sobre la base del color de la colonia, características del micelio e inicio de la formación, maduración, color y tamaño de los esclerocios.
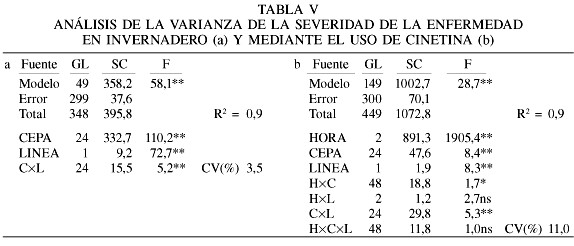
Evaluación de Virulencia. Se realizaron dos pruebas, una a nivel de laboratorio utilizando placas Petri con solución de cinetina y otra en invernadero. Los análisis de la variancia y la discriminación de las medias, en ambos ensayos, fueron realizados empleando el programa SAS JMP 5.012.
Ensayo de virulencia en solución de cinetina. Dos líneas de maíz (CML-254 y L-82201-22-1-1) del banco de germoplasma de la Fundación DANAC fueron sembradas y mantenidas en invernadero. Para tales propósitos se usaron envases plásticos con 2kg de sustrato previamente esterilizado. Los 25 aislamientos de R. solani se multiplicaron sobre granos de arroz esterilizados en autoclave a 121ºC y 15lb durante 15min. De plantas de maíz con 30-35 días de edad, se cortaron hojas completas y se dividieron en segmentos de 8cm de largo que fueron lavados con agua y colocados en capsulas de Petri que contenían 8ml de solución de cinetina (6-furfuril-amino-purina) a 2ppm. Los segmentos foliares fueron inoculados aplicando en la superficie adaxial un grano de arroz colonizado por el correspondiente aislamiento. Seguidamente, las placas se incubaron a 22-24ºC por tres días.
El desarrollo de la enfermedad se evaluó a las 24h de inoculación, utilizando la escala de Ahuja y Payak (1981), que consiste de grados de 0 a 5 según el porcentaje de área afectada de la hoja, a saber 1: 3,4%; 1.5: 10,8%; 2: 11,4%; 2.5: 23,6%; 3: 32,0%; 3.5: 38,0%; 4: 39,2%; 4.5: 45,0%; y 5:≥53,4% de área afectada. La prueba se estableció en un diseño completamente aleatorio con 3 repeticiones y en arreglo factorial con los siguientes factores: horas, cepa, genotipo y sus interacciones.
Ensayo de virulencia en invernadero. De las líneas CML-254 y L-82201-22-1-1 se sembró una semilla por punto sobre tierra esterilizada. Se emplearon 13 mesones de 60×120cm y 20cm de espesor. Cada mesón fue dividido en dos partes iguales, para utilizar un total de 25. Cada mitad tenía 14 hileras con 12 plantas, repartidas entre los dos genotipos, donde cada hilera representa una repetición. Cada parte fue inoculada con un aislamiento, para lo cual se colocó un círculo de PDA colonizado de cada uno de los aislamientos en la primera hoja verdadera entre la vaina y el tallo de la planta a los 12 días de edad (dde; Figura 1a). La evaluación se realizó 7 días después de la inoculación (ddi), utilizando para ello una escala de cinco pasos, basada en la altura relativa o avance de la lesión, a saber 1: <5% de la altura de la planta, 2: 5-15%, 3: 16-35%, 4: 36-65%; y 5: >66% de la altura de la planta y muerte de las mismas (Figura 1b).
El experimento se estableció mediante un diseño completamente aleatorio, con un arreglo factorial y siete repeticiones. El factor genotipo se analizó en dos niveles, susceptible y resistente, y el factor cepa en 25 niveles correspondientes a los diferentes aislamientos.
Identificación del grupo de anastomosis mediante rADN-ITS. Este método permite la identificación de manera precisa y rápida de los grupos de anastomosis de los aislamientos (Hernández et al., 2003a). Para la extracción de ADN de cada aislamiento y del patrón AG1-1A usado como control, se utilizaron cultivos puros multiplicados en medio líquido. El micelio fue filtrado y lavado con agua estéril para la obtención de la masa que fue macerada en N2 líquido y luego se le agregó buffer de extracción (CETAB 2%, 750µl; Mercaptoetanol, 15µl). El extracto con ADN fue transferido a tubos de microcentrífuga e incubados por 30min a 65°C, mezclando por inversión cada 8min. Se agregó 300µl de acetato de potasio 3M (pH 4,8) e inmediatamente fue incubado en hielo por 15min y luego centrifugado a 12000rpm por 9min. El sobrenadante fue transferido a tubos de microcentrífuga y se le agregó 200µl de cloroformo isoamílico (24:1), mezclando por inversión; después fue centrifugado a 12000rpm por 9min a 4°C. El sobrenadante fue transferido a tubos de microcentrífuga donde se añadió 750µl de etanol 100%, se incubó sobre hielo por 10min y se centrifugó a 18000rpm por 9min. Tras descartar el sobrenadante, se lavó 2 veces con 500µl de etanol 70%, para luego centrifugar a 9000rpm por 9min por cada lavado. El sobrenadante fue desechado y se dejó secar en papel de filtro. El precipitado fue resuspendido en 100µl de tampón TE y almacenado a 4°C.
La amplificación rDNA-ITS fue realizada usando los primers ITS1 (5-TCCGTAGGTGAACCTGCGG-3) y ITS4 (5-TCCTCCGCTTATTGATATGC-3). Cada 30µl de reacción de PCR tuvo 2,0µl de ADN, 3µl de buffer 10X, 19µl de agua destilada, 0,6µl de dNTPS 10mM, 1,8µl de Mg+2 25mM, 3µl de primers (10X) y 0,6µl de Taq DNA polimerasa. Se amplificó durante 35 ciclos a una temperatura de alineación de 58°C. El producto de amplificación fue digerido con la mezcla de las enzimas AluI y HaeIII, en donde 6µl del producto del PCR fue mezclado con 1,5µl de tampón-2, 5,5µl de agua destilada y 1µl de cada enzima y se incubó a 37°C por 3h. Se corrió una electroforesis en gel de poliacrilamida al 10% (PAGE), para luego realizar la tinción con plata al 0,2%. Posteriormente se analizó el patrón de bandas.
Resultados y Discusión
Caracterización microscópica de los aislamientos
En todos los materiales examinados se observaron hifas formando ángulos rectos, constricciones en el punto de origen de las ramificaciones e inmediatamente por encima de este sitio presentaban un septo. La caracterización nuclear de los aislamientos teñidos con azul de anilina permitió la observación de células somáticas con 3-6 núcleos. Para la caracterización del género Rhizoctonia es necesario determinar el número de núcleos que presentan las células vegetativas y en función de ello se pueden diferenciar Rhizoctonia binucleadas o multinucleadas (Parmeter y Whitney, 1970).
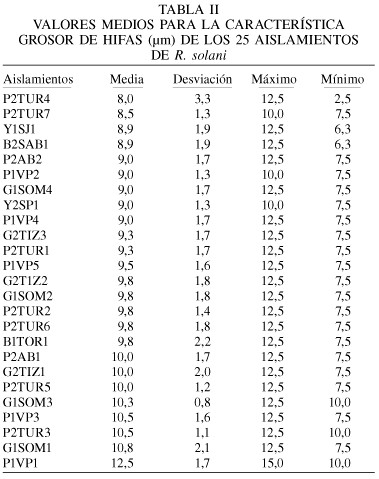
Entre las observaciones microscópicas realizadas (Tabla II) se puede señalar que el grosor de hifas estuvo comprendido entre valores promedio de 8,0 y 12,5µm. Los aislamientos P1VP1, G1SOM1, P2TUR3 y P1VP3 mostraron un mayor grosor de hifas, con valores de 12,5; 10,8; 10,5 y 10,5µm, respectivamente; mientras que el menor grosor de hifas correspondió al aislamiento P2TUR4, con 8,0µm. Los aislamientos restantes mostraron valores intermedios.
La evaluación morfológica de las colonias producidas en PDA de cada uno de los aislamientos, permitió también la caracterización cualitativa de este patógeno. Las características más resaltantes fueron: a) micelio blanco en colonias jóvenes, tornándose posteriormente amarillentas a marrón en todo el plato; b) formación de esclerocios, al principio de color blanco y posteriormente se tornan de color marrón y sin forma definida, apreciándose esclerocios semiesféricos, globosos o sencillamente de forma irregular con base aplanada; c) esclerocios de diferentes tamaños, y en ciertas ocasiones aparecieron como masas de mayor tamaño; d) ocasionalmente se observó un exudado color ámbar sobre los esclerocios. Todas las características descritas coinciden con las reportadas por otros investigadores (Carling y Summer, 1992; Cedeño et al., 1996; Cardona et al., 1999; Da Silveira et al., 2000).
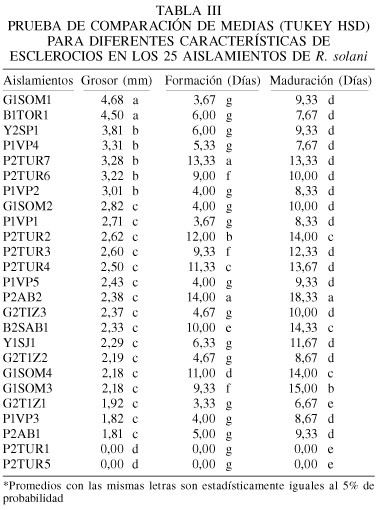
El análisis de varianza aplicado a las variables morfológicas evaluadas (grosor, días de aparición y días de maduración de los esclerocios) detectó diferencias altamente significativas entre los aislamientos (Tabla III). La prueba de comparación de medias realizada para la variable grosor de esclerocios, permitió separar cuatro grupos que presentaron valores estadísticamente similares. Los aislamientos G1SOM1 y B1TOR1 presentaron un mayor grosor, con valores de 4,68 y 4,50mm respectivamente. La mayoría presentó esclerocios de tamaño intermedio, con valores que oscilaron entre 3,80 y 1,80mm. Para los aislamientos P2TUR1 y P2TUR5 no se presentan valores porque no desarrollaron esclerocios.
En relación al tiempo de formación de esclerocios, la prueba permitió separar siete grupos. Aislamientos con valores entre 3,33 y 6,33 días, fueron los que desarrollaron esclerocios en un menor tiempo, y entre éstos se destacaron G2TIZ1 con valor promedio de 3,33 días, y P1VP1 y G1SOM1 con 3,67 días. El aislamiento P2AB2 fue el que tardó más en formar esclerocios (14 días). Con respecto al tiempo de maduración, existe una relación directamente proporcional a la formación de esclerocios. El estudio de las características de los esclerocios se realizó con el fin de evaluar el comportamiento de los 25 aislamientos de R. solani en búsqueda de diferencias que permitan relacionar la capacidad de la cepa para desarrollar la enfermedad y colonizar áreas (suelos o plantas) en forma agresiva o severa, dependiendo del caso. En tal sentido, las cepas que producen esclerocios maduros en menor tiempo, tienen mayor posibilidad de escapar a cualquier medida de control, de incrementar ciclo tras ciclo la cantidad de inóculo y una mayor probabilidad de diseminación.
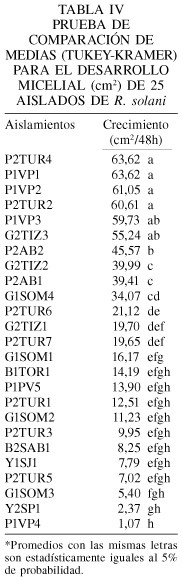
En lo que respecta al desarrollo micelial, los resultados mostraron diferencias altamente significativas entre los aislamientos probados (Tabla IV). Los aislamientos con mayor desarrollo micelial a las 48h fueron P2TUR4, P1VP1, P1VP2, P2TUR2, P1VP3, G2TIZ3, con valores promedios entre 63,62 y 55,24cm2; grupos de desarrollo micelial intermedios, con intervalos entre 45,57 y 16,17cm2, y el grupo con menor desarrollo, entre 14,18 y 1,07cm2, estuvo conformado por Y2SP1 y P1VP4. La mayor capacidad de crecimiento micelial pudiera relacionarse con la virulencia, es decir, con la capacidad de causar más daño sobre el hospedante.
Evaluación de la Virulencia
Los modelos utilizados para el análisis de los datos correspondientes a las pruebas de virulencia en invernadero y en solución de cinetina, están registrados en la Tabla V, donde se aprecia un alto grado de confiabilidad y de significación, detectando diferencias para todas las fuentes estudiadas, excepto para las interacciones hora×línea y horas×cepa×líneas. En ambas pruebas, el comportamiento de la virulencia de las cepas fue variable, al igual que el de las líneas de maíz. Hubo diferencias en agresividad entre las cepas, por cuanto la interacción cepa×hora fue significativa y, además, se observó que no todas las cepas causan el mismo grado de daño en igual tiempo.
Virulencia en solución de cinetina
Las observaciones realizadas permiten señalar que los aislamientos de R. solani comienzan su crecimiento sobre el tejido foliar de manera casi inmediata y al término de 12h ya es posible apreciar síntomas de infección. La línea CML-254 fue significativamente menos afectada por los aislamientos que la L-82201-22-1-1.
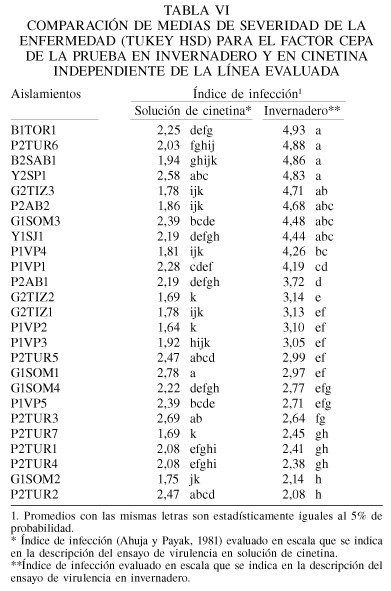
Los resultados indican diferencias altamente significativas en la virulencia o nivel de daño de los aislamientos (Tabla VI). Los más virulentos fueron G1SOM1, P2TUR3, Y2SP1, P2TUR2 y P2TUR5, con valores en la escala de Ahuja y Payak (1981) de 2,78; 2,69; 2,58; 2,47; y 2,47, respectivamente, mientras que los menos virulentos fueron G2TIZ2, P2TUR7 y P1VP2, con medias de 1,69; 1,69 y 1,64, respectivamente. Los aislamientos restantes tuvieron valores intermedios.
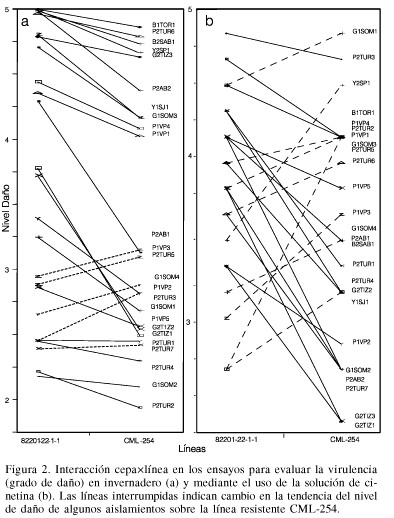
La alta significación estadística observada en la interacción cepas×líneas indica que cada cepa se comporta de manera diferente dependiendo de la línea, lo que dificulta aun más el estudio de los aislamientos (Figura 2). Al examinar la interacción existente entre cepas y líneas (Figura 2b) se observó que 16 cepas mostraron mayor grado de virulencia sobre la línea L-82201-22-1-1 en comparación con los daños causados sobre la línea CML-254. Los 9 aislamientos restantes (líneas discontínuas) mostraron una tendencia contraria.
Para R. solani, la formación del cojín de infección es de gran importancia para la invasión y posterior infección del tejido y la opinión más común es que los exudados de la planta estimulan la formación de esas estructuras. Las diferencias en formación posiblemente determinaron el nivel de virulencia y el comportamiento diferencial entre los aislamientos (Armentrout et al., 1987). La severidad de las enfermedades está directamente relacionada con la formación de estructuras de infección y esta habilidad es estimulada por el hospedante (Marchall y Rush, 1980).
Los diferentes modos de penetración empleados por los hongos fitopatógenos dependen del aislamiento, del grupo de anastomosis, las especies de plantas y la parte afectada de la planta (Dodman et al., 1968a, b). Es por eso que las respuestas de virulencia difieren, en algunos casos, cuando se compara el ensayo de invernadero y el de la solución de cinetina; en uno el daño es a nivel del tallo y en el otro en el tejido foliar, tratándose de dos mecanismos de penetración.
Virulencia en condiciones de invernadero
El síntoma inicial pudo ser apreciado en el punto de inoculación; al comienzo se observó una decoloración del tejido, que se tornó color crema y posteriormente marrón. Con el desarrollo de la enfermedad, las lesiones se hicieron de mayor tamaño hasta cubrir, en la mayoría de los casos, todo el perímetro del tallo, alcanzando posteriormente la vaina y la lámina foliar. Esta sintomatología es similar a la descrita por otros investigadores (Ahuja y Payak, 1978; Bastidas, 2003; Cabrera y García, 2000; De León, 1995).
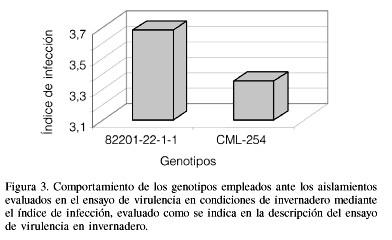
Al igual que el ensayo anterior, se detectó diferencias altamente significativas entre los aislamientos (Cuadro VI), siendo los más virulentos B1TOR1, P2TUR6, B2SAB1 y Y2SP1, con valores promedio del índice de infección de 4,93; 4,88; 4,86 y 4,83, respectivamente, seguidos de los grupos de virulencia intermedia, con medias entre 4,71 y 2,38. De igual manera se pudo apreciar que solamente dos aislamientos G1SOM2 y P2TUR2 presentaron los promedios de virulencia menores, con índices de 2,14 y 2,08, respectivamente. La línea CML-254 se mostró significativamente menos afectada que L-82201-22-1-1, coincidiendo estos resultados con los del ensayo anterior (Figura 3).
Según los resultados obtenidos en este ensayo, aislamientos pertenecientes a los estados Barinas, Portuguesa y Yaracuy, cuyas siglas comienzan por la respectiva inicial, presentaron un alto nivel de virulencia, lo que sugiere que R. solani AG1-IA posee habilidad para adaptarse a diferentes condiciones agroecológicas. En Portuguesa, uno de los principales productores de maíz, posiblemente el patógeno se ve obligado a cambiar frecuentemente su composición genética a causa de la presión de selección generada por siembras consecutivas y cambios en los cultivares comerciales utilizados, convirtiéndolo en un enemigo potencialmente peligroso, capaz de distribuirse en parcelas comerciales de manera rápida y fácil y manifestándose en intensidades considerables.
R. solani es una especie heterogénea conformada por numerosas cepas que difieren en las características de crecimiento in vitro y en patogenicidad (Ogoshi, 1987). Se ha determinado que la capacidad parasítica y saprofítica es diferente para cada aislamiento de R. solani (Papavizas, 1970). En relación con la expresión del síntoma de la enfermedad, se ha determinado que el hongo posee una toxina específica, un carbohidrato que contiene glucosa, manosa y N-acetylgalactosamina, la cual es producida en mayor cantidad por aislamientos altamente virulentos (Vidhasekaran et al., 1997).
Evaluaciones de cultivares comerciales en Venezuela indican que todos los materiales evaluados fueron susceptibles a R. solani (Cabrera y García, 2000; Bastidas, 2003). Adicionalmente, debido a las características de este patógeno de ser polífago y con un amplio rango de hospedantes, se hace difícil encontrar genotipos con características de resistencia a la enfermedad (Zambrano et al., 2002). El hongo posee gran capacidad de sobrevivencia y adaptación a diferentes ambientes agroecológicos, lo que implica serias dificultades en el establecimiento de estrategias para su combate, particularmente mediante variedades resistentes (Nass y Rodríguez, 1994).
Entre los factores involucrados en la respuesta de resistencia y/o susceptibilidad a R. solani se encuentra el potencial de inóculo y los factores edáficos. Cabe destacar que en la búsqueda de materiales de maíz que presenten algún grado de resistencia a R. solani es necesario disponer de aislamientos que presenten un grado de virulencia media-alta, con el objeto de determinar el comportamiento de estos materiales ante el patógeno. En tal sentido se recomienda utilizar primero, en los programas de mejoramiento, las pruebas de cinetina con aislamientos de grado 2 a 2,5 que representan entre un 11,4 hasta 23,6% de daño. Aquellos que resultasen promisorios en estas evaluaciones pasarían a ser evaluados en invernadero, utilizando aislamientos que tengan grado 4 de avance de la enfermedad, entre 36 y 60% de avance. Utilizar aislamientos más virulentos cuando se inicia la búsqueda de materiales promisorios puede enmascarar posibles candidatos fuentes de resistencia por la utilización de una alta presión de selección. Se podría utilizar grandes cantidades de materiales a evaluar utilizando la prueba de cinetina para luego proceder a evaluar en invernadero. Los seleccionados con estas pruebas pasarían a ser evaluados en campo. Esto permite avanzar más eficazmente, al ahorrar recursos y evaluar mayor cantidad de materiales en la búsqueda de la fuente de resistencia.
Identificación del grupo de anastomosis de aislamientos
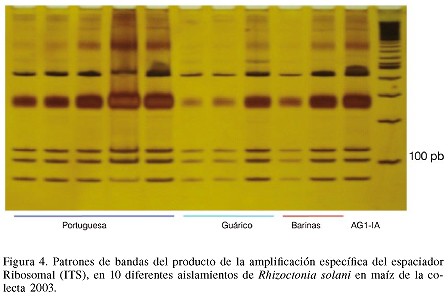
La amplificación efectuada originó un producto de 700pb. La digestión conjunta de las enzimas de restricción AluI y HaeIII dió como resultado un patrón de bandas que fueron visualizadas en PAGE (Figura 4). La comparación del patrón de bandas de la cepa AGI-1A utilizada como probador, con el mostrado por los diferentes aislados además de las pruebas de anastomosis, permitió la identificación de éstos. Los 10 aislamientos provenientes de la colecta 2003 mostraron similitud de bandas entre ellos y con el probador del grupo AGI-1A. Igual comportamiento fue descrito por Hernández et al. (2003b) al realizar el mismo análisis en 15 de los aislamientos utilizados en este estudio, provenientes de zonas productoras de maíz en la colecta 2002 y utilizando diferentes probadores, como testigos, de 9 grupos de anastomosis. El análisis en conjunto de las dos colectas realizadas confirma que el grupo de anastomosis que está afectando la producción de maíz en Venezuela, es del grupo intraespecífico AG1-1A.
Conclusiones
Las características descritas para cada uno de los aislamientos evaluados se corresponden con las de la especie Rhizoctonia solani, encontrándose rangos variables entre los diferentes aislamientos.
El método de amplificación especifica del espaciador interno ribosomal (rADN-ITS), permitió verificar que los aislamientos de R. solani evaluados pertenecen al grupo de anastomosis AGI-1A
En la prueba de virulencia en cinetina, los niveles de virulencia de los aislamientos fueron variables, encontrándose dentro del grupo de mayor virulencia las cepas G1SOM1, P2TUR3, Y2SP1, P2TUR2 y P2TUR5.
La evaluación de virulencia en condiciones de invernadero mostró que los niveles de virulencia de los aislamientos fueron variables, encontrándose dentro del grupo de mayor virulencia las cepas B1TOR1, P2TUR6, B2SAB1 y Y2SP1.
El comportamiento diferencial existente entre los aislamientos de R. solani y las dos líneas de maíz, indica que cada aislamiento tiene un comportamiento particular de virulencia, el cual se corresponde con la variabilidad mostrada en las características estudiadas en cada uno de los 25 aislamientos.
REFERENCIAS
1. Ahuja S, Payak M (1978) A field inoculation technique for evaluating maize germplasm to banded leaf and sheath blight. Indian Phytopathol. 31: 517-520 [ Links ]
2. Ahuja S, Payak M (1981) A laboratory method for evaluating maize germplasm to banded leaf and sheath blight. Indian Phytopathol. 34: 34-37. [ Links ]
3. Armentrout V, Downer A, Grasmick D, Weinhold A (1987) Factors affecting infection cushion development by Rhizoctonia solani on cotton. Phytopathology 77: 623-630. [ Links ]
4. Bastidas RO (2003) Comportamiento de cincuenta líneas de maíz (Zea mays L.) ante la incidencia de Rhizoctonia solani Kühn, en las condiciones de Agua Blanca, estado Portuguesa. Tesis. Universidad Centroccidental Lisandro Alvarado. Venezuela. [ Links ]
5. Cabrera S (2002) Prácticas de manejo para el control de la mancha bandeada de la hoja (Rhizoctonia solani). Determinación de los niveles de incidencia, severidad y efecto sobre el peso de la mazorca en siembras comerciales de maíz. INIA-CIAE. Portuguesa, Venezuela. 315 pp. [ Links ]
6. Cabrera S, García P (2000) Incidencia, severidad y efecto sobre el peso de la mazorca de maíz (Zea mays L.) de la mancha bandeada Rhizoctonia solani, en siembras comerciales en el estado Portuguesa. V Jornadas Científicas Nacional del Maíz. Guanare, Venezuela. p. 101. [ Links ]
7. Cardona R, Rodríguez H, Nass H (1999) Manchas bandeadas en maíz causadas por Rhizoctonia solani en Portuguesa, Venezuela. Fitopatol. Venez. 12: 32-33. [ Links ]
8. Carling D, Summer D (1992) Rhizoctonia. En Singleton LL, Mihail JD, Rush CM (Eds.) Methods for research on soilborne phytopathogenic fungi. The American Phythopathological Society. St. Paul, MN, EEUU. pp. 155-165. [ Links ]
9. Cedeño L, Nass H, Carrero CH, Cardona R, Rodríguez H, Alemán L (1996) Rhizoctonia solani AG1-1A, causa principal del añublo de la vaina del arroz en Venezuela. Fitopatol. Venez. 9: 6-9. [ Links ]
10. Da Silveira SF, Alfenas AC, Ferreira FA, Sutton JC (2000) Characterization of Rhizoctonia species associates with foliar necrosis and leaf scorch of clonally-propagated eucalyptus in Brazil. Eur. J. Plant Pathol. 106: 27-36 [ Links ]
11. De León C (1995) Banded leaf and sheath blight of maize. The situation in Asia. FLCGNET Newsletter 33: 5-6. [ Links ]
12. Dodman R, Barker K, Walker J (1968a) Modes of penetration by differents isolates of Rhizoctonia solani. Phytopathology 58: 31-33. [ Links ]
13. Dodman R, Barker K, Walker J (1968b) A detailed study of the different modes of penetration by Rhizoctonia solani. Phytopathology 58: 1271-1276. [ Links ]
14. Fontana H, González C (2000) El cultivo de maíz en Venezuela. 1a ed. Fundación Polar. Caracas, Venezuela. 530 pp. [ Links ]
15. Hernández A, Galindo I, Sánchez B, Pineda J, Barrientos V, González A, Gil E (2003a) Amplificación de rADN y posterior análisis del producto de digestión como un método de identificación de grupos de anastomosis de Rhizoctonia solani. I Cong. Venez. Mejoramiento y Biotecnología Agrícola. Maracay, Venezuela. [ Links ]
16. Hernández A, Galindo I, Sánchez B, Pineda J, González A, Gil E (2003b) Identificación de grupos de anastomosis de Rhizoctonia solani mediante rDNA, ITS en diferentes aislados provenientes de las zonas productoras de maíz en Venezuela. Fitopatol. Venez. 16: 57. [ Links ]
17. Johansen D (1940) Plant Microtechnique. McGraw-Hill. Londres, RU. 523 pp. [ Links ]
18. Marchall D, Rush M (1980) Infection cushion formation on rice sheaths by Rhizoctonia solani. Phytopathology 70: 947-950. [ Links ]
19. Nass H, Rodríguez H (1994) Efecto de la lamina de agua y la densidad de siembra sobre el desarrollo de Rhizoctonia solani en arroz. Bioagro 6: 31-34. [ Links ]
20. Ogoshi A (1987) Ecology and pathogenicity of anastomosis intraespecific groups of Rhizoctonia solani Kühn. Annu. Rev. Phytopathol. 25: 125-143. [ Links ]
21. Papavizas G (1970) Colonization and growth of Rhizoctonia solani in soil. En Parmeter J Jr (Ed.) Rhizoctonia solani Biology and Pathology. University of California Press. Berkeley, CA, EEUU. pp. 108-121. [ Links ]
22. Parmeter J, Whitney H (1970) Taxonomy and nomenclature of the perfect stage. En Parmeter J Jr (Ed.) Rhizoctonia solani Biology and Pathology. University of California Press. Berkeley, CA, EEUU. pp. 7-19. [ Links ]
23. Vidhasekaran P, Ponmalar R, Samiyappan T, Velazhahan R, Vimala R, Ramanathan V, Muthukrishnan S (1997) Host- specific toxin production by Rhizoctonia solani, the rice sheath blight pathogen. Phytopathology 87: 1258-1263. [ Links ]
24. Zambrano C, Molina N, Cabrera S (2002) Manejo integrado de la mancha bandeada (Rhizoctonia solani Kühn) de la hoja del maíz. INIA-CIAE Portuguesa, Venezuela. 523 pp. [ Links ]












 uBio
uBio