Interciencia
versión impresa ISSN 0378-1844
INCI v.32 n.11 Caracas nov. 2007
ACTIVIDAD FIBROLíTICA DE ENZIMAS PRODUCIDAS POR Trametes sp. EUM1, Pleurotus ostreatus IE8 Y Aspergillus niger AD96.4 EN FERMENTACIÓN SÓLIDA
Alis Teresa Márquez-Araque, Germán David Mendoza Martínez, Sergio Segundo González Muñoz, Silvia Elena Buntinx Dios y Octavio Loera Corral
Alis Teresa Márquez Araque. Ingeniero de Producción Animal, Universidad Centrocidental Lisandro Alvarado (UCLA), Venezuela. Estudiante de Doctorado en Ciencias de la Producción y Salud Animal, Universidad Nacional Autónoma de México (UNAM). Dirección: Facultad de Medicina Veterinaria y Zootecnia. UNAM. 04510. México, DF. e-mail: alismarquez@yahoo.es
Germán David Mendoza Martínez. Médico Veterinario Zootecnista. Ph.D., University of Nebraska, EEUU. Profesor, Universidad Autónoma Metropolitana, Xochimilco, México.
Sergio Segundo González Muñoz. Ph.D. en Nutrición de Rumiantes, University of Nebraska, EEUU. Profesor, Colegio de Postgraduados, Montecillo, México.
Silvia E. Buntinx Dios. Médica, Veterinaria Zootecnista, UNAM, México. M.Sc. y Ph.D. Nutrición Animal, North Calolina State, University, EEUU. Profesora UNAM, México.
Octavio Loera Corral. Ingeniero Bioquímico. Doctor en Biociencias, University of Manchester, RU. Profesor, Universidad Autónoma Metropolitana, Iztapalapa, México.
RESUMEN
Se estudió la actividad de enzimática (UI·g-1·MS) y la actividad específica (UI·mg-1 proteína) de xilanasas, celulasas y lacasas de Trametes sp. EUM1, Pleurotus ostreatus IE8 y Aspergillus niger AD96.4, a los 14 y 19 días de fermentación sólida en bagazo de caña de azúcar. Las xilanasas y celulasas producidas por Trametes sp. EUM1 mostraron la mayor actividad (P<0,01) expresando 141,77UI·g-1 MS y 1073,8UI·mg-1 proteína las primeras, y 9,04UI·g-1 MS y 69,16UI·mg-1 proteína las celulasas, sin diferencias significativas entre 14 y 19 días. La actividad de estas enzimas de P. ostreatus y A. niger fue menor (P<0,01) que Trametes sp., pero similar entre ellos y en ambos tiempos de fermentación. La mayor (P<0,01) actividad de lacasas fue expresada por P. ostreatus con promedios de 15,54UI·g-1 MS y 128,75UI·mg-1 proteína a los 14 días de fermentación, mayores (P<0,01) que a los 19 días (11,75UI·g-1 MS y 102,88UI·mg-1 proteína). En Trametes sp., la actividad de lacasas fue menor (P<0,01) que en P. ostreatus y similar en ambos tiempos de fermentación. En A. niger la actividad de lacasas fue menor (P<0,01) con respecto a Trametes sp. y P. ostreatus. La actividad de las enzimas fibrolíticas del Trametes sp. muestra potencial para su posible utilización en aplicaciones biotecnológicas.
Fibrolytic activity of enzymes produced by Trametes sp. EUM1, Pleurotus ostreatus IE8 and Aspergillus niger AD96.4 in solid fermentation
SUMMARY
The enzymatic activity (UI·g-1·dry matter) and specific activity (UI·mg-1 protein) of xylanases, celullases and laccases from the fungi Trametes sp. EUM1, Pleurotus ostreatus IE8 and Aspergillus niger AD96.4 was studied at 14 and 19 days of solid fermentation in sugar cane bagasse. The highest activity of xylanases and celullases (P<0,01) was expressed by Trametes sp., with averages of 141.77UI·g-1 DM and 1073.8UI·mg-1 protein for xylanases, and 9.04UI·g-1 DM and 69.16UI·mg-1 protein for cellulases, without significant differences at 14 and 19 days. P. ostreatus and A. niger showed lower activities of these enzymes than Trametes sp., but they were similar among them and in both fermentation periods. The higher (P<0.01) laccasse activity was expressed by P. ostreatus with averages of 15.54UI·g-1 DM and 128.75UI·mg-1 protein at 14 days, higher (P<0.01) than at 19 days (11.75 UI·g-1 DM and 102.88UI·mg-1 protein). In Trametes sp. the laccasse activity was lower than in P. ostreatus and similar in both fermentation times. In A. niger the laccasse activity was lower (P<0.01) than Trametes sp. and P. ostreatus. The activity of fibrolytic enzymes in Trametes sp. EUM1 indicates a potential use for biotechnological applications.
ATIVIDADE FIBROLÍTICA DE ENZIMAS PRODUZIDAS POR Trametes sp. EUM1, Pleurotus ostreatus IE8 E Aspergillus niger AD96.4 EM FERMENTAÇÃO SÓLIDA
RESUMO
Estudou-se a atividade enzimática (UI·g-1·MS) e a atividade específica (UI·mg-1 proteína) de xilanases, celulases e lacases de Trametes sp. EUM1, Pleurotus ostreatus IE8 e Aspergillus niger AD96.4, aos 14 e 19 dias de fermentação sólida em bagaço de cana de açúcar. As xilanases e celulases produzidas por Trametes sp. EUM1 mostraram a maior atividade (P<0,01) expressando 141,77UI·g-1 MS e 1073,8UI·mg-1 proteína as primeiras, e 9,04UI·g-1 MS e 69,16UI·mg-1 proteína as celulases, sem diferenças significativas entre 14 e 19 dias. A atividade destas enzimas de P. ostreatus e A. niger foi menor (P<0,01) que Trametes sp., mas similar entre elas e em ambos tempos de fermentação. A maior (P<0,01) atividade de lacases foi expressada por P. ostreatus com médias de 15,54UI·g-1 MS e 128,75UI·mg-1 proteína aos 14 dias de fermentação, maiores (P<0,01) que aos 19 dias (11,75UI·g-1 MS e 102,88UI·mg-1 proteína). Em Trametes sp., a atividade de lacases foi menor (P<0,01) que em P. ostreatus e similar em ambos tempos de fermentação. Em A. niger a atividade de lacases foi menor (P<0,01) em relação à Trametes sp. e P. ostreatus. A atividade das enzimas fibrolíticas do Trametes sp. mostra potencial para sua possível utilização em aplicações biotecnológicas.
PALABRAS CLAVE / Enzimas Fibrolíticas / Hongos / Tiempo de Fermentación /
Recibido: 17/10/2006. Modificado: 28/09/2007. Aceptado: 02/10/2007.
Introducción
Una estrategia para mejorar la utilización de los alimentos, particularmente aquellos fibrosos, por parte de los rumiantes es el tratamiento de forrajes con enzimas fibrolíticas exógenas o su inclusión como suplemento en la ración (Dawson y Tricarico, 1999). Los complejos de enzimas fibrolíticas se obtienen principalmente de extractos de fermentación de hongos aeróbicos. Los más utilizados para elaborar productos comerciales son Aspergillus niger, Trichoderma longibrachiatum (Beauchemin et al., 1995; Nadeau et al., 2000) y Penicilium funiculosum (Liu y Orskov, 2000).
Los hongos de los géneros Pleurotus y Trametes tienen habilidad para degradar fibra, ya que producen diferentes complejos enzimáticos lignocelulolíticos (Marzullo et al., 1995; Levin y Forchiassin, 1997). La mayoría de las enzimas caracterizadas en estos hongos son del tipo de las oxidasas (lacasas y Mn-peroxidasa) que se han utilizado principalmente en el tratamiento de aguas residuales o productos recalcitrantes (Rodríguez et al., 2003; Camarero et al., 2005). Algunos estudios indican que el tratamiento de materiales lignocelulósicos con Pleurotus ocasiona cambios en la composición química, reduciendo las fracciones fibra detergente neutro, fibra detergente ácido, celulosa y hemicelulosa (Fazaeli et al., 2003; Castro et al., 2004), efectos éstos que se asocian con la producción de enzimas fibrolíticas (Villa-Cruz et al., 1999; Sun et al., 2004). En algunas especies de Trametes se ha identificado la enzima celobiosa deshidrogenasa, importante en la degradación de celulosa (Dumonceaux et al., 2001; Ludwing et al., 2004). Por otra parte, diferentes cepas de Aspergillus niger son reconocidas productoras de xilanasas (Park et al., 2002; Wu et al., 2005) y de celulasas (Onsori et al., 2005).
El tipo y actividad de las enzimas producidas puede variar dependiendo del microorganismo y de la cepa, del sustrato de crecimiento y de las condiciones de cultivo, así como del tiempo empleado para la producción de las enzimas (Lee et al., 1998; Nsereko et al., 2000; Park et al., 2002).
En fermentación sólida, utilizando rastrojo de maíz como sustrato, la cepa Pleurotus ostreatus IE8 presentó actividad fibrolítica (Ávila, 2005). La cepa Aspergillus niger AD96.4 fue obtenida por un proceso de recombinación parasexual entre cepas de A. niger productoras de enzimas como invertasas y pectinasas en fermentación sólida (Montiel-González et al., 2002). Posteriormente, esta misma cepa fue ensayada en la producción de xilanasas, mostrándose su capacidad para sobreproducir estas enzimas en comparación con las cepas originales (Loera y Córdova, 2003). La cepa de Trametes sp. EUM1 fue aislada a partir de desechos ricos en lignocelulosa y tiene capacidad de producir lacasas termotolerantes (Márquez et al., 2004, 2005).
Estas cepas podrían representar una alternativa para obtener extractos enzimáticos con el fin de ser utilizados como fuentes de enzimas fibrolíticas exógenas para su uso en alimentación de rumiantes. Sin embargo, sus actividades fibrolíticas aun no están definidas, por lo que se planteó el objetivo de caracterizar la actividad de las enzimas fibrolíticas producidas por estos hongos en dos tiempos de fermentación en bagazo de caña.
Materiales y Métodos
Cepas de hongos
Se utilizaron las cepas Pleurotus ostreatus IE8, perteneciente a la colección del Colegio de Posgraduados de México, así como las cepas Trametes sp. EUM1 y Aspergillus niger AD96.4 de la colección de hongos del Laboratorio de Biología Molecular de la Universidad Autónoma Metropolitana Iztapalapa, México.
Inóculos y medio de fermentación
Los inóculos de los hongos Trametes sp. EUM1 y P. ostreatus IE8 se sembraron en cajas de Petri, mientras que el inóculo de A. niger AD96.4 se sembró en matraces de 125ml. El medio de crecimiento para todos los hongos fue agar extracto de malta y el tiempo de crecimiento fue de 7 días. Para el proceso de fermentación sólida se colocaron 12g de bagazo de caña en matraces de 250ml. El tamaño de partícula del bagazo fue entre 0,5 y 1cm y se ajustó la humedad al 80%. Posteriormente, los matraces con el bagazo se esterilizaron en autoclave a 121ºC y 1034,21milibar durante 30min. Cada matraz fue inoculado con cinco discos de micelio-agar de 6mm de diámetro de Trametes o Pleurotus, y con una solución que contenía 2x107 esporas de A. niger por g de bagazo. El Trametes se incubó a 34ºC, mientras que Pleurotus y Aspergillus fueron incubados 30ºC, durante 14 y 19 días de fermentación.
Extracción de enzimas
Al tiempo definido de fermentación, se adicionó a cada matraz 30ml de solución amortiguadora de citrato 50mM, pH 5,3 y se agitaron durante 15min. Posteriormente se centrifugaron a 12000g por 30min para separar el sobrenadante o extracto enz imático.
Determinación de la actividad enzimática y concentración de proteína
La actividad de xilanasas y celulasas se midió aplicando el procedimiento de Loera y Córdova (2003), y la concentración de azúcares reductores por el método del ácido dinitrosalicílico (DNS; Miller, 1959). Como sustratos, para la actividad de xilanasas se usó xilano de avena (Sigma X-0627) y para la de celulasas, carboximetilcelulosa sal de sodio (CMC, Medium viscosity; Sigma-Aldrich C4888) al 0,5%, que fueron disueltos a razón de 2,5g en 500ml de solución amortiguadora de citrato (50mM; pH 5,3). La mezcla de reacción se hizo con 0,9ml de sustrato y 0,1ml de extracto enzimático en un tubo de ensayo. Los tubos se incubaron a 50ºC durante 5min para xilanasas, o 1h para celulasas. Seguidamente, a cada tubo de ensayo se añadió 1,5ml de solución de DNS. Los tubos fueron colocados en un baño de maría de agua en ebullición y se dejaron hervir por 5min, se sacaron e inmediatamente se introdujeron en un recipiente con hielo para detener la reacción. Para cada muestra se preparó un blanco en el que el extracto enzimático se agregó después de aplicar el DNS, con el fin de corregir por azúcares presentes en el extracto enzimático. El blanco de reactivos consistió de 0,9ml de sustrato y 0,1ml de solución amortiguadora de citrato y fue utilizado para ajustar la absorbancia. Para cada muestra y blancos correspondientes se midió la absorbancia en un espectrofotómetro (DU640 Beckman) a 540nm. La concentración de azúcares reductores se calculó mediante una ecuación de regresión, obtenida de una curva patrón con b-D-glucosa y D-xilosa para glucosa y xilosa, respectivamente, que relaciona la absorbancia con la cantidad de azucares presentes en la mezcla de reacción.
La actividad enzimática de xilanasas y celulasas se reportó en Unidades Internacionales (UI), definiendo la UI como la cantidad de enzima que libera 1µmol de azúcares reductores (xilosa o glucosa) por minuto en las condiciones de la reacción. Para cada fermentación la actividad se expresó en UI por gramos de materia seca (UI·g-1 MS) y como actividad específica (UI·mg-1 de proteína). La concentración de proteína fue determinada con el método de Bradford (1976).
La actividad de lacasas fue determinada en la mezcla de reacción conteniendo 0,1ml de solución amortiguadora de acetato (0,1mM; pH 5,0), 0,7ml de agua destilada y 0,1ml de extracto enzimático. Esta mezcla se incubó por 1min a 40ºC y, posteriormente, se adicionó 0,1ml del substrato ABTS (2, 2 Azino-bis (3-etilbenz-thiazoline-6-sulfonic acid) 0,1M, y se registró la absorbancia a 420nm a los 0, 1, 2, 3 y 5 minutos (Bourbonnais et al., 1997). La concentración de sustrato oxidado (C; mol) se determinó con la ecuación C= A/e, donde A: absorbancia y e coeficiente de extinción molar del substrato (36,000M-1·cm-1). La unidad de actividad (UI) se definió como la cantidad de enzima que produce 1µmol·min-1 de substrato oxidado bajo las condiciones de la reacción.
Diseño experimental y análisis estadístico
El experimento fue realizado con un diseño completamente aleatorizado con arreglo factorial (Steel y Torrie, 1986) y cuatro repeticiones por tratamiento. Los factores fueron la especie de hongo (3 especies) y el tiempo de fermentación (14 y 19 días). Los datos se analizaron mediante el procedimiento GLM del SAS (2001). Las medias se compararon por la prueba de Tukey (Steel y Torrie, 1986).
Resultados
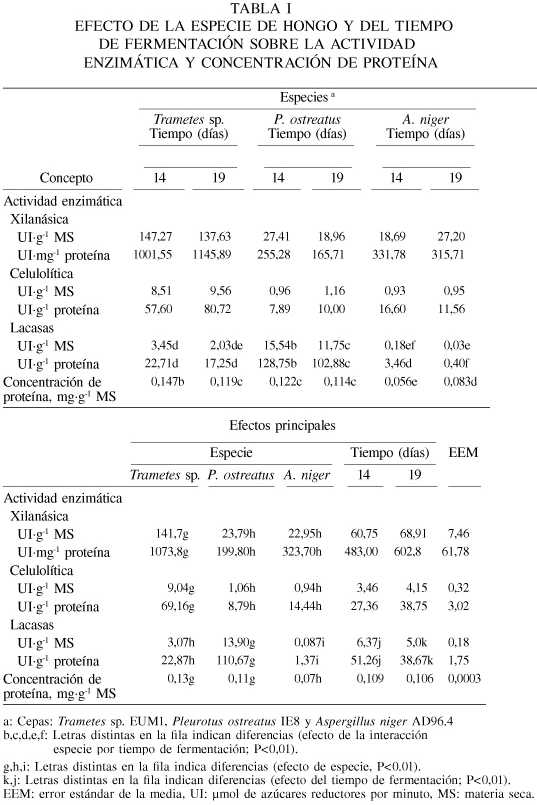
La actividad de las enzimas y la concentración de proteína de los extractos de las tres cepas de hongos estudiados se muestran en la Tabla I. No hubo interacción especie de hongo por tiempo de fermentación sobre la actividad de xilanasas. Trametes sp. presentó una mayor (P<0,01) actividad xilanásica que P. ostreatus y A. niger, no detectándose diferencias entre estas últimas. Con respecto al tiempo de fermentación, la actividad xilanásica a los 14 y 19 días no fue diferente para ninguna de las especies.
Se observó efecto (P<0,01) de la especie de hongo en la actividad celulolítica, pero no se detectó efecto alguno del tiempo de fermentación o de la interacción especie por tiempo de fermentación. Trametes sp. presentó la mayor actividad, mientras que el P. ostreatus y A. niger mostraron niveles similares de actividad. La actividad de celulasas fue similar a los 14 y 19 días de fermentación.
Hubo interacción especie de hongo por tiempo de fermentación para actividad de lacasas (P<0,01). En ambos tiempos de fermentación, la mayor actividad de lacasas fue expresada por P. ostreatus, pero su actividad disminuyó (P<0,01) a los 19 días. En contraste, Trametes sp. mostró una actividad de lacasas menor y ésta se mantuvo igual en ambos tiempos de fermentación. A. niger presentó la menor actividad de lacasas y cuando fue expresada como actividad específica disminuyó (P<0,01) a los 19 días de fermentación en comparación a los 14 días.
Se observó un efecto de la interacción especie de hongo por tiempo de fermentación (P<0,01) para la concentración de proteína. El extracto de Trametes sp. presentó mayor concentración promedio a los 14 días, mientras que en P. ostreatus fue similar en los dos tiempos y en A. niger fue mayor a los 19 días de fermentación. La correlación entre la concentración de proteína y la actividad de xilanasas y celulasas fue mediana (r2=0,57; P<0,01), mientras que la concentración de proteína no estuvo relacionada con la actividad de lacasas (r2=0,40; P>0,05).
Discusión
Por su estructura compleja y heterogénea, la degradación de la fibra por hongos requiere de un complejo sistema enzimático, en el que las polisacaridasas (xilanasas y celulasas) actúan en conjunto con enzimas lignolíticas (Eichlerová et al., 2000). En las tres especies de hongos utilizadas se detectó actividad de celulasas, xilanasas y lacasas, aun cuando se observaron algunas diferencias entre ellas. La mayor actividad de xilanasas fue expresada por Trametes sp. EUM1, con niveles similares en los dos tiempos de fermentación. A los hongos del género Trametes sp. se les reconoce principalmente como productores de enzimas celulasas y lignolíticas (Grey et al., 1998; Moldes et al., 2003; Machado et al., 2005). Algunas especies como el Trametes versicolor, T. trogii y T. gallica son eficientes degradadores de celulosa, hemicelulosa y lignina, los tres principales componentes de la madera (Dumonceaux et al., 2001; Sun et al., 2002).
De las enzimas xilanolíticas, las más estudiadas en hongos han sido las endoxilanasas y b-xilosidasas (Polizeli et al., 2005). En T. trogii, Levin y Forchiassin (1998) observaron las máximas actividades de b-xilosidasas y endoxilanasas entre los días 13 y 15 de incubación en medio líquido, respectivamente, reportando niveles de actividad de 423,0mU·ml-1 para endoxilanasas y de 38,57mU·ml-1 para b-xilosidasas en cultivo con xilano de avena y celulosa cristalina, indicando que la producción de xilanasas fue eficientemente inducida por la celulosa y el xilano. Sun et al. (2004) reportaron que la especie T. gallica produce al menos dos tipos de enzimas con actividad de xilanasas de 33,3UI·ml-1 cuando crece en paja de trigo durante 14 días.
El bagazo de caña puede favorecer la producción de muchas enzimas lignocelulolíticas, incluyendo las xilanasas (Jain, 1995) puesto que contiene cantidades significativas de celulosa y hemicelulosa (Howard et al., 2003), lo que posiblemente permitió que Trametes sp. expresara su actividad xilanolítica en este estudio.
En algunos productos comerciales utilizados para alimentación de rumiantes derivados de Trichoderma sp. y Aspergillus niger se encontraron niveles de actividad de xilanasas de 153,0; 138; 130 y 198µmol·g-1 enzima·min-1 (Nsereko et al., 2000), y de 222,16; 134,77 y 229,31µmol glucosa·min-1·mg-1 proteína (Ramírez et al., 2005).
La actividad de celulasas en Trametes sp. fue superior a P. ostreatus y A. niger, sin diferencias en los tiempos de fermentación. La degradación de la celulosa por hongos requiere de un complejo celulolítico de al menos tres enzimas que actúan en forma sinérgica: b-1,4 endoglucanasa, b-1,4 exoglucanasa y b-glucosidasa. Se ha estudiado la producción de enzimas celulolíticas en varias especies y cepas de Trametes, encontrándose que T. trogii produce un sistema celulolítico complejo cuando crece en medio con celulosa (Levin y Forchiassin 1995, 1997), la cual se considera esencial para la inducción de la síntesis de celulasas (Yoshida et al., 2002; Ludwing et al., 2004).
Ludwing et al. (2004) reportaron niveles de actividad de celobiosa deshidrogenasa en 11 cepas de Trametes, destacándose las cepas T. pubescens MB89 con 2,10U·ml-1 a los 13 días, T. versicolor MB52 con 2,03U·ml-1 a los 11 días, T. hirsuta MB50 con 0,95U·ml-1 a los 10 días y T. villosa CBS 334,49 con 759U·l-1 a los 13 días, en medio de crecimiento a base de celulosa.
P. ostreatus también ha sido reconocido como productor de enzimas lignolíticas (Guillén-Navarro et al., 1998; Eichlerová et al., 2000), más que de celulasas y xilanasas. En el presente estudio la actividad de xilanasas y celulasas expresada por P. ostreatus IE8 fueron superiores a los reportados para la misma cepa por Ávila (2005), quien encontró una máxima actividad de xilanasas de 0,195UI·g-1 MS y de celulasas de 0,073UI·g-1 MS a los 12 días de fermentación en rastrojo de maíz. Ghosh et al. (2004) señalaron que la actividad de carboximetilcelulasa, b-glicosidasa y xilanasas alcanzaron su máximo a los 16 días de crecimiento de P. ostreatus en seudotallo de banano (1,1; 0,09 y 1,1U·ml-1, respectivamente). En las cepas P19 y F6 de P. ostreatus se encontró actividad de celulasas de 11,4 y 10,14U·mg-1 MS, mientras que la de xilanasas fue ligeramente mayor, con valores de 19,02 y 0,22U·mg-1 MS para P19 y F6, respectivamente (Eichlerová et al., 2000).
Las actividades de xilanasas y celulasas observadas en A. niger AD96.4, fueron menores con respecto a Trametes sp., y a otros estudios con la misma especie. Se ha reportado que algunas especies de Aspergillus son eficientes productores de xilanasas (Pandey y Pandey, 2002; Wu et al., 2005) y se utilizan para producir enzimas comerciales. La baja actividad observada en este estudio puede estar relacionada con la duración de la fermentación, ya que en algunos reportes se indica que la máxima actividad de xilanasas se expresa entre los 3 y 5 días (Deschamps y Huet, 1985; Lenartovicz et al., 2002; Loera y Córdova, 2003). En el presente estudio esta actividad pudo decaer hasta los niveles observados a los 14 y 19 días de fermentación. Park et al. (2002) reportaron que el tiempo de cultivo y la concentración del medio fueron los factores que más influyeron en la actividad xilanásica de A. niger KK2, al encontrar valores entre 168 y 1177UI·g-1, con máximos niveles de actividad a los 5 días de fermentación en paja de arroz como medio de cultivo.
Las enzimas lacasas (fenol oxidasas) producidas por hongos participan en la degradación de lignina (Johannes y Majcherczyk, 2000). El género Pleurotus es conocido por producir una variedad de enzimas hidrolíticas y oxidativas (Bajpai, 1997; Mandel et al., 2005). En este estudio, el P. ostreatus IE8 presentó la mayor actividad de lacasas, y el nivel máximo fue registrado a los 14 días. En estudios previos con la misma cepa, Ávila (2005) detectó la máxima actividad al día 8 de la fermentación (5,38U·g-1 MS), la cual fue menor a la observada en este estudio. En otro reporte se indica que P. ostreatus 98 y P. ostreatus 108 expresaron sus máximas actividades de lacasas a los 5 y 8 días de cultivo, respectivamente (Mikiashvili et al., 2006), mientras que según Ghosh et al. (2004) P. ostreatus expresó la máxima actividad (3,0U·ml-1) a los 24 días. Estos resultados sugieren que existen varios factores que pueden afectar la actividad de las lacasas, como el tipo de cepa, el sustrato y el tiempo de fermentación.
La actividad de lacasas en varias especies de Trametes se relaciona con las condiciones de cultivo, y se destaca la fuente de carbonos, el pH del caldo de fermentación, la presencia de inductores y de materiales lignocelulósicos (Ardon et al., 1998; Sethuraman et al., 1999; Krishna Prasad et al., 2005), y el tiempo de fermentación. De manera similar a lo obtenido en el presente estudio, Moldes et al. (2003) observaron que los niveles de lacasas se incrementan durante el crecimiento del T. hirsuta, alcanzando su máximo a los 15 días de crecimiento. En T. trogii (CTM 10156) Dhouib et al. (2005) encontraron la máxima actividad de lacasas (110U·ml-1) el día 15, en condiciones óptimas de cultivo, a diferencia de Machado et al. (2005) que reportan la máxima actividad de lacasas para T. versicolor (CCB202), T. villosa (CCB165) y T. villosa (CCB213) de 10,7; 12,5; 2,3 y 3,1U·l-1 respectivamente, a los 7 días de crecimiento. En A. niger la actividad de lacasas fue significativamente muy baja.
En conclusión, se observó que Trametes sp. EUM1 produjo mayor cantidad de xilanasas que P. ostreatus IE8 y A. niger AD94.6, con valores similares a los 14 y 19 días de fermentación, lo que permite considerar con potencial a esta especie de hongo para producir enzimas con posible aplicación comercial, particularmente como enzimas exógenas para la alimentación de rumiantes.
AGRADECIMIENTOS
Los autores agradecen a CONACYT (Proyecto J42782-Z) por el financiamiento parcial de la investigación.
Referencias
1. Ardon O, Kerem Z, Hadar Y (1998) Enhancement of lignin degradation and laccase activity in Pleurotus ostreatus by cotton stalk extract. Can. J. Microbiol. 44: 676-680. [ Links ]
2. Ávila H (2005) Enzimas fibroliticas de Pleurotus ostreatus y su actividad en rastrojo de maíz. Tesis. Colegio de Posgraduados. Montecillo, Edo. de México. 92 pp. [ Links ]
3. Bajpai P (1997) Microbial xylanolytic enzyme system: properties and applications. Adv. Appl. Microbiol. 43: 141-194. [ Links ]
4. Beauchemin KA, Rode LM, Sewalt VJ (1995) Fibrolytic enzymes increase fiber digestibility and growth rate of steers fed dry forages. Can. J. Anim. Sci. 75: 641-644. [ Links ]
5. Bourbonnais R, Pice MG, Freiermuth B, Bodie E, Borneman S (1997) Reactivities of various mediators and laccases with kraft pulp and lignin model compounds. Appl. Environ. Microbiol. 63: 4627-4632. [ Links ]
6. Bradford MM (1976) A rap id and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 72: 248-252. [ Links ]
7. Camarero S, Ibarra D, Martínez MJ, Martínez AT (2005) Lignin-derived compounds as efficient laccase mediators for decolorization of different types of recalcitrant dyes. Appl. Environ. Microbiol. 71: 1775-1784. [ Links ]
8. Castro AL, De Aguiar Paiva PC, Souza Dias E, Dos Santos J (2004) Avaliação das alterações bromatológicas e degradabilidade do residuo de lixiviadera do algodón apos tratamento biológico com Pleurotus sajor-caju. Cienc. Agrotec. Lavras 28: 608-613. [ Links ]
9. Dawson KA, Tricarico JM (1999) The use of exogenous fibrolytic enzymes to enhance microbial activities in the rumen and the performance on ruminant animals. En Lyons TP, Jacques KA (Eds.) Proc. 15th Annu Symp. Biotechnology in the Feed Industry. Nottingham University Press. Loughborough, RU. pp. 303-312. [ Links ]
10. Deschamps F, Huet MC (1985) Xylanase production in solid-state fermentation: a study of its property. Appl. Microbiol. Biotechnol. 22: 177-180. [ Links ]
11. Dhouib A, Hamza M, Zouari H, Mechichi T, H'midi R, Labat M, Martínez M, Sayadi S (2005) Autochthonous fungal strains with high ligninolytic activities from Tunisian biotopes. Afr. J. Biotechnol. 4: 431-436. [ Links ]
12. Dumonceaux T, Bartholomew K, Valeanu L, Charles T, Archibald A (2001) Cellobiose dehydrogenase is essential for wood invasion and nonessential for kraft pup delignification and Trametes versicolor. Enz. Microb. Technol. 29: 478-489. [ Links ]
13. Eichlerová I, Ruel K, Homolka L, Joseleau J-P, Nerud F (2000) Ligninolytic characteristics of Pleurotus ostreatus strain F6 and its monokariotic protoplast derivate P19. Can. J. Microbiol. 46: 1153-1158. [ Links ]
14. Fazaeli H, Azizi A, Jelan ZA, Mirhadi SA (2003) Effect of fungal treatment on the chemical composition, in vitro digestibility and in sacco degradability of wheat straw. Proc. Br. Soc. Anim. Sci. 166 pp. [ Links ]
15. Ghosh M, Mukherjee R, Nandi B (2004) Production of extracellular enzymes by two Pleurotus species using banana pseudostem biomass. Acta Biotechnol. 18: 243-254. [ Links ]
16. Grey R, Hofer C, Schlosser D (1998) Degradation of 2-chlorophenol and formation of 2-chloro-1,4-benzoquinona by mycelia and cell-free crude culture liquids of Trametes versicolor in relation to extracellular laccase activity. J. Bas. Microbiol 5-6: 371-382. [ Links ]
17. Guillén-Navarro GK, Márquez-Rocha F, Sánchez Vázquez JE (1998) Producción de biomasa y enzimas lignolíticas por Pleurotus ostreatus en cultivo sumergido. Rev. Iberoam. Micol. 15: 302-306. [ Links ]
18. Howard RL, Abotsi E, Jansen van Rensburg EL, Howard S (2003) Lignocellulose biotechnology: Issues of bioconversion and enzyme production. Afr. J. Biotechnol. 2: 602-619. [ Links ]
19. Jain A (1995) Production of xylanase by thermophilic Melanocarpus albomyces PS-68. Process Biochem. 30: 705-709. [ Links ]
20. Johannes C, Majcherczyk A (2000) Laccase activity test and laccase inhibitor. J. Biotechnol. 78: 193-199. [ Links ]
21. Krishna Prasad K, Venkata Mohan S, Sreenivas Rao R, Ranjan Pati B, Sarma PN (2005) Laccase production by Pleurotus ostreatus 1804: Optimization of submerged culture conditions by Taguchi DOE methodology. Biochem Eng. J. 24: 17-26. [ Links ]
22. Lee B, Pometto AL, Demici A, Hinz PN (1998) Media evaluation for the production of microbial enzymes. J. Agric. Food Chem. 46: 4775-4778. [ Links ]
23. Levin L, Forchiassin F (1995) Influencia de fuentes carbonadas y nitrogenadas sobre la actividad celulolítica de Trametes trogii. Rev. Arg. Microbiol. 27: 11-20. [ Links ]
24. Levin L, Forchiassin F (1997) Efecto de las condiciones de cultivo sobre la producción de celulasas por Trametes trogii. Rev. Arg. Microbiol. 29: 16-23. [ Links ]
25. Levin L, Forchiassin F (1998) Influence of growth conditions on the production of xylanolytic enzymes by Trametes trogii. World J. Microbiol. Biotechnol. 14: 443-446. [ Links ]
26. Lenartovicz V, Marques De Souza CG, Guillén Moreira F, Peralta RM (2002) Temperature effect in the production of multiple xylanases by Aspergillus fumigatus. J. Bas. Microbiol. 42: 388-395. [ Links ]
27. Liu JX, Orskov ER (2000) Cellulase treatment of untreated and steam pre- treated rice straw effect on in vitro fermentation characteristics. Anim Feed Sci. Technol. 88: 189-200. [ Links ]
28. Loera O, Córdova, J (2003) Improvement of xylanase production by a parasexual Cross between Aspergillus niger strains. Braz. Arch. Biol. Technol. 46: 177-181. [ Links ]
29. Ludwing R, Salomón A, Varga J, Zamocky M, Peterauber CK, Kulbe KD, Haltrich D (2004) Characterization of cellobiose dehydrogenase from the white-rot fungi Trametes pubescens and Trametes villosa. Appl. Microbiol. Biotechnol. 64: 213-222. [ Links ]
30. Machado KMG, Matheus DR, Bononi VLR (2005) Ligninolitic enzymes production and Remazol Brilliant Blue R decolorization by tropical brazilian basidiomycetes fungi. Braz. J. Microbiol. 36: 246-252. [ Links ]
31. Mandel QA, Al-Laith AA, Mohamed SA (2005) Cultivation of oyster mushrooms (Pleurotus spp.) on various lignocellulosic wastes. World J. Microbiol. Biotechnol. 21: 601-607. [ Links ]
32. Márquez AE, Arana A, Viniegra-González G, Loera O (2004) Identification of a thermotolerant fungal strain and inducing patterns of its laccases. 7th Eur. Conf. on Fungal Genetics, Copenhagen, Denmark. 194 pp. [ Links ]
33. Márquez AE, Torres R, Arana A, Téllez A, Viniegra-González G, Loera O (2005) Condiciones de producción de lacasas termoestables de Trametes. XI Cong. Nac. Biotecnol. Bioing. Mérida, México. p. CVII1. [ Links ]
34. Marzullo L, Canio R, Giardina P, Sartini MT, Sania G (1995) Veratryl alcohol oxidasa from Pleurotus ostreatus participates in lignin biodegradation and prevent polymerization of laccase-oxidized substrates. J. Biol. Chem. 270: 3823-3827. [ Links ]
35. Mikiashvili N, Wasser SP, Nevo E, Vladimir Elisashvili V (2006) Effects of carbon and nitrogen sources on Pleurotus ostreatus ligninolytic enzyme activity. World J. Microbiol. Biotechnol. htpp://dx.doi.org/.DOI.10.1007/s11274-006-9132-6. pp. 1-4. [ Links ]
36. Miller GL (1959) Use of dinitrosalicylic acid reagent for determination of reducing sugar. Anal. Chem. 31: 426-48. [ Links ]
37. Moldes D, Gallego PP, Rodríguez Couto S, Sanrom A (2003) Grape seeds: the best lignocellulosic waste to produce laccase by solid state cultures of Trametes hirsute. Biotechnol. Lett. 25: 491-495. [ Links ]
38. Montiel-González AM, Fernández FJ, Viniegra-González G, Loera O (2002) Invertase production on solid state fermentation by Aspergillus niger strains improved by parasexual recombination. Appl. Biochem. Biotechnol. 102-103: 63-70. [ Links ]
39. Nadeau EM, Rusell JR, Buxton DR (2000) Intake, digestibility and composition of orchard-grass and alfalfa silages treated with celullase, inoculant, and formic acid fed to lambs. J. Anim. Sci. 78: 2980-2989. [ Links ]
40. Nsereko VL, Morgavi DP, Rode LM, Beauchemin KA, McAllister TA (2000) Effects of fungal preparation on hydrolysis and subsequent degradation of alfalfa hay fiber by mixed rumen microorganism in vitro. Anim. Feed Sci.Technol. 88: 153-170. [ Links ]
41. Onsori H, Raza Zamani M, Motallebi M, Zarghami N (2005) Identification of over producer strain of endo-1,4-glucanase in Aspergillus Species: Characterization of crude carboxymethyl cellulose. Afr. J. Biotechnol. 4: 26-30. [ Links ]
42. Pandey P, Pandey AK (2002) Production of cellulase-free thermosTable xylanases by an isolated strain of Aspergillus niger PPI, utilizing various lignocellulosic wastes. World J. Microbiol. Biotechnol. 18: 281-283. [ Links ]
43. Park YS, Kang SW, Lee JS, Hong SI, Kim SW (2002) Xilanase production in solid state fermentation by Aspergillus niger mutant using statistical experimental designs. Appl. Microbiol. Biotechnol. 58: 762-766. [ Links ]
44. Polizeli ML, Rizzatti AC, Monti R, Terenzi HF, Jorge JA, Amorín DS (2005) Xylanases from fungi: properties and industrial application. Appl. Microbiol. Biotechnol. 67: 577-591. [ Links ]
45. Ramírez L, Aranda E, Mendoza GD, Landois L, Miranda LA, Crosby MM (2005) Caracterización de productos fibrolíticos comerciales utilizados en la alimentación de rumiantes. Vet. Mex. 36: 1-9. [ Links ]
46. Rodríguez S, Fernández M, Bermúdez RC, Horris H (2003) Tratamiento de efluentes industriales coloreados con Pleurotus spp. Rev. Iberoam. Micol. 20: 164-168. [ Links ]
47. SAS (2001) SAS ®Software, Versión 8.2. SAS Institute Inc., Cary, NC, EEUU. [ Links ]
48. Sethuraman A, Akin DE, Ericsson KEL (1999) Production of ligninolytic enzymes and synthetic lignin mineralization by the birds nest fungus Cyathus stercoreus. Appl. Microbiol. Biotechnol. 52: 689-697. [ Links ]
49. Steel RG, Torrie HJ (1986) Bioestadística. Principios y Procedimientos. 2nd ed. McGraw-Hill. México. 620 pp. [ Links ]
50. Sun X, Ren S, Bi R (2002) Lignocelullose degradation of wheat straw by Trametes gallica. J. Microbiol. 22: 24-26. [ Links ]
51. Sun X, Zhang R, Zhang Y (2004) Production of lignocellulolytic enzymes by Trametes gallica and detection of polysaccharide hydrolase and laccase activities in polyacrylamida gels. J. Bas. Microbiol. 44: 220-231. [ Links ]
52. Villa-Cruz V, Huerta-Palacios G, Sánchez-Vázquez JE (1999) Fermentation of a mixture of corn-cobs and coffee pulp for the cultivation of Pleurotus ostreatus. Micol. Neotrop. Appl. 12: 67-74. [ Links ]
53. Wu M, Shi Chang L, Jian Ming Y, Ren Rui P, Zeng Liang Y (2005) Mutant of a xylanase-producing strain of Aspergillus niger in solid state fermentation by low energy ion implantation. World J. Microbiol. Biotechnol. 21: 1045-1049. [ Links ]
54. Yoshida M, Ohira T, Igarashi K, Nagasawa H, Samejima M (2002) Molecular cloning and characterization of a cDNA encoding cellobiose dehydrogenase from the wood-rotting fungus Grifola frondosa. FEMS Microbiol. Lett. 217: 225-230. [ Links ]












 uBio
uBio