Investigación Clínica
versão impressa ISSN 0535-5133versão On-line ISSN 2477-9393
Invest. clín v.45 n.2 Maracaibo jun. 2004
Producción de Anticuerpo Monoclonal (AcMo) con especificidad anti B, para ser utilizado como reactivo de hemoclasificación.
Graciela León, Carlos Cruz y Lola Rojas
Banco Municipal de Sangre del Distrito Capital, Caracas, Venezuela. Correo electrónico: gonzaleo@cantv.net.
Resumen. El objetivo de este trabajo fue producir un AcMo murino con especificidad anti B, el cual pudiera ser utilizado como reactivo de hemoclasificación. Ratones balb/c fueron inmunizados con sustancia antigénica de saliva de donante secretor, con el fin de obtener linfocitos esplénicos o esplenocitos productores de anticuerpos con especificidad anti B. Estos fueron fusionados con células de mieloma de ratón P3-X63.Ag8.653 utilizando PEG. Después de sembradas, las células híbridas o hibridomas resultantes que tuvieron la capacidad de secretar el anticuerpo requerido, fueron sometidas a clonación por dilución límite para asegurar su monoclonalidad. Posteriormente los anticuerpos fueron sometidos a evaluaciones inmunohematológicas e inmunoquímicas. Se obtuvo la clona BMS-4 secretora de anticuerpos IgM kappa, con especificidad anti B, los cuales demostraron tener una alta potencia, excelente avidez, gran sensibilidad y estabilidad en el tiempo. Dado el comportamiento demostrado por los anticuerpos en las evaluaciones realizadas, pensamos que esta clona puede ser utilizada para producir reactivo para la hemoclasificación.
Palabras clave: Anticuerpos monoclonales, especificidad anti B, hibridomas.
Production of monoclonal antibodies with anti B specificity used as a blood typing reagent
Abstract. The purpose of this research was to produce murine monoclonal antibodies with anti B specificity to be used as reagents in red cells typing. Balb/c mice were immunized with substance B from saliva of a donor secreting B antigen, in order to obtain spleen cells or splenocytes producing antibodies with anti B specificity. These cells were fused with mouse myeloma cells P3-X63.Ag8.653 by using the PEG technique. After seeded, the hybridomas secreting the putative antibodies were cloned through the limiting dilution technique to obtain monoclonality. Afterwards, the antibodies were evaluated using immunological and immunochemical methods. BMS-4 clone secreting antibodies IgM-kappa with anti B specificity were obtained, which displayed high potency, excellent avidity, great sensibility and long time stability. We think that this clone can be used to produce a red cell typing reagent.
Key words: Monoclonal antibodies, specificity anti B, hybridomas.
Recibido: 29-04-2003. Aceptado: 22-01-2004.
INTRODUCCIÓN
Desde que Karl Landsteiner describió los antígenos eritrocitarios que conforman el sistema ABO (1) a principios del siglo XX, es práctica obligatoria de los bancos de sangre, hacer la tipificación sanguínea de este sistema en donantes y receptores de sangre. De no transfundirse sangre isogrupo o al menos ABO compatible, se correrían grandes riesgos de provocar reacciones hemolíticas intravasculares que conllevarían a una alta morbi-mortalidad. De tal manera que el sistema ABO es de gran importancia clínica, en particular en la Medicina Transfusional y en el campo de los transplantes de órganos.
Después del advenimiento de la tecnología para producir anticuerpos monoclonales (2) descrita por Köhler y Milstein en 1975 (3), los antisueros policlonales para la hemoclasificación han sido progresivamente sustituidos por los monoclonales. Desde entonces, esta tecnología ha sido utilizada para producir anticuerpos (acs) contra múltiples antígenos (ags) y para usos diversos (4-10). En el campo de la Medicina Transfusional, a partir de finales de los años setenta y principio de los ochenta, tanto en Inglaterra como en Canadá, se produjeron acs de tipo IgM contra el sistema ABO, con características adecuadas para ser utilizadas en la hemoclasificación eritrocitaria (11-13). Posteriormente estos reactivos fueron producidos en escala industrial con la consecuente disminución en los costos y con distribución casi universal (14-16).
La metodología para producir dichos anticuerpos es laboriosa, ocupa mucho tiempo y es susceptible de afectarse por factores extrínsecos como la contaminación o por factores intrínsecos a la biología celular, al grado de inmunización obtenido en los ratones, al tipo de inmunógeno empleado, etc, los cuales pueden retardar la obtención del producto deseado.
Se han utilizado una amplia variedad de inmunógenos (eritrocitos grupo específicos, membranas celulares de amígdala humana, líneas celulares de cáncer de colon humano, fluido de quiste de ovario, saliva de individuos secretores, oligosacáridos sintéticos, etc), para producir AcMo específicos contra el sistema ABO (17-18).
Una vez logrados los hibridomas, se requieren rigurosas evaluaciones para garantizar que los anticuerpos secretados por las clonas, sean los idóneos para trabajar en banco de sangre, ya que por ser monoclonales, reaccionan contra un epítope simple del antígeno utilizado en su generación (19-20). Este hecho podría ser un factor negativo al evaluar la avidez utilizando eritrocitos de menor expresión antigénica (subgrupos débiles, eritrocitos fetales). De allí que muchas veces tenga que recurrirse a la mezcla oligoclonal de anticuerpos de composición y propiedades bien conocidas.
El objetivo fundamental de este trabajo fue obtener un AcMo murino con especificidad anti B, que reuniera las condiciones suficientes para ser utilizado como reactivo de hemoclasificación.
MATERIALES Y MÉTODOS
Esquema de inmunización
Un grupo de seis ratones balb/c de 8 semanas de nacidos, recibió inoculaciones simultáneas por vía intraperitoneal (IP) y subcutánea (SC) de 1 mg de sustancia antigénica B de saliva de donante secretor, parcialmente purificada (21,22) en 0,5 mL de adyuvante completo de Freund (Sigma Chemical Co). A las cuatro semanas, fueron reestimulados con 20 µg de dicha sustancia en solución salina (ss) por vía intravenosa (IV). A los tres días se sacrificaron para obtener esplenocitos (23).
Fusión y producción de hibridomas
Se realizó utilizando el método de Galfre y col (24) con algunas modificaciones. Se unieron 4 × 107 esplenocitos no lavados con 8 × 106 células de mieloma de ratón P3-X63.Ag8.653 en crecimiento exponencial en medio DME/F12 (SigmaR) previamente lavadas en medio sin suero fetal bovino (SFB), a una proporción de 50:1 y utilizando el polietilenglicol (PEG) como agente fusógeno (PEG 1.500 – MerckR).
Luego de unir las dos líneas celulares en tubo de poliestireno estéril de 50 mL, se centrifugó a 400 g por 7 minutos a temperatura ambiente (TA). Se eliminó el sobrenadante y se adicionó el PEG al 50% en PBS a pH de 7,2 a TA con incubación inicial de 90 segundos y en agitación constante y suave. Se fue agregando PBS cada minuto, de la siguiente manera: 100 µL c/20”, luego c/15”, c/10” y c/5” hasta cumplirse cuatro minutos. Finalmente se completó la dilución con PBS hasta alcanzar los 10 mL. Se centrifugó y se eliminó el sobrenadante. El botón celular fue resuspendido suavemente en pequeño volumen de medio HAT (hipoxantina 10-4M, aminopterina 4 × 10-5, timidina 1,6 × 10-5 M - SIGMA) suplementado con SFB al 10%, l-glutamina 2 mM, piruvato de sodio 1 mM, penicilina 100 U/mL, estreptomicina 0,1 mg/mL, anfotericina B 0,25 µg/mL, IL-6 (sobrenadante de la línea celular J744-2) al 10% (22), e insulina 20 UI/mL. Luego se completó hasta alcanzar una concentración final de 2 × 106 células/mL y se sembró en placas de 96 pozos (GreinerR) a razón de 100 µL/pozo, previamente acondicionados con células nodrizas a razón de 100 µL de una suspensión a 2 × 105 cel/mL. Se incubó a 37°C en atmósfera húmeda y CO2 al 5%. A partir del día 8 se comenzó a realizar el pesquisaje en los sobrenadantes de los pozos con crecimiento celular y a partir del día 12, se eliminó la aminopterina de la preparación.
Tamizaje de anticuerpos
A partir del 8vo día post-fusión, se comenzaron a realizar las pesquisas de acs en los sobrenadantes de cultivo (SNC) de cada uno de los pozos en los que se evidenciaba crecimiento celular. Cada SNC fue evaluado con células A1, B y O a una concentración de 3-5 % en ss. Dicha pesquisa se hizo en placa de fondo en U, agregando para cada evaluación 100 µL de SNC y 50 µL de la suspensión de eritrocitos. Se incubaron a TA por 1 hora y se leyó por aglutinación macroscópica. Los que dieron señal positiva anti B fueron evaluados con eritrocitos A1B y A2B. Se escogieron según su especificidad, potencia y avidez.
La especificidad se evaluó haciendo reaccionar los SNC con suspensiones celulares de diferentes fenotipos: A1, A2, A1B, A2B, B y O. Este ensayo se hizo en tubos de vidrio 12 × 75 mm agregando una gota del SNC y una gota de la suspensión celular. Después de incubar a TA por 1´ y 5´ se centrifugaron y leyeron en cruces (de 0 a 4+): el botón de células fue suavemente desprendido del fondo y examinado macroscópicamente en lámpara de Clay AdamsR. Las reacciones intermedias se reportaron con 1/2 + adicional. Se consideró reacción en campo mixto cuando la lectura fue mayor de 1+ pero con el fondo turbio.
A cada lectura en cruces, se le dio un valor numérico así: 4+:8; 3+:6; 2+:4; 1+:2, ½+:1, cuya sumatoria al final de la titulación reflejó el valor del tanteo o “score”. El tubo control con el diluente debía dar negativo.
La potencia se determinó haciendo titulaciones al medio, igualmente con eritrocitos al 5% en ss.
La avidez se determinó según el tiempo en segundos requerido para dar una aglutinación visible en lámina de opalina, agregando 50 µL del SNC a evaluar y 50 µL de la suspensión de eritrocitos al 50%, mezclándose suavemente.
En cada caso se realizaron controles utilizando reactivo comercial DominioR.
Clonamiento
Los pozos seleccionados se dejaron crecer, se contaron las células y se diluyeron en medio por el método de dilución límite, de manera que quedaran 0,5, 1 y 2 células en cada pozo al sembrarlas (100 µL por pozo). Las placas estuvieron previamente preparadas con células nodrizas (1 × 104Cel/pozo). Este procedimiento se repitió hasta 4-5 veces para asegurar la monoclonalidad (es decir, que clonando a 0,5 – 1 cel/pozo, al menos en el 40 % de los pozos existan híbridos creciendo y que en el 80% de ellos haya producción del anticuerpo).
Los híbridos obtenidos fueron congelados en nitrógeno líquido (NL) e inoculados en cavidad peritoneal de ratones balb/c para inducir la formación de ascitis (25).
Evaluación inmunohematológica (26, 27)
Controles. Se utilizó como control, al reactivo comercial DominioR el cual fue sometido a las mismas condiciones que el producto evaluado.
Potencia. La titulación (en tubo) se comenzó partiendo del LA sin diluir, con el cual se prepararon diluciones al medio en buffer (solución de EDTA 20 mM, ClNa 2%, azida de sodio 0,1% y albúmina al 3% a pH 7,2). Este buffer fue el medio de dilución que empleamos en la elaboración del producto final. Se utilizaron células B y A1B. Las lecturas se hicieron a centrifugación inmediata, a 1 y a 5 minutos post incubación a TA.
Especificidad. Se comprobó la especificidad haciéndolos reaccionar inicialmente con una suspensión de células B y tres de A1B. Se completó la evaluación utilizando en total ocho muestras diferentes de fenotipo B y A1B, así como con células A y O (negativas para el antígeno B).
Con estas reacciones se debió demostrar también la ausencia o presencia de hemólisis y/o fenómeno de rouleaux. La reactividad con una célula positiva para el antígeno específico, debió ser por lo menos de 2+. La prueba se consideró satisfactoria cuando no más de 1 de 8 donantes, resultó con una reacción inferior a 2+.
Para demostrar la ausencia de anticuerpos contaminantes, (diferentes a los acs anti ABO) se utilizó Resolve Panel A (OrthoR). El LA se puso en contacto con las diferentes células del panel y las evaluaciones se hicieron a centrifugación inmediata, a los 15´ de incubación a TA, adicionándoles albúmina bovina al 22%, a 37°C de incubación por 20´ y por antiglobulina humana.
También se realizaron ensayos de inhibición de la aglutinación: el LA se diluyó en ss de manera que el título no fuera mayor de 1:128. El LA diluido se puso en contacto con igual volumen de saliva secretora de sustancia antigénica B (donante B secretor) y con ss v/v como control. Ambas mezclas se incubaron a TA por 15 minutos, se hicieron reaccionar con eritrocitos B y se leyeron por aglutinación.
Avidez. Se realizó con LA no diluida, diluida 1:2 y 1:20 con el diluyente mencionado anteriormente, utilizando como control el reactivo comercial. Se utilizó el método antes descrito y se registró el tiempo en el que se detectó aglutinación menor y mayor o igual a 1mm.
Determinación de aglutinación espontánea. Se utilizaron eritrocitos “O” Rh negativo con fenotipo dccee, los cuales fueron sensibilizados con anti c, mostrando positividad fuerte (3/4+) con la prueba de antiglobulina humana directa, con el autocontrol negativo.
Al realizar la tipificación ABO en evaluación, con estas células la reacción debía resultar negativo.
Evaluación del producto final
Estabilidad. El LA original, se diluyó con el buffer antes mencionado, y fue evaluado en el tiempo: a) En viales conservados a 4°C, se evaluó mensualmente la potencia y la avidez según lo señalado anteriormente. b) En viales conservados a 37°C (temperatura que acelera la degradación de los anticuerpos). se evaluó la potencia.
Como control se utilizó reactivo comercial, sometido a las mismas condiciones.
Sensibilidad: Se implementó un trabajo de campo con el fin de evaluar el funcionamiento de los anticuerpos ante una amplia gama de muestras en diferentes bancos de sangre del área metropolitana de Caracas, incluyendo dos maternidades en las que se evaluó únicamente con células de cordón.
Determinación del isotipo de los anticuerpos
Se realizó mediante dos técnicas: doble difusión o método de Ouchterlony y por ELISA indirecto.
Método de Ouchterlony (23). Se utilizó el LA diluido 1:20 para disponerlo en el orificio central (5ul) y se utilizaron antisueros específicos (anti μ, anti γ2a, anti γ2b, anti γ3, anti α, SIGMAR) en cada orificio de la periferia de la roseta. Se incubó durante 14-18 horas en atmósfera húmeda y posteriormente se evaluó la formación de halos de precipitación.
Técnica de ELISA indirecto en SNC (28). Para ello se utilizó como antígeno específico, el proveniente de saliva de donantes secretores parcialmente purificado (21).
Estandarización preliminar: Con el fin de establecer la concentración óptima de ag de saliva a utilizar y la dilución óptima de SNC a evaluar, se realizó un primer ELISA, de la siguiente manera: Se utilizaron microplacas MaxiSorp NuncR de poliestireno con fondo en U, las cuales se sensibilizaron con 100 µL de de ag de saliva solubilizado en buffer carbonato-fosfato a pH 9,6 con incubación durante 16-18 horas a 4°C. Las concentraciones elegidas fueron de 200, 50 y 12,5 ng/100 µL. Para el bloqueo de la placa se empleó 200 µL de gelatina (BioradR) al 0,5% en PBS a pH 7,2, durante 1 hora a 37°C. Como anticuerpo primario se utilizó el SNC sin diluir y diluido 1:5 en PBS-Tween al 0,1%. Se incubó por 1 hora a 37°C en cámara húmeda. Como conjugado se empleó un anticuerpo polivalente de conejo (anti G, M, A de ratón, SIGMAR, A0412) conjugado con peroxidasa de rábano picante diluido 1:500 en PBS-Tween 0,1%. A cada pozo se colocó 100 µL del conjugado y se incubó por 1 hora a 37°C en cámara húmeda. Como sustrato se utilizó una solución de peróxido de hidrógeno al 0,5% y 2,2” azino-di (ácido 3-etilbentiazolino 6 sulfónico)-(ABTS) 36mM en buffer citrato de sodio pH 4,4 que se incubó a TA en oscuridad. Las lecturas de las absorbancias se obtuvieron en un lector de ELISA a 405 nm a los 15´, 30´ y 45´. Se corrieron junto a los controles correspondientes.
Determinación del isotipo: se usaron estándares de isotipo (PierceR N° 37501) y SNC diluido 1:5 (según resultado de la estandarización anterior). Luego que las placas fueron sensibilizadas y bloqueadas se agregó el SNC, se incubó por 1 hora a 37°C en cámara húmeda y se lavó. A cada pozo se le agregó el antisuero de conejo (IgG) específico para cada clase y subclase de inmunoglobulinas de ratón y se incubó por 1 hora a 37°C. Se utilizó conjugado de cabra, anti IgG de conejo diluido 1:2000 a 100 µL/pozo y se incubó por 1 hora a 37°C. Luego de añadir el sustrato (ABTS), se leyó a 405 nm a los 30´. Como control positivo se utilizó conjugado de ratón polivalente unido a peroxidasa a una dilución 1:5.000.
Cuantificación de IgM Mo
por inmunodifusión radial cuantitativa (Manzini) (23)
Se mezcló agar noble o azarosa con IgG de conejo anti IgM de ratón (producido en nuestro laboratorio) a una dilución final de 1:20. Para los controles o patrones de referencia se utilizó la IgM purificada (SIGMA M-3795) sin diluir y las muestras a evaluar se dispusieron sin diluir, diluidas 1:2 y 1.4. Se incubó en una cámara húmeda por 24-48 horas a TA. Las lecturas se realizaron midiendo dos diámetros perpendiculares entre sí de cada uno de los anillos de precipitación, con un visor con escala graduada incorporada. Se calculó el valor promedio de las lecturas de los dos diámetros. Se obtuvo la línea de tendencia para el cálculo de la concentración proteica (curva patrón): a cada concentración conocida de IgM, se le midió ambos diámetros y su promedio fue graficado en el eje de la ordenada. También se le calculó el Log10 y se graficó en la abcisa. De la ecuación generada, conociendo el valor promedio de los diámetros del halo de inmunodifusión de la muestra en estudio, se calculó el valor de la x, es decir, se obtuvo el Log10 de la concentración de dicha proteína, cuyo anti Log correspondió a su concentración en µg/10 µL. Se hizo la conversión a mg/mL y se multiplicó por el factor de dilución. Se calculó el promedio.
RESULTADOS
Después de utilizar el esquema de inmunización señalado y posterior a la fusión, se sembraron nueve placas de 96 pozos. A los 21 días en incubación, se obtuvieron 297 pozos con híbridos creciendo (34% del total). De ellos, cuatro pozos (B2, B6, C2 y F12) dieron señal positiva (variable entre 2+ y 4+) con las células B, A1B y A2B y señal negativa con eritrocitos A y O. Solo el sobrenadante del pozo B6 reconoció a los eritrocitos A1B con una señal fuertemente positiva, por lo que se expandió y clonó cuatro veces y se denominó clona BMS-4.
En la Tabla I se señala la potencia del LA sin diluir generado por esta clona, demostrando alto título, buen score y estabilidad durante la incubación.

Se escogió la dilución 1:20 para evaluar las posibilidades de utilizarlo como reactivo. Se pudo apreciar una potencia casi similar a la observada con el reactivo comercial (diferencias no mayores de dos tubos a favor del reactivo en evaluación) por lo que se consideró idónea la dilución seleccionada (Tabla II)
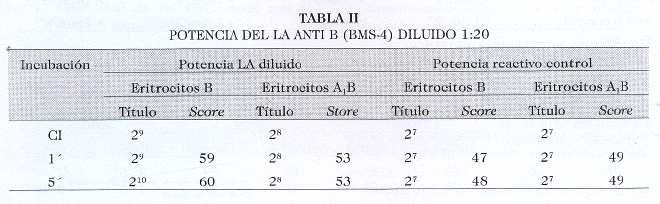 .
.
Se evaluó la especificidad, haciéndolo reaccionar con ocho muestras de suspensiones de eritrocitos B y ocho A1B provenientes de donantes diferentes y con todas, las aglutinaciones fueron de 4+. Se obtuvieron resultados negativos con eritrocitos A y O. En ningún caso se observó hemólisis ni fenómeno de reauleax. No se detectó presencia de acs contaminantes al ponerlo a reaccionar con células del panel.
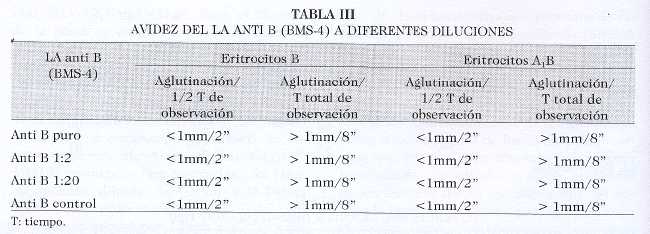
Para evaluar la avidez, hicimos las determinaciones con eritrocitos B y A1B (Tabla III). Tanto el LA puro como las diferentes diluciones demostraron excelente avidez con ambos fenotipos celulares. A los 2” se detectó aglutinación fina en todos los casos y a los 8” ya habían aglutinados grandes con fondo claro. No se apreció diferencia con la avidez demostrada por el reactivo comercial.
Para apreciar la reactividad del anticuerpo con sustancia antigénica soluble B y reafirmar la especificidad, se realizó un ensayo de inhibición de la aglutinación con saliva de donante B secretor, con el cual se demostró su especificidad anti B al inhibirse la aglutinación del ac en estudio.
Al evaluar la reactividad de los acs contra eritrocitos autosensibilizados, con el fin de descartar los resultados falsos positivos, se hizo reaccionar el LA diluido con 36 suspensiones celulares O Rh negativo sensibilizadas. En todos los casos los resultados fueron negativos.
En vista de las características observadas en los acs provenientes de la clona BMS-4, pasamos a la fase de su evaluación en el tiempo, utilizando diluciones 1:20 conservadas a 4°C (Tabla IV) y a 37°C. Se demostró una reducción inicial de los títulos con ambos fenotipos celulares y una lenta y leve disminución de la avidez con los eritrocitos A1B un poco más pronunciada con el anti B BMS-4, aunque el comportamiento general fue casi similar al control. Para apreciarlo gráficamente podemos ver las Fig 1 y Fig 2.
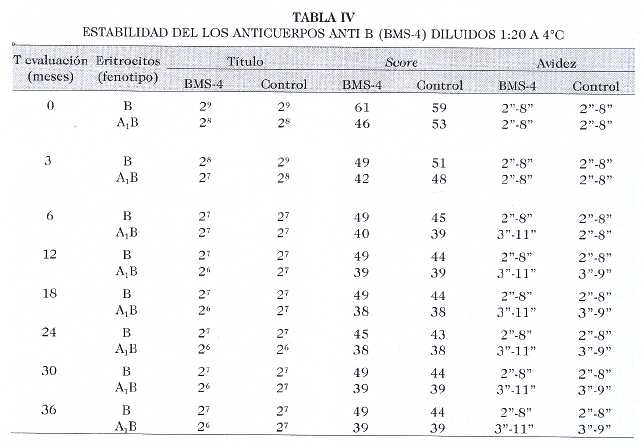
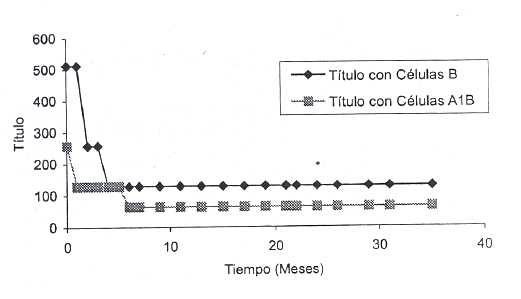
Fig. 1. Estabilidad de los anticuerpos anti B (BMS-4) conservado a 4 °C.
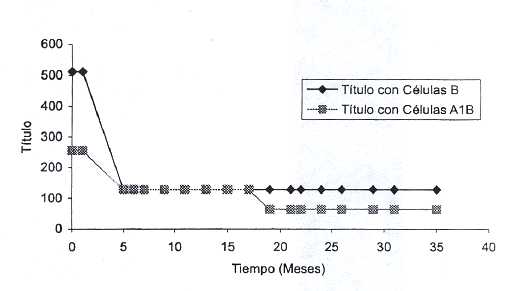
Fig. 2. Estabilidad del reactivo comercial anti B conservado a 4 °C.
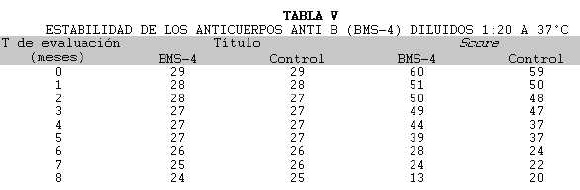
El estudio de estabilidad a 37°C se realizó utilizando solamente eritrocitos B (Tabla V). Se apreció un descenso progresivo de la potencia de los acs en el curso de ocho meses. Ambos reactivos demostraron un comportamiento bastante similar al comienzo pero finalmente hubo mayor aceleramiento en la degradación de los acs en la clona BMS-4. De cualquier manera, esta reducción está dentro de los rangos permitidos, es decir, reducción de no más de una dilución al mes.
Se evaluaron muestras al azar de donantes, pacientes y eritrocitos de cordón y se apreció su excelente reconocimiento antigénico (Tabla VI). También se evaluaron 36 pacientes con problemas hematológicos e inmunohematológicos y con ninguno hubo diferencias con respecto al control.

Se realizaron evaluaciones con fenotipos más débiles de B (New York Blood Center), evidenciándose reactividad fuerte (score de 11 en escala de 0-12) con células Bh, B(A), AB mosaico y A1B débil. Además reaccionó moderadamente (score 6) con células B3 (similar a lo obtenido con reactivos comerciales).
Con el fin de conocer el isotipo de los acs obtenidos se realizaron evaluaciones por la técnica de Ouchterlony y por ELISA (Tabla VII). Podemos observar que se trata de una IgM kappa, lo cual corresponde con su comportamiento serológico.

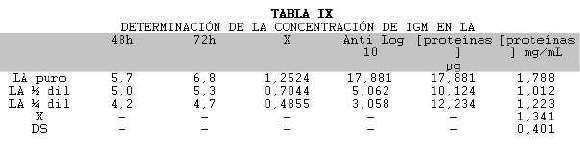
Se procedió a cuantificar las Igs específicas en LA con el fin de evaluar su utilidad futura en la estandarización de los lotes. Para ello realizamos una curva patrón utilizando diluciones de IgM comercial de ratón (Tabla VIII y Fig 3). La cuantificación resultó en 1,34 mg/mL (Tabla IX).
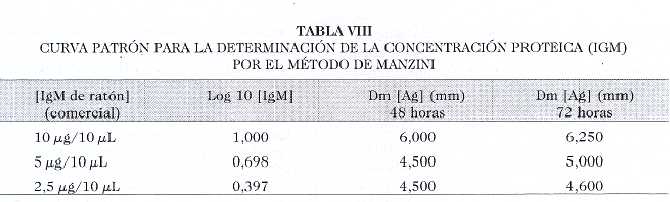
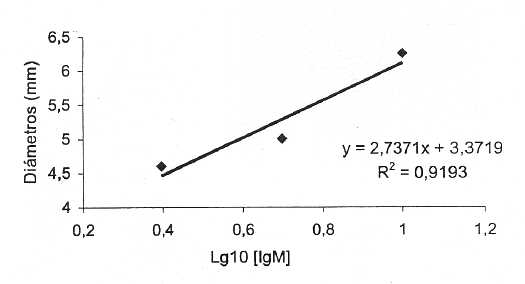
Fig. 3. Determinación de concentración del IgM por el método de Manzani. Curva patrón.
La producción de anti B monoclonal ha sido señalada en la literatura como dificultosa, considerando el hecho de que los ratones balb/c tienen un grupo B-like sobre su membrana eritrocitaria (13). Por otra parte no todos los esquemas de inmunización, ni los inmunógenos utilizados, inducen a la obtención de un buen anticuerpo. En este estudio, demostramos que utilizando un esquema en el que se inmunizó simultáneamente por vía IP y SC con antígeno B de saliva, con un estímulo final por vía IV, fue posible obtener un anticuerpo con excelentes cualidades.
Al inducir producción de LA anti B, se lograron titulaciones de 1014 con eritrocitos B y de 1012 con eritrocitos A1B, con alto score. Esto permitió una dilución del LA en 1:20 y de esta manera realizar las evaluaciones programadas para determinar su comportamiento inmunohematológico. A esta dilución los títulos, la avidez, la estabilidad en el tiempo a 4°C y a 37°C, así como la sensibilidad para la tipificación de eritrocitos de cordón, de individuos con patologías hematológicas e inmunohematológicas y con eritrocitos de muy débil expresión antigénica, fueron similares a los del reactivo comercial. Es importante mencionar que el estudio de inhibición de la aglutinación, reveló total inhibición por la sustancia antigénica B de saliva, lo que reafirma aún más su clara especificidad anti B, al reaccionar con la región inmunodominante del antígeno que confiere la especificidad de grupo. Desafortunadamente no disponemos de oligosacáridos sintéticos para establecer la especificidad fina (29). Sin embargo, dado el comportamiento demostrado, podemos inferir que los anticuerpos secretados por esta clona pueden ser utilizados sin mezclarlos, para la producción de reactivos de hemoclasificación.
Posteriormente decidimos utilizar un sistema capilar artificial (30,31) para la producción a escala intermedia. Pudimos obtener acs en un título similar al del LA, con un score superior (125 vs 82), pero con una concentración medida por inmunodifusión radial menor (0,70 mg/mL vs 1,34 mg/mL) (datos no mostrados). Esto reveló que la cuantificación proteica no necesariamente es equivalente a la titulación del anticuerpo y para nuestros propósitos nos guiaremos más por el comportamiento inmunohematológico del anticuerpo que por la cuantificación en sí, aunque a cada lote que se produzca se le cuantificarán las Inmunoglobulinas.
AGRADECIMIENTOS A los Dres Egidio Romano y Ramón Montaño del Laboratorio de Patología Celular del Instituto Venezolano de Investigaciones Científicas, por su asesoría y facilitación de líneas celulares utilizadas en los experimentos de fusión. A la Dra Marion Reid del New York Blood Center, por su ayuda al evaluar el anticuerpo con fenotipos menos frecuentes. Al Prof. Pedro Aso del Departamento de Biología de la Universidad Simón Bolívar, por su asesoría y ayuda logística para las determinaciones inmunoquímicas. REFERENCIAS 1. Citado por Race R y Sanger R en: Blood groups in man. 6ta Ed. Oxford: Blackwell Scientific Publications, 1975. [ Links ] 2. Linares J. Inmunohematología y Transfusión. Principios y Procedimientos. 1ra Ed. Caracas 1986. [ Links ] 3. Köhler G, Milstein C. Continuos cultures of fused cells secreting antibody of predefinided specificity. Nature 1975; 256: 495-497. [ Links ] 4. Horejsi V. Surface antigens of human leukocytes. Adv Immunol 1991; 49:75-147. [ Links ] 5. De Rossi G, Zarcone D, Mauro F, Cerruti G, Tenca C, Puccetti A, Mandelli F, Grossi C. Adhesion molecule expresion on B cell chronic lymphocytic leukemia cells; malignant cell phenotypes define distinct disease subsets. Blood 1993; 81: 2679-2687. [ Links ] 6. Yoshimura M, Nishimura R. Assessment of urinary beta-core fragment of human chrorionic gonadotropin as a new tumor marker of lung cancer. Cancer 1994; 73: 2745-2752. [ Links ] 7. Skolnick A. First immunotoxin therapy for many common solid tumors enters phase clinical trial. JAMA 1993; 270(19):2280. [ Links ] 8. Miller R, Maloney D,Warnke R. Leny R. Treatment of B cell lymphoma with monoclonal anti idiotype antibody. N Engl J Med 1982; 306:517-522. [ Links ] 9. Osteoborg A, Fassas A, Anagnostopoulos A, Dyer M, Catovsky D, Mellstedt H. Humanized CD 58 monoclonal antibody Campath IH as first line treatment in chronic lymphocytic leukaemia. Br J Haematol 1996; 93:151-153. [ Links ] 10. Maloney D, Liles T, Czerwinski D, Waldichuk C, Rosenberg J, Grillo-López A, Levy R. Phase I clinical trail using escalating single dose infusion of chimeric anti CD20 monoclonal antibody (IDEC-C2B8) in patients with recurrent B cell lymphoma. Blood 1994; 84:2457-2466. [ Links ] 11. Rouger P, Anstee D. First International Work Shop on Monoclonal Antibodies Against Human Red Blood cells and Related Antigens. Final Report. Vox Sang 1988; 55:57. [ Links ] 12. Messeter L. Monoclonal Antibodies Against ABO Antigents. Biotest Bulletin. 1989, 4:9-14. [ Links ] 13. Messeter L, Brodin J, Chester M, Low B, Lundblad A. Mouse Monoclonal antibodies with anti A, anti B and anti AB Specificities, some Superior to Human Polyclonal ABO Reagents. Vox Sang 1984; 46:185-194. [ Links ] 14. Voak D, Lennox E, Sacks S, Milstein C, Darnbougn J. Monoclonal anti A anti B as cost-effective reagents. Med Lab Sci 1982; 39:109-122. [ Links ] 15. Sacks S, Lennox E. Monoclonal anti B as a new blood typing reagent. Vox Sang 1981; 40: 99-104. [ Links ] 16. Becker M, Juica F, Jamett A, Tzichinovsky S, Barros S, Aguayo J, de Ioannes A. Development of anti B blood group monoclonal antibodies suitable as a blood typing reagent. Hybridoma 1994; 13 (4):303-310. [ Links ] 17. Clausen H, Hakomori S. ABH and related histo-blood group antigens. Immunochemical differences in carrier isotypes and their distribution. Vox Sang 1989; 56:1-20. [ Links ] 18. Watkins W. Blood Group Substances. Science 1996; 152:172-181. [ Links ] 19. Lubenko A, Redman M. Weak B antigens and heterogeneity of monoclonal anti B reagents. Vox Sang 1989; 57: 275. [ Links ] 20. Gane P, Vellayoudom J, Mollicone R, Breimer M, Samuelsson B, Rouger P, Gérard G, Le Pendu J, Oriol R. Heterogeneity of anti A and anti B monoclonal reagents. Vox Sang 1987; 53:117-125. [ Links ] 21. Barrie E, Fraser R, Munro A, Williamson A, Hamilton E, Mitchell R. Monoclonal anti B produced by the immunization of mice with soluble salivary glycoproteins. J Inmunogenetics 1983; 10:41-44. [ Links ] 22. Bazin R, Lemieux R. Increased proportion of B cell hybridomas secreting monoclonal antibodies of desired specificity in cultures containing macrophage-derived hybridoma growth factor (IL-6) J Immunol Meth 1989; 116:245-249. [ Links ] 23. Harlow E, Lane D. Antibodies: A laboratory manual. Cold Spring Harbor laboratory, 1988. [ Links ] 24. Galfre G, Howe S, Milstein C, Butcher G, Howard J. Antibodies to major histocompatibility antigens produced by hybrid cell lines. Nature 1977; 266: 550-552. [ Links ] 25. Broderur B, Tsang P. High yield monoclonal antibody production in ascitis. J Immunol Meth 1986; 239-241. [ Links ] 26. Recommended methods for blood grouping reagents evaluation March 1992 (Docket N° 845-0181). Center for Biologics Evaluation and Research (HFB-940) Food Drug Administration. [ Links ] 27. McGowan A, Tod A, Chirnside A, Green C, McColl K, Moore S, Yap P, McClelland D, McCann M, Micklem L, James K. Stability of murine monoclonal anti A, anti B and anti A,B ABO grouping reagents and a multicentre evaluation of their performance in routine use. Vox Sang 1989; 56: 122-130. [ Links ] 28. Voller A, Bidwell D, Bartlett A. Enzime Immunoassays. In: Diagnostic Medicine. WHO 1989; 53: 55-65. [ Links ] 29. Gane P, Mollicone R, Rouger R, Oriol R. Inhibition of haemagglutination with synsorbs and salivas of anti A monoclonal antibodies. Rev Fr Transfus Immunohematol 1987; 30:435-442. [ Links ] 30. Nayak R, Herman I. Meassurement of glucose consumption by hybridoma cells growing in hollow fiber cartridge bioreactors: use of blood glusose self-monitoring devices. J Immunol Meth 1997; 205:109-114. [ Links ] 31. Jackson L, Trudel L, Fox J, Lipman N. Evaluation of hollow fiber bioreactor as an alternative to murine ascitis production for small scale monoclonal antibody production. J Immunol Meth 1996; 189: 217-231. [ Links ]












 uBio
uBio 

