Investigación Clínica
versión impresa ISSN 0535-5133
Invest. clín v.46 n.2 Maracaibo jun. 2005
El caprino: aproximación a un modelo animal en la cromomicosis humana.
Eustacia C. Martínez1, Catalina Rey Valeirón2, Francisco Yegres3 y Rómulo Reyes4.
1Unidad de Diagnóstico y Servicios.
2Programa de Veterinaria, Área Ciencias del Agro y Mar.
3Laboratorio de Microbiología, Área Ciencias de la Salud.
4Hospital Dr. Alfredo Van Griecken.
1,2,3,4Universidad Nacional Experimental Francisco de Miranda (UNEFM). Coro, Venezuela.
Correo electrónico: crey@unefm.edu.ve
Resumen. En el estado Falcón, Venezuela, la cromomicosis es causada principalmente por un hongo dimórfico, Cladophialophora carrionii. Las zonas endémicas tienen predominio de vegetación xerófita de espinar y la principal ocupación es la cría de caprinos en forma extensiva. La literatura especializada no reporta lesiones compatibles con cromomicosis en estos animales, a pesar de su exposición permanente a la inoculación accidental con las espinas de cáctaceas infectadas por el hongo. A fin de evaluar la posible transformación parasitaria a células escleróticas, el tiempo de viabilidad del hongo y las alteraciones histopatológicas en caprinos, se inocularon cabritos de cinco meses de edad con 1×106 células de C. carrionii, vía subcutánea en la tabla del cuello y se realizaron biopsias a los 10, 19, 30 y 60 días post-inoculación en los sitios de inyección. El tejido obtenido fue analizado por a) examen directo con KOH al 10%, b) retrocultivo y microcultivo en Sabouraud dextrosa y c) técnicas histopatológicas. Se observaron hifas y células escleróticas al examen directo, crecimiento en los cultivos con sobrevivencia del hongo hasta las cuatro semanas post-inoculación y cadenas ramificadas típicas de las formas filamentosas de C. carrionii. La evaluación histopatológica mostró necrosis central, infiltrado inflamatorio mixto, predominio de mononucleares, linfocitos, plasmocitos y células gigantes, hifas y cuerpos escleróticos en todas las muestras. C. carrionii ocasionó en esta especie animal una reacción celular intradérmica similar a la observada en el humano en la primera etapa de la infección, aunque no se observaron las lesiones macroscópicas típicas de esta enfermedad en humanos.
Palabras clave:
Cromomicosis, caprino, Cladophialophora carrionii, células escleróticas.
The goat: approach to an animal model in human chromomycosis.
Key words:
Chromomycosis, Cladophialophora carrionii, goat, sclerotic cells.
Abstract. In Falcon State, Venezuela, human chromomycosis is mainly caused by a dimorphic fungus, Cladophialophora carrionii. Xerophytes plants are common in the State and goat breeding in an extensive system as the main way of living. There are not published reports of chromomycosis in goats, despite the fact of their permanent exposition to fungus by accidental inoculation with infected spines. To evaluate parasitic transformation to sclerotic cells, length of fungus-surviving period and histopathological lesions, goats of five months of age were inoculated with 1×106 cells of C. carrionii by subcutaneous route in the neck and biopsies at 10, 19, 30 and 60 days from inoculated places were performed. Tissues were analyzed by a) direct test with KOH 10%; b) inoculation in Saboraud dextrose culture and c) histopathological techniques. Hyphae and sclerotic cells were observed on tissues treated with KOH 10%; growing of fungus was detected in specific medium up to four weeks post-inoculation. Tissue pathology showed necrotic foci, mixed polymorphonuclear infiltrate, predominance of mononuclear cells, lymphocytes, plasmocytes, eosinophils and giant cells, hyphae and sclerotic cells in each one of samples. C. carrionii caused cellular reactions in goats as those seen in humans at the first stages of infection; however, animals did not develop the typical macroscopic lesions of the human disease.
Recibido:02-02-2004. Aceptado: 04-11-2004.
INTRODUCCIÓN
La cromomicosis es una micosis profunda localizada, crónica, de lenta evolución e invalidante, causada por hongos filamentosos con melanina. La enfermedad tiene distribución mundial, pero es más frecuente en regiones tropicales y subtropicales (1). En Venezuela, la zona endémica más importante se localiza en los estados Lara, Zulia y Falcón, en los que las plantas xerófitas Opuntia caribaea (guazábara) y Prosopis juliflora (cují) son predominantes (2, 3). La cría de caprinos en forma extensiva es uno de los medios de subsistencia. Las poblaciones integradas por campesinos criadores de caprinos son las más afectadas por la cromomicosis, por lo que esta ocupación duplica el riesgo de infección (4, 5).
La transmisión de la infección ocurre por inoculación traumática y accidental del hongo saprófito en la piel. Se caracteriza clínicamente por lesiones nódulo-escamosas y costrosas, verrugosas en piel y tejido subcutáneo, que rara vez muestran tendencia a diseminarse por vía hematógena o linfática a otras zonas no afectadas del cuerpo (2).
En Venezuela, los agentes etiológicos más frecuentes de la cromomicosis son Cladophialophora carrionii y Fonsecaea pedrosoi (1). C. carrionii es un hongo dimórfico patógeno, clasificado en el orden Chaetothyrial y la familia Herpotrichiellaceae (6), crece en forma saprófita y se asocia con la vegetación xerófila. Las conidias son ovoides o globosas, que se ramifican en cadenas, con pared lisa o levemente verrugosa. Las células escleróticas son de color pardo a pardo-amarillento, y aparecen como células de forma esféricas (5 a 15 µm de diámetro), con paredes tabicadas gruesas, planas, dispuestas en forma aislada, agrupadas o en cadenas. La temperatura máxima de crecimiento de este hongo in vitro es de 37°C (7-9). Se ha sugerido que la forma esférica y la división mediante septo transversal podría representar una adaptación al parasitismo de los tejidos vivos animales o vegetales (10-13).
Recientemente, el caprino doméstico se ha convertido en un modelo animal importante para el desarrollo de la nueva industria tecnológica, debido a su adaptabilidad, fácil manejo y la posibilidad de ser usado como animal transgénico. Asimismo, los caprinos son los animales más estrechamente relacionados con los grupos humanos afectados por la cromomicosis y están expuestos permanentemente a sufrir inoculaciones accidentales con cactáceas infectadas con C. carrionii; sin embargo, no existen en la literatura reportes previos de lesiones compatibles con cromomicosis en esta especie animal en forma natural. El objetivo de este trabajo fue evaluar las muestras de piel obtenidas de cabritos inoculados con la forma saprófita de C. carrionii aislada de un paciente y cultivada en el laboratorio, con el fin de analizar si ocurre la transformación a la forma parasitaria, el tiempo de viabilidad del hongo y posibles alteraciones histopatológicas en el tejido inoculado. Estos resultados permitirían dilucidar si el caprino puede constituirse como modelo animal para el estudio de esta enfermedad.
MATERIALES Y MÉTODOS
Animales
Se utilizaron dos caprinos mestizos criollos, machos, de 5 meses de edad, con un promedio de 12 kilogramos de peso vivo. Los animales fueron mantenidos en condiciones de estabulación y alimentados con pasto fresco, heno, alimento concentrado y agua ad libitum. Dos veces a la semana se midió la temperatura corporal de los animales hasta los 60 días post-inoculación.
Preparación del inóculo
Se utilizó una cepa de C. carrionii de un paciente (PP-8201) con diagnóstico de cromomicosis proveniente de la zona semi-árida del Estado Falcón. El hongo fue crecido en fiolas que contenían 50 mL de Saboraud líquido, manteniéndose en agitación mecánica a 35°C/60 rpm durante dos semanas. Después de ese tiempo, la suspensión celular fue concentrada por centrifugación a 2000 rpm por 10 minutos y se eliminó el sobrenadante, hasta una cantidad igual al volumen de células empaquetadas. Las células fueron separadas en un homogeneizador manual Wheaton para luego ser lavadas tres veces a 2000 rpm por 5 minutos con solución salina estéril al 0,85%, descartándose el sobrenadante. El número de células en 0,1 mL de la suspensión celular fue estimada en un hemocitómetro para ajustar finalmente la suspensión a 1 × 106 células /mL (14).
Inoculación
Los caprinos fueron inoculados con 1 mL de la suspensión celular conteniendo 1×106 células (conidias/hifas) de C. carrionii, vía subcutánea, en cada uno de cuatro puntos de la tabla del cuello, para la obtención de muestras de tejido (14-16).
Toma y estudio de muestras
Previa anestesia de los dos animales experimentales, se realizaron biopsias a los 10, 19, 30 y 60 días post-inoculación. Cada una de las cuatro muestras obtenidas de las biopsias fueron divididas en tres secciones para determinar a) presencia del hongo mediante examen directo con KOH al 10%; b) viabilidad del hongo a través del cultivo en Sabouraud dextrosa; c) identificación del hongo por microcultivo; d) la respuesta celular al hongo y confirmar la presencia del mismo en el tejido inoculado a través de técnicas histopatológicas (13).
RESULTADOS
Los animales se mantuvieron en estabulación dos semanas antes de la inoculación hasta ocho semanas después de la misma. Durante este período, el promedio de temperatura rectal de los animales permaneció dentro de los valores normales (39 ± 0,5°C). Ninguno de los animales presentó fiebre después de la inoculación (datos no mostrados).
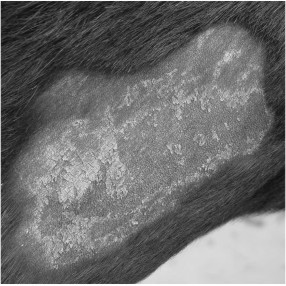
Durante el período experimental se observaron nódulos no supurativos en el sitio de inyección (Fig. 1), pero con disminución paulatina de su tamaño, hasta hacerse casi indetectable mediante palpación a los 60 días post-inoculación. A partir de los 10 días después de la inoculación se visualizaron escamo-costras en la tabla del cuello (Fig. 2).
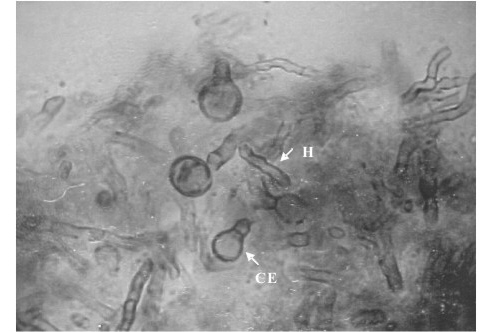
En la biopsia correspondiente a los 10 días post-inoculación, se observó en el tejido subcutáneo de ambos animales un nódulo encapsulado, de color negro (Fig. 3), el cual disminuyó progresivamente hasta un décimo del tamaño inicial en la biopsia de 60 días. Al examen directo con KOH de las muestras de 10, 19, 30 y 60 días post-inoculación, se observaron hifas tabicadas y células escleróticas dispuestas en forma aislada (Fig. 4). En agar Sabouraud dextrosa, se advirtió el crecimiento de colonias negruzcas típicas del hongo, así como se observaron cadenas ramificadas con conidias ovoides en los microcultivos en lámina de las muestras hasta los 30 días post-inoculación (Tabla I).
Fig1 Nódulo no supurativoen la tabla del cuello a los 10 días de postinoculación.
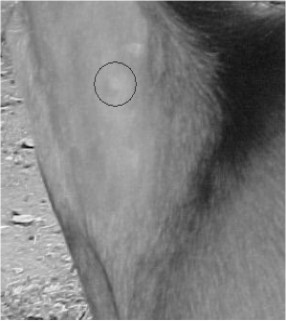
Fig 2. Escamo-costras en la tabla del cuello a los 30 días de postinoculación
En la evaluación histológica de las muestras de 10 días se observó epitelio con hiperqueratosis marcada e hiperplasia de células basales; dermis superficial con fibrosis e infiltrados difusos de células inflamatorias mononucleares y con aumento del tejido colágeno. Entre dermis profunda y músculo esquelético se observaron nódulos delimitados con necrosis central en donde se destacaron células de aspecto epitelial, mononuclear y algunas células gigantes multinucleadas de tipo cuerpo extraño. El infiltrado inflamatorio estaba conformado por abundantes polimorfonucleares neutrófilos, y en menor cantidad eosinófilos, linfocitos y plasmocitos. A los 19 días post-inoculación, se observaron nódulos bien delimitados por cápsula fibrosa entre la dermis profunda y tejido muscular, con células epiteliales grandes y células gigantes multinucleadas. El centro de los nódulos presentó material necrótico e infiltrado mixto de mononucleares y polimorfonucleares eosinófilos. A los 30 días post-inoculación, la histología mostró nódulos conformados por células epiteliales, células gigantes multinucleadas e infiltrado inflamatorio con predominio franco de linfocitos, aislados plasmocitos y polimorfonucleares eosinófilos. En los nódulos se observó abundante reacción desmoplástica (fibrosis). A los 60 días post-inoculación, se realizaron biopsias de nódulos no supurativos escasamente visibles. En los cortes histopatológicos se observó hiperqueratosis discreta y células gigantes multinucleadas tipo cuerpo extraño (Tabla I).
Fig 3. Nódulo obtenido de la biopsia de tejido a los 10 días de postinoculación
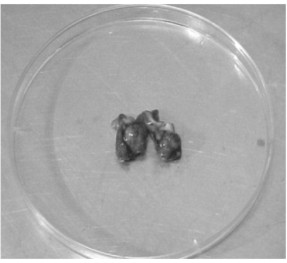
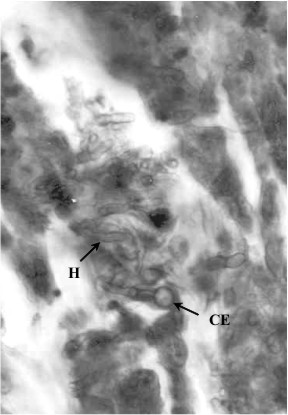
Fig 4. Segmento de hifas células escleróticas provenientes de nódulo no supurativo, a los 10 días de post-inoculación,en examen directo (KOH al 10%). 400x. CE: Células Escleróticas . H:Hifas.
Los resultados histopatológicos de todas las biopsias demostraron abundantes hifas gruesas, septadas, de color castaño oscuro y células escleróticas aisladas (Fig. 5).
Fig 5. Hifas células escleróticas de Chladophialophora carrionii, en biopsia de piel de caprino a los 60 días post-inoculación . Hematoxilina-eosina 1000x CE: Células Escleróticas . H:Hifas.
DISCUSIÓN
Algunos autores han experimentado con diversos modelos en ratones normales o inmunosuprimidos (17) en búsqueda de la transformación a células escleróticas de F. pedrosoi (18) o C. carrionii (14), o utilizando diversas vías de inoculación (15). Cardona-Castro y Agudelo, en un modelo múrido, no pudieron demostrar la sobrevivencia del hongo en las lesiones nodulares en ratones BALB/c a los 30 días post-inoculación vía subcutánea, mas sí encontraron una reacción inflamatoria progresiva con abundante material purulento en ratones inoculados vía intraperitoneal (15). En los caprinos inoculados, a pesar de ser una población experimental pequeña, se apreció la transformación del hongo saprófito a la forma parasitaria (células escleróticas), de manera similar a Sánchez y col. (19) quienes comprobaron la viabilidad del hongo en caprinos hasta 30 días post-inoculación y a los hallazgos señalados por Yegres y col. en ratones inmaduros o consanguíneos, en los cuales se evidenció la presencia de hifas y células escleróticas en lesiones granulomatosas (14, 18). Aunque en los dos caprinos hubo transformación parasitaria, también se observó el hongo a través del examen directo de las escamo-costras recogidas de la superficie de la piel de los animales, como evidencia del mecanismo de eliminación transepitelial de este patógeno.
Las células escleróticas se observaron desde los 10 hasta los 60 días después de la inoculación en las muestras de tejido de los caprinos, en los cuales la temperatura corporal se mantuvo por encima de 38,6°C. Estos resultados contradicen aquellos que señalan la incapacidad del hongo de crecer a una temperatura de 37°C (7, 8, 13). Sin embargo, no hubo invasión del hongo a los tejidos circundantes, como se demostró por la reducción notable del nódulo no supurativo y la fibrosis circundante a los 60 días post-inoculación. No está claro el por qué los caprinos de este estudio redujeron naturalmente el tamaño del nódulo. Los animales fueron observados ocasionalmente hasta 154 días después de la inoculación y no se visualizaron lesiones granulomatosas o supurativas macroscópicamente en los sitios de la inoculación, aun cuando la dosis infectiva en el inóculo administrado posiblemente fue mucho mayor que la recibida usualmente por la inoculación accidental con cáctaceas infectadas.
Los detalles histopatológicos observados sugieren que las células inmunocompetentes de la epidermis ejecutan un papel importante en la respuesta local inmune de estos animales, pues no se observó invasión de los tejidos circundantes. Sin embargo, estos mecanismos de defensa parecieran ser lentos en eliminar el hongo, como fue confirmado por la existencia de células escleróticas e hifas en los tejidos obtenidos de las biopsias hasta los 60 días post-inoculación.
En forma general, la respuesta celular aguda y granulomatosa observada en las biopsias de los caprinos corresponde a la descrita en humanos, pero no se visualizaron las lesiones típicas de estos pacientes durante el tiempo de evaluación. Debido a la ausencia de estas lesiones a pesar de la administración de un inóculo infectante, se sugiere utilizar al caprino como modelo animal en estudios de larga duración con un mayor número de animales.
AGRADECIMIENTOS
A la Prof. Nicole Richard-Yegres, de la Universidad Francisco de Miranda, Coro, por la lectura y aportes críticos al manuscrito.
REFERENCIAS
1. Yegres F, Richard-Yegres N. Cladophialophora carrionii: Aportes al conocimiento de la endemia en Venezuela durante el siglo XX. Rev Soc Ven Microbiol 2002; 2: 153-157. [ Links ]
2. Richard-Yegres N, Yegres F, Zeppenfeldt G. Cromomicosis: endemia rural, laboral y familiar en Venezuela. Rev Iberoam Micol 1992; 9: 38-41. [ Links ]
3. Zeppenfeldt G, Richard-Yegres N, Yegres F, Hernández R. Cladosporium carrionii: hongo dimórfico en cactáceas de la zona endémica para la cromomicosis en Venezuela. Rev Iberoam Micol 1994; 11: 61-63. [ Links ]
4. Jiménez A, Yegres F, Richard-Yegres N. Cromomicosis: Evaluación del factor ocupacional en Mitare, distrito Miranda, estado Falcón. Acta Cien Venez 1990; 41:250. [ Links ]
5. Colina C, Espinoza C, González-Vivas R, Miyaji M, Nishimura K, Yegres F, Richard-Yegres N. Hipersensibilidad retardada en criadores de caprinos de la zona endémica para la cromomicosis en Venezuela. Acta Cient Venez 1989; 40:133. [ Links ]
6. De Hoog GS, Queiroz-Telles F, Haase G, Fernández-Zeppenfeldt G, Attili Angeliss D, Gerrits Van Den Ende A, Matos T, Peltroche-Llacsahuanga H, Pizzirani-Kleiners A, Rainer J, Richard-Yegres N, Vicente V, Yegres F. Black fungi: clinical and pathogenic approaches. Med Mycol 2000; 38: 243-250. [ Links ]
7. Borelli D. A method for producing chromomycosis in mice. T Roy Soc Trop Med H. 1972; 66(5): 793-779. [ Links ]
8. Yegres F, Richard-Yegres N, Medina RE, Gonzalez R. Cromomicosis por Cladosporium carrionii en criadores de caprinos del estado Falcón. Invest Clin 1985; 26 (4):235-246. [ Links ]
9. De Hoog GS, Guého E, Masclaux F, Gerrits Van Den Ende A, Kwon-Chung K, McGinnis M. Nutricional physiology and taxonomy of human-pathogenic Cladosporium-Xylohypha species. J Med Vet Mycol 1995; 33:339-347. [ Links ]
10. Rippon J. Chromoblastomycosis. In: Medical Mycology. The pathogenic fungi and pathogenic actinomycetes. W.B. Saunders. Philadelphia; 1988. P 299-320. [ Links ]
11. López M R. Diagnóstico y tratamiento de las micosis subcutáneas. Rev Iberoam Micol 1996; 13:56. [ Links ]
12. Herrera A, Yegres F, González-Vivas R, Caleiras E, Richard-Yegres N. Cladosporium carrionii, Phialophora verrucosa: inducción de la forma parasitaria en cultivo. Act Cient Venez 1990; 40: 69-71. [ Links ]
13. Sánchez-Mirt A, Pérez-Blanco M, Caleiras E, Rangel O. Histopatología y ultraestructura de la cromomicosis causada por Cladosporium carrionii. Invest Clin 1995; 36(4):173-182. [ Links ]
14. Yegres F, Richard-Yegres N, Nishimura K, Miyaji M. Virulence and pathogenicity of human and environmental isolates of Cladosporium carrionii in newborn ddY mice. Mycopathologia 1991; 114: 71-76. [ Links ]
15. Cardona N, Agudelo P. Development of a chronic chromoblastomycosis model in immunocompetent mice. Med Mycol 1999; 37: 81-83. [ Links ]
16. Coles Embert H. Diagnóstico y Patología en Veterinaria. 4ta.. Ed. México: Editorial Interamericana Mc Graw-Hill. 1986. P 246-271. [ Links ]
17. Ahrens J, Graybill JR, Abishawl A, Tio FO, Rinaldi MG. Experimental murine chromomycosis mimicking chronic progressive human disease. Am J Trop Med Hyg 1989; 40(6): 651-8. [ Links ]
18. Yegres F, Niel F, Gantier JC, Richard-Yegres N. Murine humoral inmune response against Cladophialophora carrionii y Fonsecaea pedrosoi infection. J Mycol Med 1998; 8:179-182. [ Links ]
19. Sánchez R, Yegres F, Chassaigne J, Tkachuck O, Richard-Yegres N. Respuesta inflamatoria en caprinos inoculados con Cladophialophora carrionii y Ciclosporina A. Memorias de las XXVIII Jornadas Venezolanas de Microbiología, 2002, Barquisimeto, Venezuela. 18M. P 38. (Resumen). [ Links ]
20. Uribe F, Zuloaga A, Leon W, Restrepo A. Histopathology of chromomycosis. Mycopathologia 1989; 105: 1-6. [ Links ]
21. Esterre P, Peyrol S, Sainte-Marie D, Pradinaud R, Grimaud JA. Granulomatous reaction and tissue remodeling in the cutaneous lesion of chromomycosis. Virchows Arch A Pathol Anat Histopathol 1993; 422: 285-91. [ Links ]












 uBio
uBio 
