Investigación Clínica
versión impresa ISSN 0535-5133versión On-line ISSN 2477-9393
Invest. clín v.47 n.2 Maracaibo jun. 2006
Aislamiento de Helicobacter pylori en mucosa gástrica, placa dental y saliva en una población de los Andes venezolanos.
Lilibeth De Sousa1, Libia Vásquez1, Judith Velasco1 y Donatella Parlapiano2.
1Laboratorio de Síndromes Gastrointestinales y Urinarios “Lic. Luisa Vizcaya”, Departamento de Microbiología y Parasitología, Facultad de Farmacia y Bioanálisis, Universidad de Los Andes y 2Servicio de Gastroenterología, IAHULA. Mérida, Venezuela. Correo electrónico: lilibeth72@yahoo.com
Resumen. La infección por H. pylori es una de las más comunes en el hombre. Sin embargo, los reservorios extragástricos y las vías de transmisión permanecen en el campo de lo controversial. La cavidad oral ha sido propuesta como reservorio de H. pylori, por lo que se realizó un estudio para determinar la presencia de H. pylori en placa dental y saliva asociando estos resultados con los obtenidos en biopsia gástrica. Se estudiaron 97 pacientes dispépticos y 50 pacientes sin dispepsia a quienes se les tomó muestras de biopsia gástrica, placa dental y saliva. Las muestras de biopsia gástrica fueron evaluadas mediante métodos microbiológicos e histológicos. A las muestras de cavidad oral se les realizó cultivo y prueba de la ureasa y se incluyó un método de pretratamiento, usando urea y HCl. La prevalencia de infección por H. pylori fue de 75,5% en la totalidad de los pacientes evaluados. No se logró aislar H. pylori en saliva y placa dental de ninguno de los dos grupos estudiados, con o sin pretratamiento de la muestra. La prueba de la ureasa en placa dental fue positiva en 99,3% de los pacientes y 89,8% en saliva. No hubo diferencia estadísticamente significativa entre la frecuencia de infección por H. pylori en pacientes dispépticos y sin dispepsia. Los resultados obtenidos sugieren que la metodología empleada para la detección de H. pylori no es suficientemente sensible para la determinación del microorganismo en cavidad oral.
Palabras clave: Helicobacter pylori, placa dental, saliva, cultivo.
Isolation of Helicobacter pylori in gastric mucosa, dental plaque and saliva in a population from the Venezuelan Andes.
Abstract. Helicobacter pylori infection is common in people. However, the existence of extra gastric reservoirs and transmission routes remain controversial in the field. Because the oral cavity has been proposed as a reservoir for H. pylori, a study was carried out to determine the presence of H. pylori in dental plaque and saliva. The results were asociated with those obtained in the gastric biopsy. Ninety-seven dyspeptic and fifty asymptomatic patients were studied and samples taken for biopsy, dental plaque and saliva. The gastric biopsies were evaluated using microbiology and histology methods. Cultures and urease tests were carried out on the oral cavity samples and included pretreatment methods using urea and HCl. The frequency of H. pylori for all the patients evaluated was 75.5%. H. pylori was not isolated in saliva or dental plaque in any of the two groups studied with or without sample pretreatment. The urease test in dental plaque was positive in 99.3% of the patients and 89.8% in saliva. There was no statistically significant difference between the infection prevalence by H. pylori in dyspeptic or not dyspeptic patients. The obtained results suggest that the methodology used for the detection of H. pylori is not sufficiently sensitive for the determination of the microorganism in the oral cavity.
Key words: Helicobacter pylori, dental plaque, saliva, culture.
Recibido: 16-02-2005. Aceptado: 01-12-2005.
INTRODUCCIÓN
Aproximadamente la mitad de la población mundial está infectada por Helicobacter pylori, bacteria que ha sido asociada a gastritis crónica, úlcera péptica, neoplasia gástrica y linfoma (1); sin embargo se han descrito varias fuentes de infección y vías de transmisión (2). Hasta hace poco tiempo se reconocía como su único reservorio natural el estómago, recientemente la cavidad bucal ha sido considerada como reservorio importante de H. pylori en el hombre, y esto avala las diferentes rutas de transmisión propuestas (3-5).
En la presente investigación se planteó el aislamiento de H. pylori en muestras de placa dental y saliva, y su asociación con el aislamiento en biopsia gástrica, con la finalidad de evaluar el potencial de la cavidad oral como posible reservorio del microorganismo y vía de infección, así como aplicar métodos sensibles y específicos que puedan brindar alternativas diagnósticas en la generación de pruebas no invasivas que permitan el estudio de la prevalencia de H. pylori en cavidad oral.
MÉTODOS
Pacientes
Se estudiaron un total de 147 pacientes adultos, 109 correspondientes al género masculino y 38 al género femenino, en edades comprendidas entre 15 y 75 años; 97 de ellos acudieron al Servicio de Gastroenterología por presentar síntomas dispépticos (pirosis, eructos, distensión abdominal, epigastralgia, sensación temprana de llenura, náuseas, vómitos, regurgitación) y 50 eran pacientes sin dispepsia que consultaban por otra causa (estreñimiento, hemorroides, pérdida de peso). Se excluyeron aquellos pacientes que hubiesen recibido terapia antibiótica o inhibidora de la bomba de protones cuatro semanas previas al estudio, antagonistas de los receptores de histamina tipo II dos semanas previas al estudio y neutralizantes o citoprotectores en un lapso de una semana antes del estudio.
A cada paciente se le explicaron los procedimientos a los cuales serían sometidos y les fue solicitada una autorización por escrito para ser incluido en la investigación, de acuerdo a las normativas éticas y legales para ensayos clínicos.
Recolección de muestras
Previo a la endoscopia, se colectaron las muestras de saliva por salivación en un colector estéril y muestra de placa dental a nivel gingival, mediante raspado de la superficie dentaria de los molares sexto y séptimo superiores e inferiores, con cureta de Gracey®, para cultivo y prueba de ureasa.
Posteriormente, el médico gastroenterólogo realizó una gastroscopia (Olympus® CV-100 GIF-130), mediante la cual se obtuvieron 6 muestras de mucosa gástrica, 3 de antro y 3 de fundus para estudio histológico mediante coloración de Giemsa modificada y hematoxilina-eosina, prueba de ureasa rápida usando el medio de Christensen modificado, cultivo y coloración de Gram modificado.
Cultivo microbiológico de muestras de biopsia gástrica
Cada fragmento de biopsia fue dividido para realizar coloración de Gram y macerado en un micromortero con 200 µL de solución salina fisiológica estéril para siembra en dos medios de cultivo:
- Agar Belo Horizonte diferencial: Agar Infusión Cerebro Corazón (BHI) suplementado con 10 % de sangre de caballo, e indicador 2,3 difenil tetrazolium (6).
- Agar Belo Horizonte selectivo diferencial: Agar BHI suplementado con 10% de sangre de caballo, indicador 2,3 difenil tetrazolium y suplemento antibiótico Dent® (Oxoid).
Para la generación de la atmósfera microaerofílica necesaria, se usó el método propuesto por Hernández y Rivera (7), que consiste en colocar dentro de la jarra de anaerobiosis una vela encendida y una tableta de antiácido efervescente tipo Alka-Seltzer en una bolsita de plástico con agua destilada. Posteriormente, las jarras se incubaron en estufa a una temperatura de 37°C durante 3-7 días.
Cultivo microbiológico de muestras de saliva y placa dental
Se realizó una siembra directa de las muestras de saliva y placa dental; a una parte de la muestra se le aplicó pretratamiento con 10 µL de HCl (0,06 N) y 5 µL de Urea (0,08 M) durante 5 minutos a 37°C, para la eliminación de la flora habitual de cavidad oral, según el método propuesto por Song y col. (8).
Ambas muestras se centrifugaron durante 5 minutos a 15.000 rpm y el sedimento se inoculó en los medios descritos para la muestra de biopsia gástrica, en iguales condiciones de incubación.
Identificación
Las pruebas de referencia usadas para el diagnóstico de infección fueron la histología y cultivo.
La identificación de H. pylori se llevó a cabo por características morfológicas y de cultivo (colonias pequeñas, de color dorado debido al indicador del medio), coloración de Gram modificado, hidrólisis de la urea y producción de catalasa y citocromo oxidasa.
Estudio estadístico
Se utilizó el programa estadístico SPSS versión 10.0. Las variables categóricas se expresaron como porcentajes y se compararon mediante Chi cuadrado c2 o test de Fisher.
El grado de concordancia para las variables cultivo y prueba de la ureasa en cavidad oral y biopsia gástrica se evaluó a través de la metodología de Medidas Simétricas para Variables Nominales, utilizando tablas de contingencia 2 × 2, y se clasificó de acuerdo al coeficiente Gamma.
RESULTADOS
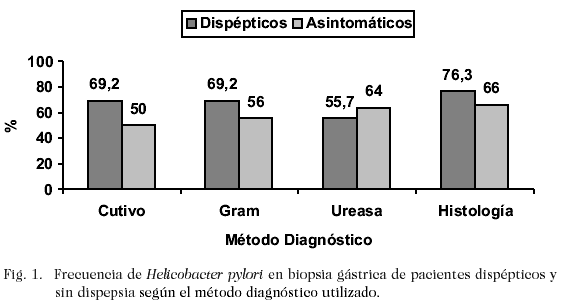
De los 147 pacientes estudiados, se obtuvo una frecuencia de infección de 75,5%, tomando como criterio para el diagnóstico de infección por H. pylori el aislamiento del microorganismo mediante cultivo microbiológico, la presencia del microorganismo por histología, o en su defecto la positividad a un mínimo de dos pruebas diagnósticas (prueba de la ureasa y coloración de Gram).
No se observó diferencia estadísticamente significativa entre la frecuencia de infección por H. pylori en pacientes dispépticos (77,3%) y sin dispepsia (72%).
La frecuencia de H. pylori en pacientes dispépticos y sin dispepsia en muestras gástricas, según cada método diagnóstico utilizado se observa en la Fig. 1.
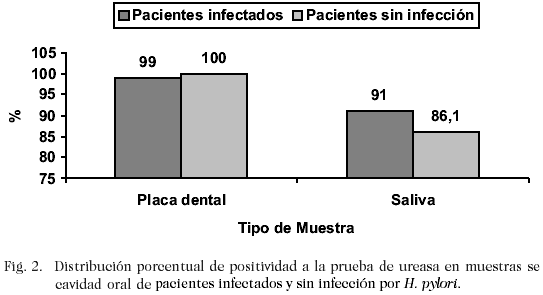
No se obtuvo crecimiento de H. pylori en placa dental ni saliva de ningún paciente, independientemente de la utilización o no del método de pretratamiento de la muestra. La frecuencia de positividad ante la prueba de la uresa en cavidad oral de pacientes infectados por H. pylori y pacientes sin infección fue similar (Fig. 2), no observándose diferencia estadísticamente significativa.
No se observó concordancia estadísticamente significativa entre los métodos utilizados para la determinación de colonización en cavidad oral por H. pylori (cultivo o prueba de la ureasa en placa dental y saliva) y los mismos métodos utilizados para diagnóstico de infección en mucosa gástrica.
DISCUSIÓN
Diversos procedimientos han sido empleados para el diagnóstico de infección por H. pylori; en el presente estudio se utilizaron tres métodos microbiológicos y uno histológico para la determinación de infección por H. pylori en mucosa gástrica, obteniendo una elevada frecuencia de infección semejante a la obtenida en otros estudios realizados en Venezuela (9-11), con un alto grado de concordancia entre el cultivo, que ha sido catalogado como el método de oro, con la histología y la coloración de Gram. Por otra parte, la prueba rápida de ureasa en biopsia gástrica presentó un grado de concordancia intermedio con el cultivo, evidenciando estos resultados la posibilidad de diferentes alternativas diagnósticas sensibles y específicas en la determinación de H. pylori en mucosa gástrica.
Es importante destacar, que la frecuencia de infección fue similar en pacientes dispépticos y sin dispepsia, coincidiendo con un estudio realizado en Argentina (12), esto sugiere que una vez adquirida la infección por H. pylori ésta persiste en la mucosa gástrica por años o décadas en ausencia de sintomatología.
Se han realizado esfuerzos en la búsqueda de procedimientos para la detección de H. pylori en cavidad oral, abarcando desde técnicas microbiológicas convencionales hasta técnicas moleculares. Las conclusiones de los diferentes trabajos son controvertidas y hasta ahora no se conoce si existe una colonización transitoria de la cavidad oral, en casos de reflujo o en pacientes sometidos a endoscopia. Los resultados de prevalencia en este tipo de muestras fluctúan desde valores elevados (3, 4, 13, 14), hasta resultados próximos a cero (15-20).
En un estudio realizado por Berroterán y col. (5) en Venezuela, lograron recuperar H. pylori mediante cultivo en 7/40 (17,5%) muestras de placa dental, sin embargo, en el presente estudio, no se logró aislar H. pylori en las muestras de cavidad oral en ningún paciente. Estos resultados concuerdan con los reportados por Bernarder (15) en Suecia, quien no logró aislar H. pylori en cultivos de placa dental y saliva de 52 pacientes que fueron positivos en muestras de biopsia gástrica.
Oshowo y col. (20), lograron aislar H. pylori a partir de placa dental en sólo 2 pacientes de 208 estudiados, sin recuperarlo en saliva, raspado de lengua ni hisopado orofaríngeo. Bickley y col (16) en 1993, tampoco lograron detectar el microorganismo mediante cultivo o PCR de placa dental de 62 pacientes con biopsias positivas. Por otra parte, Kradjen y col. (21) en un estudio Canadiense, así como Luman y col. (18), en el Reino Unido, no aislaron el microorganismo en saliva. De modo similar, en un estudio reciente realizado por Allaker y col. (22), en un grupo de pacientes con resultados positivos o negativos en biopsia gástrica, no lograron aislar H. pylori en muestras de placa dental que resultaron positivas por técnicas de PCR.
Los cultivos negativos en cavidad oral podrían deberse a que H. pylori se encuentra en bajo número, dificultando su aislamiento por el sobrecrecimiento de abundantes poblaciones de microorganismos competitivos. Otra explicación, podría basarse en la distribución no uniforme de H. pylori en cavidad oral (23, 24). En vista de las dificultades planteadas por varios investigadores, Song y col. (8), propusieron un método de pretratamiento usando Urea y HCl para eliminar la cantidad de microorganismos competitivos en muestras naturalmente contaminadas. Este procedimiento fue aplicado en la presente investigación, con lo cual se logró eliminar o minimizar el crecimiento de la microbiota habitual de cavidad oral; sin embargo, no se logró aislar H. pylori de ningún paciente mediante la aplicación de este procedimiento. Cabe destacar que estos investigadores usaron el método de pretratamiento en muestras de saliva inoculadas previamente con cepas de H. pylori, obtenidas por cultivo del microorganismo en biopsia gástrica y no con muestras de pacientes para la recuperación primaria del microorganismo en saliva, por lo cual se deduce que este hallazgo podría deberse a que se trata de un cultivo secundario, en el cual la recuperación de la cepa es de más fácil obtención que en aislamiento primario. En el presente estudio, los cultivos negativos en placa dental y saliva, podrían atribuirse a que los pacientes no poseían H. pylori en cavidad oral o que se encontraran en inóculos menores a 102 UFC/mL. También se ha planteado como dificultad para el éxito del cultivo a partir de cavidad oral, la existencia de H. pylori en forma cocoide, la cual se especula sea una forma de resistencia capaz de soportar las condiciones adversas que encuentra en el medio ambiente y reversible a la forma espiral en el momento en que se vuelven a dar las condiciones óptimas (17, 25). Numerosos intentos de cultivar la forma cocoide han fracasado, lo que han llevado a denominar a la forma cocoide como “forma viable pero no cultivable” de H. pylori (26).
Los resultados obtenidos mediante la prueba de la ureasa en cavidad oral sugieren que esta no puede ser considerada una prueba alternativa para la determinación de infección en mucosa gástrica, ni para evaluar la colonización en cavidad oral como ha sido propuesto por otros investigadores (27, 28). Es importante destacar que la cavidad oral puede poseer otras bacterias ureasa positivas que pueden originar resultados falsos positivos.
Nasrolahei y col. (29) en un estudio similar a esta investigación, evaluaron 180 pacientes dispépticos mediante varias técnicas (ureasa, coloración de Giemsa, PCR, cultivo en placa dental y biopsia gástrica), evidenciando la presencia de H. pylori en placa dental tanto en pacientes infectados como no infectados, por lo que concluyen que no hay asociación entre colonización en placa dental e infección gástrica.
En conclusión los resultados obtenidos se pueden atribuir a la existencia de H. pylori en inóculos bajos o la presencia de formas cocoides no cultivables, lo cual sugiere que la metodología empleada para la detección de H. pylori no es suficientemente sensible para la determinación del microorganismo en cavidad oral.
AGRADECIMIENTO
Al Fondo Nacional de Ciencia y Tecnología e Innovación (FONACIT, Código Nº F-2000001633, Ministerio de Ciencia y Tecnología, Caracas-Venezuela) y al Consejo de Desarrollo Científico Humanístico y Tecnológico (CDCHT, Código Nº FA- 326-04-07-B. Universidad de los Andes, Mérida, Venezuela) por financiar esta investigación.
REFERENCIAS
1. Moss S, Sood S. Helicobacter pylori (Gastrointestinal Infections). Cur Op Infect Dis 2003; 16(5): 445-451. [ Links ]
2. Brown LM. Helicobacter pylori: epidemiology and routes of transmisión. Epidemiol Rev 2000; 22(2):283-297. [ Links ]
3. Pytko-Polonczyk J, Konturek E, Bielanski W, Kaszmarczyk- Stachowska A. Oral cavity as permanent reservoir of Helicobacter pylori and potential source of reinfection. J Physiol Pharmacol 1996; 47:121-129. [ Links ]
4. Karczewska E, Konturek JE, Konturek P, Czesnikiewicz M, Sito E, Bielanski W, Kwiecien N, Obtulowicz W, Ziemniak W, Majka J, Hahn EG, Konturek SJ. Oral cavity as a potential source of gastric reinfection by Helicobacter pylori. Dig Dis Sci 2002; 47(5):978-986. [ Links ]
5. Berroteran A, Perrone M, Correnti M, Cavazza M, Tombazzi C, Lecuna V, Goncalvez R. Prevalencia de Helicobacter pylori en el estómago y placa dental de una población en Venezuela. Acta Odontol Venezol 2001; 39(2):35-41. [ Links ]
6. Queiroz D, Mendes E, Rocha G. Indicator Medium for Isolation of Campylobacter pylori. J Clin Microbiol 1987; 25(12): 2378-2379. [ Links ]
7. Hernández F, Rivera P. A low cost method for production of the gaseous environment for isolation of Helicobacter pylori. Rev Inst Med Trop Sao Paulo 1992; 34:167-169. [ Links ]
8. Song Q, Zirnstein GW, Swaminathan B, Gold BD. Pretreatment with Urea-Hydrochloric Acid enhances the isolation of Helicobacter pylori from contaminated specimens. J Clin Microbiol 2001; 39: 1967-1968. [ Links ]
9. Bracho S, Vizcaya L, Velásquez A, Casanova G. Valoración de la Prueba de la Ureasa, Cultivo y Coloración de Gram en la investigación de Helicobacter pylori de biopsias gástricas. Rev Fac Farm 1995; 33:10-14. [ Links ]
10. Plummer M, Vivas J, Fauchere JL, Del Giudice G, Pena AS, Ponzeto A, Lopez G, Miki K, Oliver W, Munoz N. Helicobacter pylori and stomach cancer: A Case-Control study in Venezuela. Cancer Epidemiol, Biomark & Prevent 2000; 9:961-965. [ Links ]
11. Fuenmayor B, Cavazza M, Beltran D, Gallegos B, Inciarte A, Botero L. Infección por Helicobacter pylori en pacientes con patología gastroduodenal benigna. Rev Soc Ven Microbiol 2002; 22(1):27-31. [ Links ]
12. Mattana C, Vega A, Gómez P, Puig O. Perfil serológico de la infección por Helicobacter pylori en la población de San Luis (Argentina). Enferm Infecc Microbiol Clin 2004; 22:227-229. [ Links ]
13. Li C, Ha T, Ferguson DA Jr, Chi DS, Zhao R, Patel NR, Krishnaswamy G, Thomas E. A newly developed PCR assay of H. pylori in gastric biopsy, saliva, and faeces. Dig Dis Sci 1996; 41:2142-2149. [ Links ]
14. Ogunbodede EO, Lawal OO, Lamikanra A, Okeke IN, Rotimi O, Rasheed AA. Helicobacter pylori in the dental plaque and gastric mucosa of dyspeptic Nigerian patients. Trop Gastroenterol 2002; 23(3): 127-133. [ Links ]
15. Bernarder S. Absence of Helicobacter pylori in dental plaques and saliva in Helicobacter pylori positive dyspeptic patients. Eur J Clin Microbiol Infect Dis 1993; 12: 283-285. [ Links ]
16. Bickley J, Owen RJ, Fraser AG, Pounder RE. Evaluation of the polymerase chain reaction for detecting the urease C gene of Helicobacter pylori in gastric biopsy samples and dental plaque. J Med Microbio1 1993; 39(5):338-344. [ Links ]
17. Von Recklinghausen G, Weisher T, Ansorg R, Mohr C. No cultural detection of Helicobacter pylori in dental plaque. Zentralb Bakteriol. 1994; 281(1):102-106. [ Links ]
18. Luman W, Alkout A, Blackwell C, Weir D, Plamer K. Helicobacter pylori in the mouth-negative isolation from dental plaque and saliva. Eur J Gastroenterol Hepatol 1996; 8(1):11-14. [ Links ]
19. Mattana CM, Vega AE, Flores G, De Domenicon AG, De Centorbi OV. Isolation of Helicobacter pylori from dental plaque. Rev Argent Microbiol 1998; 30:93-95. [ Links ]
20. Oshowo A, Guillam D, Botha A, Tunio M, Holton J, Boulos P, Hobsley M. Helicobacter pylori: the mouth, stomach, and gut axis. Ann Periodontol 1998; 3(1): 276-280. [ Links ]
21. Kradjen S, Fuksa M, Anderson J, Kempston J, Boccia C, Petrea C, Babida M, Penner JL Examination of human stomach biopsies, saliva, and plaque for Campylobacter pylori. J Clin Microbiol 1989; 27:1397-1398. [ Links ]
22. Allaker RP, Young KA, Domizio P, Meadows NL. Prevalence of Helicobacter pylori at oral and gastrointestinal sites in children: evidence for possible oral to oral transmission. J Med Microbiol 2002; 51(4): 312-317. [ Links ]
23. Nguyen AM, Engstrand L, Genta RM, Grahan DY, El-Zaatari. Detection of Helicobacter pylori in dental plaque by reverse transcription-polymerase chain reaction. J Clin Microbiol 1993; 31:783-787. [ Links ]
24. Cammarota G, Tursi A, Montalvo M, Papa A, Veneto G, Bernardi S, Boari A, Colizzi V, Fedeli G, Gasbarrini G. Role of dental plaque in the transmission of Helicobacter pylori. J Clin Gastroenterol 1996; 22(3): 174-177. [ Links ]
25. Young K, Allaler F, Hardie J. Morphological analysis of Helicobacter pylori from gastrics biopsies and dental plaque by scanning electron microscopy. Oral Microbiol Inmunol 2001; 16(3): 178-181. [ Links ]
26. Bode G, Mauch F, Malfertheiner P. The coccoid forms of Helicobacter pylori. Criteria for their viability. Epidemiol Infect 1993; 111:483-490. [ Links ]
27. Gurbuz AK, Ozel AM, Yazgan Y, Celik M, Yildirim S. Oral colonization of Helicobacter pylori: Risk Factors and response to Eradication Therapy. South Med J 2003. March 96(3): 244-247. [ Links ]
28. Butt AK, Khan AA, Izhar M, Alam A, Shah SW, Shafqat F. Correlation of Helicobacter pylori in dental plaque and gastric mucosa of dyspeptic patient. J Pak Med Assoc 2002; 52(5):196-200. [ Links ]
29. Nasrolahei M, Maleki I, Emadian O. Helicobacter pylori colonization in dental plaque and gastric infection. Rom J Gastroenterol 2003; 12(4):293-296. [ Links ]
Autor de correspondencia: Lilibeth De Sousa De Abreu. Conjunto residencial Villas del Rimac, Sector Río Negro. Av. Atlántico, Casa 29. Puerto Ordaz, Estado Bolívar, Venezuela. Teléfono: + 58 286 9314543. Correo electrónico: lilibeth72@yahoo.com












 uBio
uBio