Investigación Clínica
versión impresa ISSN 0535-5133versión On-line ISSN 2477-9393
Invest. clín v.47 n.2 Maracaibo jun. 2006
Metaloproteasas en la progresión tumoral. Revisión.
Francisco Arvelo y Carlos Cotte.
Laboratorio de Cultivo de Tejidos y Biología de Tumores, Instituto de Biología Experimental, Facultad de Ciencias, Universidad Central de Venezuela, Apartado 47114, Caracas, Venezuela. Correo electrónico: franarvelo@yahoo.com
Resumen. Las dos propiedades biológicas que determinan la malignidad en el cáncer son la infiltración y la metástasis, lo cual ha llevado al estudio de todos los mecanismos que tienen que ver tanto con la invasión de las células tumorales como con la relación de estas células con su estroma, con el cual interactúan produciendo factores que provoca la movilización y acumulación de células inflamatorias, formación de nuevos vasos sanguíneos, multiplicación de fibroblastos y síntesis de componentes de la matriz extracelular. La invasión tumoral está mediada por diversas enzimas, en particular las proteasas, que degradan la matriz extracelular y cuyos productos facilitan la progresión tumoral, destacando entre ellas las metaloproteasas (MMP), que al jugar un papel importante en la biología del cáncer, son blanco potencial para usarlas en la terapia contra esta enfermedad. Por ello inhibidores sintéticos de las metaloproteasas ya han sido desarrollados, que si bien han presentando actividad antitumoral al usarse en varios modelos animales, en estudios clínicos hechos en pacientes con cánceres avanzados no se ha logrado, hasta ahora, obtener una respuesta terapéutica efectiva. Dada la importancia y significado biológico y clínico de estas investigaciones, este artículo resume el papel que desempeñan las metaloproteasas en la promoción tumoral, proliferación celular, invasión tumoral y la angiogénesis.
Palabras clave: Cáncer, invasión, metástasis, progresión tumoral, metaloproteasas.
Metalloproteinases and tumor progression.
Abstract. The two biological characteristics that determine the malignancy of cancer are infiltration and metastasis. The study of these mechanisms is related to the invasion of tumoral cells and the relationship of these cells with their stroma, which interact producing the movement and accumulation of inflammatory cells, the formation of new blood vessels, multiplication of fibroblasts and the synthesis of the components of the extra cellular matrix production. Tumoral invasion is conditioned through various enzyme activities, in particular proteases which degrade the matrix, thus facilitating the progression of the tumor. The metalloproteinases (MMP) are a family of proteinases that play an important role in cancer as well as in numerous other diseases. MMP are, therefore, a potential factor in cancer therapy. Several synthetic MMP inhibitors have been developed and have shown successful anti-tumor activity in a variety of animal species, but in clinical studies of patients with advanced forms of cancer, this therapeutic strategy has not resulted as effective. In this article, due to the biological and clinical importance of this therapy, we summarize the current views on the role of metalloproteinases (MMP) in tumor promotion, proliferation, invasion, metastasis and angiogenesis.
Key words: Cancer, invasion, metastasis, tumor progression, metalloproteinases.
Recibido: 05-05-2005. Aceptado: 08-09-2005.
INTRODUCCIÓN
La invasión es una característica común a casi todos los tumores malignos, y microscópicamente resulta evidente cuando se observa la composición del tejido vecino a un cáncer, constituido por células neoplásicas y no neoplásicas (1). En algunos tumores, las células malignas se mezclan con las normales o las sustituyen, pero permanecen confinadas en el plano en que se originaron. Por ejemplo, las células de un carcinoma epidermoide del cuello uterino pueden reemplazar a las células normales en un espesor de varios milímetros sin romper la membrana basal ni pasar al tejido adyacente. Estos tumores se denominan carcinomas in situ, pero los mismos, con el tiempo y de no diagnosticarse y tratarse, rompen la membrana basal y crecen en el estroma que los rodea, transformándose en carcinomas infiltrantes, cuyo patrón de invasión puede haberse desarrollado en una fase muy precoz de la progresión tumoral (2). La invasión del tejido adyacente al tumor primario y la migración de las células malignas a órganos distantes, fenómeno denominado metástasis, son las características más funestas del cáncer (3, 4). Si esta propiedad de invadir no existiera, la extirpación quirúrgica bastaría para controlar la mayor parte de los tumores malignos, y ello no constituiría el mayor problema que enfrentan los pacientes con cáncer. Las células malignas, al ser capaces de invadir y producir metástasis, a lo cual hay que sumar la resistencia que pueden desarrollar ante las drogas antitumorales, hacen que los tratamientos usados para controlar la enfermedad no sean efectivos para todos los pacientes con cáncer (4-7).
La capacidad de metastatizar es un fenómeno complejo, como se señala en la Fig. 1, que requiere, al menos, cinco pasos: a) invasión por las células tumorales de las estructuras adyacentes, como las membranas basales; b) paso hacia la sangre o los vasos linfáticos con liberación de células tumorales hacia la circulación, fenómeno denominado intravasaciòn; c) supervivencia de las células tumorales en la sangre circulante y superación de la vigilancia inmunológica; d) escape de la circulación, fenómeno conocido como extravasación; e) implantación en un tejido diferente, extraño, con formación de un nuevo foco tumoral (8). En el momento de efectuarse la detección de un cáncer, cerca de la mitad de los pacientes tienen evidencias de focos metastásicos, siendo factible que muchos más tengan metástasis ocultas, por lo que algunos oncólogos clínicos piensan que siempre debe considerarse que al momento del diagnostico, ya hay células dispersas, aun cuando las mismas no hayan sido detectadas, por lo que ellos piensan que en el tratamiento siempre debería considerarse esta posibilidad (9). Las metástasis pueden ser detectadas cuando el tumor primario es muy pequeño, menos de 0,5 cm de diámetro, pero en general, con la mayoría de los tipos de cáncer, el incremento de tamaño del tumor primario se correlaciona con el aumento de la posibilidad de metástasis, lo cual no es verdad cuando se hacen comparaciones entre diferentes tipos de cáncer, ya que si bien ellos pueden tener similar tamaño, pueden tener, en tiempo, velocidades variables de metástasis. Todo esto nos indica que la diseminación tumoral es un fenómeno complejo y de difícil solución, ya que, pese a los grandes avances alcanzados en el tratamiento convencional del cáncer por el perfeccionamiento de los tratamientos con radioterapia, quimioterapia y las nuevas técnicas quirúrgicas, la mayoría de los decesos por cáncer siguen siendo el resultado del no control de la diseminación tumoral.
Casi todos los carcinomas nacen de las capas de células epiteliales que reposan sobre una membrana basal compuesta por proteoglicanos densos, constituyendo una barrera a la diseminación precoz del tumor. Ante esta protección y defensa, los tumores invasores suelen secretar enzimas capaces de degradar esta barrera física (10), siendo la expresión de tales enzimas un paso indispensable en la invasión de las estructuras y capas celulares adyacentes, así como en todos los mecanismos que tienen que ver con los fenómenos de circulación tanto sanguínea como linfática. Investigaciones recientes que evidencian la implicación fundamental de las proteasas en los procesos de invasión tumoral están permitiendo el avance de estrategias terapéuticas potenciales, y es por esta razón que el estudio de las enzimas proteolíticas, y su papel en los procesos fisiológicos y patológicos sean fundamentales, por cuanto se pudiese llegar a diseñar probables agentes terapéuticos contra el cáncer basados en la inhibición y control de la acción de estas enzimas.
Entre las enzimas proteolíticas más representativas implicadas en los procesos de diseminación de tumores se incluye las metaloproteasas, de las cuales hablaremos en esta revisión en sus diferentes tipos y su papel fundamental en los mecanismos de infiltración y metástasis, dos de los mayores obstáculos del éxito de los tratamientos contra el cáncer
PAPEL DE LAS ENZIMAS PROTEOLÍTICAS EN LA INFILTRACIÓN Y LA METÁSTASIS
Para lograr producir una metástasis, las células malignas de un tumor primario deben invadir a través de las células de los tejidos del huésped y la matriz extracelular (MEC), entrar a la circulación, llegar a una cama vascular distante, extravasarse y penetrar la MEC para pasar a los intersticios de un órgano blanco, proliferar como una nueva colonia e inducir la formación de nuevos vasos que hagan posible mantener su crecimiento (11). Para que la mayoría de estos pasos ocurran se requiere de la liberación de enzimas proteolíticas, por lo que el potencial invasivo y metastásico de las células malignas ha sido correlacionado con la acción de varias proteasas, actividad que no solo es característica del cáncer, sino que también lo es de las células normales involucradas en un significativo numero de procesos naturales. La reparación de los tejidos normales, remodelación de los tejidos durante el desarrollo, remodelación mamaria después de la lactancia, implantación del blastocito, crecimiento de la placenta, la angiogénesis y muchos más ocurren gracias al concurso y acción de las enzimas proteolíticas. Esta realidad es de una importancia muy particular, ya que demuestra que la producción de altos niveles de actividad proteolítica extracelular no es exclusiva de estados neoplásicos, sino que también representa la expresión de funciones celulares normales. Si bien en el cáncer esta actividad es inapropiada y lesiva para el organismo, la característica común de estos fenómenos fisiológicos en los procesos normales y patológicos, es que los mismos están involucrados en el rompimiento de barreras histológicas, como lo son la lámina basal y el estroma intersticial, lo cual causa cambios pasajeros o permanentes en la arquitectura de los tejidos (12-14). En el caso de la remodelación normal, contrapuesto a lo que ocurre con los tumores malignos, las proteasas tienen en contrapartida inhibidores, lo cual significa la existencia de mecanismos de regulación que mantiene un balance delicadamente controlado mediante dispositivos que involucran, por ejemplo, la liberación local de factores de crecimiento, mecanismos de retroalimentación, etc. Así, en los procesos de remodelación normales, como los ya señalados, hay un proceso regulador efectivo que controla la liberación de las proteasas, inhibiéndolas, una vez que ellas han concluido su trabajo. Todo lo contrario ocurre con los tumores metastásicos, los cuales han perdido o no responden a estos mecanismos de control (15, 16). Los primeros indicios de que las proteasas estaban involucradas en el proceso de invasión en cáncer se remontan a los estudios iniciales realizados con cultivos de tejidos a principios del siglo XX, ya que, en ese tiempo se usaba preferentemente el coágulo de plasma como sustrato para el crecimiento de los tejidos. Con esta técnica se observó que los tejidos provenientes de tumores malignos tenían la capacidad de disolver los coágulos de plasma, mientras que los tejidos normales no poseían esa capacidad, por lo que Fischer, en 1925, propuso que este fenómeno podría estar relacionado con la degradación de la fibrina, y que a su vez ello estaba asociado al crecimiento invasivo de tumores, sugiriendo que un agente lítico producido por las células malignas era el responsable de la degradación del coágulo de fibrina (17). Investigaciones posteriores confirmaron la observación inicial de Fisher, y hoy ya sabemos que las proteasas juegan un papel fundamental en la progresión del cáncer, siendo utilizadas en tres de los eslabones fundamentales que constituyen la cadena de eventos que llevan a la invasión tumoral mediante la infiltración y la metástasis, como lo son la invasión del sitio de crecimiento primario; la lisis de la membrana basal, y la invasión del sitio de la metástasis. De las cinco clases de proteasas existentes, dos de ellas destacan en los procesos de degradación proteolítica observada en el cáncer, categorizadas de acuerdo a si ellas requieren Zn2+ o Ca2+ o no, llamadas así metaloproteasas, que incluyen, por ejemplo, las colagenasas Tipo I y IV. El mejor ejemplo de una de las no metaloproteasas es el plasminógeno, que tiene un residuo de serina en el sitio activo, y por tanto pertenece a la clase de las serinproteasas.
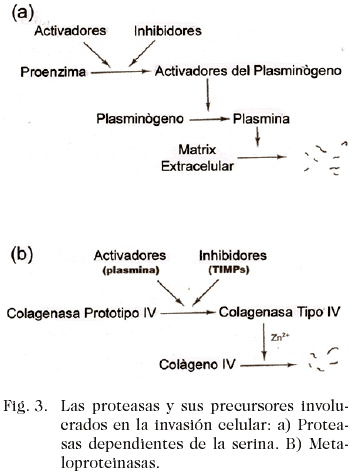
Una característica común a estas dos categorías de proteasas es que ellas son secretadas como proenzimas inactivadas, las cuales deben ser activadas por otras proteasas, como es señalado en la Fig. 2. Inhibidores tisulares de la activación también existen, pero de tal forma que la invasión puede ser influenciada por alguno de estos tres componentes: la cantidad de pro enzima, el activador y el inhibidor.
Cada uno de ellos, puede ser producido por las células normales, pero su balance es alterado en el cáncer, favoreciéndose la proteolisis. En el caso del plasminógeno este es convertido a la proteasa activa plasmina por otras proteasas llamadas activadores del plasminógeno, que a la vez pueden convertir a la proenzima en la forma inactivadora, como se señala esquemáticamente en la Fig. 3. Así, los activadores del plasminógeno son categorizados como tipo-tejido (tPA) o tipo-uroquinasa (uPA), nomenclatura que puede llevar a cierta confusión al estar hecha en base a su caracterización original, ya que uPA es más importante en la proteolisis de los tejidos, en tanto que la primera función de la tPA es disolver los coágulos de plasma. Los anticuerpos contra uPA inhiben la invasión en tanto que su sobre expresión tiene el efecto opuesto y los inhibidores sintéticos, como lo es el amilorida, también decrecen el numero de colonias metastásicas en los modelos ensayados. Las metaloproteasas son también secretadas como proenzimas que pueden ser proteolíticamente activadas por la plasmina, la cual tiene así un rol doble al provocar la lisis de la matriz extracelular, así como activar otras proteasas. Los inhibidores tisulares de las metaloproteasas o TIMP, también bloquean la activación, y en el caso de la colagenasa tipo IV ella incrementa la dispersión metastàsica en los sistemas experimentales, en tanto que los TIMP los decrece.
Es importante señalar que la metaloproteasas y serinproteasas, seguidas por las cisteinproteasas, constituyen los grupos de proteasas con mayor número de miembros, habiendo sido señalado que hasta el momento han sido caracterizadas para el primer grupo 186 y para el segundo176. Las cisteinproteasas son 143 y los otros dos grupos restantes, las treoninproteasas y aspartilproteasas son muy bajas en el número de sus miembros, menos de treinta para cada grupo, siendo altamente especializadas (18).
LAS METALOPROTEASAS
Las metaloproteasas fueron inicialmente caracterizadas por su propiedad de degradar la matriz extracelular, requiriendo el ion Zn2+ o Ca2+ en su sitio activo, siendo inhibidas por agentes quelantes de zinc y calcio. Son secretadas en forma latente y requiere activación para llevar a cabo su actividad proteolítica, siendo inhibidas por los inhibidores tejidos-específicos de metaloproteasas (TIMPs). La familia de las MMPs está constituida por al menos 20 endopeptidasas que comparten homología –30-50%– y están constituidas por tres dominios: a) el “pre”-dominio necesario para su desplazamiento intracelular hasta la superficie celular, el cual es eliminado rápidamente después de la secreción, y está ausente de la forma enzimática madura; b) el “pro”-dominio, que mantiene la actividad enzimática bajo forma latente, y está constituido de una secuencia peptídica que comprende un residuo de cisteina que interactúa con el sitio catalítico y finalmente, c) el dominio catalítico propiamente dicho, que contiene un átomo de zinc sostenido por tres residuos de histidina. Es necesario señalar que el residuo de cisteína del “pro”-dominio actúa como un cuarto ligando del ion metálico, donde el clivaje proteolítico libera el átomo de zinc del residuo de cisteína provocando la activación del sitio catalítico que ahora se puede unir a su sustrato por la penetración de una molécula de H2O. También debemos considerar que la mayor parte de las metaloproteasas posee un cuarto dominio en la posición carboxilo terminal. Esta cadena polipeptídica es homologo de la vitronectina o de la hemopexina que intervienen en el reconocimiento de los sustratos de la metaloproteasas.
De acuerdo a sus diferencias estructurales las metaloproteasas pueden ser clasificadas en seis grupos.
1. Matrilisinas
Las metaloproteasas matrilisina-1 (MMP-7) y matrilisina-2 (MMP-26) son estructuralmente las más simples, ya que no contienen dominio homólogo de la hemopexina, y son expresadas específicamente por células tumorales de origen epitelial, cuyos espectros proteolíticos son divergentes, pero incluyen la fibronectina y la gelatina (19, 20).
2. Colagenasas intersticiales
MMP-1, MMP-8, MMP-13 forman un segundo grupo de metaloproteasas que intervienen en la degradación del colágeno fibrilar que incluye los colágenos tipo I, II, III y VII. El clivaje proteolítico de estos colágenos conduce a la formación de colágenos desnaturalizados o gelatinas, que a su vez es degradado por las gelatinasas (21). La MMP-13 o colagenasa 13 es caracterizada por un espectro enzimático más amplio, y es esencialmente expresado en zonas donde se requiera remodelación rápida de la matriz extracelular, tal como el tejido óseo fetal en desarrollo o en lugares de inflamación crónica. Algunos carcinomas y sarcomas están asociados a una hiperactividad de la MMP-13 (22).
3. Estromalisinas
Estas metaloproteasas comprenden la MMP-3 o estromalisina-1, la MMP-10 o estromalisina-2, y la MMP-11 o estromalisina-3. En relación a estas proteasas hay que señalar que los estudios con células transformadas por oncogenes, líneas celulares tumorales y modelos de tumores experimentales, señalan que las células cancerosas son responsables de la producción de metaloproteasas en los tumores humanos. Sin embargo, en estudios llevado a cabo en canceres de mama humanos se ha reportado que los fibroblastos del estroma que rodeaban a las células tumorales, no las células tumorales mismas, son responsables en producir las estromalisinas (23). Una posible explicación de la producción de MMPs por las células estromales del tumor fue el hallazgo de un inductor de metaloproteasas de la matriz extracelular o EMMPRIN (Extracellular Matrix Metaloproteinase Inducer) también llamado basigina o DDT/37 (24). El EMMPRIN es una glicoproteína de la membrana plasmática que es producida en grandes cantidades por las células tumorales, provocando la estimulación local de los fibroblastos a sintetizar MMP-1, MMP-2 y MMP-3. La interacción de las células tumorales con los fibroblastos vía EMMPRIN, conduce a la degradación local de la membrana basal y componentes de la matriz extracelular, facilitando así la invasión por parte de las células tumorales, por lo que, de manera indirecta las células malignas facilitan su propia diseminación (25, 26). El EMMPRIN además, de inducir la producción de metaloproteasas también induce la angiogenesis vía estimulación del VEGF, así como resistencia multidroga mediante la sobreexpresión de ErbB2 (27).
4. Gelatinasas
La actividad proteolítica de las MMP-2 y MMP-9 está dirigida contra el colágeno intersticial desnaturalizado o gelatina, colágeno tipo IV y V de la membrana basal (28). Una característica estructural de las gelatinasas es la presencia en el seno de su dominio catalítico de tres secuencias peptidicas repetitivas análogos a los motivos de la fibronectina de tipo II (29). La MMP-2 o gelatinasa-A es fisiológicamente expresada por las células del estroma de la mayoría de los tejidos, pero la expresión de la MMP-9 o gelatinasa-B es débil o ausente en los tejidos normales, y se encuentra limitada a monocitos y macrófagos. Sin embargo, su expresión puede ser inducida en caso de remodelación tisular como el desarrollo embrionario, cicatrización o invasión tumoral (30, 31).
5. Metaloproteasas asociadas a membrana
Las MMP-14, MMP-15, MMP-16, MMP-17, MMP-24, MMP-25 también denominadas MT1-MMP a MT6-MMP, presentan la característica esencial de poderse unir a la membrana celular, bien sea por intermedio de un sitio hidrófobo de la membrana independiente del dominio hemopexina o por la vía del GPI o glicosilfosfatidilinositol (32). Es importante señalar que estas enzimas intervienen en la activación proteolítica de otras metaloproteasas (33).
6. Grupo heterogéneo de metaloproteasas
Una serie de metaloproteasas, las MMP-12, MMP-19, MMP-20, MMP-21, MMP-22, MMP-23/B, MMP-28, ha sido identificada sin que, hasta el momento se tenga claro el papel que desempeñan en el desarrollo del cáncer (34, 35). La MMP-12 cuyo sustrato principal es la elastina es secretada por los macrófagos, mientras que la MMP-20 o enamelisina, interviene en la formación del esmalte dentario (36, 37).
REGULACIÓN DE LA ACTIVIDAD DE LAS METALOPROTEASAS
La actividad de las metaloproteasas en el espacio extracelular depende del equilibrio que se establece entre su activación e inhibición, este último fenómeno controlada por inhibidores endógenos conocidos como TIMP o Tissue Inhibitors of Matrix Metalloproteinases, siendo activos contra la mayoría de las MMPs, y difieriendo entre ellos en cuanto a su solubilidad, regulación y su interacción específica con la proenzima (15). La expresión de las metaloproteasas está estrictamente controlada, siendo inducida por factores de crecimiento EGF, PDGF, TGF-a, bFGF; citoquinas como IL-1 y TNF-a y varios oncogenes (38), existiendo otros factores, como el TGF-a y la IL-4, que inhiben su expresión. Como ejemplo de la relación de las proteasas con la oncogenicidad, el gen de la ST-1 o estromalisina-1 está inducido en fibroblastos por promotores tumorales como el TPA y factores de crecimiento como el EGF o PDGF, además está reprimido por inhibidores como el TGF-b, AMP cíclico, ácido retinoico y glucocorticoides. También se ha observado que la expresión activada de oncogenes como ras o v-mos o la sobreexpresión de c-fos, erbA inducen la expresión del gen de la estromalisina-1 (39). Confirmando la importancia de esta proteasa, y el papel clave que la destrucción de la membrana basal de los epitelios tiene en el proceso tumorigénico, se ha observado que en ratones transgénicos, que sobreexpresan ST-1, muestran una alta incidencia de cáncer de mama (40). Por otra parte, un mecanismo único de regulación de la gelatinasa-A o MMP-2 fue descrito a nivel de la superficie celular. La forma inactiva de esta MMP se puede unir a la MMP transmembrana, MT1-MMP formando un complejo trimolecular con TIMP-2 en la superficie de la célula que permite a una segunda molécula de MT1-MMP de cortar el péptido N-terminal de la pro-MMP-2, y de activar así la proteasa. En este mecanismo de activación, TIMP-2 juega un papel de activador, y no de inhibición, al actuar como una molécula adaptadora; MT1-MMP juega un doble papel de molécula receptora y activadora (41). Algunas MMP pueden ser activadas en el interior de la célula antes de su secreción, que es el caso de algunas MT-MMP, las cuales poseen una secuencia específica RRKR en su pro-dominio, reconocido por las furinas, una familia de serin-proteasas.
Los TIMP inhiben las MMPs formando un complejo reversible y de alta afinidad (42), controlan la activación de varias MMPs y forman complejos con dichas proenzimas. El TIMP-1 lo hace preferencialmente con proMMP-9 y TIMP-2 con proMMP-2, jugando un papel fundamental en el mantenimiento del balance entre la deposición y la degradación de la matriz extracelular en una amplia gama de procesos fisiológicos, como la remodelación ósea o el mantenimiento del cuerpo lúteo (43), siendo también actores centrales en la fisiopatología de diversas enfermedades tales como la artritis, cáncer, cirrosis, etc (44, 45). Se ha observado que la administración sistémica de TIMP-1 reduce la incidencia de erosión articular en ratones artríticos, además TIMP-1 y 2 presentan actividad antiangiogénica, lo cual abrió un nuevo campo de interés sobre el papel que los TIMPs podrían jugar en varias enfermedades que involucran la formación de nuevos vasos (46). Algunas proteasas, como la plasmina, y mismas las MMP son capaces de eliminar el pro-péptido y activar las MMPs, por lo cual una MMP particular pueden activar un miembro de otra clase como por ejemplo, la MMP-1 es activada por la plasmina o estromalisina-1 (47).
PAPEL DE LAS METALOPROTEASAS EN LA PROGRESIÓN TUMORAL
Inicialmente, la importancia de las metaloprotesas fue atribuida a su capacidad de degradar proteínas de la matriz extracelular, favoreciendo así la invasión tumoral, pero actualmente se tiene claro que estas enzimas ejercen una actividad proteolítica dirigida contra proteínas no pertenecientes a la matriz extracelular, por lo que su papel en la progresión tumoral ha sido objeto de intensos estudios en los últimos veinte años. Así, independientemente de otras consideraciones, las metaloproteasas juegan un papel importante en las diferentes etapas de la progresión tumoral, como es considerado a continuación.
a. Proliferación
Una etapa la progresión tumoral donde las metaloproteasas intervienen es en la proliferación de las células tumorales (48). Fenómeno inicialmente sospechado por la observación del efecto negativo de los inhibidores de las metaloproteasas sobre el crecimiento tumoral (49). Los mecanismos para este efecto son múltiples y complejos e involucra los factores de crecimiento, citocinas y sus receptores. Algunas metaloproteasas como las estromalisinas, digieren proteínas extracelulares que secuestran factores de crecimientos como es el caso de IGFBP-3 o insulin-like growth factor binding protein 3, que se une a IGF II o insulin-like growth factor II, también del perlacan que secuestra a su vez el bFGF o basic fibroblast growth factor (50, 51).
Por otra parte, hay metaloproteasas que inducen un aumento de la actividad biológica de citocinas y de factores de crecimiento como fue demostrado para el caso de la interleukina-8, en la cual su actividad aumentó en un valor de 10 veces después de la digestión por la MMP-9 (52, 53). Algunas metaloproteasas tienen efecto antiproliferativo por su capacidad de solubilisar receptores de membrana de citocinas, y por lo tanto, disminuir su efecto biológico (54); ellas también actúan sobre la proliferación de las células tumorales por las modificaciones estructurales que inducen en las proteínas de la matriz extracelular, como la degradación del colágeno fibrilar que permiten, a células del melanoma, activar la integrina a2b1, disminuir la expresión de la proteína p27 para estimular, de esta manera, la proliferación celular (55). La interacción de células del melanoma a través del ligando para avb3 con colágeno desnaturalizado causa un incremento de la relación Bcl-2:Bax protegiendo a estas células de la apoptosis, aumentando así su sobrevivencia (56). La estromalisina-3 o MMP-11 incrementa la tumorigénesis a través de un decrecimiento de la apoptosis o necrosis por un mecanismo todavía no precisado (57).
b. Pérdida de adhesividad
Metaloproteasas tales como MMP-3 y MMP-7 están implicadas en la pérdida de la adhesividad celular, y la modificación fenotípica de las células epiteliales que se originan durante los primeros estadíos del desarrollo de un tumor (58). Estas enzimas presentan la característica de digerir la cadherina E con la subsecuente ruptura de las adherencias intercelulares de los epitelios, además de estimular la expresión de genes promotores del cáncer, favoreciendo la activación de la b-catenina a partir de la cadherina hacia el núcleo celular (59, 60).
c. Invasión
La invasión local es otra etapa de la progresión tumoral en la cual intervienen las proteasas (61). En particular, MMP-2 y MMP-9 presentan actividad proteolíticas contra proteínas de la membrana basal tales como colágeno tipo IV y V (62, 63), las MMP-1 y la MT1-MMP contra el colágeno intersticial tipo I, II o III presente en el tejido conjuntivo que rodea las células tumorales invasivas (33). El papel que desempeñan las metaloproteasas en la invasión tumoral ha sido bien estudiado, habiéndose demostrado que las presentes a nivel del frente invasivo no son producidas por las células tumorales mismas, sino por las células estromales tales como fibroblastos, células endoteliales, macrófagos estimuladas por las células tumorales (31, 64). Por otra parte, se han identificado en células malignas estructuras especializadas constituidas por una red de microfilamentos que se ha denominado invadopodias o podosomas, las cuales utilizan proteasas para degradar una variedad de sustratos que incluye fibronectina, laminina, colágeno y otros componentes de la matriz extracelular. También se han identificado otras enzimas de membrana de diferentes clases como componentes esenciales de estos elementos (65), y que incluyen serin-proteasas, seprase, dipeptil peptidasa IV así como también MT-MMP (66). La membrana plasmática de los invadopodias vierte el contenido de vesículas que contienen MMP-9 y MMP-2 en la proteolisis direccional de la matrix extracelular durante la migración, especialmente durante la invasión por parte de las células cancerosas (67, 68).
d. Angiogénesis
Numerosos estudios experimentales demuestran que la formación de nuevos vasos sanguíneos es un requerimiento vital para el crecimiento de un tumor maligno, demostrándose una correlación entre el incremento del número de vasos sanguíneos y la prognosis del tumor (69). Se han identificado y caracterizados reguladores positivos de la angiogénesis, incluyendo factores de crecimiento tales como VEGF, alfa FGF, beta FGF, EGF, TGF-alfa, TGF-beta, TNF-alfa, angiopoetina, angionina, interleuquina-8. También se han identificado receptores para factores angiogénicos, así como señales de traducción implicados en la angiogénesis (70-72). Es un proceso complejo que requiere: 1.- degradación de la membrana basal y matriz extracelular que rodea vasos sanguíneos; 2.- la quimiotaxis de las células endoteliales como respuesta a un estimulo angiogénico; 3.- la proliferación de las células endoteliales; 4- la remodelación de la membrana basal del vaso sanguíneo neoformado. Esta remodelación se puede llevar a cabo como resultado de la actividad de las metaloproteasas, las cuales son producidas por las células endoteliales que secretan MMP-1, MMP-2, MMP-3 y MT-MMP (73). El papel que desempeñan MMP-2 y MT-MMP ha sido mejor estudiado, y representan un papel crucial en este fenómeno. Tratamiento de células endoteliales del cordón umbilical humano con ester de forbol (TPA) provoca una activación de MMP-2 e inducción de MT-MMP con la correspondiente formación de una estructura tubular multicelular cuando fueron cultivadas en una matriz de colágeno (74). Un inhibidor de las metaloproteasas, el marimastato o BB2516 impide la formación tubular y bloquea la activación de MMP-2 (75). Las metaloproteasas también participan en ayudar a las células endoteliales a invadir y revascularizar tejidos ricos en fibrina tanto in vivo como in vitro. Esta capacidad de invadir fue independiente del activador del plasminógeno y MT1-MMP representa la principal de las metaloproteasas en causar este efecto, ya que en su ausencia no hay actividad fibrinolitica; además las células fueron incapaces de invadir el tejido rico en fibrina (76, 77). Las integrinas, que comprende un grupo de moléculas de adhesión de superficie que se unen a componentes de la matriz extracelular (78), donde, por ejemplo, la integrina avb3 se une directamente a MMP-2 a través del dominio hemopexin MMP-2 (79). La angiogénesis depende de eventos de adhesión mediados por la integrina avb3; un fragmento de MMP-2 que comprende el dominio c-terminal (PEX) impide la unión de MMP-2 a avb3. por lo que el fragmento de PEX puede interrumpir la angiogénesis y el crecimiento tumoral. Por ello se ha propuesto como estrategia terapéutica, el empleo de PEX como inhibidor de la angiogénesis (80).
La trombospondina que es una glicoproteína que actúa como promotor de la angiogénesis vía regulación de MMP-9 promueve a células endoteliales bovinas a formar túbulos (81, 82). Las proteasas intervienen en esta etapa de la progresión tumoral, donde ellas pueden tener un papel bien sea de estimulación o inhibición, haciendo énfasis también en que algunas metaloproteasas son expresadas por las células endoteliales que responden a un estimulo angiogénico. Estas enzimas juegan un papel importante en la degradación de la matriz extracelular que acompaña la invasión del tejido tumoral a través de vasos sanguíneos.
Por otra parte, las metaloproteasas pueden causar un efecto inhibitorio en la angiogénesis produciendo factores antiangiogénicos a partir de moléculas precursoras como es el caso de la angioestatina o endoestatina, producidas en el área peritumoral por las metaloproteasas –2,-7,-9 y –12 a partir de precursores tales como el plasminógeno y colágeno XVIII (77, 83, 84).
e. Intravasión, extravasión y crecimiento de los tumores metastáticos
Las metaloproteasas son activas en los procesos de intravasión, efecto posible por la capacidad que tienen de destruir la membrana basal que rodea el vaso sanguíneo (85). Inhibidores de las metaloproteasas reducen la formación de metástasis a partir de un tumor primario o la invasión de una membrana basal reconstituida in vitro (72, 86). Por otra parte, el papel desempeñado en la extravasión es menos evidente, pero sin embargo, se ha demostrado que inhibidores de las metaloproteasas son incapaces de inhibir la colonización de los pulmones por células tumorales inyectadas en la circulación venosa (87, 88). Las metaloproteasas también podrían intervenir en el crecimiento de los tumores metastásicos, efecto complejo, ya que, implica una participación activa sobre la angiogénesis y la proliferación celular.
INHIBIDORES TERAPÉUTICOS DE LAS METALOPROTEASAS: ENSAYOS PRECLÍNICOS Y CLÍNICO
El papel de las metaloproteasas en la progresión tumoral representa un blanco terapéutico importante, principalmente si consideramos que en numerosos tumores ellas son producidas por las células del estroma, más que por las células tumorales, lo que sugiere que la inhibición de las metaloproteasas podrían escapar a los mecanismos de resistencia que desarrollan las células cancerosas ante los agentes quimioterápicos debido a la inestabilidad genética (89-91). Por ello diferentes estrategias han sido desarrolladas para interferir tanto con la expresión como la activación de las metaloproteasas, donde la metodología principal reside en la utilización de inhibidores sintéticos que interactúan directamente con el sitio catalítico de las metaloproteasas, bloqueando de manera reversible su actividad proteolítica (42). Se han sintetizado gran cantidad de moléculas que poseen una alta afinidad por estas enzimas, clasificándose en dos categorías.
1. Inhibidores pseudopeptídicos
Estos compuestos presentan una estructura que mimetizan el sitio de clivage del sustrato, y presentan la particularidad de entrar en competencia con el sustrato de las metaloproteasas, uniéndose al sitio catalítico por quelantes del átomo de Zn, y que actualmente son utilizados en el tratamiento de una amplia variedad de tumores (92). La mayoría de los inhibidores estudiados tanto in vitro como in vivo de esta categoría son derivados de hidroxamatos, siendo los más conocidos el Batimastato o BB94 y Marimastato o BB2516, los cuales presentan un amplio espectro de acción (93). El segundo presenta una mejor biodisponibilidad oral que el primero, que fue el primer inhibidor de metaloproteasas que se experimento clínicamente, y que en la fase I presentó toxicidad. Los principales efectos secundarios reportados fueron dolores músculo-articulares de tipo inflamatorio, los cuales desaparecen al suspender el tratamiento.
Estudios combinando el marimastato con drogas citotóxicas como el temozolomida, mostraron un efecto sinergístico, el cual mejoró el cuadro clínico de pacientes con glioblastoma multiforme (94). Pacientes con cáncer avanzado de pulmón en fase I fueron tratados con la combinación de marimastato, carboplatino, paclitaxel a las dosis de 10 mg, 7 mg/m2, 175 mg/m2 respectivamente; los pacientes toleraron las dosis suministradas, pero solamente presentaron una respuesta parcial (95).
2. Inhibidores no-peptídicos
La limitada biodisponibilidad oral de los inhibidores pseudopeptídicos, a excepción del marimastato, más la falta de selectividad, han conducido a la síntesis de inhibidores no-peptídicos. La estructura de estos compuestos se fundamentó sobre el análisis tridimensional del sitio catalítico por radio-cristalografía, y el modo de acción inhibitorio es similar al de los agentes pseudo-peptídico, pero con una mayor especificidad por el tipo de metaloproteasa a inhibir. Su espectro de acción es más selectivo, con una débil actividad frente a la metaloproteasa-1, pero con una fuerte actividad para la metaloproteasa-2 y 9.
Entre las principales moléculas de esta categoría tenemos el prinomastato que es un inhibidor selectivo para las metaloproteasas 2, 3, 9,13 y 14, el cual fue evaluado clínicamente, por su capacidad de inhibir la metástasis en pacientes con diferentes tipos de tumores sólidos. A dosis toleradas y con bajos niveles de citotoxicidad, se observó una buena respuesta durante los tres meses de tratamiento (96). En el modelo ortotópico de cáncer de pulmón NCI-H460, que exhibe alto patrón metastásico y que expresa MMP-2, MT1-MMP (MMP-14), se estudió la actividad antitumoral del prinomastato como simple agente o en combinación con el carboplatino a bajas dosis; en ambos casos se observó un incremento en la supervivencia de ratones portadores de este tumor (97). Combinando el prinomastato con gemcitabine y cisplatino a las dosis de 15 mg, 1.250 mg/m2, 75 mg/m2 respectivamente, se realizó un estudio en pacientes con cáncer de pulmón en fase III. Los resultados no mostraron mejoría, así como tampoco un aumento en la sobrevivencia (98).
El BMS-275291 es otro nuevo inhibidor de las metaloproteasas, el cual se ensayó a dosis límite de 1200 mg/día en pacientes en avanzado cáncer metastático colorectal y pulmón en fase II, observándose un incremento de la supervivencia, y hallándose también que a dosis superiores el valor ya señalado provocó una alta citotoxicidad (99). Tratamientos combinando BMS-275291 con paclitaxel y carboplatino fueron bien tolerados en pacientes con cáncer de pulmón en fase II (100). Esta misma combinación terapéutica fue suministrada a pacientes con avanzado cáncer de pulmón fase III, observándose que no mejora la sobrevivencia de los pacientes, sumado a una alta citotoxicidad (101). Un inhibidor oral de las metaloproteasas, el MMI270 (CGS27023A) redujo el crecimiento del tumor y la metástasis en ensayos preclínicos, pero provoca efectos tóxicos que son reversibles una vez que se detiene el tratamiento. Combinando el MMI270 con fluoruracilo y ácido folínico, se realizó un estudió en pacientes con cáncer colorectal avanzado utilizandose dosis de 500mg de fluoruracilo, 200mg de ácido folínico y 300 mg de MMI270; los pacientes toleraron el tratamiento sin efectos citotóxicos evidentes y con un aumento de sobrevivencia (102).
El BAY 12-9566 es otro inhibidor no peptídico que inhibe la angiogénesis y la metástasis, observándose experimentalmente efectos secundarios tales como elevaciones asintomáticas de las enzimas hepáticas, así como de trombocitopenia Sin embargo, en el modelo ortotópico MDA-MB-435 de un carcinoma mamario humano transplantado en ratón, el BAY 12-9566 administrado diariamente a una dosis límite de 100mg/kg /día inhibió en crecimiento del tumor así como la metástasis sin producir efectos citotóxicos secundarios. Este inhibidor no ha sido, hasta el presente utilizado en clínica, pero sin embargo, se presenta como una alternativa para ser utilizado en el tratamiento de cáncer de mama adyuvante a la cirugía (103). Por otra parte, han sido suspendidos los ensayos clínicos con BAY 12-9566 debido a su alta toxicidad profundizándose las investigaciones en modelos preclínicos (104).
2a. Derivados de la tetraciclina
Estos compuestos inhiben las colagenasas y gelatinasas y comprenden los antibióticos clásicos tales como la tetraciclina, deoxiciclina, minociclina, y también nuevos compuestos análogos, tal como el Metastato (col-3) que es una tetraciclina modificada para eliminar la actividad antimicrobiana y la toxicidad gastrointestinal (105, 106). Entre los efectos secundarios de este inhibidor tenemos foto toxicidad cutánea, anemia, nauseas, elevación de enzimas hepáticas, fiebre y neurotoxicidad. Estos derivados bloquean las actividades de las metaloproteasas por acción de agentes quelantes del átomo de Zn del sitio catalítico, interfiriendo con la activación proteolítica de las proenzimas, reduciendo a su vez la expresión de las metaloproteasas y disminuyendo su degradación (42, 107). Ensayos clínicos con pacientes presentando variados tumores sólidos recibieron col-3 a dosis límite de 50 mg/m2/día experimentando una estabilización de la enfermedad con pocos efectos secundarios (108).
2b. Bifosfonatos
Son moléculas capaces de inhibir las metaloproteasas, inicialmente utilizados en las alteraciones del equilibrio del calcio, y más tarde en el tratamiento paliativo de las metástasis óseas (109, 110). Estas moléculas actúan disminuyendo la actividad proteolítica y reduciendo la secreción de MMP-2 y MT1-MMP (MMP-14) El clodronato, un bifosfonato, inhibe la actividad de MM1-MMP, reduciendo la capacidad invasiva y metastásica de las células del osteosarcoma MG-63 (111, 112). Los estudios terapéuticos utilizando estos inhibidores han sido realizados en pacientes que presentan cáncer en estado avanzado, y las experiencias hechas con modelos animales han mostrado claramente que la inhibición de las metaloproteasas es más eficaz en las etapas precoces de la progresión tumoral. En pacientes con cáncer avanzado, los principales blancos para las metaloproteasas, como son la invasión tumoral, angiogénesis y la diseminación metastásica, los resultados esperados no se han producido, por lo que el efecto de estos inhibidores son insignificantes a este nivel. Por tanto, ahora que no se ha podido obtener un claro efecto benéfico del papel de los inhibidores de las metaloproteasas en el tratamiento antitumoral de los pacientes con cáncer, hay necesidad de insistir dada la importancia crucial de los mecanismos involucrados. Lo deseable sería poder realizar con seguridad, estudios clínicos en pacientes con cáncer en estado precoz o en remisión, con el fin de lograr un tratamiento preventivo de la diseminación metastásica (113, 114). Adicionalmente, como previamente se ha sugerido, estos inhibidores podrían ser utilizados en la clínica en combinación con otros agentes antitumorales. Para lo cual, se requiere la disponibilidad de marcadores biológicos capaces de identificar, precozmente y específicamente la actividad de los inhibidores de las metaloproteasas, lo cual permitiría hacer la evaluación exhaustiva de estos estudios.
La concentración plasmática de VEGF y bFGF o la excreción urinaria de la degradación del colágeno han sido monitoreadas en pacientes tratados con marimastato y prinomastato (115), sin embargo estos estudios no han sido concluyentes. Bremer ha desarrollado un método de imagen óptica para monitorear selectivamente el nivel de expresión específica de la metaloproteasa-2 (MMP-2) in vivo, técnica que podría detectar in vivo tumores que posean una gran actividad proteolítica, y hacer un seguimiento de la eficacia de inhibidores sintéticos sobre los tumores (116).
PERSPECTIVAS DE FUTURO
La participación activa de las metaloproteasas en las diferentes etapas de la progresión tumoral se apoyan sobre las diferentes observaciones clínicas de la expresión de estas enzimas en diferentes tipos de canceres metastásicos humanos, así como también sobre las proteínas de la matriz que son modificadas por ellas, y su influencia tanto en el crecimiento como en la invasión tumoral, lo que ha traído como consecuencia el desarrollo de inhibidores sintéticos de las metaloproteasas.
Estudios pre-clínicos realizados en modelos animales utilizando estos inhibidores han demostrado inhibición de las metaloproteasas en los tumores con resultados alentadores, por lo cual es necesario hacer mayores estudios e insistir en la posibilidad de su utilización en el tratamiento de pacientes con cáncer, a pesar de que los primeros ensayos no han aportado un claro beneficio terapéutico. No obstante, el estudio de la aplicación de estos inhibidores tanto en etapas precoces como avanzadas deben continuar desarrollándose para aprovechar el potencial inhibitorio de estas moléculas, siendo también muy importante el desarrollo de marcadores biológicos que permitan el seguimiento in vivo del efecto de estos inhibidores, así como el mecanismo de acción de estos compuestos.
Adicionalmente, es necesario identificar las señales que son responsables de la interacción molecular entre las células del estroma y las tumorales, requisito necesario para evaluar los posibles blancos de las metaloproteasas que son producidas por las células del estroma. La estabilidad genética de las células del estroma, comparada a las de las células tumorales, hacen del sistema un blanco atractivo para los tratamientos quimioterapéuticos, por lo que, es necesario profundizar los estudios de los mecanismos moleculares que aclaren en toda su dimensión el papel que desempeñan las metaloproteasas en la fisiopatología del cáncer.
Largos años de investigación han demostrado el papel fundamental que desempeñan las proteasas tanto en el desarrollo embrionario, reparación y remodelación de tejidos, así como en los procesos de invasión por parte de las células malignas que llevan a la infiltración y metástasis, propiedades que signan la malignidad del cáncer. ¿Por qué no insistir en controlarlas?
REFERENCIAS
1. Geho DH, Bandle RW, Clair T, Liotta LA. Physiological mechanism of tumor-cell invasion and migration. Physiology 2005; 20: 194-200. [ Links ]
2. Ruddon RW. Cancer Biology, 3th Ed (N.Y) Oxford University Press; 1995, p 402-427. [ Links ]
3. Arvelo F, Poupon MF. Aspectos moleculares y celulares de la metástasis cancerosa. Acta Cient Venez 2001; 52:304-312. [ Links ]
4. Chin D, Boyle GM, Kane AJ, Theile DR, Hayward NK, Parson PG, Coman WB. Invasion and metastasis markers in cancers. Br J Plast Surg 2005; 58:466-474. [ Links ]
5. Tsuruo T, Naito M, Tomida A, Fujita N, Mashima T, Sakamoto H, Haga N. Molecular targeting therapy of cancer: drug resistance, apoptosis and survival signal. Cancer Sci 2003; 94:15-21. [ Links ]
6. Arvelo F, Merentes E, Cotte C. Resistencia a los agentes antitumorales citotóxicos. Informe Médico 1999; 1:335-346. [ Links ]
7. Arvelo F, Poupon MF, Bourgeois Y, Jacrot M, Le Chevalier T. Adding reverser (verapamil) to combined chemotherapy overrides resistance in small lung cell cancer xenografts. Eur J Cancer 1995; 31: 1862-1868. [ Links ]
8. Cairns RA, Khokha R, Hill RP. Molecular mechanisms of tumor invasion and metastasis: an integrated view. Curr Mol Med 2003: 3:659-671. [ Links ]
9. Pantel K, Woelfle U. Micrometastasis in breast cancer and other solid tumors. J Biol Regul Homeost Agent 2004; 18:120-125. [ Links ]
10. Curran S, Murray GI. Matrix metalloproteinases: molecular aspects of their roles in tumour invasion and metastasis. Eur J Cancer 2000; 36:1621-1630. [ Links ]
11. Costa C, Soares R, Schmitt F. Angiogenesis: now and then APMIS 2004; 112: 402-412. [ Links ]
12. Holmbeck K, Bianco P, Pidoux I, Inoue S, Billinghurst RC, Wu W, Chrysovergis K, Yamada S, Birkedal-Hansen H, Poole AR. The metalloproteinase MT1-MMP is required for normal development and maintenance of osteocyte processes in bone. J Cell Sci 2005; 118:147-156. [ Links ]
13. Zhang X, Nothnick WB.The role and regulation of the uterine matrix metalloproteinase system in menstruating and non-menstruating species. Front Biosci 2005; 10:353-366. [ Links ]
14. Bister VO Salmela MT, Karjalainen-Lindsberg ML, Uria J, Lohi J, Puolakkainen P, Lopez-Otin C, Saarialho-Kere U. Differential expression of three matrix metalloproteinases, MMP-19, MMP-26, and MMP-28 in normal and inflamed intestine and colon cancer. Dig Dis Sci 2004; 49:653-661. [ Links ]
15. Lambert E, Dasse E, Haye B, Petitfrere E. TIMPS as multifacial proteins. Crit Rev Oncol Hematol 2004; 49:187-198. [ Links ]
16. Maskos K, Bode W. Structural basis of matrix metalloproteinases and tissue inhibitors of metalloproteinases. Mol Biotechnol 2003; 25:241-266. [ Links ]
17. Mignatti P, Rifkin DB. Biology and Biochemistry of proteinases in tumor invasion. Physiol Rev 1993; 73:161-195. [ Links ]
18. Puente XS, Sánchez LM, Overall CM, López-Otin C. Human and mouse proteases: a comparative genomic approach. Nat Rev Genet 2003; 4:544-558. [ Links ]
19. Marchenko GN, Ratnikov BI, Rozanov DV, Godzik A, Deryugina EL, Strogin AY. Characterization of matrix metalloproteinase-26, a novel metalloproteinase widely expressed in cancer cells of epithelial origin. Biochem J 2001; 356:705-718. [ Links ]
20. Impola U, Uitto VJ, Hietanen J, Hakkinen L, Zhan L, Larjava H, Isaka K, Saarialho-Kore U. Differential expression of Matrilysin-1 (MMP-27), 92KD gelatinase (MMP-9) and Metalloelastase (MMP-12) in oral verrucous and squamous cell cancer. J Pathol 2004; 202:14-22. [ Links ]
21. Ala-aho R, Kahari UM. Collagenases in Cancer. Biochimie 2005; 87:273-286. [ Links ]
22. Steman M, Paju A, Hanemaaijer R, Tervahartiala T, Leminen A, Steman UH, Konttinen YT, Sorsa T. Collagenases (MMP-1,-8,-13) and trysinigen-2 in fluid form benign and malignant ovarian cysts. Tumor Biol 2003; 24:9-12. [ Links ]
23. Sternlicht MD, Bissett MJ, Werb Z. The matrix metalloproteinase stromelysin-1 acts as a natural mammary tumor promoter. Oncogene 2000; 19:1102-1113. [ Links ]
24. TangY, Kesavan P, Nakada MT, Yan L. Tumor-stroma interaction: positive feeback regulation of extracellular matrix metalloproteinase inducer (EMMPRIN) expression and matrix metalloproteinase-dependent generation of soluble EMMPRI. Mol Cancer Res 2004; 2:73-80. [ Links ]
25. Guo H, Li R, Zucker S, Toole BP. EMMPRIN (CD147), an inducer of matrix metalloproteinase synthesis, also binds intertisial collagenase to the tumor surface. Cancer Res 2000; 60:888-891. [ Links ]
26. Gabinson EE, Hoang-Xuan T, Mauviel A, Menashi S. EMMPRIN/CD147, an MMP modulator in cancer, development and tissue repair. Biochimie 2005; 87: 361-368. [ Links ]
27. Yan L, Zucker S, Toole BP. Roles of the multifuntional glycoprotein, emmprin (basigin; CD147) in tumor progression. Thromb Haemost 2005; 93:199-204. [ Links ]
28. Turpeenniemi-Hujanen T. Gelatinases (MMP-2 and–9) and their natural inhibitors as prognostic indicators in solid cancers. Biochimie 2005; 87:287-297. [ Links ]
29. DeClerck YA. Interactions between tumour cells and stromal cells and proteolytic modification of the extracellular matrix by metalloproteinase in cancer. Eur J Cancer 2000; 36:1258-1268. [ Links ]
30. Patel BP, Shah PM, Rawal UM, Desai AA, Shah SV, Rawal RM, Patel PS. Activation of MMP-2 and MMP-9 in patients with oral squamous cell carcinoma. J Surg Oncol 2005; 90:81-88. [ Links ]
31. Pellikainen JM, Ropponen KM, Kataja VV, Kellokoski JK, Eskelinen MJ, Kosma VM. Expression of matrix metalloproteinase MMP-2 and MMP-9 in breast cancer with special reference to activator protein-2, HER-2 and prognosis. Clin Cancer Res 2004; 10:7621-7628. [ Links ]
32. Kajima S, Itoh Y, Matsumoto S, Masuho Y, Seiki M. Membrane type-6 matrix metalloproteinase (MT6-MMP, MMP-25) is the second glycosylphosphatidyl inositol (GPI)-anchored MMP. FEBS Lett 2000; 480:142-146. [ Links ]
33. Sabeh F, Ota I, Holmbeck K, Birkedal-Hansen H, Soloway P, Balbin M, Lopez-Otin C, Shapiro S, Inada M, Krane S, Allen E, Chung D, Weiss SJ. Tumor cell traffic through the extracellular matrix is controlled by the membrane-anchored collagenase MT1-MMP. J Cell Biol 2004; 167: 769-781. [ Links ]
34. Murphy G, Knauper V, Cowell S, Hembry R, Stanton H, Butler G, Freije J, Pendas AM, Lopez-Otin C. Evaluation of some newer matrix metalloproteinases. Ann N Y Acad Sci 1999; 878:25-39. [ Links ]
35. Marchenko GN, Strongin AY. MMP-28, a new human matrix metalloproteinase with an unusual cysteine-switch sequence is widely expressed in tumors. Gene 2001; 265:87-93. [ Links ]
36. Shapiro SD, Kobayashi DK, Ley TJ. Cloning and characterization of a unique elastolytic metalloproteinase produced by human alveolar macrophages. J Biol Chem 1993; 268:23824-23829. [ Links ]
37. Llano E, Pendas AM, Knauper V, Sorsa T, Salo T, Salido E, Murphy G, Simmer JP, Bartlett JD, Lopez-Otin C. Indentification and structural and functional characterization of human enamelysin (MMP-20). Biochemistry 1997; 36:15101-15108. [ Links ]
38. Wilson MJ, Sellers RG, Viehr C, Melamud O, Pei D, Peehl DM. Expression of matrix metalloproteinase-2 and –9 and their inhibitors, tissue inhibitor of metalloproteinase-1 and –2, in primary cultures of human prostatic stromal and epithelial cells. J Cell Physiol 2002; 191:208-216. [ Links ]
39. Nova D, LeGriel C, Holvoet S, Gentilhomme E, Vicent C, Staquet MJ, Schmitt D, Serres M. Comparative studies on the secretion and activation of MMPs in two reconstructed human skin models using HaCaT- and HaCaT-ras-transfected cell lines. Clin Exp Metastasis 2003; 20:675-683. [ Links ]
40. Ahn SM, Jeong SJ, Kim YS, Sohn Y, Moon A. Retroviral delivery of TIMP-2 inhibits H-ras-induced migration and invasion in MCF10A human breast epithelial cells. Cancer Lett 2004; 207:49-57. [ Links ]
41. Koyama S. Enhanced cell surface expression of matrix metalloproteinase and their inhibitors, and tumor-induced host response in progression of human gastric carcinoma. Dig Dis Sci 2004; 49:1621-1630. [ Links ]
42. Hidalgo M, Eckhardt SG. Development of matrix metalloproteinase inhibitors cancer therapy. J Natl Cancer Inst 2001; 93:178-193. [ Links ]
43. Hu J, Zhang X, Nothnick WB, Spencer TE. Matrix metalloproteinase and their tissue inhibitors in the developing neonatal mouse uterus. Bio Reprod 2004; 71:1598-1604. [ Links ]
44. Ozen O, Krebs B, Hemmerlien B, Pekrun A, Kretzschmar H, Heims J. Expression of matrix metalloproteinase and their inhibitors in medulloblastoma and their prognostic relevance. Clin Cancer Res 2004; 10:4746-4753. [ Links ]
45. López-Otín C. Las metaloproteasas como dianas terapéuticas en enfermedades reumatológicas. Rev Esp Reumatol 2003; 30: 95-98. [ Links ]
46. Noel A, Maillard C, Rocks N, Jost M, Chabottaux V, Sounni NE, Maquoi E, Cataldo D, Foidart JM. Membrane associated proteases and their inhibitors in tumour angiogenesis. J Clin Pathol 2004; 57:577-584. [ Links ]
47. Nagase H. Activation mechanisms of matrix metalloproteinases. Biol Chem 1997; 378:151-160. [ Links ]
48. Nozaki S, Sledge GW, Nakshatri H. Cancer cell-derived interleukin 1 alpha contributes to autocrine and paracrine induction of prometastatic genes in breast cancer. Biochem Biophys Res Comm 2000; 275:60-62. [ Links ]
49. DeClerck YA, Perez N, Shimada H, Boone TC, Langley KE, Taylor SM. Inhibition of invasion and metastasis in cells transfected with and inhibitor of metalloproteinases. Cancer Res 1992; 52: 701-708. [ Links ]
50. Wang CS, Tetu B. Stromelysin-3 expression by mammary tumor-associated fibroblast under in vitro breast cancer cell induction. Int J Cancer 2002; 99:792-799. [ Links ]
51. Fowkes JL, Serra DM, Bunn RC, Thrailkill KM, Enghild JL, Nagase H. Regulation of insulin-like growth factor (IGF)-I action by matrix metalloproteinase-3 involves selective disruption of IGF-I/IGF-binding protein-3 complexes. Endocrinology 2004; 145:620-626. [ Links ]
52. Janowska-Wieczorec A, Wysuczynski M, Kijowki J, Marquez-Curtis L, Machalinski B, Ratajczak J, Ratajczac MZ. Microvesicles derived from activated platelets induce metastasis and angiogenesis in lung cancer. Int J Cancer 2005; 113:752-760. [ Links ]
53. Aalinkeel R, Nair MP, Sufrin G, Mahajan SD, Chahda KC, Chawda RP, Schwartz SA. Gene expression of angiogenic factors correlates with metastatic potential of prostate cancer cell. Cancer Res 2004; 64:5311-5321. [ Links ]
54. Lombard MA, Wallace TL, Kubicek MF, Petzold GL, Mitchell MA, Hendges SK, Wiks JW. Synthetic matrix metalloproteinase inhibitors and tissue inhibitors of metalloprteinase (TIMP2 but not TIMP-1, inhibit shedding of tumor necrosis factor-areceptors in a human colon adenocarcinoma (colo 205) cell line. Cancer Res 1998; 58: 4001-4007. [ Links ]
55. Henriet P, Zhong ZD, Brooks PC, Weinberg KI, DeClerck YA. Contact with fibrillar collagen inhibits melanoma cell proliferation by up-regulating p27KIPI. Proc Natl Acad Sci USA 2000; 97:1026-1031. [ Links ]
56. Petitclerc E, Stromblad S, von Schalscha TL, Mitjans F, Piulats J, Montgomery AM, Cheresh DA, Brooks PC. Integrin alpha(v)beta3 promotes M21 melanoma growth in human skin by regulating tumor cell survival. Cancer Res 1999; 59:2724-2730. [ Links ]
57. Fromigue O, Louis K, Wu E, Belhacene N, Loubat A, Shipp M, Auberger P, Mari B. Active stromelysin-3(MMP-11) increases MCF-7 survival in three-dimensional matrigel culture via activation of p42/p44 MAP-Kinase. Int J Cancer 2003; 106: 355-363. [ Links ]
58. Crawford HC, Finglenton BM, Rudolph-Owen LA, Goss Kj, Rubinfeld B, Polakis P, Matrisian LM. The metalloproteinase matrilysin is a target of b-catenin transactivation in intestinal tumors. Oncogene 1999; 18:2883-2891. [ Links ]
59. Noe V, Finglenton B, Jacobs K, Crawford HC, Vermeulen S, Steelant N, Bruyneel E, Matrisian LM, Mareel M. Release of an invasion promoter E-cadherin fragment by matrilysin and stromelysin-1. J Cell Sci 2001; 114:111-118. [ Links ]
60. Nawrocki-Raby B, Gilles C, Polette M, Martinela-Catusse C, Bonnet N, Puchelle E, Foidart JM, VanRoy F, Birembaut P. E-cadherin mediates MMP down-regulation in highly invasive bronchial tumors cell. Am J Pathol 2003; 163:653-661. [ Links ]
61. Kong Y, Poon R, Nadesan P, DiMuccio T, Fodde R, Khokha R, Alman, BA. Matrix metalloproteinase activity modulates size, cell motility, and cell invasiveness in murine aggressive fibromatosis. Cancer Res 2004; 64:5795-5803. [ Links ]
62. Mook OR, Frederiks WM, Van Noorden CJ. The role of gelatinases in colorectal cancer progression and metastasis. Biochim Biophys Acta 2004; 1705:69-89. [ Links ]
63. Bjorklund M, Koivunen E. Gelatinase-mediated migration and invasion of cancer cells. Biochim Biophys Acta 2005; 1755: 37-69. [ Links ]
64. Lafleur MA, Drew AF, De Sousa EL, Blick T, BillisM, Walker EC, Williams ED, Waltham M, Thompson EW. Upregulation of matrix metalloproteinases (MMPS) in breast cancer xenografts: a major induction of stromal MMP-13. Int J Cancer 2005; 114:544-554. [ Links ]
65. Nekahara H, Howard L, Thompson EW, Sato H, Seiki M, Yeh Y, Chen WT. Transmembrane/cytoplamatic domain-mediated membrane type 1-matrix metalloprotease docking to invadopodia is required for cell invasion. Proc Natl Acad. Sci USA 1997; 94: 7959-7964. [ Links ]
66. Ghersi G, Dong H, Goldstein LA, Yeh Y, Hakkinen L, Larjava HS, Chen WT. Regulation of fibroblast migration on collagenous matrix by a cell surface peptidase complex. J Biol Chem 2002; 277:29231-29241. [ Links ]
67. Nguyen M, Arkell J, Jackson CJ. Active and tissue inhibitor of matrix metalloproteinase-free gelatinase B accumulates within human microvascular endothelial vesicles. J Biol Chem 1998; 273: 5400-5404. [ Links ]
68. Lorenz M, Yamaguchi H, Wang Y, Singer RH, Condeelis J. Imaging sites of N-wasp activity in lamellipodia and invadopodia os carcinoma cell. Curr Biol 2004; 14: 697-703. [ Links ]
69. Giatromanolak A, Sivridis E, Koukourakis MI. Tumor angiogenesis: vascular growth and survival. APMIS 2004; 112:431-440. [ Links ]
70. Ferrara N, Heinsohn H, Walder CE, Bunting S, Thomas GR. Regulation of blood vessel growth by vascular endothelial growth factor. Ann NY Acad Sci 1995; 752: 246-256. [ Links ]
71. Dvorak HF, Brown LF, Detmar M, Dvorak AM. Vascular permeability factor/vascular endothelial growth factor, microvascular hiperpermeability and angiogenesis. Am J Pathol 1995; 146:1029-1039. [ Links ]
72. Chakrabort S, Mandal M, Pas S, Mandal A, Chakrabort T. Regulation of matrix metalloproteinase: an overview. Mol Cell Biochem 2003; 253:269-285. [ Links ]
73. Fisher C, Gilbertson-Beadling S, Powers EA, Petzlod G, Poorman R, Mitchell MA. Interstitial collagenase is required for angiogenesis in vitro. Dev Biol 1994; 162: 499-510. [ Links ]
74. Haas TL, Madri JA. Extracellular matrix-driven matrix metalloproteinase production in endothelial cells: implications for angiogenesis. Trends Cardiovasc Med 1999; 9:70-77. [ Links ]
75. Haas Tl, Davis SJ, Madri JA. Three-dimensional type I collagen latices induce coordinate expression of matrix metalloproteinases MT1-MMP and MMP-2 in microvascular endothelial cells. J Biol Chem 1998; 273:3604-3610. [ Links ]
76. Chun TH, Sabeh F, Ota I, Murphy H, McDonagh KT, Holmbeck K, Birkedal-Hansen H, Allen ED, Weiss ST. MT1-MMP-dependent neovessel formation within the confines of the three-dimensional extracellular matrix. J Cell Biol 2004; 167:757-767. [ Links ]
77. Handsley MM, Edwards DR. Metalloproteinases and their inhibitors in tumor angiogenesis. Int J Cancer 2005; 115:849-860. [ Links ]
78. Guo W, Giancoti FG. Integrin signalling during tumour progression. Nat Rev Mol Cell Biol 2004; 5:816-826. [ Links ]
79. Brooks PC, Stromblad S, Sanders LC, Von Schalscha TL, Aimes RT, Stetler-Stevenson WG, Quigley JP. Localization of matrix metalloproteinase MMP-2 to the surface of invasive cells by interaction with integrin αvβ3. Cell 1996; 85:683-6931. [ Links ]
80. Brooks PC, Silleti S, Schalscha TL, Friedlander M, Cheresh DA. Disruption of angiogenesis by PEX a noncatalytic metalloproteinase fragment with integrin binding activity. Cell 1998; 92:391-400. [ Links ]
81. Qian X, Wang TN, Rothman VL, Nicosia RF, Tuszynski GP. Thrombospondin-1 modulates angiogenesis in vitro by up-regulation of matriz metalloproteinase-9 in endothelial cells. Exp Cell Res 1997; 235:403-412. [ Links ]
82. Hayashido Y, Nakashima M, Urabe K, Yoshiota H, Yoshiota Y, Hamana T, Kitano H, Koizumi K, Okamoto T. Role of stromal thrombospondin-1 in motility and proteolytic activity of oral aquamous cell carcinoma cells. Int J Mol Med 2003; 12: 447-452. [ Links ]
83. Masson V, de la Ballina LR, Manaut C, Wielockx B, Jost M, Maillard C, Blacher S, Bajou K, Itoh T, Itohara S, Werb Z, Liber C, Faidart JM, Noel A. Contribution of host MMP-2 and MMP-9 to promote vascularization and invasion of malignant keratinocytes. FASEB J 2005; 19:234-236. [ Links ]
84. Jadhav U, Chigurupati S, Lakka SS, Mohanam S. Inhibition of matriz metalloproteinase-9 reduce in vitro invasion and angiogenesis in human microvascular endothelial cells. Int J Oncol 2004; 25:1407-1414. [ Links ]
85. Sato H, Takino T, Miyamori H. Roles of membrene-Type matrix metalloproteinase-1 in tumor invasion and metastasis. Cancer Sci 2005; 96:212-217. [ Links ]
86. O’Reily MS, Wiederschain D, Stetler-Stevenson WG, Folkman J, Moses MA. Regulation of angiostatin production by matrix metalloproteinase-2 in a model concomitant resistance. J Biol Chem 1999; 274:29568-29571. [ Links ]
87. Bazarbachi A, Abou Merhi R, Gessain A, Talhouk R, El-Khoury H, Nasr R, Gout O, Sulahian R, Homaidan F, The H, Hermine O, El-Sabban ME. Human T-cell lymphotropic virus type I infected cells extravasate through the endothelial barrier by a local angiogenesis-like mechanism. Cancer Res 2004; 64:2039-2046. [ Links ]
88. Skrzydlewska E, Sulkowska M, Koda M, Sulkowski S. Proteolytic-antiproteolytic balance and its regulation in carcinogenesis. World J Gastroenterol 2005; 11:1251-1260. [ Links ]
89. Yang JM, Xu Z, Wu H, Zhu H, Wu X, Hait WN. Overexpression of extracellular matrix metalloproteinase inducer in multidrug resistance cancer cells. Mol Cancer Res 2003; 1: 420-427. [ Links ]
90. Arvelo F, Merentes E, Cotte C. Resistencia Multidroga (MDR) o Pleiotropica. Acta Cient Venez 2000; 51:45-52. [ Links ]
91. Canitrot Y, Bichat F, Cole S, Deeley R, Gerlach J, Bastian G, Arvelo F, Poupon MF. Multidrug resistance genes MRP and MDR1 expression in small cell lung cancer xenografts: relationship with response to chemotherapy. Cancer Letters 1998; 130:133-141. [ Links ]
92. Coussens LM, Fingleton B, Matrisian LM. Matrix metalloproteinase inhibitors and cancer: trials and tribulations. Science 2002; 295: 2387-2392. [ Links ]
93. Bramhall SR, Hallissey MT, Whiting J, Scholefield J, Tierney G, Stuart RC, Hawkins RE, McCulloch P, Maughan T, Brown PD, Baillet M, Fielding J. Marimastat as maintenance therapy for patients with advanced gastric cancer: a randomised trial. Br J Cancer 2002; 86:1864-1870. [ Links ]
94. Groves. MD, Puduvalli VK, Hess KR, Jaeckle KA, Peterson P, Yung WK, Levin VA. Phase II trial of temozolomide plus the matrix metalloproteinase, Marimastat, in recurrent and progressive glioblastoma multiforme. J Clin Oncol 2002; 87:161-167. [ Links ]
95. Goffin JR, Anderson IC, Supko JG, Eder JP, Shapiro GI, Lynch TJ, Shipp M, Johnson BE, Skarin AT. Phase I trial of the matrix metalloproteinase inhibitor marimastat combined with carboplatin and paclitaxel in patients with advanced non-small cell lung cancer. Clin Cancer Res 2005; 11: 3417-3424. [ Links ]
96. Hande KR, Collier M, Paradiso L, Stuart-Smith J, Dixon M, Cleudeninn N, Youn GT, Alberti D, Binger K, Wilding G. Phase I and pharmakinetic study of prinomastat, a matrix metalloprotease inhibitor. Clin Cancer Res 2004; 10:909-915. [ Links ]
97. Liu J, Tsao MS, Pagura M, Shalinsky DR, Khoka R, Fata J, Johnston MR. Early combined treatment with carboplatin and the MMP inhibitor, prinomastat prolongs survival and reduces systemic metastasis in an aggresive orthotopic lung cancer model. Lung Cancer 2003; 42:335-344. [ Links ]
98. Bissett D, O’Byirne KJ, von Pawel J, Gatzemeier U, Price A, Nicolson M, Mercier K, Mazabel E, Penning C, Zhang MH, Collier MA, Shepherd FA. Phase III study of matrix metalloproteinase inhibitor prinomastat in non-small-cell lung cancer. J Clin Oncol 2005; 23: 842-849. [ Links ]
99. Rizvi NA, Humphrey JS, Ness EA, Johnson MD, Gupta E, Williams K, Daly DJ, Sonnichsen D, Conway D, Marshall J, Hurwitz H. A phase I study of oral BMS-275291 a novel nonhydroxamate sheddase-sparing matrix metalloproteinase inhibitor in patients with advanced or metastatic cancer. Clin Cancer Res 2004; 10: 1963-1970. [ Links ]
100. Douillard JY, Peschel C, Sheperd F, Paz-Ares L, Arnold A, Davis M, Tonato M, Smyle M, Tu D, Voi M, Humphrey J, Ottaway J, Young K, Vrecken AV, Seymour L. Randomized phase II feasibility study of combining the matrix metalloproteinase inhibitor BMS-275291 with paclitaxel plus carboplatin in advanced non-small cell lung cancer. Lung Cancer 2004; 46: 361-368. [ Links ]
101. Leighl NB, Paz-Ares L, Douillard JY, Peschel C, Arnold A, Depierre A, Santoro A, Betticher DC, Gatzemier U, Jassem J, Crawford J, Tu D, Bezjak A, Humphrey JS, Voi M, Galbraith S, Hann K, Seymour L, Shepherd FA. Randomized phase III study of matrix metalloproteinase inhibitor BMS-275291 in combination with paclitaxel and carboplatin in advanced non-small-cell lung cancer: National Cancer Institute of Canada-Clinical trials group study BR.18. J Clin Oncol 2005; 23: 2831-2839. [ Links ]
102. Eatock M, Cassidy J, Johnson J, Morrinson R, Devlin M, Blackey R, Owen S, Choi L, Twelves C. A dose-finding and pharmacokinetic study of the matrix metalloproteinase inhibitor MMI270 (previously termed CGS27023A) with 5-Fu and folinic acid. Cancer Chemother Pharmacol 2005; 55:39-46. [ Links ]
103. Nozaki S, Sissons S, Chien DS, Sledge GW. Activity of biphenyl matrix metalloproteinase inhibitor BAY 12-9566 in a human breast cancer orthotopic model. Clin Exp Metastasis 2003; 20: 407-412. [ Links ]
104. Nelson AR, Finglenton B, Rothenberg ML, Matrisian LM. Matrix metalloproteinases: biologic activity and clinical implications. J Clin Oncol 2000; 18:1135-1149. [ Links ]
105. Rammath N, Creaven PJ. Matrix metalloproteinase inhibitors. Curr Oncol Rep 2004; 6:96-102. [ Links ]
106. Acharya MR, Venitz J, Figg WD, Sparreboom A. Chemically modified tetracyclines as inhibitors of matrix metalloproteinases. Drug Resist Update 2004; 7: 195-208. [ Links ]
107. Rudek MA, Figg WD, Dyer V, Dahut W, Turner ML, Steinberg SM, Liewehr DJ, Kohler DR, Pluda JM, Reed E. Phase I clinical trial of oral Col-3, a matrix metalloproteinase inhibitor, in patients with refractory metastatic cancer. J Clin Oncol 2001; 19: 584-592. [ Links ]
108. Syed S, Takimoto C, Hidalgo M, Rizzo J, Kunn JG, Hammond LA, Schwartz G, Tolcher A, Patnaik A, Eckhard SG, Rowinsky EK. A phase I and phermacokinetic study of col-3 (Matastat), and oral tetracycline derivative with potent matrix metalloproteinase and antitumor properties. Clin Cancer Res 2004; 10: 6512-6521. [ Links ]
109. Lipton A. Pathophysiology of bone metastases: how this knowledge may lead to therapeutic intervention. J Support Oncol 2004; 2:205-213. [ Links ]
110. Eaton CL, Coleman RE. Phatophysiology of bone metastases from prostate cancer and the role of biphosphonate in treatment. Cancer Trat Rev 2003; 29: 189-198. [ Links ]
111. Heikkila P, Teronen O, Hirn MY, Sorsa T, Tervahartiala T, Salo T, Konttinen YT, Halttunen T, Moilanen M, Hanemaaijer R, Laitinen M. Inhibition of matrix metalloproteinase-14 in osteosarcoma cells by clodronate. J Surg Res 2003; 111: 45-52. [ Links ]
112. Gulley J, Dahu T. Clodronate in the prevention and treatment of skeletal metastasis. Expert Rev Anticancer Ther 2005; 5: 221-230. [ Links ]
113. Zucker S, Cao J, Chen WT. Critical appraisal on the use of matrix metalloproteinase inhibitors in cancer treatment. Oncogene 2000; 19: 6642-6666. [ Links ]
114. Jedina KA, Mahar T. Inhibitors of proteases as anticancer drugs. Neoplasma 2005; 52: 185-192. [ Links ]
115. Sridhar SS, Shepherd FA. Targeting angiogenesis: a review of angiogenesis inhibitors in the treatment of lung cancer. Lung Cancer Suppl 2003; 1: S81-S91. [ Links ]
116. Bremer C, Bredow S, Mahmood U, Weissleder R, Tung CH. Optical imaging of matrix metalloproteinase-2 activity in tumors: feasibility study in a mouse model. Radiology 2001; 221:523-529. [ Links ]
Autor de correspondencia: Francisco Arvelo. Instituto de Biología Experimental, Facultad de Ciencias, Universidad Central de Venezuela. Calle Suapure, Colinas de Bello Monte, Caracas, Venezuela. Telfs: (0212) 751.09.44/751.07.66/751.03.77 Correo electrónico: franarvelo@yahoo.com












 uBio
uBio