Investigación Clínica
versão impressa ISSN 0535-5133versão On-line ISSN 2477-9393
Invest. clín v.49 n.1 Maracaibo mar. 2008
Determinación de los efectos de la N-acetilcisteína y metionina en cerebelo de ratas intoxicadas con plomo.
Lourdes Calderón-Cabrera1, María Gabriela Durán-Galetta2, Ingo Garcia2, Douglas Galetta3, Luis Lacruz1, Raquel Naranjo1, Beatriz Pérez1 y Elizabeth Ferreira1
1 Unidad de Toxicología. Departamento de Farmacología y Toxicología,
2 Cátedra de Bioquímica Adaptativa, Facultad de Medicina, Universidad de Los Andes y 3Terapia Intensiva y Medicina Crítica, Instituto Autónomo Hospital Universitario de los Andes. Mérida, Venezuela.
Autor de correspondencia: Lourdes Calderón-Cabrera. Unidad de Toxicología, Departamento de Farmacología y Toxicología, Facultad de Medicina, Universidad de Los Andes. Mérida, Venezue la. Correo electrónico: love - ling04@cantv.net
Resumen.
Se realizó un ensayo terapéutico para determinar los efectos de la N-Acetilcisteína (NAC), Metionina (MET) y la combinación NAC + MET sobre los niveles sanguíneos de Plomo (Pb), los niveles de malondialdehido(MDA) y actividad de catalasas (CAT) en el cerebelo de ratas intoxicadas con 0,5 y 2 µg/g de acetato de Pb. Se sometieron a prueba 198 ratas Wistar macho con peso promedio de 240 g divididas en cinco grupos. En el Grupo 1 Control, se determinaron niveles basales, el Grupo 2 corresponde a las ratas intoxicadas, los grupos restantes una vez intoxicados recibieron tratamiento de la forma siguiente Grupo 3 NAC, Grupo 4 MET, Grupo 5 NAC + MET. Los resultados mostraron que la NAC disminuye los niveles de plomo en sangre en un 35% y 38% con dosis de intoxicación de 0,5 µg/g y 2 µg/g de acetato de Pb respectivamente. Esta disminución no fue estadísticamente significativa; sin embargo, hubo una disminución del MDA en cerebelo en 56% con la dosis de 0, 5µg/g de Pb y de 75% con la dosis de 2µg/g. La CAT en cerebelo aumentó su actividad en 62% y 71% con las dosis de Pb estudiadas, siendo esta diferencia estadísticamente significativa (p < 0,0001) en relación al grupo intoxicado. La MET tuvo un efecto similar a la NAC aunque fue menor, no obstante cuando se combinan la NAC + MET mostraron un efecto quelante significativo observándose 45% y 51% de disminución de los niveles de Pb con las dosis de intoxicación administradas (p < 0,001) así como disminución del MDA y aumento de la actividad de CAT en el cerebelo de ratas expuestas al Pb. En esta investigación se puede concluir que la combinación de NAC + MET tiene efectos beneficiosos sobre los parámetros aquí estudiados en intoxicación aguda por Pb.
Palabras clave: Intoxicación por plomo, malondialdehído (MDA), actividad de catalasas (CAT), N-acetilcisteina (NAC), metionina (MET).
Determination of the N-acetylcysteine and methionine effectsin the cerebellum of rats intoxicated with lead.
Abstract.
A therapeutic essay was done to determine the effects of N-Acetylcysteine (NAC), Methionine (MET) and the NAC + MET combination on the lead (Pb) blood levels, the malondialdehide (MDA) and catalase activity (CAT) in cerebellum of rats treated with 0.5 and 2 µg/g of Pb acetate. One hundred ninety eight male Wistar rats with an average weight of 240 g were subjected to a test, divided into five groups. Group 1 was the control group where basal levels were determined; Group 2 was the treated group; the rest of the groups once treated received the following: Group 3 NAC, Group 4 MET, Group 5 NAC + MET. The results showed that NAC lowers blood lead levels by 35% and 38% with intoxication doses of 0.5 µg/g and 2 µg/g of Pb acetate respectively. This decrease was not statistically significant; however, there was a 56% decrease of MDA in the cerebellum with a dose of 0.5 µg/g of Pb and of 75% with 2 µg/g; CAT activity increased in the cerebellum by 62% and 71% with the studied Pb doses, making this a statistically significant difference (p < 0.0001) in relation to the intoxication group. MET has a similar effect to NAC, even though it was less strong; anyhow, when NAC + MET are combined a quelant effect is shown, with a statistically significant 45% and 51% reduction in the Pb levels with the doses administered (p < 0.001); MDA decreased and CAT activity increased in the cerebellum. In this research we can conclude that NAC+MET when combined, have a beneficial effect on the studied parameters during acute Pb treatment.
Key words: Lead intoxication, malondialdehide (MDA), catalase activity (CAT), N-acetylcysteine (NAC), methionine (MET).
Recibido: 06-09-2006. Aceptado: 26-04-2007.
INTRODUCCIÓN
El plomo es un importante contaminante ambiental con peligrosos efectos sobre la salud humana. Su amplia distribución en el medio ambiente así como la exposición poblacional que de ello resulta lo han convertido en un problema de salud pública a nivel mundial (1) Gran parte de la población que vive en ciudades está expuesta en forma crónica a niveles ambientales de plomo que, aunque reducidos, podría implicar un riesgo para la salud, específicamente en lo concerniente al sistema nervioso (2-4).
Aunque el plomo permea todos los tejidos del organismo, algunos componentes del sistema nervioso exhiben una mayor afectación en la exposición al plomo. El hipocampo, el estriado, tálamo y cerebelo son algunas de las áreas más afectadas (5).
Los efectos ocasionados por el plomo son irreversibles, pueden pasar inadvertidos no existiendo hasta la presente un umbral de toxicidad y la sintomatología de una intoxicación resultante de la exposición al plomo es vaga y difícilmente detectable, lo que plantea un problema para el médico. Varios hallazgos han sido de utilidad para la identificación de una intoxicación por el plomo, como son las deficiencias cognitivas, motoras, conductuales y más recientemente se ha descrito la falta de coordinación de los movimientos oculares y de las extremidades así como el desequilibrio y la disminución de fuerza muscular, lo que hace suponer que aparte del hipocampo, el cerebelo es uno de los primeros afectados en este tipo de intoxicación (5-7).
En el cerebelo se han demostrado efectos ultraestructurales con dosis de plomo altas, alrededor de los 60 µg/g, entre los cuales se han demostrado la reducción de la arborización dendrítica de las células de Purkinje, degeneración de las células endoteliales y dilataciones vasculares (8, 9).
El estrés oxidativo es considerado como el posible mecanismo molecular que involucra la neurotoxicidad por plomo. Algunos estudios han demostrado que el plomo induce a la peroxidación lipídica dando lugar a una serie de productos de descomposición como el malondialdehido (MDA), el cual se emplea como indicador directo del daño celular y de la peroxidación lípidica (10-13). Así mismo se ha demostrado que el plomo altera el mecanismo antioxidante de las células, disminuyendo la actividad de las enzimas superóxido dismutasa, catalasa (CAT) y el glutatión (GLU) (14).
En los últimos años han surgido nuevos esquemas terapéuticos a través de estudios experimentales en modelos animales para el manejo de este tipo de intoxicación, utilizando antioxidantes como: N-acetilcisteína (NAC), vitamina E, zinc, metionina (MET) y captopril, ya que actúan como barredores de radicales libres bloqueando el daño oxidativo y aumentando la defensa antioxidante a través de los grupos tioles presentes en estos fármacos (15-17).
La NAC ha sido ampliamente utilizada en este tipo de intoxicación, mostrando efectos beneficiosos como suplemento en la terapia de quelación, ya que se ha reportado en numerosos estudios que mejora significativamente el estrés oxidativo inducido por el plomo. La MET ha sido menos estudiada sin embargo en el trabajo experimental de Patra y col. (18) demostraron que la MET combinada con Vitamina E y Vitamina C revierte el estrés oxidativo inducido por el plomo en hígado, riñón y corteza cerebral de ratas expuestas crónicamente al plomo. De la misma manera, en un trabajo experimental realizado por nuestro grupo de investigación se demostró que la NAC y la MET revierten las alteraciones sobre el hematocrito (Hto), dehidratasa del ácido deltaminolevulínico (ALA-D) y niveles de malondialdehido (MDA) en hígado y riñón de ratas intoxicadas con 30mg/Kg de acetato de plomo por vía i.p. (19).
En este sentido y debido a que hasta la fecha no existen estudios, al menos en la literatura revisada, que indiquen que dosis bajas de acetato de plomo (0,5 µg/g y 2 µg/g), administrado en forma aguda pueda inducir a estrés oxidativo a nivel del cerebelo de ratas Wistar, ya que los trabajos reportados son modelos de intoxicación crónica con dosis de intoxicación más alta y en otras regiones de sistema nervioso como son hipocampo y tálamo.
Se planteó un trabajo experimental con el propósito de conocer si dosis bajas de acetato de plomo (0,5 µg/g y 2 µg/g), son capaces de inducir un aumento de niveles sanguíneos de plomo, asimismo si inducen estrés oxidativo en cerebelo de ratas Wistar determinado por MDA y actividad de CAT. Por otra parte si estas dosis de plomo inducen a estrés oxidativo cuál sería el efecto de la NAC, MET y NAC+MET sobre los niveles sanguíneos de plomo, niveles de MDA y actividad de CAT en el cerebelo de ratas Wistar expuestas a dosis bajas de acetato de plomo.
Si los efectos son beneficiosos y si se pudiera extrapolar a humanos, se podría utilizar en exposición aguda a dosis bajas de plomo, en pacientes que presenten trastornos de equilibrio y coordinación inducidos por plomo.
MATERIALES Y MÉTODOS
Animales
Para este estudio se seleccionaron ratas Wistar, macho entre 10 y 12 semanas de nacidas, con un peso promedio de 240 g, fueron distribuidas aleatoriamente en nueve grupos. Estas fueron alimentadas con ratarina (Super Rat®) y agua ad libitum, manteniéndose a una temperatura ambiental de 27°C.
La investigación se dividió en dos fases: Fase 1 en la cual se realizó la determinación de niveles de Pb en sangre, MDA y actividad de CAT en cerebelo. Fase 2 se determinaron los efectos de los diferentes fármacos NAC, MET y NAC+MET sobre los niveles de Pb en sangre, MDA y actividad de CAT en cerebelo.
Fase 1. Al grupo 1 se le denominó grupo control (n = 22) recibieron agua destilada por vía i.p, alimento y agua ad libitum durante diez días. Al grupo 2 se le denominó grupo de intoxicación y se dividió a su vez en dos subgrupos. El subgrupo 2.1. (n = 22) correspondió al grupo de animales que se trató con una dosis de 0,5 µg/g de acetato de Pb y el subgrupo 2.2. (n = 22) grupo de animales que se intoxicó con una dosis de 2 µg/g de acetato de Pb, vía i.p durante cinco días y luego se les administró una dosis de agua destilada por vía i.p durante los 5 días subsiguientes. Entre el día once y doce del experimento, cada una de las ratas de los grupos control (n = 10) y de intoxicación (n = 20) se sometieron a anestesia con cloroformo, luego se hizo una incisión toracoabdominal y se extrajo aproximadamente 6 mL de sangre desde la vena cava; fue transferido a tubos de plástico con heparina, previamente tratados con ácido nítrico al 5% y se determinó los niveles de Pb en sangre. El resto de los animales de cada grupo se sacrificó mediante trauma cervical y se extrajo el cerebelo para determinar MDA y actividad de CAT.
Fase 2. (n = 132) se distribuyeron los grupos 3,4, y 5 con los respectivos subgrupos de intoxicación (0,5 µg/g y 2 µg/g) y se les denominó grupos de experimentación; luego de intoxicados durante cinco días, al grupo 3 se le administró NAC 100 mg/kg/día por vía i.p durante cinco días, al grupo 4 se le administró MET 100 mg/kg/día por vía i.p durante cinco días y al grupo 5 se le administró NAC + MET 100 mg/kg/día de cada fármaco por vía i.p igualmente por cinco días. Desde el día once hasta quince del experimento, a 10 ratas de cada uno de los grupos 3, 4 y 5 se sometieron a anestesia con cloroformo, luego se hizo una incisión toracoabdominal y se extrajo aproximadamente 6 mL de sangre para la determinación de los niveles de Pb en sangre. El resto de animales se sacrificaron para determinar en cada grupo los niveles de MDA y actividad de CAT en cerebelo.
Determinación de niveles de plomo en sangre
La concentración de plomo en las muestras de sangre se determinó por Espectrofotometría de Absorción Atómica utilizando la técnica de Zinterhofer y Phopiano 1971 y los resultados se expresaron en µg/dL (20).
Determinación de productos reactivos al ácido tiobarbitúrico (malondialdehído)
Luego de la intoxicación aguda con acetato de plomo, se extrajeron los cerebelos de las ratas, los cuales fueron transferidos a tubos que contenían 500µL de Krebs-Bicarbonato, previamente gaseados con N2 y luego fueron homogeneizados a 4°C. Se determinó el malondialdehido como producto final de la lipoperoxidación por la técnica de Bird y Draper (20) modificada por García (21), los resultados se expresaron en µmol de MDA por mg de proteína.
Determinación de actividad de catalasas
El ensayo es basado sobre la descomposición de peróxido de hidrogeno. Una unidad de CAT fue definida como la cantidad de enzima que cataliza la descomposición de 1 µM de peróxido de hidrógeno por minuto a 25°C y pH 7,0. Luego de la intoxicación aguda con acetato de plomo, se extrajo el cerebelo de las ratas, el cual fue homogeneizado con 500 µL de agua destilada, se centrifugó a 16.000 rpm durante 15 min y se extrajo el sobrenadante. El substrato de la enzima se preparó con buffer fosfato de potasio (K2HPO4 y KH2PO4) 10mM. Se adicionaron en la cubeta del espectrofotómetro 725 µL de substrato de la enzima y se colocó dentro del equipo. La lectura fue realizada a 240 nm (abs. entre 0,350 a 0,500). Se le añadió 25 µL del sobrenadante se mezcló y luego se comenzó a medir los cambios de absorbancia cada 15 seg. Los resultados se expresaron en mol por mg de proteína. Fue basado en el método de Aebi y Cabalase (23).
Análisis estadístico
Una vez obtenidos los resultados se procedió al análisis correspondiente mediante la utilización del paquete estadístico Instat 3 Graph Pad. Se realizó un análisis descriptivo de las variables en estudio (niveles séricos de Pb, niveles de MDA y actividad de CAT). Se calculó media, desviación estándar y limites de confiabilidad. Luego se realizó el análisis inferencial; para los niveles sanguíneos de Pb se utilizó la Prueba de Mann-Whitney con p < 0,05 y para los diferentes tratamientos se utilizó ANOVA de una vía y post-test de Tukey con p < 0,05 como valor significativo.
RESULTADOS
El nivel promedio del metal fue de 10 ± 7,2 µg/dL en el grupo de ratas intoxicadas con 0,5 µg/g de acetato de Pb y con la dosis de 2 µg/g de acetato de Pb se incrementó en un 53% los niveles de Pb en sangre, con respecto a los niveles del grupo control (7,1 ± 2,3), esta diferencia resultó estadísticamente significativa (p < 0,001) (Tabla I).
NIVEL DE PLOMO EN SANGRE, EN LOS DIFERENTES GRUPOS EN ESTUDIO
| Grupos | Nivel de Pb en sangre (µg/dL) | |
| 0, 5 µg/g | 2 µg/g | |
| Intoxicados | 10 ± 7,2 (n = 10) | 15 ± 4,2* (n = 10) |
| NAC | 6,5 ± 7,3 (n = 10) | 9,2 ± 1,7 (n = 10) |
| MET | 8,7 ± 9,7 (n = 10) | 12,1 ± 3,3 (n = 10) |
| NAC+MET | 5,5 ± 0,7** (n = 10) | 7,3 ± 0,7** (n = 10) |
Los resultados se presentan como media ± DE de µg/dL. *p < 0.001 con respecto al control, el nivel de Pb en sangre control (n = 10) fue de 7,1 µg/dL ± 2,3. **p < 0.001 con respecto al grupo de intoxicación.
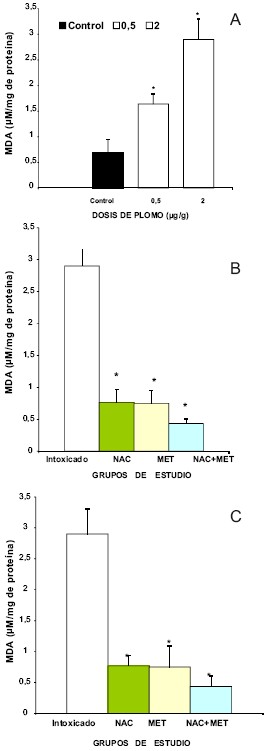
Por otra parte, el acetato de plomo usado en dosis crecientes de 0,5 y 2 µg/g, incrementó los niveles de MDA en cerebelo en 57% y 70%, respectivamente en relación con el grupo control, siendo este aumento estadísticamente significativo (p < 0,001) (Fig. 1a, 1b).
Fig. 1. A. Niveles de MDA en cerebelo de ratas intoxicadas con diferentes dosis de acetato de plomo. B. Niveles de MDA en ratas intoxicadas con 0,5 μg /g de plomo y tratadas con los fármacos en estudio (NAC, MET y NAC+MET). C. Niveles de MDA en ratas intoxicadas con 2 μg /g de plomo y tratadas con los fármacos en estudio (NAC, MET y NAC+MET). Los resultados se presentan como media ± DE de μM/mg de proteínas. (*p < 0,001) entre grupo de intoxicación y grupo de tratamiento (**p < 0,0001) entre el grupo control y el intoxicado.
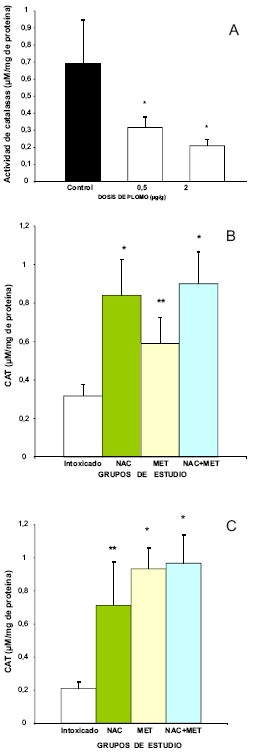
Con respecto al efecto del Pb sobre la actividad de catalasas en cerebelo, se encontró una disminución estadísticamente significativa (p < 0,001) en los grupos de intoxicación de 0,5 y 2 µ/g en relación con el grupo control, representando un 55% y un 70%, respectivamente (Fig. 2a, 2b).
Fig. 2. A. Niveles de CAT en cerebelo de ratas intoxicadas con diferentes dosis de acetato de plomo. B. Niveles de CAT en ratas intoxicadas con 0,5 μg /g de plomo y tratadas con los fármacos en estudio (NAC, MET y NAC+MET). C. Niveles de CAT en ratas intoxicadas con 2 μg /g de plomo y tratadas con los fármacos en estudio (NAC, MET y NAC+MET). Los resultados se presentan como media ± DE de μM/mg de proteínas. (*p < 0,001) entre grupo de intoxicación y grupo de tratamiento (**p < 0,0001) entre el grupo control y el intoxicado.
En relación al efecto de los fármacos en las variables estudiadas, se observa en la Tabla I que la NAC redujo en un 35% los niveles del Pb en sangre en el grupo de animales que recibió 0,5 µg/g de acetato de plomo y 38% en las que recibieron 2 µg/g, esta diferencia no resultó significativa estadísticamente. Cuando se administró la MET los niveles de Pb en sangre disminuyeron en un 13% y en un 19% con dosis de intoxicación de 0,5 µ/g y 2 µ/g respectivamente, ésta disminución no es significativa estadísticamente. Con la combinación de los fármacos (NAC + MET), se observó una disminución de los niveles de Pb en sangre de un 45% y 51% cuando se intoxicaron los animales con una dosis de 0,5 µg/g-2 µ/g de acetato de Pb (p < 0,001).
Con los niveles de MDA en cerebelo, se observa que con la administración NAC disminuyó en 56% con la dosis de 0,5 µg/g de acetato de Pb, y con la dosis de 2 µg/g de acetato de Pb disminuyó los niveles de MDA en cerebelo 3 veces y medio (75%), con respecto al grupo de intoxicación (p < 0,001) (Figs. 1a y 1b). Con la administración de la MET la reducción de los niveles de MDA fue del 63% en el grupo intoxicado con 0,5 µg/g de acetato de Pb, y cuando se incrementó la dosis del tóxico a 2 µg/g, la MET redujo los niveles de MDA en cerebelo en un 68% (p < 0,001). La combinación de los fármacos (NAC+MET) redujo los niveles de MDA en un 87% en los intoxicados con 0,5 µg/g de Pb, y en un 86% en los intoxicados con 2 µg/g de Pb (p < 0,001).
En relación a la actividad de la CAT en el cerebelo la NAC aumentó la actividad de la misma en 62% en el grupo intoxicado con 0,5 µg/g de Pb, y en 71% en el grupo intoxicado con 2 µg/g de Pb, con respecto al grupo de intoxicación, esta diferencia es muy significativa estadísticamente (p < 0,0001).Con la administración de la MET, la actividad de la CAT aumentó en 49% con una dosis de intoxicación de 0,5 µg/g de Pb, mientras que en el grupo de intoxicación con 2 µg/g de Pb, la actividad de la CAT aumentó en un 77% (p < 0,001). Cuando se administró la combinación de fármacos NAC + MET, la actividad de la CAT, aumentó en un 66% y 76%, con las dosis de intoxicación 0,5 µg/g y 2 µg/g respectivamente.
DISCUSIÓN
El cerebro y el cerebelo son tejidos muy susceptibles al estrés oxidativo debido a que sus membranas celulares son ricas en ácidos grasos poliinsaturados de una sola cadena, además existe una baja concentración de los sistemas antioxidantes, es decir, de superóxido dismutasa, glutatión peroxidasa y catalasas en especial en cerebelo, aunado a que el sistema nervioso central es rico en epinefrina y dopamina que reaccionan con el oxígeno para formar superóxido y los iones férricos aceleran esta oxidación (24).
Por otra parte, debido a que el plomo no es biodegradable y no se desintegra, es considerado una fuente de exposición permanente, provocando daños a altas y bajas concentraciones de exposición y en consecuencia la presentación de polimorfismo de sus efectos, por ello es muy difícil precisar a qué niveles y tiempo de exposición al plomo comienzan a producirse los cambios estructurales y funcionales a nivel celular (25).
En la presente investigación se utilizaron dos dosis bajas (0,5µg/g-2µg/g) de acetato de plomo por vía i.p por cinco días, con la finalidad de conocer sí estas dosis inducen a un aumento de las concentraciones plasmáticas de plomo y si inducen a estrés oxidativo a nivel de cerebelo de ratas Wistar. Los datos obtenidos muestran que los niveles de plomo en sangre aumentan 1,5 veces con dosis de exposición de 0,5 µg/g de plomo y 2,2 veces más con dosis de exposición de 2 µg/g de plomo en relación al control (7 µg/dL ± 2,3) siendo esta última diferencia estadísticamente significativa (p < 0,001). Estos resultados demuestran que el plomo fue capaz de incrementar su concentración en la sangre en los grupos experimentales, reflejando el libre acceso del metal al organismo.
Por otra parte, la exposición a dosis bajas de plomo (0,5 µg/g y 2 µg/g) induce a estrés oxidativo, demostrado por el aumento de MDA y la disminución de actividad de CAT en el cerebelo de ratas cuyo resultado fue estadísticamente significativo (p < 0,0001).
Estos resultados coinciden con los publicados por Soltaninejad y col. (12), quienes encontraron niveles elevados de MDA asociados a desmielinización y atrofia neuronal en regiones del hipocampo en ratas intoxicadas con acetato de plomo al 0,1% con diferencias estadísticamente significativas en relación al grupo control.
Otros estudios como los publicados por Villeda y col. (13) de igual manera demostraron la peroxidación lipídica en diferentes regiones cerebrales de ratas expuestas a dosis bajas de acetato de Pb, siendo el MDA el marcador biológico de este proceso. Así mismo, en el estudio de Hande y col. (10), se demostró un incremento en los valores de MDA al intoxicar animales con Pb por vía oral durante 2 semanas.
En relación a la CAT, es una enzima que se encuentra en los peroxisomas y cataliza la transformación del H2O2 en agua y oxígeno. Esta enzima se encuentra abundante en algunos tejidos (eritrocitos 1300 U/mg de proteína, hígado 1500 U/mg de proteína, riñón 430 U/mg de proteína) y escasa en otros (cerebro 10 U/mg de proteína, cerebelo 8 U/mg de proteína, corazón 54 U/mg de proteína y músculo esquelético 25 U/mg de proteína) (26, 27).
Los efectos del Pb sobre la actividad de la CAT, son divergentes. Algunos trabajos sugieren que en personas expuestas a dosis bajas al metal, no se observa inhibición de la enzima a nivel sanguíneo y lo explican por la capacidad que tiene el organismo humano de adaptar y activar mecanismos detoxificantes, como por ejemplo incrementar la actividad enzimática (27). En forma contradictoria, otros estudios a nivel experimental obtuvieron una inhibición importante de la enzima CAT, como resultado de exposición al Pb, explicando el fenómeno por la corta exposición y las altas dosis de Pb a los cuales son sometidos los animales (28, 29).
Nuestros resultados muestran que el Pb induce a inhibición de la actividad de la enzima (CAT), con dosis de exposición baja (0,5 µg/g) alcanzando una inhibición del 70% con la dosis de Pb más alta (2 µg/g), dejando desprovisto al cerebelo de esta defensa antioxidante, y haciéndolo vulnerable al ataque oxidativo. Por otra parte la actividad de CAT en el cerebelo es muy baja (8 µM/mg de proteína) por lo que asumimos, que no es suficiente para catalizar el H2O2 producto de la exposición al Pb.
La catalasa es una enzima que ofrece protección contra el estrés oxidativo severo (26) y ha sido el centro de atención de muchos investigadores; entre ellos Slawormir y col. (30), quienes demostraron que la actividad de diversas enzimas antioxidantes entre ellas la catalasa disminuye a nivel del cerebelo, cuerpo estriado, hipocampo y corteza frontal de ratas intoxicadas con Pb.
De la misma manera, Shukla y Knanna en el 2004 demostraron que la actividad de esta enzima en cerebro y cerebelo de ratas expuestas a este metal se encuentra disminuida (31).
En cuanto a la terapia en la intoxicación por Pb convencionalmente ha estado dirigida a la eliminación y reducción de la fuente de exposición, soporte nutricional y la quelación con agentes como el ácido etilendiaminotetraacético (EDTA), el ácido dielentriaminopentaacético (DPTA), el dimercaptopropanil (BAL) y la penicilamina (PEN) (16, 17).
En vista de que el estrés oxidativo se ha considerado como uno de los mecanismos moleculares involucrados en la neurotoxicidad por Pb, se ha propuesto el uso de antioxidantes como la N-acetilcisteína y la metionina como drogas prometedoras en el tratamiento de la intoxicación por este metal (17, 19, 30).
Los fármacos administrados en este experimento fueron la NAC y MET solas y combinadas con el fin de observar sus efectos sobre los niveles de Pb en sangre, la peroxidación lipídica inducida por el Pb, y la actividad de la CAT en cerebelo de ratas Wistar.
La NAC redujo en un 35% los niveles sanguíneos de este metal en el grupo de ratas que recibió la dosis de 0,5 µg/g de acetato de Pb y en un 38% en las que recibieron la dosis de 2 µg/g. Mientras que la MET redujo los niveles de Pb en sangre en 13% y 19% en los grupos de animales intoxicados con 0,5 µg/g y 2 µg/g de acetato de Pb respectivamente, esta reducción no fue significativa estadísticamente, por lo que sugiere un efecto quelante débil. Con la combinación de NAC + MET los niveles de Pb en sangre se redujeron en 45% y 51% con las dosis de Pb administradas (con 0,5 µg/g y 2 µg/g).
Con respecto a los otros parámetros estudiados como la producción de MDA y la actividad de la CAT en cerebelo, los fármacos en estudio arrojaron resultados beneficiosos, como fue la disminución de los niveles de MDA y aumento de la actividad de la CAT.
La NAC y la MET tienen grupos thioles (-SH) en su estructura química, lo que le permite interactuar en forma directa con el Pb para formar quelatos y ser eliminados, y en consecuencia disminuyen los niveles de Pb en sangre. Estudios previos han reportado este mecanismo para la NAC en la intoxicación por metales pesados (15, 19, 31), y aunque no existen trabajos publicados sobre el efecto quelante de la MET, es probable que el mecanismo sea el mismo que para la NAC ya que en su estructura química también está presente un grupo azufrado, sin embargo, se debe tomar en cuenta la diferencia en la posición de estos grupos (32, 33). En la NAC el grupo -SH se encuentra en la parte libre de la cadena, que le permite actuar rápidamente, mientras que en la MET el grupo thiol está dentro de la estructura y necesita ser biotransformado para dejarlo libre. Cuando se administra la combinación de fármacos NAC+MET los niveles sanguíneos de Pb disminuyen en forma significativa estadísticamente (p < 0,001). Esta disminución obedece a un efecto aditivo probablemente, sin embargo la administración de los dos fármacos no supera a la utilización de los quelantes, de forma tal que su administración sería suplemento de la quelación.
Por otra parte, se ha descrito que las propiedades antioxidantes de la NAC se debe a que grupo sulfidrilo (-SH) libre es un donador de H y por tal es un eficaz agente reductor, frenando así las reacciones oxidativas que pueden tener lugar e impide la oxidación de importantes moléculas estructurales y funcionales y el comienzo de lesiones por radicales libres. Penetra en células y a través de sus reacciones subsiguientes se transforma en glutatión reducido.
La Metionina por su parte es un aminoácido esencial azufrado con propiedades antioxidantes (32), que hasta los actuales momentos no había sido estudiado en el cerebelo de ratas sometidas al estrés oxidativo inducido por el Pb. En este estudio se observó una reducción del 63% de los niveles de MDA en el grupo intoxicado con dosis de 0,5 µg/g de acetato de Pb y el comportamiento fue similar cuando se incrementó la dosis del tóxico a 2 µg/g; ambas diferencias estadísticamente significativas. (p < 0,001).
Nuestros resultados coinciden con otras investigaciones, que aunque fueron hechas en otros órganos y con otros modelos experimentales (dosis, vías, tiempo de exposición) corrobora los resultados aquí obtenidos, algunos de estos trabajos son los de Nehru y Kanwar (34) quienes posterior a la administración de la NAC, pero usada en dosis mayores a las empleadas en este experimento (160 mg/kg/día), obtuvieron una disminución de los niveles de MDA y un incremento significativo en la actividad de CAT en todos los grupos de ratas expuestas al estrés oxidativo inducido por el acetato de Pb.
Así mismo Flora y col. (35) estudiaron el efecto de la NAC a dosis de 200 mg/kg/día adicionada a la Melatonina en ratas macho expuestas al Pb durante la quelación con Succimer; encontrando un efecto protector contra la producción de productos reactivos al ácido tiobarbiturico (MDA) y de esta manera ratificando el efecto beneficioso de la NAC, debido al grupo thiol con habilidad para interactuar con especies reactivas de oxígeno (eROS).
En conclusión, en esta investigación se comprueba una vez más el efecto beneficioso de la NAC para disminuir niveles de Pb en sangre, aunque el efecto quelante es muy débil; así mismo induce una disminución de los niveles de MDA llevándolos incluso al valor del grupo control y restaura la actividad de la CAT en cerebelo de ratas expuestas a dosis bajas de plomo. La MET por su parte, tiene menos efectos sobre la disminución de los niveles de plomo en sangre, pero tiene capacidad de disminuir los niveles de MDA y aumentar la actividad de la CAT en cerebelo, y la combinación del NAC+MET ejercen un efecto aditivo en la disminución de plomo a nivel sanguíneo, pero no muestra efectos adicionales sobre los niveles de MDA y CAT en cerebelo de ratas expuestas al plomo.
Sin embargo, estos resultados deben ser confirmados estudiando otros parámetros como los niveles de dienos conjugados, los hidroperóxidos, el anión superóxido y la determinación de la superóxido dismutasa, y el glutatión, solo así podemos concluir inequívocamente que estos fármacos son útiles en el estrés oxidativo inducido por el Pb a nivel del cerebelo.
AGRADECIMIENTO
Al Consejo de Desarrollo Científico Humanístico y Tecnológico (CDCHT, Código Nº M-797-04-03-A. Universidad de los Andes, Mérida, Venezuela) por financiar esta investigación y al Instituto de Investigaciones Clínicas “Dr. Américo Negrette” Facultad de Medicina, Universidad del Zulia. Maracaibo, Venezuela, por los aportes en las técnicas de laboratorio.
REFERENCIAS
1. Acta de Acuerdos Consejo Directivo de la Comisión Nacional del Ministerio del Ambiente de Chile. 1997; Anexo 3: Informe Entregado por Ministerio de Salud de Norma Primaria de Calidad Ambiental para Plomo en Aire; 31 de enero. 1997. Chile. [ Links ]
2. Córdoba D. Toxicología. 4ª ed. Manual Moderno 2000; 34:276-290. [ Links ]
3. Diario Oficial de las Comunidades Europeas, C 375 1-24, 10-12-97. posición común (CE) Nº 41/97 aprobada por el Consejo del 7 de octubre de 1997. [ Links ]
4. Sepúlveda V. Exposición al plomo ambiental en población infantil de la ciudad de Antofagasta aledaña a acopios de concentrado de este mineral. Toxicology 2000; 21(4):160-175. [ Links ]
5. Shih R, Hu H, Weisskopf MG, Schwartz B. Cumulative lead dose and cognitive function in adults: a review of studies that measured both blood lead. NIEHS 2006. [ Links ]
6. Martínez MA, Sosa G. Intoxicación por plomo. Salud de los trabajadores 1994; 2(2): 159-162. [ Links ]
7. Needleman Hl. Low level exposure and the IQ of children: a metanalysis of modern studies. JAMA 1990; 263:673-678. [ Links ]
8. Patrick GW, Anderson WJ. Dendritic alterations of cerebellar Purkinje neurons in postnatally lead exposed rats. Dev Neurosci 2000; 22:320-328. [ Links ]
9. Lonton D, Anderson WJ. The effects of postnatal lead toxicity on the development of cerebellum in rats. Neurobehav Toxicol Teratol 1986; 8(1):51-59. [ Links ]
10. Shafiq UR. Lead induced regional lipid peroxidation in brain. Toxicology 1984; 21 (3):333-337. [ Links ]
11. Calderón V, Hernández C, Maldonado V, Saénz D. Mechanism of the toxic effect of lead. J Expo Anal Environ Epidemiol 1993; 3:153-164. [ Links ]
12. Soltaninejad K, Kebriaeezadeh A, Minaiee B, Ostad SN, Hosseini R, Azaza E, Abdollahi M. Biochemical and ultraestructural evidences for toxicity of lead through free radicals in rats brain. Hum Exp Toxicol 2003; 22(8):417-423. [ Links ]
13. Villeda J, Barroso R, Méndez M, Nava C, Huerta R, Ríos C. Enhanced brain regional lipid peroxidation in developing rats exposed to low level lead acetate. Brain Res Bull 2001; 55(2):247-251. [ Links ]
14. Adanaylo V, Oteiza PL. Lead intoxication: antioxidant defenses and oxidative damage in rat brain. Toxicology 1999; 135:77-85. [ Links ]
15. Gurer H, Ercal N. Can antioxidants be beneficial in the treatment of lead poisoning? Free Radic Biol 2000; 29(10): 927-935. [ Links ]
16. Arenas O. Efectos de la N-acetilcisteina sobre la excreción urinaria de zinc en rats intoxicadas con plomo. [Tesis de grado]. Universidad de Los Andes. Facultad de Farmacia. Escuela de Bioanalisis; 1996. [ Links ]
17. Cáceres ML, Villarreal R, Palacios E, Calderón L. Comparación de efectividad de EDTA y NAC en intoxicación aguda con plomo. [Tesis de grado]. Universidad de Los Andes. Facultad de Medicina. Escuela de Medicina; 2002. [ Links ]
18. Patra RC, Swarup D, Dwivedi SK. Antioxidant effects of alpha tocopherol, ascorbic acid and L-methionine on lead induced oxidative stress to the liver, kidney a brain in rats. Toxicology. 2001; 162(2):81-88. [ Links ]
19. Calderón L, Carrasco M, Hernández R, Naranjo R, Lacruz L. Efectos de la N-Acetilcisteína y Metionina en intoxicación aguda con plomo en ratas Wistar. Arch Venez Farmacol Terap 2006; 25:33-38. [ Links ]
20. Zinterhofer LJM, Phopiano AP. Atomic absortion determination of lead in blood and urine in presence EDTA. Lab Clin Med 1971; 78:664. [ Links ]
21. Bird RP, Draper HH. Comparative studies on different methods of malonaldehyde determination. In Methods in Enzimology 1984; 105:299-305. [ Links ]
22. Garcia IJ, Rodríguez-Malaver AJ, Peñaloza N. Lipid peroxidation measurement by thiobarbituric acid assay in rat cerebellar slices. J Neurosci Methods 2005; 144: 127-135. [ Links ]
23. Aebi HE, Cabalase I. In Methods of Enzymatic Analysis, Bergmeyer HU, (ed.3º, Vol III) Weinheim, Verlag Chemise, Germany. 1984, pp. 273-282. [ Links ]
24. Jendryezko A. Involvement of free radicals in lead poisoning. Med Pr 1998; 48:1. [ Links ]
25. González A. La Epidemia silenciosa del Saturnismo. Cyber Pediatric Venezuela 2002. p.1-2. [ Links ]
26. Marklund SL, Westman NG, Lundgren E, Roos G. Copper- and zinc-containing superoxidase dismutase, manganese-containing superoxide dismutase, catalase, and glutathione peroxidase in normal and neoplastic human cell lines and normal human tissues. Cancer Res 1982; 42:1955-1961. [ Links ]
27. Halliwell B, Gutteridge JM. Free Radicals in Biology and Medicine. Second Edition. Clarendon Press-Oxford 1989. p.87. [ Links ]
28. Darr D, Fridovich I. Irreversible inactivation of catalase by 3-amino1, 2, 4-triazole. Biochem Pharmacol 1986; 35: 3642. [ Links ]
29. Valenzuela A, Lefauconnier, JM, Chaudiere J. Bourre JM. Effects of lead acetate on cerebral glutathione peroxidase and catalase in the suckling rat. Neurotoxicology 1989; 10:63-69. [ Links ]
30. Slawormir K, Birkner E, Kasperczyk L. Activity of superoxide dismutase and catalase in people protractedly exposed to lead compounds. Ann Agric Environ Med 2004;11:291-296. [ Links ]
31. Shukla PK, Knanna VK. Protective of curcumin against lead neurotoxicity in rat. Hum Exp Toxicol 2003; 22:653-658. [ Links ]
32. Swaran JS Flora, Manisha P, Asís M. Beneficial effect of combined administration of same naturally ocurring antioxidants and thiol chelators in the treatment of chronic lead intoxication. Chem Biol Interactions 2003; 145(3): 267-280. [ Links ]
33. Suzanne P, Costas I. Mechanism of the protective action of n-acetylcysteine and methionine against paracetamol toxicity in the hamster. Arch Toxicol 1985; 57:173-177. [ Links ]
34. Nehru B, Kanwar SS. N-acetylcysteine exposure on lead induced lipid peroxidative damage and oxidative defense system in brain regions of rats. Biol Trace Elem Res 2004; 101(3):257-264. [ Links ]
35. Flora SJ, Pandl, Kankan GM, Mehta A. Lead induced oxidative stress and its recover following co-administration of melatonin of acetylcysteine during chelation with succimer in male rats. Cell Mol Biol 2004; 50:543-551. [ Links ]












 uBio
uBio