Investigación Clínica
versão impressa ISSN 0535-5133versão On-line ISSN 2477-9393
Invest. clín v.49 n.1 Maracaibo mar. 2008
Efecto del veneno del escorpión Tityus discrepans sobre las pruebas globales de la coagulación. Estudios preliminares.
Josmary Brazón1, Belsy Guerrero2, Carmen Luisa Arocha-Piñango2, Carlos Sevcik1 y Gina D´Suze1.
1 Laboratorio de Neurofarmacología Celular, Centro de Biofísica y Bioquímica y
2 Laboratorio de Fisiopatología, Centro de Medicina Experimental, Instituto Venezolano de Investigaciones Científicas (IVIC), Apartado 21827. Caracas 1020-A. Venezuela.
Autor de correspondencia: Gina D´Suze. Instituto Venezolano de Investigaciones Científicas (IVIC), Centro de Biofísia y Bioquímica (CBB), Apdo. 21827. Caracas 1020-A, Venezuela. Teléfono: 0212 5041225; Fax: 0212 5041764. Correo electrónico: gdsuze@ivic.ve.
Resumen.
El veneno del escorpión Tityus discrepans (Td) altera los tiempos de coagulación en humanos. En este trabajo se estudió el efecto in vitro de este veneno sobre el tiempo de tromboplastina parcial (TTP), el tiempo de protrombina (TP) y su actividad coagulante directa, utilizando como substrato plasma humano fresco y/o fibrinógeno purificado. El veneno completo (VC) fue fraccionado con una columna de exclusión molecular Protein Pak 125™ (0,5 mL/min, CH3COONH4 20 mM, pH 4,7). Seis fracciones (F1 a F6) eluyeron con tiempos de retención entre 12,8 y 31 minutos. El VC (78-625 µg/mL) y la fracción F1 (10-42,5 µg/mL), acortaron el TTP; el VC (700-1000 µg/mL) y la fracción F6 (16,5-700 µg/mL), alargaron esta prueba. El VC (40-240 µg/mL) y la fracción F2 (5-40 µg/mL), prolongaron el TP. No se detectó actividad coagulante parecida a trombina sobre plasma humano o fibrinógeno purificado. Estos resultados evidencian que en el veneno de Td existen componentes con acción procoagulante, que acortan el TTP. Además, presenta componentes anticoagulantes que inducen un alargamiento del TP y TTP.
Palabras clave: TTP, TP, anticoagulante, procoagulante, Tityus discrepans.
Effect of Tityus discrepans scorpion venom on global coagulation test. Preliminary studies.
Abstract.
Tityus discrepans (Td) scorpion venom modifies clotting times in humans. We studied the in vitro venom effect on partial thromboplastin time (PTT), prothrombin time (PT) and its direct clotting activity, using fresh human plasma and purified fibrinogen as substrates. Whole venom (WV) was fractioned with a Protein Pak 125TM molecular exclusion column (0.5 mL/min, CH3COONH4 20 mM, pH 4.7). Six fractions (F1 through F6) with retention times ranging from 12.8 to 31 min were obtained. WV (78 to 625 µg/mL) and fraction F1 (10 to 42.5 µg/mL), shortened PTT; WV (700 to 1000 µg/mL) and fraction F6 (16.5 to 700 µg/mL), prolonged PTT. WV (40 to 240 µg/mL) and fraction F2 (5 to 40 µg/mL), prolonged PT. No thrombin-like activity was found with this venom on human plasma or purified fibrinogen. Td venom contains procoagulant components, able to shorten PTT. In addition, the venom contains anticoagulant components which prolong PT and PTT.
Key words: PTT, PT, anticoagulant, procoagulant, Tityus discrepans.
Recibido: 30-01-2007. Aceptado:10-05-2007.
INTRODUCCIÓN
Los escorpiones del género Tityus son los responsables de los accidentes graves de escorpionismo en Venezuela y por ende son de importancia médica. Las regiones con mayor incidencia de casos de escorpionismo son los estados Falcón, Lara, Mérida, Miranda, Monagas, Sucre, Trujillo, Zulia y Distrito Capital (1). El veneno de estos animales es una mezcla compleja de polipéptidos, enzimas, nucleótidos y lípidos con diversos efectos fisiológicos y farmacológicos, los cuales pueden tener acción sobre insectos, crustáceos, bacterias, parásitos, hongos y mamíferos (2-10). De ahí el interés que despiertan como posible fuente de nuevos medicamentos o como herramientas para el estudio de los procesos patológicos que desarrollan las víctimas de escorpionismo.
El veneno de Tityus discrepans está compuesto por más de 205 componentes bioactivos, entre los que abundan las neurotoxinas de origen proteico. Este veneno induce en sus víctimas una respuesta sistémica que incluye hipertensión o hipotensión, taquicardia o taquipnea, hipotermia, leucocitosis, sialismo, miocarditis, pancreatitis y síndrome de dificultad respiratoria; esta última es la complicación más grave del escorpionismo. En paralelo con su neurotoxicidad, el veneno contiene componentes capaces de establecer un síndrome inflamatorio generalizado con liberación de citoquinas, así como de inducir alteraciones en el sistema hemostático, manifestadas por prolongación o acortamiento del tiempo de tromboplastina parcial (TTP) y tiempo de protrombina (TP), hemorragias digestivas y hematoma cerebral masivo, las cuales sugieren la presencia de coagulación intravascular diseminada (CID) (11-20).
En todos los casos de escorpionismo ocurridos en nuestro país, donde se detectaron alteraciones en el TP y TTP, han estado involucradas especies del género Tityus. Aún se desconocen los componentes responsables de este efecto y la manera de actuar de los mismos. Esto nos estimuló a evaluar in vitro la acción del veneno de T. discrepans y sus fracciones sobre las pruebas básicas del sistema de la coagulación, el TTP y TP. Estas pruebas sirven como herramienta para detectar alteraciones en alguna de las vías clásicas de la coagulación (intrínseca o extrínseca), lo que facilita la interpretación de resultados con fines de investigación y diagnóstico.
MATERIALES Y MÉTODOS
Los escorpiones utilizados en este estudio pertenecen a la especie Tityus discrepans. Estos fueron colectados en las áreas urbanas y forestales de los altos mirandinos y clasificados taxonómicamente por el Dr. M.A. González Sponga. Los animales fueron anestesiados con CO2 y el veneno se obtuvo por estimulación eléctrica del telson del alacrán, el cual se disolvió con agua destilada, posteriormente se centrifugó a 7.200 g durante 30 minutos a 4°C en centrifuga para eppendorf 5415C (Hamburgo, Alemania). El sobrenadante se liofilizó en un liofilizador LABCONCO (Kansas, USA) y se almacenó a –80°C hasta el momento de su uso.
El contenido proteico en el veneno, se estimó mediante espectrofotometría a 280 nm utilizando un espectrofotómetro Spectronic® GENESYS™ 2 (New York, USA), suponiendo que una unidad de absorbancia/cm de longitud de paso de luz a través de la solución, es equivalente a 1 mg/mL de proteína (21).
El veneno completo (2,7 mg en 100 µL de solución CH3COONH4 20 mM a pH 4,7) se fraccionó de forma semipreparativa sobre una columna Protein-Pack 125™ (0,78 × 30 cm, Waters, Massachussets, USA), utilizando un equipo de cromatografía líquida de alta resolución (HPLC, Waters Corporation 2996, Massachussets, USA) a 20°C, con detección a 280 nm. La columna se equilibró y eluyó con el mismo tampón, a 0,5 mL/min, en condiciones isocráticas.
Se determinó el efecto de las fracciones aisladas sobre tiempo de tromboplastina parcial (TTP) y tiempo de protrombina (TP). Además, se determinó, el efecto coagulante directo de las fracciones sobre plasma humano y solución de fibrinógeno purificado. Estas pruebas se realizaron en forma manual, debido a que cuando se trabaja en presencia de secreciones animales, donde pueden existir una variedad de proteasas e inhibidores del proceso de la coagulación, los equipos automatizados no permiten detectar cambios significativos durante la formación de la fibrina, como por ejemplo la estabilidad del coágulo.
Para la obtención de plasma se extrajo sangre de voluntarios sanos por punción venosa. Los voluntarios firmaron el consentimiento informado válido, avalado por el comité de bioética del Instituto Venezolano de Investigaciones Científicas. La sangre se mezcló con citrato de sodio al 3,8% en proporción 1:10. Se obtuvo plasma pobre en plaquetas (PPP) centrifugando la sangre citratada a 1.312 g durante 15 minutos a 4°C en centrífuga refrigerada 4227R R.C.F METER (Milano, Italia). A cada muestra de PPP se le determinó el TTP y TP en forma manual tal como se describe más adelante. Las muestras que presentaron tiempos de coagulación dentro de los valores normales, se mezclaron y almacenaron a –40°C, en alícuotas de 1 mL, por un tiempo máximo de 1 semana.
El TTP (22) se determinó con los reactivos y la metodología de Diagnóstica Stago. En un tubo de borosilicato (10 × 75 mm) se colocaron 0,1 mL de PPP y 0,1 mL de solución tampón Tris-HCl 50 mM con NaCl 150 mM a pH 7,4 (denominada desde ahora tampón) y 0,1 mL de sustituto plaquetario activado denominado Ck-Prest-Diagnóstica Stago (Asnieres-Sur-Seine, Francia). Esta mezcla se incubó a 37°C durante 3 minutos, luego se le agregó 0,1 mL de CaCl2 25 mM a 37°C, se mezcló y se determinó el tiempo de coagulación. Para evaluar el efecto del VC y sus fracciones, se sustituyó el volumen del tampón por una solución de veneno a diferentes concentraciones. Para la interpretación de los resultados se comparó el TTP obtenido en presencia del veneno (muestra experimental), con el obtenido con el tampón (muestra control).
Para la determinación del TP (23) se utilizaron los reactivos y la metodología de Dade®. En un tubo de borosilicato (10 × 75 mm) se colocaron 0,1 mL de PPP y 0,1 mL de tampón. Esta mezcla se incubó durante 2 minutos a 37°C; luego se le añadió 0,2 mL de factor tisular denominado tromboplastina C Plus Dade® (Marburg, Alemania) preincubada a 37°C, se agitó suavemente y se determinó el tiempo de coagulación. Para evaluar el efecto del VC y de sus fracciones, se sustituyó el volumen de tampón por una solución de veneno a diferentes concentraciones y se comparó el TP obtenido en presencia del veneno (muestra experimental), con el obtenido con el tampón (muestra control).
Se evaluó el efecto coagulante directo del VC o sus fracciones sobre plasma humano fresco o fibrinógeno bovino purificado siguiendo el método coagulante de Austen y Rhymes (24). Para ello se colocaron 0,1 mL de PPP o solución de fibrinógeno (Sigma Chemical Co, St. Louis, USA) al 0,3% en tampón y 0,1 mL de una solución de trombina/tampón (2,5 UI/mL) (Sigma Chemical Co, St. Louis, USA) en un tubo de borosilicato (10 × 75 mm); se agitó suavemente y se determinó el tiempo de coagulación. Para evaluar la actividad semejante a trombina en el VC y sus fracciones, se sustituyó el volumen de trombina/tampón por una solución de veneno a diferentes concentraciones (1-1000 µg/mL).
Los datos se analizaron con estadística no paramétrica. Los resultados son presentados como la mediana y sus intervalos de confianza (IC), al 90% con n = 3; calculado por el método de Hodges y Lehmann (25).
RESULTADOS
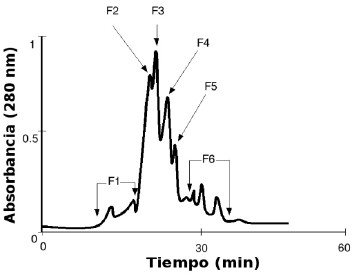
El fraccionamiento de 2,7 mg de veneno completo del escorpión T. discrepans, se presenta en la Fig. 1. El VC se separó en 6 fracciones con los siguientes tiempos de retención 12,80, 21,50, 22,74, 23,81, 25,95 y 31,00 minutos, respectivamente. Estas fracciones fueron denominadas F1 hasta F6 y se utilizaron para evaluar el efecto del veneno sobre el TTP, TP y su actividad coagulante semejante a trombina.
Fig. 1. Perfil de elución del veneno de Tityus discrepans (2,7 mg) fraccionado sobre una columna Protein-Pack 125 (7,8 × 300 mm, Waters), equilibrada y eluida con CH3COONH4 0,02 M, pH 4,7; velocidad de flujo de 0,5 mL/min. Las letras y números sobre los picos indican las fracciones obtenidas.
Para los ensayos se usó una mezcla de plasma de 5 voluntarios sanos, cuyos valores de TTP y TP estaban dentro de los valores normales: 38,6 (38,5-39,0) seg, y 13,2 (13,2-13,5) seg, respectivamente.
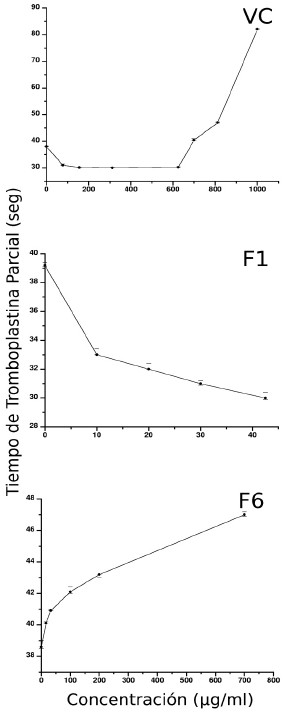
El efecto del VC y sus fracciones sobre el TTP, se muestra en la Fig. 2. El VC a concentración de 78 µg/mL, produjo un acortamiento de 8 segundos con respecto al control, valor que se mantuvo constante hasta 625 µg/mL de VC. En contraste, a concentraciones entre 700 y 1000 µg/mL se observó un alargamiento progresivo del TTP, hasta ser 44 segundos mayor que el control.
Fig. 2. Efecto del veneno completo y de las fracciones F1 y F6, obtenidas por la columna Protein Pak 125 sobre el TTPde plasma fresco preincubado por 3 minutos a 37°C con el veneno. Se graficaron las medianas y sus IC del 90% de confianza, n = 3.
La fracción F1, a concentraciones entre 10 y 42,5 µg/mL, acortó de manera dosis dependiente el TTP desde 6 hasta 9 seg. En cambio, la fracción F6 a concentraciones entre 16 y 700 µg/mL prolongó de manera dosis dependiente esta prueba desde 2 hasta 8 seg. Las fracciones restantes (F2 a F5) no modificaron el TTP (resultados no mostrados).
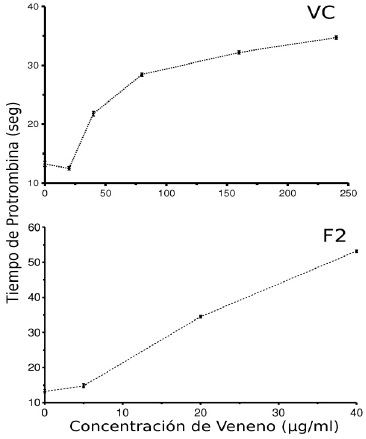
Los resultados en la Fig. 3 muestran que el VC a concentraciones entre 40 y 240 µg/mL prolongaron de manera dosis dependiente el TP desde 9 hasta 21 seg. Este efecto se observó también cuando se utilizó la fracción F2, la cual entre 5 y 40 µg/mL prolongó el TP desde 2 hasta 40 segundos. Las otras fracciones (F1, F3 a F6) no causaron ningún efecto sobre este tiempo (resultados no mostrados).
Fig. 3. Efecto del veneno completo y de la fracción F2 obtenida por la columna Protein Pak 125 sobre el TP de plasma fresco preincubado por 2 minutos a 37°C con el veneno. Se graficaron las medianas y sus IC del 90% de confianza, n = 3.
El veneno de T. discrepans ni sus fracciones promovieron la coagulación de plasma humano fresco citratado o de una solución de fibrinógeno bovino purificado.
DISCUSIÓN
El sistema de la coagulación o hemostasia secundaria se inicia a nivel de células que expresan el factor tisular (FT), tales como los fibroblastos expuestos después de una lesión, células mononucleares, monocitos, macrófagos y células endoteliales activadas. Por tal razón a este sistema se le denomina modelo celular de la coagulación y se divide en tres fases denominadas iniciación, amplificación y propagación. La fase de iniciación comienza cuando el FT expuesto a nivel celular forma con trazas circulantes de factor VIIa, el complejo enzimático FT/factor VIIa que activa al factor X y al factor IX. El factor Xa genera trazas de trombina, las cuales en la fase amplificación activan las plaquetas adheridas a la matriz extravascular y a otros factores como el VIII y XI. Finalmente en la fase de propagación, a nivel de la membrana plaquetaria activada, las enzimas (FIXa y FXa) y sus respectivos cofactores (FVIIIa y FVa) forman complejos enzimáticos que permiten una mayor generación de trombina para asegurar la formación de un coágulo estable capaz de cumplir las necesidades hemostáticas (26).
El sistema de la coagulación, desde el punto de vista didáctico, también se divide en tres vías denominadas intrínseca, extrínseca y común. Esta división es de utilidad en laboratorios de diagnóstico, ya que permite determinar mediante las pruebas clásicas TTP, TP y TT, el factor o los factores que pueden estar alterados. El TP refleja alteraciones en los factores de la vía extrínseca de la coagulación (factor tisular, factores VII, X, V, y II), siendo muy sensible para evaluar el factor VII y menos específico para los factores V, X y II. El TTP refleja alteraciones en la vía intrínseca de la coagulación (factores XII, XI, IX, VIII, X, V, y II), y es muy sensible a alteraciones de los factores VIII y IX. Ambos tiempos también pueden ser influenciados por niveles bajos de fibrinógeno o por la presencia de inhibidores de estos factores en su forma activa. El TT estudia el último paso de la cascada de la coagulación, y refleja la conversión de fibrinógeno en fibrina por acción de la trombina (22, 23, 27).
Los resultados de este trabajo, demostraron que toxinas presentes en el veneno de Td, producen alargamiento o acortamiento del TTP y/o del TP, dependiente de las concentraciones ensayadas (Figs. 2 y 3). Este es, el primer estudio de los efectos del veneno de Td sobre el TP y TTP in vitro y demuestra la existencia de componentes con acción sobre la cascada de la coagulación. Estos resultados concuerdan con alteraciones en el sistema hemostático observadas en víctimas de escorpionismo (12, 14, 28, 29).
En Venezuela, un estudio de 205 pacientes emponzoñados por Tityus discrepans con sintomatología local, sistémica moderada o sistémica severa, reveló que 6,5% de los pacientes con sintomatología local (n = 164) presentó alargamiento en el TP; mientras que 39% de los pacientes con sintomatología sistémica severa (n = 41) presentó alteraciones del TTP (prolongación o acortamiento) (14). Sin embargo existen casos de escorpionismo donde ambas pruebas (TP y TTP) están alteradas. También se ha descrito en Venezuela el caso de un niño de 9 años de edad víctima de escorpionismo (con un ejemplar del género Tityus), que presentó hemorragia estomacal y prolongación del TP y TTP (mayor a 25 y 60 segundos, respectivamente) (12). En otro caso de escorpionismo, en la India con un ejemplar del género Buthus, el paciente desarrolló prolongación del TP y TTP, presencia de productos de degradación del fibrinógeno y conteo de plaquetas bajo (27); lo que sugiere en ambos casos una coagulación intravascular diseminada (CID) (12, 28).
Adicionalmente, en el veneno de un ejemplar del género Buthus se demostró la presencia de componentes capaces de disminuir el TP en animales de experimentación, sugiriendo activación del sistema de coagulación (29).
Los resultados del presente trabajo, demuestran la presencia de componentes con actividad procoagulante en el veneno de Td. Al ser incubado plasma humano con VC se observó acortamiento significativo del TTP. Esta actividad procoagulante se aisló en la fracción F1. Al fraccionar el VC, el acortamiento del TTP se incrementó en un factor de 1,80, ya que 78 µg/mL de VC acortaron el TTP en 8 segundos mientras que con 42,5 µg/mL de F1 se acortó en 9 seg.
Dado el tiempo de retención de F1 (12,80 min), sus componentes deben ser las toxinas de mayor masa molecular presentes en el veneno completo de Td. El estudio proteómico de este veneno reveló la presencia de 205 componentes con masas moleculares entre 272 y 58.000 Da (11). Del veneno de serpientes e invertebrados se han aislado enzimas con masas moleculares mayores a 30 kDa que presentan actividad procoagulante (30, 31); probablemente las toxinas del veneno de Td con actividad procoagulante tengan masas similares a éstas.
La actividad procoagulante inducida por venenos de animales puede ser debida a proteasas que activan a los factores V, IX, X, a la protrombina, o a proteasas con acción semejante a la trombina (31). Dado que el efecto procoagulante inducido por el veneno de Td se hace evidente con el TTP y ligeramente con el TP, se sugiere que el o los componentes procoagulantes actúan sobre la vía común, estos probablemente pueden ser activadores directos de la protrombina o semejantes al factor Xa, así como activadores del factor X. La presencia de proteasas semejantes a trombina se descartó debido a que el veneno no coaguló plasma fresco ni fibrinógeno purificado. La ausencia de un efecto dosis respuesta en relación al acortamiento del TTP por el veneno de Td, puede deberse a la presencia de un efecto anticoagulante también presente en el veneno completo.
Los componentes del veneno responsables del alargamiento del TTP y del TP se aislaron en las fracciones F6 y F2, respectivamente. Al fraccionar el VC, la actividad anticoagulante sobre el TTP se incrementó en un factor de 43,75. De manera similar, la actividad anticoagulante sobre el TP se incrementó en un factor de 4,40. Este efecto anticoagulante podría ser debido a un inhibidor tipo serpina, que actúe contra proteasas de serina involucradas en el proceso de formación de fibrina, o a una acción proteolítica sobre substratos como el fibrinógeno.
En diversos venenos de invertebrados (32-34), se han identificado proteasas semejantes a la tripsina con actividad fibrino(geno)lítica, y masas moleculares menores o iguales que 30 kDa. Si el veneno de Td contiene toxinas con actividades semejantes a estas proteasas, el alargamiento del TTP y TP podría explicarse por la presencia de componentes fibrino(geno)líticos, lo cual también explicaría el hecho que el veneno no coagula plasma fresco ni fibrinógeno purificado. Los productos de degradación de fibrinógeno que se forman, pueden actuar como anticoagulantes.
La fracción F6 es la última en eluir de la columna de exclusión molecular ésta contiene los componentes de menor masa molecular presentes en el veneno de Td y prolonga de manera dosis dependiente el TTP. Los componentes de esta fracción pudieran actuar de manera semejante a los anticoagulantes aislados del veneno del parásito intestinal Anisakis simplex y de los hematófagos Triatoma infestans y Boophilus calcaratus (30, 35-37). De estos invertebrados se han aislado componentes con baja masa molecular que prolongan de manera dosis dependiente el TP y TTP, al inhibir uno o varios factores activados de la vía común de la coagulación, como el factor Xa, la trombina y/o el factor Va (35-37).
Para determinar los mecanismos procoagulantes y/o anticoagulantes evidenciados en este trabajo, están en progreso estudios con substratos purificados como fibrinógeno/fibrina, protrombina, substratos deficientes en factor X y protrombina, así como substratos sintéticos que semejan el sitio de acción de proteasas tipo serina involucradas en la activación del sistema de la coagulación o de la fibrinólisis. Además se está evaluando la presencia de componentes con acción inhibitoria sobre enzimas como trombina y factor Xa. Estos componentes pueden servir de herramientas para el estudio del funcionamiento del sistema hemostático y/o como potenciales agentes terapéuticos en procesos trombo-embólicos.
AGRADECIMIENTO
Los autores les damos las gracias a los habitantes y al cuerpo de bomberos de San Antonio de Los Altos, Edo. Miranda, por el suministro de los escorpiones. Además agradecemos la asistencia técnica de Adelina Ojeda, MSc, y del Sr. Moisés Sandoval. Esta investigación fue financiada parcialmente por los fondos FONACIT: S2-2001000889 (JB), S1-2001000908 (GDS), G2005000400 (BG).
REFERENCIAS
1. Guinand A, Cortés H, D´Suze G, Díaz P, Sevcik C, González-Sponga M, Eduarte G. Escorpionismo del género Tityus en la sierra falconiana y su correlación con la liberación de mediadores inflamatorios y enzimas cardíacas. Gac Méd Caracas 2004; 112:131-138. [ Links ]
2. Miranda F, Rochat H, Lissitzki S. Sur les neurotoxines de deux especes de scorpions nord-africains. I Purification des neurotoxines (scorpamines d Androctonus australis Hector et Buthus occinatus tunetanus). Toxicon 1964a; 2:51-69. [ Links ]
3. Miranda F, Rochat H, Lissitzki S. Sur les neurotoxines de deux especes de scorpions nord-africains. II Properties des neurotoxines (scorpamines d Androctonus australis Hector et Buthus occinatus tunetanus). Toxicon 1964b; 2:113-121. [ Links ]
4. Miranda F, Rochat H, Lissitzki S. Complexes moleculaires presentes par les neurotoxines animales. I neurotoxines des venins de scorpions (Androctonus australis Hector et Buthus occinatus tunetatus). Toxicon 1966; 4:123-144. [ Links ]
5. Babin DR, Watt D, Goos SM, Mlenjnik RV. Amino acid sequence of neurotoxic protein variants from the venom of Centruroides sculturatus Ewing. Arch Biochem Bioph 1974; 164:694-706. [ Links ]
6. Possani LD, Becerril B, Delepierre M, Tytgat J. Scorpion toxins specific for Na+-channels. Eur J Biochem 1999; 269:287-300. [ Links ]
7. Torres-Larios A, Gurrola G, Zamudio F, Possani LD. Hadrurin, a new antimicrobial peptide from the venom of the scorpion Hadrurus aztecus. Eur J Biochem 2000; 267:5023-5031. [ Links ]
8. Conde R, Zamudio FZ, Rodríguez MH, Possani LD. Scorpine, anti bacterial agent purified from scorpion venom. FEBS Letters 2000; 471:165-168. [ Links ]
9. Batista CVF, D´Suze G, Gómez-Lagunas F, Zamudio FZ, Encarnación S, Sevcik C, Possani L. Proteomic analysis of Tityus discrepans scorpion venom and amino acid sequence of novel toxins. Proteomics 2006; 6:3718-3727. [ Links ]
10. D´Suze G, Sevcik C, Corona M, Zamudio FZ, Batista CVF, Coronas FI, Possani L. Ardiscretin a novel arthrop-selective toxin from Tityus discrepans scorpion venom. Toxicon 2004; 43:263-272. [ Links ]
11. D´Suze G, Batista CV, Frau A, Murgia A, Zamudio F, Sevcik C, Possani L, Prestipino G. Discrepin, a new peptide of the sub-family a-KTx15, isolated from the scorpion Tityus discrepans irreversibly blocks K+-channels (IA currents) of cerebellum granular cells. Arch Biochem Biophys 2004; 430: 256-263. [ Links ]
12. De Sousa L, Kiriakos D, Jiménez J, Michieli D, Rodríguez C, Mirabal J, Quiroga M. Accidente cardiovascular isquémico por emponzoñamiento escorpiónico: Observación clínica. Saber 1995; 7:7-14. [ Links ]
13. D’Suze G, Comellas A, Pesce L, Sevcik C, Sánchez de León R. Tityus discrepans venom produces a respiratory distress syndrome in rabbits through an indirect mechanism. Toxicon 1999; 37:173-180. [ Links ]
14. D´Suze G, Moncada S, González C, Sevcik C, Aguilar V, Alagón A. Relationship between plasmatic levels of various cytokines, tumor necrosis factor, enzymes, glucose and venom concentration following Tityus scorpion sting. Toxicon 2003; 41:367-375. [ Links ]
15. D´Suze G, Salazar V, Díaz P, Sevcik C, Azpurua H, Bracho N. Histophatological changes and inflammatory response induced by Tityus discrepans scorpion venom in rams. Toxicon 2004; 44:851-860. [ Links ]
16. Ghersy de Nieto MT, Ortega MA, Castellini P, Mota J, Moncada S, Sevcik C, D´Suze G. Emponzoñamiento escorpiónico: concentración de veneno en plasma y su efecto desencadenante de la respuesta inflamatoria sistémica. Arch Venez Pueric Pediatr 2002; 65: 150-158. [ Links ]
17. López R. Purificación del veneno del escorpión Tityus IVIC-nancor y caracterización de su efecto en páncreas. [Tesis de maestría] Gran Caracas: CEA, IVIC; 2000. [ Links ]
18. Mazzei-Dávila C, Dávila D, Donis J, Arata-Bellabarba G, Villareal V, Barboza J. Sympathetic nervous system activation, antivenin administration and cardiovascular manifestations of scorpion envenomation. Toxicon 2002; 40:1339-1346. [ Links ]
19. Toxico.ivic.ve. Caracas: Reseña del tratamiento del emponzoñamiento por escorpiones del género Tityus. Al día para 7 de Agosto de 2004. Viable a partir de: ftp://toxico.ivic.ve/pub/pautas. [ Links ]
20. Novoa E, D’Suze G, Winter M, Crespo A, Tortoledo M, Marcano H, Friedman E, Sevcik C, Zabner J, Sánchez de León R. Further evidence for the indirect role of Tityus discrepans venom to produce respiratory distress syndrome. Respir Physiol Neurobiol 2003; 134:33-41. [ Links ]
21. D’Suze G, Zamudio F, Gómez-Lagunas F, Possani L. A novel K+ toxin from Tityus discrepans scorpion venom. FEBS Letters 1999; 456:146-148. [ Links ]
22. Langdell RD, Wagner RH, Brinkhous KM. Effect of antihemophilic factor on one-stage clotting tests. A presumptive test for hemophilia and a simple one-stage antihemophilic factor assay procedure. J Lab Clin Med Sci 1953; 41:637-647. [ Links ]
23. Quick AJ, Stanley-Brown M, Bancroft FW. A study of the coagulation defect in hemophilia. Am J Med Sci 1935; 190:501-511. [ Links ]
24. Austen D, Rhymes I. A Laboratory Manual of blood coagulation. Osney Mead, Oxford, London: Blackwell Scientific Publications; 1975. p 38. [ Links ]
25. Hollander M, Wolfe DA. Nonparametric statistical procedures. Eds John Wiley and Sans (New York). 1973, p 204-220. [ Links ]
26. Monroe D, Hoffman M, Robert H. Platelets and Thrombin Generation. Arterioscler Thromb Vasc Biol 2002; 22:1381-1389. [ Links ]
27. Curiel D, Arocha-Piñango CL, Bosch NB. Tiempo de trombina. En: Manual de hemostasia y trombosis, 2da Eds. Argentina; 1990. p 175-177. [ Links ]
28. Kochar DK, Singh P, Saini BV, Aggarwal P, Gauri LA. Scorpion envenomation causing hemiparesis. J Assoc Physicians India 2002; 50:606-607. [ Links ]
29. Gajalakshmi BS. Coagulation studies following scorpion venom injection in animals. Indian J Med Res 1982; 76:337-341. [ Links ]
30. Arocha-Piñango CL, Marchi R, Carvajal Z, Guerrero B. Invertebrate compounds acting on the hemostatic mechanism. Blood Coagul Fibrinol 1999; 10:43-68. [ Links ]
31. Markland F. Snake venoms and hemostatic system. Toxicon 1998; 36:1749-1800. [ Links ]
32. Mihara H, Sumi H, Yoneta T, Mizumoto H, Ikeda R, Seiki M, Maruyama M. A novel fibrinolytic enzyme extracted from the earthworm Lumbricus rubellus. Jpn J Physiol 1991; 41:461-472. [ Links ]
33. Sumigoto M, Nakajima N. Molecular cloning, sequencing, and expression of cDNA encoding serine protease with fibrinolytic activity from earthworm. Biosci Biotechnol Biochem 2001; 65:1575-1580. [ Links ]
34. Zhao J, Li L, Wu C, He RQ. Hydrolysis of fibrinogen and plasminigen by immobilized earthworm fibrinolytic II from Eisenia fetida. Int J Biol Macromol 2003; 32:165-171. [ Links ]
35. Pereira MH, Souza ME, Vargas AP, Martins MS, Penido CM, Diotaiuti L. Anticoagulant activity of Triatoma infestans and Panstrongylus megistus saliva (hemiptera/ triatominae). Acta Tropica 1996; 66:255-261. [ Links ]
36. Perteguer M, Raposo R, Cuellar C. In vitro study on the effect of larval excretory/secretory products and crude extracts from Anisakis simplex on blood coagulation. Int J Parasitol 1996; 26:105-108. [ Links ]
37. Motoyashiki T, Tu A, Azimov D, Ibragim K. Isolation of anticoagulant from the venom of tick Boophilus calcaratus, from Uzbekistan. Thromb Res 2003; 110:235-241. [ Links ]












 uBio
uBio