Investigación Clínica
versão impressa ISSN 0535-5133versão On-line ISSN 2477-9393
Invest. clín v.49 n.1 Maracaibo mar. 2008
Efecto toxigénico de Acinetobacter baumannii aislado en niños con diarrea aguda.
Nina Polanco y Lorna Manzi.
Laboratorio de Patogenicidad Bacteriana, Escuela de Bioanálisis, Facultad de Medicina, Universidad Central de Venezuela, Caracas, Venezuela.
Autor de correspondencia: Nina Polanco. Laboratorio de Patogenicidad Bacteriana, Escuela de Bioanálisis, Facultad de Medicina, Universidad Central de Venezuela. Caracas, Venezuela. Correo electrónico: polancon@camelot.rect.ucv.ve.
Resumen.
Las enfermedades diarreicas constituyen una causa frecuente de mortalidad y morbilidad en niños. Su etiología no siempre se logra identificar sugiriendo la presencia de otros enteropatógenos desconocidos. El aislamiento de Acinetobacter spp. en heces de niños con diarrea aguda no asociada a enteropatógenos clásicos, motivó su investigación a fin de detectar un posible efecto tóxico sobre células HT-29. El estudio estuvo constituido por 150 niños en edades entre 0 a 5 años; 120 fueron asistidos en el Hospital Materno Infantil del Este, Caracas, Venezuela, por presentar síndrome gastrointestinal y 30 eran niños sanos que acudían a dicho centro por control de rutina. En el 25% de los pacientes sintomáticos se diagnosticaron parásitos y bacterias de identificación rutinaria. De cuatro pacientes sintomáticos se aislaron tres cepas de Acinetobacter baumannii y dos de Acinetobacter calcoaceticus, estas cepas se cultivaron durante 24 y 48 horas a 35°C en caldo infusión cerebro corazón de donde se obtuvieron por centrifugación y filtración los sobrenadantes cuya actividad se ensayó en células HT-29. Los sobrenadantes de las tres cepas de A. baumannii presentaron profundas alteraciones en la monocapa celular, manifestada por el desprendimiento de la misma, disgregación, redondeamiento y expansión de las células. La toxicidad del sobrenadante de la cepa 016 superó la de los controles positivos. Este efecto toxigénico de A. baumannii, podría representar un mecanismo de patogenicidad cuya definición requiere de posteriores estudios para determinar un posible papel en la patogenia de este bacilo.
Palabras clave: Acinetobacter, toxigénico, diarrea, células, exoproductos.
Toxigenic effect of Acinetobacter baumannii isolated from children with acute diarrhoea.
Abstract.
Diarrheal diseases with diarrhea are the most frequent cause of morbidity and mortality in children; however the causative agent cannot be identified always, which suggests the presence of unknown enteropathogens inducing diarrhea. The isolation of Acinetobacter sp. from feces of children with acute diarrhea, unrelated to known enteropathogens motivated this investigation to detect a possible enterotoxigenic effect on HT-29 cells. The study population comprised 150 children with an age range from 0 to 5 years old; 120 were assisted in the “Hospital Materno Infantil del Este with gastrointestinal syndrome and 30 healthy controls who went to the center for routine analysis. In 25% of symptomatic patients were diagnosed parasites and bacteria, identified routinely. From four symptomatic patients were isolated three Acinetobacter baumannii strains and two A. calcoaceticus strains. The strains were cultured in brain-heart infusion for 24 and 48 hrs, at 35°C, and the supernatants were obtained by centrifugation and filtration and their activity tested on HT-29 cell monolayers. The supernatants of the three strains of A. baumannii induced alterations of the cell monolayer, showed by detachments of cell monolayers, cell segregation, cell rounding and swelling. These effects were more intense with the 48 h culture exoproducts of the 016 strain, which were higher than the positive control. This toxigenic effect of A. baumannii, could represent a pathogenic mechanism whose definition requires more studies to determine the possible role in the pathogenicity of this bacillus.
Key words: Acinetobacter, toxigenic, diarrhoea, cells, exoproducts.
Recibido: 07-11-2006. Aceptado: 26-06-2007.
INTRODUCCIÓN
La diarrea de origen infeccioso es una entidad clínica que reviste especial interés en los países en vías de desarrollo, donde constituyen una de las tres primeras causas de enfermedad y muerte en niños menores de cinco años (1, 2). En Venezuela, la incidencia de diarreas infecciosas es de 2,2 episodios por niño/año, este síndrome representa la novena causa de mortalidad en la población general y la segunda en niños menores de cinco años (3). De acuerdo a las estadísticas suministradas por el Ministerio de Salud y Desarrollo Social (MSDS, 2005), en el período de 2002 al 2004 en Venezuela se presentaron un total de 320.711 casos de diarrea en niños entre uno y cuatro años, con una tasa de morbilidad de 14.274,6/100.000 habitantes (4). Estas cifras son indicativas de un problema serio en salud pública, que requiere de atención urgente por parte de las autoridades competentes.
Los microorganismos más frecuentemente asociados con diarrea aguda en niños son los rotavirus en un 30 a 40%, las bacterias en un 20% donde Escherichia coli enterotoxigénica (ECET), Salmonella sp, Shigella sp y Campylobacter jejuni, son los aislados con mayor frecuencia y los parásitos en un 10 a 12% representados por Crystosporidium, Entamoeba histolytica y Giardia lamblia. Estos porcentajes muestran que entre el 40 y 50 % de las diarreas quedan sin definición etiológica (5-8).
En las últimas décadas Bacteroides fragilis enterotoxigénico ha tomado cada vez más importancia como agente causal de diarreas en humanos sobre todo en niños menores de 5 años (6, 9-11). Aunque este microorganismo lamentablemente no se investiga en los coprocultivos de rutina, no parece ser la causa del alto porcentaje de diarreas que permanecen sin diagnóstico etiológico, lo cual sugiere que pudieran existir otros patógenos causantes de este síndrome.
Polanco y col. demostraron que algunas cepas de Pseudomonas aeruginosa aisladas de heces provenientes de niños con diarrea son tóxicas en células HEp-2 e inductoras de acumulación de líquido en asa ileal de conejo, lo cual sugiere un posible mecanismo enteropatógeno en algunas cepas de este bacilo cuyos efectos en la infección clínica requiere de posteriores estudios (8).
Además de P. aeruginosa, se ha observado con frecuencia en este tipo de muestras, la presencia de algunos bacilos gram negativos pertenecientes al género Acinetobacter. Este género está constituido por un grupo de cocobacilos gram negativos de naturaleza ubicua. Puede formar parte de la flora normal de la piel de los adultos sanos, especialmente en las manos de donde puede colonizar otros sitios del cuerpo los cuales se convierten en reservorios importantes responsables de brotes nosocomiales (12). En general no son virulentos, pero por su ubicuidad en el ambiente se han aislado de aparatos de ventilación mecánica, catéteres, líquido de diálisis peritoneal y de una amplia variedad de instrumentos en hospitales donde se han encontrado involucrados en una serie de infecciones en pacientes inmunosuprimidos, sobre todo en aquellos recluidos en unidades de cuidados intensivos (13, 14).
En los últimos años se ha reportado un incremento significativo de A. baumannii en las infecciones de origen nosocomial. Es agente causal de sepsis (15), neumonía (16), meningitis (17), infecciones genitourinarias (18), entre otras patologías.
El presente estudio se fundamentó en las observaciones previas de Acinetobacter spp en heces de niños con diarrea de etiología desconocida y fue orientado para investigar su presencia en esta misma población infantil y la posible existencia de actividad toxigénica en células epiteliales de colon humano (HT-29).
PACIENTES Y MÉTODOS
El material de estudio estuvo constituido por heces de 120 pacientes ambulatorios de ambos sexos en edades comprendidas entre cero a cinco años, asistidos en la emergencia del Hospital Materno Infantil del Este “Dr. Joel Valencia Parpacena”, ubicado en la Parroquia Petare del Municipio Sucre, del Estado Miranda, Venezuela por presentar síndrome gastrointestinal. Los controles sanos estuvieron representados por 30 niños de ambos sexos en el mismo rango de edades, ambulatorios, quienes acudían al hospital por controles de rutina sin antecedentes de hospitalización en dicho centro.
Las muestras de heces fueron obtenidas de la población en estudio siguiendo las normas del código de Bioética y Bioseguridad (19). Se tomaron como criterios de exclusión la administración de tratamiento antimicrobiano antes de la toma de muestra, edades por encima del rango mencionado, así como la presencia de otro síndrome clínico concomitante al síndrome diarreico. El periodo de estudio fue desde febrero hasta junio del año 2003.
Todas las muestras fueron tomadas por emisión directa en envases descartables, se identificaron con las siglas PAc (Proyecto Acinetobacter) y se enumeraron en forma consecutiva para indicar el número del paciente.
Estudio parasitológico
El estudio parasitológico fue realizado en el servicio de Bioanálisis del Hospital Materno Infantil, mediante la observación microscópica del examen directo de las muestras de heces tratadas con solución salina 0,9% y lugol (20).
Estudio bacteriológico
De las muestras de heces se extrajo un hisopado y se introdujo en el medio Cary and Blair para su transporte hasta el Laboratorio de Patogenicidad Bacteriana de la Escuela de Bioanálisis, Facultad de Medicina de la Universidad Central de Venezuela, Caracas, Venezuela. Las muestras fueron procesadas y los enteropatógenos de rutina identificados según las especificaciones del Manual de Microbiología de la Sociedad Americana de Microbiología (21). La serotipificación de las cepas de Escherichia coli enteropatógena (ECEP) se realizó con sueros polivantes I, II, III, IV, y la serotipificación de las cepas de Salmonella sp se realizó con el suero polivalente A-I (Fuvesin).
El aislamiento de las colonias compatibles con el género Acinetobacter se hizo a partir de los medios Mac Conkey, Levine y XLD (GIBCO), la separación del género de otros bacilos gram negativos no fermentadores de glucosa se realizó según Schrecknberger y col. en el 2003 (22). La identificación de las especies se realizó según la metodología de Bouvet y Grimont (23). En esta fase se utilizaron como controles las cepas de Acinetobacter baumannii ATCC 19606 y Acinetobacter calcoaceticus ATCC 23055, obtenidas del Centro Venezolano de Colecciones de Microorganismos (CVCM).
Obtención del sobrenadante de Acinetobacter spp
Las cepas identificadas como A. baumannii y A. calcoaceticus se sembraron en placas de Agar nutritivo y se incubaron a 35°C durante 24 horas en aerobiosis. De estos cultivos se tomaron algunas colonias y se inocularon por duplicado en tubos que contenían caldo infusión cerebro corazón (Difco), hasta lograr una densidad comparable al Patrón de Mc Farland número 0,5 (24). Posteriormente se incubaron a 35°C durante 24 y 48 horas. Transcurrido este tiempo fueron centrifugados (Sorvall RC-5b) a 4°C durante 10 minutos a 2000g. El sobrenadante fue filtrado a través de una membrana de 0,22 µm (Fischer) e inmediatamente se probó su actividad en los cultivos celulares. A fin de comprobar la pureza del cultivo, el sedimento se sembró en placas de agar sangre en condiciones de aerobiosis. Tanto el control negativo (E. coli K12), como el control positivo Shigella dysenteriae Tipo 1 fueron procesados de la misma forma.
Los exoproductos de Bacteroides fragilis enterotoxigénico productora de la toxina BFT-1 (cepa vip) fueron obtenidos según procedimiento de Polanco y col. (6).
Cultivo celular
El clon de células HT-29 fue obtenido de la Unidad de Cultivos Celulares del Centro de Bioquímica y Biofísica del Instituto Venezolano de Investigaciones Científicas, Caracas, Venezuela. Para su uso experimental las células fueron despegadas con tripsina EDTA 0,5%, lavadas con PBS pH 7,2 y posteriormente resuspendidas en 5 mL de Medio Dulbecco Modificado Eagle (DMEM, GIBCO) para su cultivo hasta lograr un crecimiento confluente.
Ensayos de citotoxicidad en células HT-29
Los ensayos celulares fueron realizados según la metodología de Weikel y col. (25). Se utilizaron placas de 24 pozos (NUNC Brand) y en cada uno de ellos se sembraron 180.000 células HT-29 por mililitro de DMEM suplementado con 0,1% de suero fetal bovino (Sigma) y se incubaron a 37°C en estufa 5% CO2, 100% de humedad hasta obtener un crecimiento celular confluente. Posteriormente se lavaron con buffer fosfato de sodio (PBS) pH 7,2 y se agregó a cada pozo 0,5 mL de DMEM suplementado más 0,5 mL de cada sobrenadante a ensayar. Se realizó una serie con sobrenadantes de 24 y otra de 48 horas de cultivo cada una por triplicado, seguidamente se diluyeron con DMEM hasta la dilución 1:8. Se empleó un control con DMEM y un control de células cultivadas en caldo infusión cerebro-corazón. Posteriormente las placas fueron incubadas en las mismas condiciones anteriormente descritas para ser observadas a través de un microscopio invertido a las 3, 24 y 48 horas. Los cambios en la monocapa fueron registrados con una cámara digital (Nikon). A continuación las placas se lavaron con PBS (pH 7,2), se fijaron con metanol (90%) durante 5 minutos y se colorearon con Giemsa diluido 1:10 con PBS pH 7,2. Nuevamente fueron observadas al microscopio y registradas las impresiones fotográficas.
La actividad de la toxina, definida como alteraciones en la morfología en las células HT-29, incluyendo redondeamiento, expansión, separación celular, retracción del citoplasma y desprendimiento de la monocapa, fueron registrados en un modelo cualitativo usando una escala modificada (25). Una puntuación de 4+ indica desprendimiento total de la monocapa, redondeamiento del 100% de la células, 3+ indica desprendimiento de un 75% de la monocapa y redondeamiento de las células, 2+ indican desprendimiento del 30%-40% de la monocapa, redondeamiento y expansión celular y 1+ expansión de las células, sin desprendimiento de la monocapa.
RESULTADOS
Tanto el estudio coprológico como el coprocultivo de las 120 muestras de heces que conformaron este estudio, evidenciaron que el 25% fueron positivas para los enteropatógenos clásicos (Tabla I).
PORCENTAJE DE ENTEROPATÓGENOS IDENTIFICADOS DE RUTINA EN HECES DE PACIENTES CON DIARREA AGUDA
| Enteropatógeno | Nº Casos | Porcentaje (%) |
| Salmonella typhi | 12 | 10,0 |
| E. coli enteropatógena | 6 | 5,0 |
| Ascaris lumbricoides | 4 | 3,3 |
| Giardia lamblia | 3 | 2,5 |
| Amebas | 3 | 2,5 |
| Blastocystis hominis | 2 | 1,6 |
| TOTAL | 30 | 25,0 |
En cuatro pacientes sintomáticos (PAc 016; 032; 108; 109) se identificaron 5 cepas de Acinetobacter sp, de las cuales tres fueron A. baumannii (PAc 016; 032 y 109ª) y dos A. calcoaceticus (PAc 108; 109b). Las muestras de los controles fueron negativos para parásitos y bacterias de identificación rutinaria así como para Acinetobacter spp.
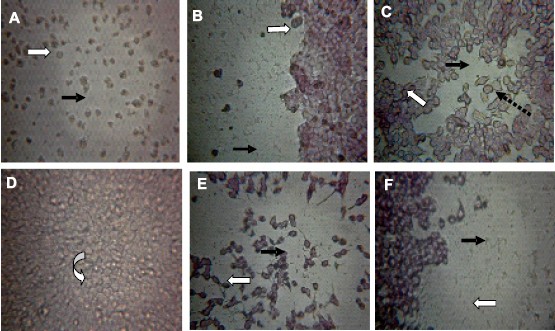
Los exoproductos de las cepas (PAc 016; 032) de A. baumannii cultivados durante 48h en caldo infusión cerebro corazón indujeron a las 3 h de incubación ligera separación y redondeamiento de las células HT-29, este efecto se hizo prominente a medida que transcurrió el tiempo de incubación de las placas hasta producir a las 48 h, desprendimiento de la monocapa, con disgregación, separación y redondeamiento celular, mientras que con los sobrenadantes de 24 h de cultivo de estas mismas cepas, aunque se evidencia a las tres horas, el efecto tóxico fue mucho menor (2+). Los exoproductos de A. baumannii, cepa 109a indujeron a las 48 h del cultivo celular un desprendimiento leve de la monocapa. El control de células incubadas con DMEM y el control de células incubadas con sobrenadantes de E. coli K12 presentaron el patrón de una monocapa confluente con uniones intracelulares estrechas durante todo el período de incubación. La cepa vip de Bacteroides fragilis enterotoxigénico no indujo alteraciones sobre la monocapa a las 3 h de incubación, situación que fue variando con el tiempo hasta lograr un evidente efecto enterotoxigénico el cual fue máximo (4+) a las 48 h de incubación a la dilución 1:8. Por otra parte, Shigella dysenteriae tipo 1, presentó efecto enterotoxigénico a las 3 h de incubación a una dilución 1:2, fenómeno que se mantuvo hasta las 48 h de incubación (Fig. 1).
Fig. 1. Alteraciones morfológicas en células HT-29 tratadas con exoproductos de Acinetobacter bau - mannii con 48 horas de cultivo. Magnificación 400X. A: cepa 016. B: cepa 032. C: cepa 109a. D: Exoproductos de E. coli K12. E: Exoproductos de B. fragilis enterotoxigénico. F: Exoproductos de S. dysenteriae Tipo 1. Monocapa confluente (Flecha curva). Desprendimiento de la monocapa (Flecha negra). Redondeamiento de las células (Flecha blanca). Expansión de las células (Flecha discontinua).
Las cepas de A. calcoaceticus aisladas de los pacientes identificados con los números 108 y 109b no presentaron toxicidad en esta línea celular.
DISCUSIÓN
No obstante los esfuerzos realizados por distintas organizaciones mundiales de la salud, las enfermedades diarreicas siguen conformando un grave problema de salud pública a nivel mundial sobre todo en los países en desarrollo, donde contribuyen de manera significativa a incrementar la tasa de morbilidad y mortalidad en niños menores de cinco años.
En los 120 pacientes analizados se puso de manifiesto que el 25% fueron positivos para enteropatógenos parasitarios y/o bacterianos. El 9,99% de éstos fueron parásitos, cifras comparables con las obtenidas por otros investigadores en nuestro país (26), y parecen variar según la localidad donde se realice el estudio (27). El 15% del resto de los aislados patógenos estuvo constituido por Salmonella typhi y Escherichia coli enteropatógena, este porcentaje fue bajo en comparación con el reportado por el MSDS (2001) así como por otros autores (6) quienes reportan valores que oscilan entre 20 y 30 %, estas diferencias pudieran ser ocasionadas por el concurso de múltiples factores tanto de orden epidemiológico como de carácter estacional.
Aunque A. baumannii es un patógeno extraintestinal conocido sobre todo en el ambiente hospitalario (12, 13, 15), no se ha demostrado hasta ahora la producción de exotoxinas que pudieran explicar en parte su patogenicidad. En algunos reportes lo han asociado a cuadros diarreicos en base a la observación del bacilo en heces de pacientes con este cuadro clínico sin demostración de algún hecho que explique su participación (28).
Algunos autores afirman que la mayoría de las genoespecies del género Acinetobacter no pueden ser separadas por pruebas fenotípicas y por tal razón, para referirse a estas especies quizás se deba recurrir al término: Complejo Acinetobacter calcoaceticus-Acinetobacter baumannii (29), ya que los métodos para tipificarlas mejor son: estudio de las proteinas de la célula entera, análisis de plásmidos, reacción en cadena de la polimerasa (PCR) y electroforesis de campo pulsado, esta última brinda mayor especificidad (30). Sin embargo, en ausencia de estos laboriosos métodos se puede utilizar el esquema de Bouvet y Grimont (23) que permite mediante pruebas bioquímicas diferenciar las genoespecies desde la 1 hasta la 17, donde A. calcoaceticus corresponde a la genoespecie 1 y A. baumannii a la genoespecie 2. Adicionalmente, se utilizaron los controles ATCC 23055 correspondientes a A. calcoaceticus y la ATCC 19606 correspondientes a A. baumannii, cuyas reacciones bioquímicas en forma repetida siempre fueron iguales a las cepas aisladas en este trabajo, sin que eso excluya estudios futuros a fin de clasificar por algunas de estos métodos las diferentes cepas del género Acinetobacter aisladas en esta investigación.
Todos los exoproductos obtenidos a las 48 horas de cultivo de las cepas de A. baumannii (Pac 016, 032, 109a), presentaron pronunciadas alteraciones morfológicas en la línea celular HT-29, las cuales variaron, dependiendo de la cepa, en redondeamiento, expansión y separación celular, desprendimiento de la monocapa y retracción del citoplasma (Fig. 1). Este efecto fue muy pronunciado con los exoproductos de la cepa 016, los cuales superaron la toxicidad de S. dysenteriae y B. fragilis enterotoxigénico, ambas especies causantes de diarrea en humanos (31, 32). Las diferencias en toxicidad vistas en las células tratadas con los distintos exoproductos podría ser por que la producción de la toxina ocurra a diferentes tiempos (33, 34), en relación a esto, en otro modelos experimentales se han planteado varias hipótesis, las cuales incluyen diferencias en la expresión o tiempo de secreción de la toxina así como la presencia de otros factores de virulencia. Los datos más recientes utilizando cepas de Bacteroides fragilis con baja producción de enterotoxinas derivadas de cepas altamente toxigénicas indican que la regulación de la transcripción de los genes es el mecanismo probablemente responsable de este comportamiento (35), este mecanismo tal vez pudiera ocurrir en A. baumannii.
Este es el primer reporte de actividad toxigénica de A. baumannii en células de cultivo, el cual requiere posteriores estudios a fin de determinar el mecanismo de acción de esta(s) exotoxina(s) así como sus posibles efectos en el síndrome gastrointestinal.
REFERENCIAS
1. Snyder JD, Merson M. The magnitude of the global problem of acute diarrheal diseases. A review of active surveillance data. Bull WHO 1982; 60:605-613. [ Links ]
2. Mugarra X. Avance en el manejo del síndrome de diarrea aguda. Arch Venez Puericul Pediatr 1990; 53:1. [ Links ]
3. Urresterazu MI, Liprandi F, Pérez de Suárez E, Gonzalez R, Perez-Schael I. Características etiológicas, clínicas y sociodemográficas de la diarrea aguda en Venezuela. Rev Panam Salud Pública 1999; 6:149-156. [ Links ]
4. Ministerio de Salud y Desarrollo Social (MSDS). Boletín Epidemiológico 2005. Fuente: dirección de Epidemiología regional/ DVE/DEAE/MSDS. Venezuela. Año 2005. [ Links ]
5. Urresterazu M, Darricarrere R, Pérez G, Daoud G, Serrano M, Cavazza E, Pérez-Schaell I. Frecuency of C. jejuni and other agents in acute diarrhea in Venezuelan childrens. PAHO 1987; 21:240-249. [ Links ]
6. Polanco N, Garcia A, Candela E, Seijias U. Aislamiento de Bacteroides fragilis enterotoxigénico en pacientes del Hospital de Niños J. M. De los Ríos con síndrome gastrointestinal. Acta Científica Venezolana. Memorias de la XLIV Convención Annual, 1994. 45:236. [ Links ]
7. Guerrant R, Hughes JM, Lima MI, Crane J. Diarrhea in developed an developing countries, magnitud, special settings and etiologies. Rev Infect Dis 1990; 12:541-50. [ Links ]
8. Polanco N, Giuffrida R, Gonzalez F, Negron E, Gonzalez R. Pseudomonas aeruginosa aisladas de pacientes con síndrome gastrointestinal. Memorias del VII Congreso Venezolano de Microbiología, 2000. “Elsa La Corte Anselmi”. Maracaibo, Venezuela, p 53. [ Links ]
9. Myers, LL, Shoop DS, Stackhouse LL, Newman SF, Flaherty RJ, Lestón W, Sack B. Isolation of Bacteroides fragilis from humans with diarrhea. J Clin Microbiol 1987; 25:2330-2333. [ Links ]
10. Durmaz B, Dalgalar M, Durmaz R. Prevalence of Enterotoxigenic Bacteroides fragilis in children less than 5 years of age in Hanoi, Vietnam. Anaerobe 2005; 11:318-321. [ Links ]
11. Cohen SH, Shetab R, Tang-Feldman YJ, Sarma P, Silva J Jr, Prindiville TP. Prevalence of enterotoxigenic Bacteroides fragilis in hospital-acquired diarrhea. Diagn Microbiol Infect Dis 2006; 55:251-254. [ Links ]
12. Benitez L, Ricart M. Pathogenesis and Environmental Factors in ventilator- associated pneumonia. Enferm Infecc Microbiol Clin 2005; 23:46-51. [ Links ]
13. Joly-Guillou ML. Clinical impact and pathogenicity of Acinetobacter. Clin Microbiol Infect 2006; 11:868-873. [ Links ]
14. Bergogne-Bérezin E, Towner K. Acinetobacter spp as nosocomial pathogens: microbiological, clinical and epidemiological features. Clin Microbiol Rev 1996; 9:148-165. [ Links ]
15. Peleq AY, Potoski BA, Rea R, Adams J, Sethi J, Capitano B, Husain S, Kwak EJ, Bhat SV, Paterson DL. Acinetobacter baumannii bloodstream infection while receiving tigecycline: a cautionary report. J Antimicrob Chemother 2007; 59:128-131. [ Links ]
16. Benitez L, Ricart M. Pathogenesis and enviromental factors in ventilator-associated pneumonia. Enferm Infecc Microbiol Clin 2005; 23:10-17. [ Links ]
17. Abbas M, Chowdhury M. Acinetobacter baumannii meningitis. Eur J Clin Microbiol Infect Dis 2002 ; 21:212-214. [ Links ]
18. Braun G, Vidotto Mc. Evaluation of adherence, hemagglutination, and presence of genes codifying for virulence factors of Acinetobacter baumannii causing urinary tract infections. Mem Inst Oswaldo Cruz 2004; 99:839-44. [ Links ]
19. Briceño E, Suárez E, Michelangi C, Feliciangeli D, Ptaiza E, Mendible J, Villalón M, Aguilera M, Ceballo H, Godoy J. Código de Bioética y Bioseguridad, Capítulo 2 y 3. Ministerio de Ciencia y Tecnología (FONACIT). 2da. Edición, 2002. Venezuela. [ Links ]
20. Garcia LS, Shimizu RY, Deplazes P. Specimen, Collection, transport and processing: Parasitology. En: Murray PR, Baron EJ, Jorgensen JH, Pfaeller MA, Yolken RH. Manual of Clinical Microbiology. 8 th edition. ASM Press Washington DC; 2003. p1903-1919. [ Links ]
21. Mohr C, Weinstein MP, Miller M. Manual and automated system for detection and identification of microorganisms. En: Murray PR, Baron EJ, Jorgensen JH, Pfaeller MA, Yolken RH. (eds). Manual of Clinical Microbiology. 8 th edition. ASM Press. Washington D.C. 2003. p 185-217. [ Links ]
22. Schreckenberger PC, Daneshvar MI, Weyant R, Hollis D. Acinetobacter, Achromobacter, Chryseobacterium, Moraxella and other Nonfermentative Gram-Negative Rods. En: Murray PR, Baron EJ,Jorgensen JH, Pfaeller MA, Yolken RH. (eds). Manual of Clinical Microbiology. 8 th edition. ASM Press. Washington D.C. 2003. p 749-779. [ Links ]
23. Bouvet PJ, Grimont P. Taxonomy of the Genus Acinetobacter with the Recognition of Acinetobacter baumannii sp. nov., Acinetobacter haemolyticus sp. nov., Acinetobacter johnsonii sp. nov. and Acinetobacter junii sp. Nov. and emended descriptions of Acinetobacter calcoaceticus and Acinetobacter lwoffi. Int J Syst Bacteriol 1986; 36:228-240. [ Links ]
24. NCCLS. Methods for dilution antimicrobial susceptibility test for bacteria that grow aerobically. 2000. Approved standard M7-A5. NCCLS, Wayne Pa. [ Links ]
25. Weikel C, Grieco F, Reuben J, Myers L, Sack B. Human colonic cells, HT-29/C1, treated with crude Bacteroides fragilis enterotoxin dramatically alter their morphology. Infect Immun 1992; 60:321-327. [ Links ]
26. Vizcaya L, Flores A, Hernández J, Blanco B, Perez Schael I. Origen bacteriano de la enfermedad diarreica aguda en Mérida, Venezuela. Rev Cubana Med Trop 1999; 51: 9-14. [ Links ]
27. Rincon W, Acurero E, Serrano E, Quintero M, Beauchamp S. Enteroparásitos asociados a diarrea aguda en niños menores de 12 años de edad. Kasmera 2006; 34:31-39. [ Links ]
28. Okeke IN, Lamikanra A, Steinrück H, Kaper JB. Characterization of Escherichia coli strains from cases of childhood diarrhea in provincial southwestern Nigeria. J Clin Microbiol 2000; 38:7-12. [ Links ]
29. Gerner-Smidt P, Tjernberg I, Ursing J. Reability of phenotypic test for identification of Acinetobacter species. J Clin Microbiol 1991; 29:277-282. [ Links ]
30. Marcos MA, Vila J, Jimenez MT. Correlation of six methods for typing nosocomial isolates of Acinetobacter baumannii. J Med Microbiol 1995; 42:328-335. [ Links ]
31. Sharma N, Chaudhry R. Rapid detection of enterotoxigenic Bacteroides fragilis in diarrhoeal faecal samples. Indian J Med Res 2006; 124:575-582. [ Links ]
32. Niyogi SK. Shigellosis. J Microbiol 2005; 43:133-143. [ Links ]
33. Polanco N, Ramos M, Rodríguez B, O’Daly JA. Actividad proteolítica en exoproductos de Bacteroides fragilis enterotoxigénico y su reconocimiento inmunológico. Memorias del XXVI Congreso Venezolano de Microbiología 1999 “Dr. José Esparza”, Valencia, Venezuela. p69. [ Links ]
34. Polanco N, Giuffrida R, Rodríguez M, Marfil H. Actividad proteolítica en sobrenadantes de cultivo de Acinetobacter baumannii. Memorias del VII Congreso Venezolano de Microbiología 2000 “Elsa La Corte Anselmi”. Maracaibo, Venezuela. [ Links ]
35. Wu S, Dreyfuss LA, Tzianabos AO, Hayashi CH, Sears C. Diversity of the metalloprotease toxin produce by enterotoxigenic Bacteroides fragilis. Infect Immun 2002; 70:2464-2471. [ Links ]












 uBio
uBio