Investigación Clínica
versão impressa ISSN 0535-5133versão On-line ISSN 2477-9393
Invest. clín v.51 n.1 Maracaibo mar. 2010
Evaluación de la calidad del espermatozoide humano: comparación entre la integridad del ADN espermático y variables del semen.
Ibis Cruz1, Melisa Colmenares1, Leidith Berrueta-Carrillo2, Roald Gomez-Perez3, Henry Montes4, Lisbeth Berrueta2, Siham Salmen2 y Jesús Alfonso Osuna1.
1Laboratorio de Andrología, Centro de Microscopía Electrónica, Escuela de Medicina, 2Instituto de Inmunología Clínica, Universidad de Los Andes, 3Unidad de Endocrinología, Instituto Autónomo Hospital Universitario de Los Andes y 4CAMIULA, Universidad de Los Andes. Mérida, Venezuela
Autor de correspondencia: Jesús Alfonso Osuna. Laboratorio de Andrología, Centro de Microscopía Electrónica, Escuela de Medicina, Universidad de Los Andes. Mérida, Venezuela. Correo electrónico: jesusosuna.oc@gmail.com
Resumen. El análisis del semen no tiene valor predictivo absoluto de fertilidad, pero informa sobre el potencial de fertilidad del varón, el cual está relacionado con la calidad de sus espermatozoides y de otras variables del semen. Se ha comprobado que los valores del semen pueden mostrar gran variabilidad en un mismo individuo. Esto explica por que un hombre cuyas variables no son absolutamente normales, puede lograr un embarazo en su pareja. Dentro de los parámetros tradicionalmente utilizados en la evaluación clínica de la fertilidad masculina se encuentran: la concentración, la movilidad y la morfología espermática; además de medir estas variables, nuevos procedimientos han sido incorporados para evaluar la capacidad funcional de los espermatozoides, uno de los que ha alcanzado particular importancia en la última década es la medida de la integridad del ADN nuclear. La fragmentación del ADN consiste en interrupciones en las cadenas simples o dobles del ADN que ocurre frecuentemente en la muestra de pacientes no fértiles. Se ha llevado a cabo un estudio clínico, en muestras de semen provenientes de pacientes que acudieron al laboratorio de Andrología de la Universidad de los Andes, colectadas entre marzo del 2007 y marzo del 2009, a fin de establecer comparaciones entre los parámetros convencionales y la medición de la integridad de la cromatina espermática, mediante citometría de flujo. Los resultados obtenidos mostraron correlaciones evidentes entre los parámetros convencionales y la integridad del ADN espermático y aportan datos de gran utilidad en el estudio clínico integral de la infertilidad masculina.
Palabras clave: Cromatina espermática, integridad del ADN, fragmentación del ADN, espermatozoides, fertilidad masculina, muerte celular.
Evaluation of the quality of the human spermatozoon: comparison between spermatic DNA integrity and semen variables.
Abstract. Semen analysis does not have an absolute predictive value on fertility, however it is a reflection of male fertility potential, which is related to its spermatozoa quality and other semen variables. Great variability in human semen parameters has been demonstrated within a single individual, an observation that could explain why a male with low semen quality can successfully fertilize an egg. Although conventional semen analysis, such as sperm concentration, motility and morphology, provide important information about the clinical status of male fertility, new procedures to predict the sperm functional capability have been developed in the last decade, such as analysis of nuclear DNA integrity, which have improved considerably the clinical diagnosis of male infertility, and increased the knowledge about spermatozoa function. DNA fragmentation consist in interruptions, both in single and double DNA strains, that frequently occur in sperm samples from infertile patients. We have conducted a clinical study in semen samples from patients who have attended the Andrology laboratory of the University of Los Andes, between March 2007 and March 2009. The aim of this study was to compare sperm DNA integrity, analyzed by flow cytometry, with traditional semen parameters. Our results show remarkable correlations between conventional human semen variables and sperm chromatin integrity, contributing to asses an integral evaluation of sperm quality allowing the analysis of its fertilizing potential in clinical studies.
Key words: Sperm chromatin, DNA integrity, DNA fragmentation, spermatozoa, male fertility, cell death.
Recibido: 08-04-2009. Aceptado: 02-11-2009.
INTRODUCCIÓN
La infertilidad es definida como la incapacidad de una pareja para concebir después de un año de relaciones sexuales frecuentes, sin medidas anticonceptivas. La prevalencia de la infertilidad se ha estimado que ocurre en 15% de las parejas en edad reproductiva (1). Se atribuye al factor masculino 40 a 50% de los casos de infertilidad (2, 3). De acuerdo con su etiología, la infertilidad masculina es clasificada en tres categorías: causas pre-testiculares (factores genéticos); causas testiculares (alteraciones de la espermatogénesis); y causas post-testiculares. Con base a la efectividad de un tratamiento médico para mejorar las tasas de embarazos, la infertilidad es clasificada en: esterilidad intratable, alteraciones tratables y subfertilidad intratable (4, 5).
Los trastornos gonadales son la causa más frecuente de alteraciones de la espermatogénesis, en cuya etiopatogenia concurren diversos factores: causas genéticas y alteraciones cromosómicas. Defectos en el empaquetamiento del ADN, mal descenso testicular; procesos inflamatorios, alteración en el mecanismo de regulación de la temperatura escrotal (varicocele), exposición a compuestos químicos tóxicos (agroquímicos), fármacos diversos y drogas, alcohol, tabaco, quimioterapia con citotóxicos y radioterapia por malignidad de los testículos, se encuentran entre otras causas (6, 7).
La evaluación inicial del hombre que forma parte de una pareja infértil debe incluir un examen clínico integral, con particular énfasis en la historia de su sistema endocrino-reproductor; al mismo tiempo se deben solicitar por lo menos dos análisis del semen. Es criterio unánimemente aceptado que el espermograma es el estudio fundamental del hombre que consulta por infertilidad. El análisis del semen provee información esencial a partir de la cual se orientan los estudios subsiguientes. Las diferentes variables del semen han sido revisadas a lo largo de las últimas siete décadas, a partir de los estudios realizados por MacLeod (8). Una de esas variables que ha sido objeto de mayor atención es la relacionada con niveles normales de espermatozoides y una mayor probabilidad de lograr embarazos espontáneos o los obtenidos mediante técnicas de reproducción asistida (9-11). Entre los nuevos procedimientos incorporados para evaluar la capacidad funcional de los espermatozoides, uno que ha alcanzado particular importancia en la última década, es la medida de la integridad del ADN nuclear contenido en la cabeza de los espermatozoides. La fragmentación del ADN consiste en interrupciones en las cadenas simples o dobles del ADN que ocurre frecuentemente en la muestra de pacientes no fértiles. Se ha comprobado que la proporción de ADN fragmentado es mayor en espermatozoides de hombres que consultan por infertilidad, comparada con sujetos de fertilidad probada (12, 13). Además, en hombres con semen alterado se ha encontrado mayor daño del ADN nuclear que en los hombres con semen normal (13-15).
La citometría de flujo representa una de las herramientas más objetivas y precisas para analizar la integridad de la cromatina espermática, hace uso de fluorocromos específicos para el ADN como el anaranjado de acridina (AA) (16) y el ioduro de propidio (IP) (17). El método que utiliza el AA aprovecha las propiedades metacromáticas del mismo para evidenciar la susceptibilidad de la cromatina espermática a la desnaturación inducida por ácidos (18). La estructura anormal de la cromatina se cuantifica mediante citometría de flujo a través de la desviación metacromática de fluorescencia verde (ADN de doble cadena) hacia la fluorescencia roja (ADN de cadena sencilla). El tratamiento con pH bajo causa una denaturación parcial del ADN solo en aquellos espermatozoides que tienen alterada la estructura de la cromatina, de tal manera que en presencia de cromatina espermática alterada se espera una mayor proporción de ADN de cadena sencilla (fluorescencia roja) (19, 20); el grado de daño se expresa como DFI (DNA fragmentation index). Estudios previos han indicado que valores de DFI mayores de 27% están asociados con fallas de embarazo, cuando se usan técnicas de reproducción asistida (21, 22); sin embargo, estudios recientes cuestionan el valor predictivo del ensayo de la estructura de la cromatina espermática, SCSA ya que se han reportado casos de embarazo, usando esos mismos procedimientos, en técnicas de reproducción asistida, con valores de DFI mayores de 27% (23-25).
Otra estrategia para analizar la integridad del ADN y que ha sido ampliamente utilizada para medir la muerte en una variedad de tipos celulares, es la tinción del ADN con ioduro de propidio (IP) analizada también mediante citometría de flujo (26). El IP es un compuesto fluorescente que se une estequiométricamente al ADN, de tal manera que la emisión de la fluorescencia es proporcional al contenido de ADN de la célula. Cuando las células apoptóticas se tiñen con IP y analizan con un citómetro de flujo, muestran un pico de hipodiploidía (por detrás del pico G1), el cual puede ser fácilmente distinguido del pico estrecho que corresponde a ADN de células diploides normales, que se detecta en los canales de fluorescencia roja (27). Estudios recientes han mostrado una correlación positiva entre el DFI medido por SCSA con muerte celular y el porcentaje de esperma hipodiploide determinado mediante tinción con IP (28).
El objetivo de este estudio fue analizar y establecer correlaciones entre las características del semen y la integridad del ADN espermático en muestras eyaculadas de hombres provenientes de parejas infértiles. Además de las pruebas convencionales utilizadas en el laboratorio de andrología, se implementó el recurso de la citometría de flujo para evaluar: 1) La integridad de la cromatina a través de la tinción con AA expresada como DFI y 2) La muerte celular en las células espermáticas, puesta en evidencia a través de la tinción con IP.
MATERIAL Y MÉTODOS
En este estudio se analizó un total de 341 muestras de hombres procedentes de parejas que acudieron al Laboratorio de Andrología del Centro de Microscopía Electrónica, Facultad de Medicina, Universidad de Los Andes, Mérida, entre abril de 2007 y marzo del 2009, para evaluación por infertilidad. Cuarenta y un sujetos (grupo A) poseían características normales en el semen, de acuerdo con los criterios del segundo manual de la Organización Mundial de la Salud (29): concentración de espermatozoides mayor o igual a 20 millones por mL; volumen total de semen entre 2 y 5 mL; número total de espermatozoides en la eyaculación mayor o igual a 40 millones; viabilidad de los espermatozoides mayor o igual a 50%; espermatozoides con morfología normal mayor o igual a 50%; espermatozoides progresivos rápidos (movilidad a) mayor o igual a 25% y la suma de los progresivos rápidos y lentos (movilidad a + b) mayor o igual a 50%. Los 300 individuos restantes, no cumplieron en su totalidad con estos criterios y fueron denominados como grupo (B) (Tabla I).
PARÁMETROS ANALIZADOS EN EL SEMEN
| Parámetro | Grupo A (Promedio ±IC) | Grupo B (Promedio ±IC) | p |
| Edad | 33 ± 2,37 | 33 ± 0,96 | NS |
| Volumen | 3,29 ±0,41 | 3,41 ± 0,18 | NS |
| pH | 7,92 ± 0,09 | 7,99 ± 0,03 | NS |
| Concentración | 98,49 ± 11,75 | 57,21 ± 4,87 | <0,01 |
| Test de integridad de membrana | 57,15 ± 4,66 | 48,9 ± 2,22 | <0,01 |
| Eosina | 20,15 ± 1,44 | 25,11 ± 1,55 | <0,01 |
| Espermatozoides normales | 54,88 ± 3,58 | 43,7 ± 1,85 | <0,01 |
| Cabezas amorfas | 17 ± 1,85 | 21,36 ±0,94 | <0,01 |
| Cabezas pequeñas | 13,27 ± 1,19 | 14,82 ± 0,57 | NS |
| Cabezas alargadas | 0,63 ± 0,28 | 0,29 ± 0,09 | <0,01 |
| Taipery | 0,03 ± 0,05 | 0,11 ± 0,04 | NS |
| Pieza intermedia patológica | 9,15 ± 1,05 | 10,19 ± 0,43 | NS |
| Cola defectuosa | 5,07 ± 1,02 | 7,01 ± 0,49 | <0,01 |
| Grado a | 28,83 ± 2,81 | 6,38 ± 1,18 | <0,01 |
| Grado b | 46,66 ± 4,20 | 36,44 ± 2,11 | <0,01 |
| Grado a + b | 75,49 ± 3,93 | 42,62 ± 2,58 | <0,01 |
| Inmóviles | 24,51 ± 4,62 | 54,27 ±2,56 | <0,01 |
| DFI | 24,9 ± 1,34 | 51,23 ± 1,55 | <0,01 |
| Muerte celular | 22,13 ± 5,86 | 39,50 ± 3,47 | <0,01 |
Las muestras se obtuvieron mediante masturbación y se recolectaron en recipientes de plástico estériles. Los pacientes fueron instruidos para guardar abstinencia sexual de 3 a 5 días antes de la obtención de la muestra, las mismas se analizaron en menos de 1 hora después de su obtención.
Para determinar la concentración y motilidad, las muestras se dejaron a 37°C durante 20 minutos para que licuaran y a continuación se realizó el análisis de la concentración (expresada en 106/mL) y movilidad (expresada en %), para lo cual se utilizaron 5 µL de semen de cada muestra, que fueron colocados en una cámara de Makler para contaje espermático. Para valorar la movilidad espermática se analizaron un mínimo de 200 espermatozoides, en al menos 5 campos distintos de cada muestra. La evaluación se realizó siguiendo los criterios de la Organización Mundial de la Salud (OMS); así los espermatozoides móviles correspondieron a aquellos progresivos rápidos unidireccionales (a) 25 µm/s a 37°C) y progresivos lentos (b) (entre 5 y 25 µm/s a 37°C). Otros parámetros como aspecto, volumen, viscosidad y pH fueron también evaluados posterior a la licuefacción.
Para estudiar la morfología se realizó una extensión de semen en fresco, la cual se dejo secar y posteriormente se realizó la tinción con Diff-Quick (30). La morfología fue evaluada en 200 espermatozoides consecutivos, mediante un microscopio de luz convencional siguiendo los criterios de la OMS (29). Los resultados fueron expresados como porcentaje de espermatozoides normales y anormales (defectos en las cabezas, defecto en la pieza media y defectos en la cola). Los análisis del semen fueron llevados a cabo antes de los ensayos para medir la integridad de la cromatina.
La vitalidad espermática se evaluó mediante la permeabilidad al colorante vital Eosina. Se analizaron un total de 200 espermatozoides haciendo uso del microscopio óptico con contraste de fase (400X), diferenciando los espermatozoides vivos (no coloreados) de los muertos (coloreados) y el valor se expresó en porcentaje del total de espermatozoides.
La integridad de membrana (TIM) se mide como una prueba basada en la semipermeabilidad de la membrana celular intacta responsable de que los espermatozoides se hinchen en condiciones hiposmóticas. Para tal efecto, se añadieron 0,1 mL de semen a 1 mL de solución hiposmótica a 150mOsm/L, preparada disolviendo 0,735 g de citrato de sodio y 1,35g de fructosa en 100mL de agua destilada, la cual fue incubada durante 30 minutos a 37°C, y las células fueron examinadas con un microscopio de contraste de fase. Se analizaron un total de 200 células, se evaluaron cambios en la conformación de la cola y el resultado se expresó en porcentajes de todos los espermatozoides del eyaculado.
La integridad de la cromatina se midió mediante citometría de flujo:
1) Ensayo de la estructura de la cromatina espermática (SCSA): en este estudio se utilizó el procedimiento para SCSA descrito por Evenson y Jost en 1994 (18), con modificaciones menores. Una alícuota de 400 µL se lavó dos veces mediante centrifugación a 600 g por 5 min con buffer TNE (0,15 M NaCl, 0,01 M de Tris HCl, 1 mM de EDTA, pH 7,4), el sedimento fue resuspendido en etanol al 70% e incubado para fijación durante 30 minutos a temperatura ambiente. Después de tres lavados mediante centrifugación con buffer TNE a 600 g por 5 min, las muestras fueron resuspendidas en proporción 1:2 en solución desnaturalizante ácida (0,1% de Tritón X100, 0,15 M NaCl, 0,08N HCl, pH 1,4) durante 30 segundos, seguido por la adición de la solución colorante en proporción 1:2 (muestra: colorante, respectivamente), (6 µg/mL anaranjado de acridina (Molecular Probes, Eugene, OR, USA), 0,1 M ácido cítrico, 0,2 M Na2HPO4, 1mM EDTA, 0,15 M NaCl, pH 6). Después de 30 segundos de incubación las muestras fueron analizadas en un citómetro de flujo (FACsort, mediante el programa Cell Quest, Becton Dickinson, San José California, USA). Se analizaron un total de 5.000 eventos y mediante un gráfico tipo dot-plot, se estableció la región donde se ubican los espermatozoides en un gráfico tipo FSC (Forward scatter) y SSC (Side scatter). Por cuanto las propiedades metacromáticas del anaranjado de acridina permiten la distinción entre ADN de cadena simple (fluorescencia roja) y ADN de cadena doble (fluorescencia verde), se pudo calcular el DFI, que resulta de la relación entre la fluorescencia roja y la fluorescencia total (roja más verde) expresada en porcentaje, de tal manera que:
![]()
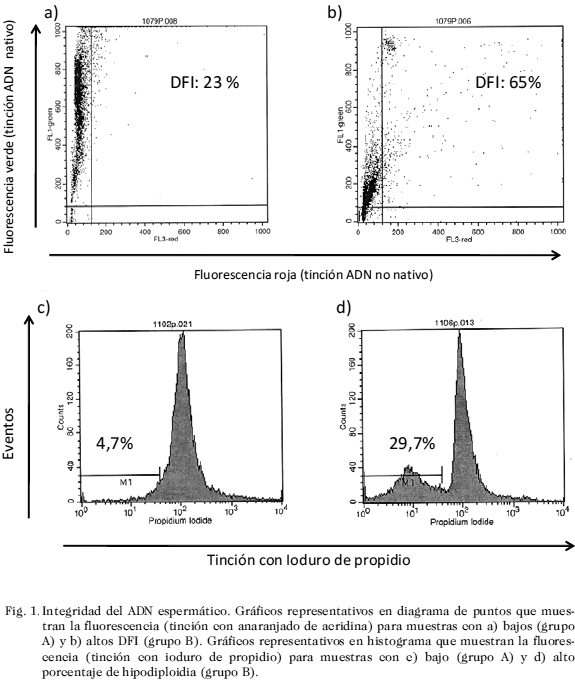
donde DFI es el Índice de fragmentación, IFR es la intensidad de la fluorescencia Roja (Figs. 1a y 1b).
Para establecer los parámetros apropiados en el citómetro y evitar sesgos de instrumentación, se utilizaron muestras de eyaculado con características seminales normales y con valores de DFI menor a 30%, como referencias para calibrar el voltaje de los fotomultiplicadores. Una vez determinados estos parámetros, los mismos fueron mantenidos como molde paras todos los ensayos subsiguientes y comprobados semanalmente con las muestras normales mencionadas.
2) Análisis de la muerte celular mediante la tinción con IP: una segunda alícuota de las muestras fijadas en etanol y tratadas de igual manera que las muestras para SCSA, fue utilizada para este análisis, con la diferencia de que la tinción con AA fue sustituida mediante la adición de 10 µg/mL de IP (Santa Cruz Biotechnology Inc., Santa Cruz, CA, USA). Después de 10 minutos de incubación se procedió al análisis mediante citometría de flujo. Se analizaron un total de 20.000 eventos mediante histogramas, estableciéndose como punto de referencia que las muestras normales anteriormente referidas, mostraran un pico agudo predominante de fluorescencia (correspondiente al estadio G1 del ciclo celular) establecido para conveniencia a nivel de 102 canales de fluorescencia, en la escala logarítmica (Figs. 1c y 1d).
Los parámetros evaluados en este estudio fueron expresados en media ± 95% de intervalo de confianza (IC). Las diferencias entre los promedios de los grupos estudiados se analizaron usando la prueba t-student calculada con el programa Statgraphic Centurion XV.II. Se consideraron estadísticamente significativos los valores de p < 0,05. Las correlaciones fueron establecidas mediante regresión lineal, con un valor de significancia de p < 0,05.
RESULTADOS
La media de la edad del grupo examinado fue de 33±0.9 de intervalo de confianza (IC), con un rango entre 17 y 53 años de edad. En la Tabla I se resumen las características físicas del semen de los individuos estudiados.
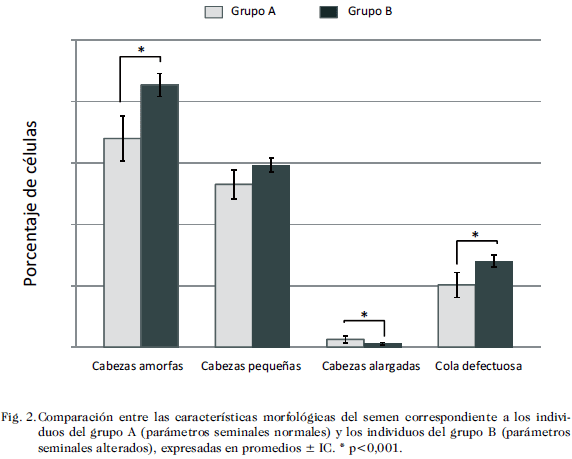
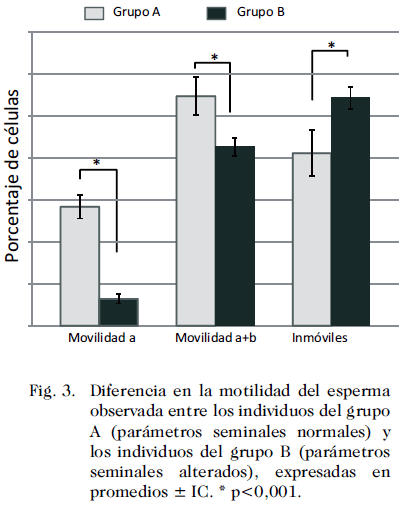
El promedio del volumen del semen fue de 3,29 mL (± 0,41 IC) para el grupo A y de 3,41 mL (±0,18 IC) para el grupo B. El promedio de la concentración espermática fue de 98,49x106/mL (±11,77×106/mL IC) para el grupo A y de 57,21×106/mL (±4,87×106/mL IC) para el grupo B. El promedio de espermatozoides con morfología normal fue de 54,83 (±3,58 IC) para el grupo A y de 43,7 (±1,18 IC) para el grupo B. La Fig. 2 que se refiere a las comparaciones de las características morfológicas entre los grupos A y B, mostraron diferencias estadísticamente significativas en lo que respecta a los parámetros: cabezas amorfas, cabezas alargadas y colas defectuosas (17 ± 1,85 vs 21,36 ± 0,94; 13,27 ± 1,19 vs 14,82 ± 0,57 y 0,63 ± 0,28 vs 0,29 ± 0,09, respectivamente) (p< 0,01). Cuando se compararon los parámetros de motilidad entre los grupos A y B, se observó claramente que los pacientes del grupo B tenían alterada la movilidad progresiva lenta y la rápida, la media del porcentaje de motilidad tipo “a” fue de 28,83 (±2,81 IC) para el grupo A y de 6,38 (±1,18 IC) para el grupo B, y la suma de la motilidad de tipo “a + b” fue de 54,73 (±5,47 IC) para el grupo A y de 42,63 (± 2,58 IC) para el grupo B, mostrando un mayor número de espermatozoides inmóviles, al compararlos con los individuos del grupo A (24,51 ± 4,62 vs 54,25 ± 2,56) (Fig. 3, p < 0,05).
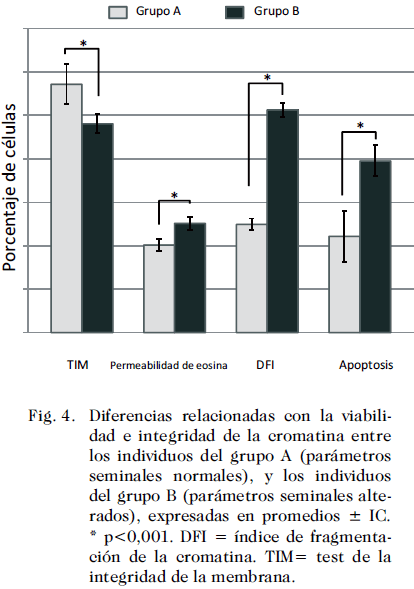
El análisis de la viabilidad examinada en este estudio a través de la evaluación de la integridad de la membrana (TIM) y la permeabilidad del colorante vital Eosina, mostraron una vitalidad menor en el grupo B (48,9 ± 2,22 IC y 25,11 1,5 IC, respectivamente) en comparación con el grupo A (57,15± 4,66 IC y 20,15±1,44 IC, respectivamente, p < 0,05) (Fig. 4). La integridad de la cromatina analizada mediante el DFI y la muerte celular visualizada a través de la tinción con IP son mostradas en las Figs. 4 y 1. Este estudio demuestra claramente que para ambas técnicas aplicadas, existen diferencias muy marcadas y estadísticamente significativas entre ambos grupos, de tal manera que el porcentaje de DFI para el grupo A fue de 24,9 ± 1,34 IC, mientras que para el grupo B fue de 51,23 ± 1,55 IC, p < 0,001). De igual manera el porcentaje de hipodiploidia fue mayor en el grupo B (39,50 ± 3,47 IC), en comparación con el grupo A (22,13 ± 5,86 IC), p<0,01.
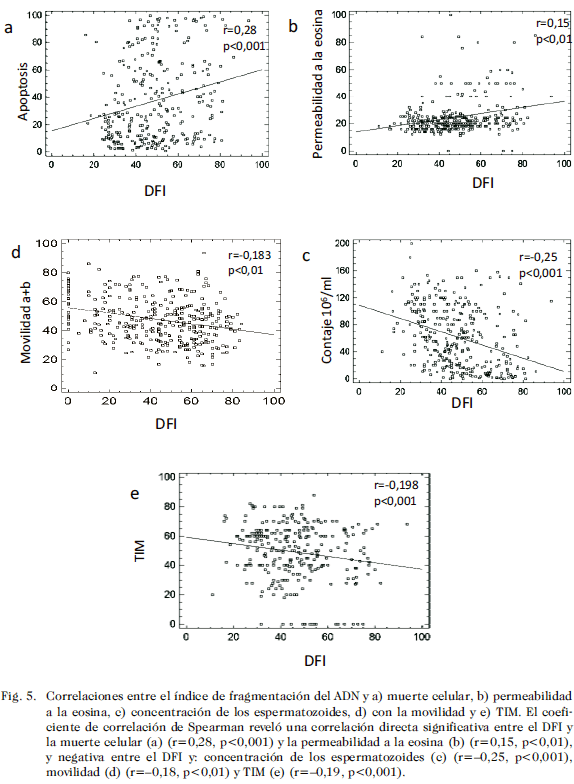
Estas observaciones se ven reforzadas cuando se logran establecer correlaciones importantes entre diversos parámetros explorados, de las cuales se pueden resaltar: correlaciones negativas entre el DFI y: motilidad (r=–0,183, p<0,01), concentración de espermatozoides (r=–0,25, p<0,001) y el TIM (r=–0,198, p<0,001). Mientras que las correlaciones fueron positivas entre el DFI y: muerte celular (r=0,28, p<0,001) y permeabilidad a la eosina (r=0,15, p<0,01) (Fig. 5).
DISCUSIÓN
Con la intención de realizar una evaluación integral de la calidad del semen de pacientes que consultan por infertilidad, se llevó a cabo un estudio observacional descriptivo durante dos años, de 341 muestras de semen humano y se combinaron la evaluación de las variables convencionales utilizadas para analizar las características morfológicas de los espermatozoides, con dos técnicas que miden la integridad de la cromatina espermática, a saber: la propensión a la fragmentación de la cromatina, también conocida como SCSA expresada a través del DFI y la muerte celular como una medida de la degradación del ADN, detectada por la tinción con ioduro de propidio.
Los resultados del presente trabajo mostraron diferencias estadísticamente significativas entre el semen con espermatozoides con morfología normal mayor o igual a 50% y los especímenes que presentaron morfología espermática normal menor de 50%, los cuales también presentaron alteraciones en la concentración, motilidad, viabilidad y en la integridad del ADN. Las alteraciones en la morfología de los espermatozoides, particularmente de la cabeza y la región intermedia, no son infrecuentes y carecen de especificidad para atribuirlas con certeza a alguna patología del testículo o de las vías seminales. Estas alteraciones se observan en pacientes con oligozoospermia y en menor proporción en semen con concentración normal de espermatozoides. Se ha comprobado que una pequeña proporción de espermatozoides móviles (menor de 25%) de hombres fértiles, tiene capacidad para unirse in vitro a la zona pelúcida; tal capacidad está relacionada con la morfología de la cabeza espermática (31). La disminución de la movilidad espermática (astenozoospermia) frecuentemente acompaña a la oligozoospermia, y son alteraciones del semen que revelan una espermatogénesis defectuosa (11). La oligozoospermia junto con la teratozoospermia son hallazgos usuales en pacientes con varicocele, una de las causas importantes de infertilidad masculina (32, 33).
Tal y como ha sido previamente reportado (34-38), el estudio de la estabilidad de la cromatina espermática ha puesto en evidencia correlaciones significativas entre la integridad del ADN espermático y parámetros estándar del semen, tales como: motilidad, concentración de espermatozoides, TIM, y permeabilidad a la eosina. Basada en estos y otros estudios, ha sido ampliamente comprobada una correlación positiva entre la integridad de la cromatina espermática y la fertilidad, adjudicándosele un valor pronóstico en el resultado de la fecundación y posible éxito de la gestación (20-22, 34, 39). Sin embargo, otros estudios no han mostrado correlaciones significativas entre los niveles de integridad de la cromatina y los parámetros del semen, lo que cuestiona el valor predictivo de este ensayo y su implementación como prueba de rutina en la evaluación de la fertilidad masculina (23, 24, 40).
Los resultados presentes muestran además una correlación positiva elevada entre el DFI y la muerte celular medida a través de la tinción con IP del ADN hipodiploide. Dos posibles interpretaciones de esta observación son: 1.- Un porcentaje de la muerte celular es explicada por la predisposición de la cromatina a ser degradada, observación que es reforzada por el hecho de que el DFI detecta la susceptibilidad a la degradación del ADN, mientras que la muerte celular es una medida directa de la degradación. Por cuanto este porcentaje no explica la totalidad del fenómeno de muerte, otros factores deberán ser considerados como causales para inducir muerte celular, como por ejemplo el estrés oxidativo (41). Esta observación es corroborada por otros estudios donde se ha evidenciado una asociación entre la apoptosis detectada por túnel y la denaturacion del ADN (SCSA) (42) y otras técnicas empleadas en el estudio de la fragmentación del ADN espermático (43). 2.- Contrariamente, un porcentaje del ADN espermático propenso a la degradación podría explicarse como producto de la apoptosis, tal y como ha sido sugerido recientemente (28). Sin embargo, a diferencia del mencionado estudio, en el presente trabajo se ha evaluado un fenómeno tardío e irreversible, de muerte genética de la célula y no de propensión a la misma. Se requieren nuevos estudios para evaluar los eventos tempranos del proceso de muerte celular.
Otra correlación importante que se pone en evidencia en este estudio, es la existente entre ambos parámetros de la integridad de la cromatina y la motilidad de los espermatozoides, la cual es de naturaleza inversa. Esta observación se ve sustentada porque los espermatozoides que han sufrido daño en el ADN durante su trayectoria desde el testículo hasta ser eyaculados, experimentan reducción de su motilidad (44). Es precisamente durante esta etapa en donde el empaquetamiento apropiado del material genético dentro del núcleo espermático es crítico para proteger al genoma del espermatozoide de agresiones externas (45). Otra observación importante de este estudio, que involucra trastornos de movilidad de los espermatozoides y su conexión con el daño en el ADN, es la referente a una asociación positiva entre la muerte celular y el daño de la pieza intermedia de los espermatozoides, por cuanto la motilidad del espermatozoide está relacionada con el volumen mitocondrial dentro de dicho segmento (46).
En conclusión los resultados del presente estudio mostraron estrechas correlaciones entre la morfología, la concentración y la movilidad espermática, con la integridad del ADN de los espermatozoides, lo cual refuerza el criterio de que el análisis de la integridad de la cromatina (incluidas tanto la susceptibilidad como la degradación propiamente dicha del ADN) pudiera contribuir con los estudios convencionales del semen en la evaluación de la fertilidad masculina.
AGRADECIMIENTO
Los autores desean expresar su agradecimiento al Consejo de Desarrollo Científico, Humanístico y Tecnológico (CDCHT) de la Universidad de Los Andes subvención CDCHT-ULA Código M-965-08-07-B.
REFERENCIAS
1. Irvine DS. Epidemiology and aetiology of male infertility. Hum Reprod 1998; 13 (Suppl 1): 33-44. [ Links ]
2. Bhasin S, de Krester DM, Baker HW. Pathophysiology and natural history of male infertility. J Clin Endocrinol Metab 1994; 79:1525-1529. [ Links ]
3. World Health Organization. Infertility: a tabulation of available data on prevalence of primary and secondary infertility. Geneva. WHO Programs on Maternal and Child Health and Family Planning, Division of Family Health, 1991. [ Links ]
4. de Krester DM, Baker HWG. Human Infertility: The Male Factor. En: Adashi EY, Rock JA, Rosenwaks Z (Eds). Reproductive Endocrinology, Surgery, and Technology. Philadelphia, PA. Lippincott-Raven. 1996: 2031-2061. [ Links ]
5. Kerr JB, de Krester DM. Functional Morphology of the Testis. En: Endocrinology, De Groot LJ, Jameson JL (Eds), 5a. Edición. Philadelphia, PA. Elsevier Saunders. 2006:3089-3120. [ Links ]
6. Baker HWG. Clinical Management of Male Infertility. En: Endocrinology, De Groot LJ, Jameson JL (Eds), 5a. Edición. Philadelphia, PA. Elsevier Saunders. 2006:3199- 3225. [ Links ]
7. Burrows PJ, Schrepferman CG, Lipshultz LI. The infertile male. Comprehensive office evaluation in the new millenium. Urol Clin N Am 2002; 29:873-894. [ Links ]
8. MacLeod J. The significance of deviation in human sperm morphology. En: Rosemberg E, Paulsen CA (Eds). The Human Testis. New York, NY. Plenum Press; 1970. [ Links ]
9. Menkveld R, Stander FSH, Kotze TWW, Kruger TF, Van Zyl JA. The evaluation of morphological characteristics of human spermatozoa according to stricted criteria. Hum Reprod 1990; 5:586-592. [ Links ]
10. Mortimer D, Menkveld R. Sperm morphology Assessment-Historical Perspectives and Current Opinions. J Androl 2001; 22: 192-205. [ Links ]
11. WHO. Laboratory manual for the examination of human semen and sperm-cervical mucus interaction. Fourth edition. Cambridge University Press 1999. [ Links ]
12. Agarwal SA, Said TM. Role of sperm chromatin Abnormalities and DNA damage in male infertility. Human Reprod Update 2003; 9:331-345. [ Links ]
13. Ollero M, Gil-Guzman E, Lopez MC, Sharma RK, Agarwal A, Larson K, Evenson D, Thomas AJJ, Alvarez JG. Characterization of subsets of human spermatozoa at different stages of maturation: implications in the diagnosis and treatment of male infertility. Hum Reprod 2001; 16: 1912-1921. [ Links ]
14. Irvine S, Twigg JP, Gordon EL, Fulton L, Milne PA, Aitken RJ. DNA integrity in human spermatozoa: relationship with semen quality. J Androl 2000; 31:33-44. [ Links ]
15. Lopes S, Sun JG, Jurisikova A, Meriano J, Casper RF. Sperm desoxyribonucleic acid fragmentation is increased in poor quality semen samples and correlates with failed fertilization in intracytoplasmic sperm injection. Fertil Steril 1998; 69:528- 532. [ Links ]
16. Evenson DP, Darzynkiewicz Z, Melamed MR. Relation of mammalian sperm chromatin heterogeneity to fertility. Science 1980; 210:1131-1133. [ Links ]
17. Molina J, Castilla JA, Gil T, Hortas ML, Vergara F, Herruzo A. Influence of incubation on the chromatin condensation and nuclear stability of human spermatozoa by flow cytometry. Hum Reprod 1995; 10: 1280-1286. [ Links ]
18. Evenson DP, Thompson L, Jost L. Flow cytometric evaluation of boar semen by the sperm chromatin structure assay as related to cryopreservation and fertility. Theriogenology 1994; 41: 637-651. [ Links ]
19. Evenson D, Jost L. Sperm chromatin structure assay: DNA denaturability. Methods Cell Biol 1994; 42 Pt B: 159-176. [ Links ]
20. Spanò M, Cordelli E, Leter G, Lombardo F, Lenzi A, Gandini L. Nuclear chromatin variations in human spermatozoa undergoing swim-up and cryopreservation evaluated by the flow cytometric sperm chromatin structure assay. Mol Hum Reprod 1999; 5:29-37. [ Links ]
21. Larson-Cook KL, Brannian JD, Hansen KA, Kasperson KM, Aamold ET, Evenson DP. Relationship between the outcomes of assisted reproductive techniques and sperm DNA fragmentation as measured by the sperm chromatin structure assay. Fertil Steril 2003; 80: 895-902. [ Links ]
22. Evenson D, Wixon R. Meta-analysis of sperm DNA fragmentation using the sperm chromatin structure assay. Reprod Biomed Online 2006; 12:466-472. [ Links ]
23. Bungum M, Spanò M, Humaidan P, Eleuteri P, Rescia M, Giwercman A. Sperm chromatin structure assay parameters measured after density gradient centrifugation are not predictive for the outcome of ART. Hum Reprod 2008; 23:4-10. [ Links ]
24. Gandini L, Lombardo F, Paoli D, Caruso F, Eleuteri P, Leter G, Ciriminna R, Culasso F, Dondero F, Lenzi A, Spanò M. Full-term pregnancies achieved with ICSI despite high levels of sperm chromatin damage. Hum Reprod 2004; 19:1409-1417. [ Links ]
25. Meseguer M, Santiso R, Garrido N, Gil-Salom M, Remohí J, Fernandez JL. Sperm DNA fragmentation levels in testicular sperm samples from azoospermic males as assessed by the sperm chromatin dispersion (SCD) test. Sperm DNA fragmentation levels in testicular sperm samples from azoospermic males as assessed by the sperm chromatin dispersion (SCD) test. Fertil Steril 2008; 92(5): 1638-1645. [ Links ]
26. Riccardi C, Nicoletti I. Analysis of apoptosis by propidium iodide staining and flow cytometry. Nat Protoc 2006; 1: 1458-1461. [ Links ]
27. Pollack A, Ciancio G. Cell cycle phase-specific analysis of cell viability using Hoechst 33342 and propidium iodide after ethanol preservation. Methods Cell Biol 1990; 33:19-24. [ Links ]
28. Mahfouz RZ, Sharma RK, Said TM, Erenpreiss J, Agarwal A. Association of sperm apoptosis and DNA ploidy with sperm chromatin quality in human spermatozoa. Fertil Steril 2009; 91: 1110-1118. [ Links ]
29. WHO laboratory manual for the examination of human semen and semen-cervical mucus interaction. Second edition. World Health Organization. Cambridge University Press (Edit). 1987. [ Links ]
30. Enginsu ME, Dumoulin JC, Pieters MH, Bras M, Evers JL, Geraedts JP. Evaluation of human sperm morphology using strict criteria after Diff-Quik staining: correlation of morphology with fertilization in vitro. Hum Reprod 1991; 6:854-858. [ Links ]
31. Liu DY, Garrett C, Baker HW. Low proportions of sperm can bind to the zona pellucida of human oocytes. Hum Reprod 2003; 18:2382-2389. [ Links ]
32. Richardson I, Grotas AB, Nagler HM. Outcomes of varicocelectomy treatment: an updated critical analysis. Urol Clin North Am 2008; 35:191-209. [ Links ]
33. Schlesinger MH, Wilets IF, Nagler HM. Treatment outcome after varicocelectomy. A critical analysis. Urol Clin North Am 1994; 21:517-529. [ Links ]
34. Evenson DP, Jost LK, Marshall D, Zinaman MJ, Clegg E, Purvis K, de Angelis P, Claussen OP. Utility of the sperm chromatin structure assay as a diagnostic and prognostic tool in the human fertility clinic. Hum Reprod 1999; 14: 1039-1049. [ Links ]
35. Muratori M, Piomboni P, Baldi E, Filimberti E, Pecchioli P, Moretti E, Gambera L, Baccetti B, Biagiotti R, Forti G, Maggi M. Functional and ultrastructural features of DNA-fragmented human sperm. J Androl 2000; 21:903-912. [ Links ]
36. Sills ES, Fryman JT, Perloe M, Michels KB, Tucker MJ. Chromatin fluorescence characteristics and standard semen analysis parameters: correlations observed in andrology testing among 136 males referred for infertility evaluation. J Obstet Gynaecol 2004; 24: 74-77. [ Links ]
37. Moskovtsev SI, Willis J, Azad A, Mullen JB. Sperm DNA integrity: correlation with sperm plasma membrane integrity in semen evaluated for male infertility. Arch Androl 2005; 51:33-40. [ Links ]
38. Dorado-Silva M, Migueles B, González M, Hebles M, Aguilera L, Sánchez P, Sánchez F, Rodríguez A, Lara JA, Meyer M, Cruz N. Relación entre los parámetros seminales y la fragmentación del ADN espermático. Rev Int Androl 2008; 6:14-17. [ Links ]
39. Evenson DP, Wixon R. Data analysis of two in vivo fertility studies using Sperm Chromatin Structure Assay-derived DNA fragmentation index vs. pregnancy outcome. Fertil Steril 2008; 90: 1229-1231. [ Links ]
40. Muriel L, Meseguer M, Fernández JL, Alvarez J, Remohí J, Pellicer A, Garrido N. Value of the sperm chromatin dispersion test in predicting pregnancy outcome in intrauterine insemination: a blind prospective study. Hum Reprod 2006; 21:738-744. [ Links ]
41. Makhlouf AA, Niederberger C. DNA integrity tests in clinical practice: it is not a simple matter of black and white (or red and green). J Androl 2006; 27:316-323. [ Links ]
42. Zini A, Bielecki R, Phang D, Zenzes MT. Correlations between two markers of sperm DNA integrity, DNA denaturation and DNA fragmentation, in fertile and infertile men. Fertil Steril 2001; 75: 674-677. [ Links ]
43. Chohan KR, Griffin JT, Lafromboise M, De Jonge CJ, Carrell DT. Comparison of chromatin assays for DNA fragmentation evaluation in human sperm. J Androl 2006; 27:53-59. [ Links ]
44. Edwards RG. New outlooks on IVF spermatozoa. Reprod Biomed Online 2003; 5: 89-91. [ Links ]
45. Zini A, Libman J. Sperm DNA damage: clinical significance in the era of assisted reproduction. CMAJ 2006; 175: 495-500. [ Links ]
46. Kao SH, Chao HT, Wei YH. Multiple deletions of mitochondrial DNA are associated with the decline of motility and fertility of human spermatozoa. Mol Hum Reprod 1998; 4: 657-666. [ Links ]












 uBio
uBio