Investigación Clínica
versión impresa ISSN 0535-5133versión On-line ISSN 2477-9393
Invest. clín v.51 n.4 Maracaibo dic. 2010
Efecto del sulodexide sobre la capacidad de relajación y alteraciones estructurales de la arteria aorta en ratas diabéticas por estreptozotocina.
José Vásquez 1, Yaira Mathison 1, Eduardo Romero-Vecchione 1 y Claudia Suárez 2.
1 Laboratorio de Estudios Cardiovasculares, Cátedra de Farmacología, Escuela de Medicina “José María Vargas” e
2 Instituto de Anatomía Patológica. Facultad de Medicina, Universidad Central de Venezuela, Caracas, Venezuela.
Autor de correspondencia: José Vásquez. Laboratorio de Estudios Cardiovasculares, Cátedra de Farmacología, Escuela de Medicina José María Vargas, Facultad de Medicina, Universidad Central de Venezuela. Caracas, Venezuela. Teléfono: 0416- 4210489. Correo electrónico: jovivas43@yahoo.es
Resumen.
La disfunción endotelial (DE) se presenta en pacientes con hipercolesterolemia, hipertensión arterial, obesidad y diabetes mellitus. Evidencias sugieren un papel de los glicosaminoglicanos en la DE. Evaluamos el efecto del sulodexide (SLD), un glicosaminoglicano utilizado en el tratamiento de la albuminuria y la enfermedad isquémica en pacientes diabéticos, sobre la relajación arterial y los cambios morfológicos en un modelo experimental de diabetes tipo 1. La diabetes se indujo a ratas Sprague Dawley administrando estreptozotocina (STZ), 60 mg/kg, i.v. Los animales fueron distribuidos en los siguientes grupos: I= control, II= diabéticas, III: control + sulodexide, IV= diabéticas + sulodexide (15 mg/kg/día s.c). A los 3 meses fueron sacrificados, las aortas extraídas para evaluar la relajación vascular inducida por acetilcolina (Ach) y nitroprusiato de sodio en anillos precontraídos con fenilefrina. Fueron evaluadas histológicamente mediante microscopía de luz y coloraciones diversas. El SLD in vitro no modificó la tensión basal de los anillos arteriales en reposo o precontraídos con fenilefrina. La diabetes disminuyó la capacidad de relajación arterial en respuesta a la Ach en un 28,8-35,1% vs control, efecto que fue prevenido por SLD. No se observó diferencia significativa en la relajación inducida por nitroprusiato sódico entre los grupos. El estudio histológico en los animales diabéticos mostró alteraciones estructurales, particularmente en la íntima y la adventicia, cambios que fueron prevenidos por el tratamiento con SLD. Nuestros resultados apoyan la potencial utilidad terapéutica del SLD en el tratamiento de la disfunción endotelial.
Palabras clave: diabetes, sulodexide, disfunción endotelial, estreptozotocina.
Effect of sulodexide on aortic vasodilation capacity and associated morphological changes in rats with streptozotocin-induced diabetes.
Abstract.
Endothelial dysfunction (ED) is observed in patients with hypercholesterolemia, arterial hypertension, obesity and diabetes mellitus. Recent evidences suggest the involvement of glycosaminoglycans(GSG) in ED. We evaluated the effect of sulodexide (SLD), a natural GSG used in albuminuria and ischemic diabetes treatment, on arterial relaxation and vascular morphological changes in a diabetic type I model. Diabetes was induced, in Sprague-Dawley rats by streptozotocine (STZ) administration, 60 mg, iv. Rats were divided into four groups; I: control, II: diabetics, III: control + SLD, IV: diabetics treated with SLD (15 mg/day). After three months, phenylephrine precontracted aortic rings were used to evaluate acetylcholine (ACh) and sodium nitroprusside (NPS) relaxation capacities. Light microscopy of aorta was done with several staining procedures. In vitro, SLD did not change smooth muscle tone in resting or phenylephrine precontracted aortic rings. In diabetic rats, ACh relaxation was 28.8-35.1% lower than in control rats. Diabetic rats treated with SLD showed aortic ACh relaxation similar to control rats. No significative statistical difference was found in endothelium-independent NPS relaxation, between the different groups. Light microscopy histological studies revealed important morphological alterations, particularly in intima and adventitia layers of aortic artery; those changes were dramatically reversed in SLD treated rats. Our experiments support the conclusion that SLD is a potential drug for improving endothelial dysfunction in diabetes.
Key words: diabetes, sulodexide, endothelial dysfunction, streptozotocin.
Recibido: 27-10-09. Aceptado: 22-04-10
INTRODUCCIÓN
Las células endoteliales cumplen un papel fundamental en el mantenimiento de la homeostasis a través de la síntesis de sustancias vasoactivas que modulan el tono vascular, inhiben la agregación plaquetaria, la proliferación de células musculares lisas y activan la fibrinólisis (1, 2). En la disfunción endotelial (DE), el endotelio pierde la capacidad de regular el comportamiento fisiológico del lecho vascular, condición ésta, que ha sido implicada como uno de los eventos iniciales en la patogénesis de la ateroesclerosis (3). Entre las causas que producen DE podemos citar la elevación y oxidación de las lipoproteínas de baja densidad, el aumento de los radicales libres, el hábito de fumar, la hipertensión arterial, alteraciones genéticas y la elevación de la homocisteína plasmática (4, 5). La diabetes mellitus (DM), enfermedad que cursa con alteraciones del metabolismo de los carbohidratos, grasas y proteínas, junto con un déficit absoluto o relativo de la secreción de insulina o grados variables de resistencia a esta hormona, también se asocia a DE. La mayoría de pacientes con DM de larga evolución presentan complicaciones microangiopáticas renales y oculares, así como macroangiopáticas con compromiso de arterias coronarias, de la circulación periférica y neuropatía (6-8).
En 1989, Deckert y col. propusieron la existencia de una correlación entre la disfunción vascular generalizada y la microalbuminuria, con alteración de las enzimas involucradas en el metabolismo de componentes aniónicos de la matriz extracelular, y pérdida de proteoglicanos. La aparición de proteinuria coincide con el engrosamiento de la membrana basal glomerular y la reducción de las cargas aniónicas, debido a la glucosilación no enzimática de proteínas de la membrana basal o alteraciones metabólicas de los glicosaminoglicanos (GSG), lo que determina un aumento anormal de permeabilidad (9-11). El tratamiento con GSG mejora la proteinuria en estos pacientes (12-14).
El objetivo de este estudio fue evaluar el efecto del sulodexide (SLD), sobre las alteraciones producidas por la diabetes experimentalmente inducida mediante la administración de estreptozotocina, sobre la vasodilatación arterial dependiente e independiente del endotelio y su correlación con cambios histológicos visibles en la aorta de ratas. El sulodexide, GSG aislado y purificado de la mucosa intestinal del cerdo ha demostrado su efectividad en el tratamiento de la enfermedad isquémica, debido a su acción fibrinolítica, antitrombótica, hemorreológica y protectora del endotelio (15, 16). Por esta razón, es posible que su administración exógena pueda mejorar algunas variables asociadas a la diabetes; específicamente, nos propusimos investigar si el SLD (Vessel Due F, Laboratorios ELMOR®), es capaz de modificar el tono vascular y prevenir las alteraciones de la respuesta vasodilatadora, junto a los cambios morfológicos que se producen en las arterias de ratas con diabetes experimentalmente inducida por estreptozotocina.
MATERIALES Y MÉTODOS
Se utilizaron ratas de la cepa Sprague-Dawley, machos, de 200 a 250g de peso, las cuales se dividieron en los siguientes grupos (n=10-12/grupo): Grupo I: control, Grupo II: diabetes inducida por estreptozotocina, Grupo III: tratadas con sulodexide. Grupo IV: diabéticas tratadas con sulodexide.
Inducción de la diabetes
La diabetes fue inducida mediante la administración de una inyección única de estreptozotocina (Sigma Chemical Co, St. Louis, MO), 60 mg/Kg de peso, en la vena caudal. El incremento de la glicemia fue confirmado a los 2 y 7 días posteriores a la administración de estreptozotocina, mediante la determinación de los niveles sanguíneos de glucosa utilizando un método enzimático (Glucosa HK Reagent, Bayer), y posterior a ello los animales fueron asignados al azar a los diferentes grupos de tratamiento.
Tratamiento con sulodexide
El tratamiento con sulodexide, en las ratas del grupo III como en los animales diabéticos, se inició a los 7 días posteriores a la inyección de estreptozotocina, administrándolo por vía subcutánea, a la dosis de 15 mg/Kg/día durante cinco días a la semana, por tres meses.
Reactividad de los anillos de aorta
Bajo anestesia con pentobarbital sódico por vía i.p. a la dosis de 30 mg/Kg, se practicó toracotomía para extraer los dos tercios proximales de la aorta torácica. De ella se obtuvo un segmento de 2 cm de longitud, el cual fue suspendido en estribos metálicos para el registro de los cambios de tensión muscular utilizando un transductor de fuerza conectado a un polígrafo marca LETICA SA (España). Los anillos fueron colocados en baños para órganos aislados, con una tensión basal de 1,5 g en solución de Krebs-Henseleitt (pH 7,4) de la siguiente composición (mM): NaCl 118, 0, KCl 4,7, CaCl2 2,5, MgSO4 7H2O 1,2, Na2HPO4 1,2, NaHCO3 25, glucosa 11,1. La solución se mantuvo a 37 ºC gasificada con 02 95% y CO2 5%. Después de un periodo de estabilización de 30 min se evaluó la capacidad de relajación de los anillos arteriales mediante curva dosis-respuesta acumulativa a cloruro de acetilcolina (ACh) y nitroprusiato sódico (NPS) en todos los grupos experimentales, después de la precontracción con fenilefrina a una dosis equivalente al 75% de su contracción máxima en curva dosis respuesta realizada previamente.
Estudio histológico de la aorta (microscopía óptica)
Muestras de segmentos de aorta de cada grupo experimental, fueron fijadas el solución de formaldehído al 10%, e incluidas en parafina. Las secciones fueron teñidas con las coloraciones combinadas de: hematoxilina-eosina, reacción histoquímica de ácido periódico Schiff (PAS)/azul alciano y método de Verhoff/van Gieson para fibras elásticas.
Estadística
Los datos están expresados como media ± error estándar. Las diferencias entre las medias fueron evaluadas con la prueba t de Student para datos no pareados y la prueba de ANOVA fue utilizada para evaluar las diferencias entre las mediciones de los diferentes grupos. El nivel de significancia se consideró para p<0,05.
RESULTADOS
Después del tratamiento con estreptozotocina la glicemia plasmática fue significativamente mayor (332 ± 26 mg/dL) comparada con el grupo control (92 ± 11mg/dL), analizado mediante t de Student, p< 0,01 vs control.
Reactividad de la aorta
El sulodexide, añadido directamente al baño de órgano aislado en concentraciones crecientes de 10–7, 10–5, y 10–3 M no modificó la tensión muscular de los anillos arteriales en reposo o precontraidos con fenilefrina.
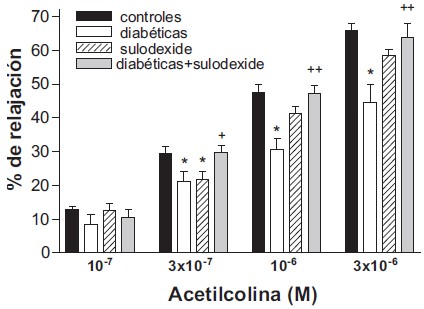
La ACh en dosis crecientes de 1×10–7, 3×10–7, 1×10–6 y 3×10–6 M, produjo relajación dosis dependiente de los anillos arteriales precontraídos con fenilefrina (Fig. 1).
Fig. 1. Porcentaje de relajación de la aorta torácica previamente contraída con noradrenalina en respuesta a la administración de acetilcolina. Los datos se representan como la media ± EEM de 6-8 ratas, analizados por ANOVA *p<0,01 vs control, + p< 0,05; ++ p< 0,01 vs diabéticas.
En el grupo II (diabéticas), la relajación fue significativamente menor comparada con el grupo control (p <0,05), sin embargo, en el grupo IV (diabéticas tratadas con sulodexide), la relajación fue similar al grupo control; no hubo diferencias estadísticamente significativas entre ambos grupos (Fig. 1). La relajación en el grupo III fue ligeramente menor al control sin diferencias significativas.
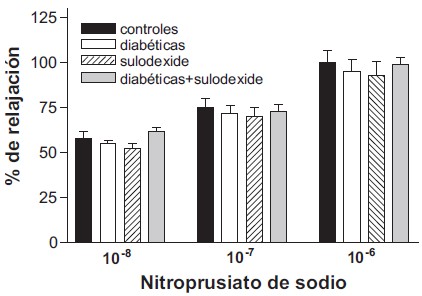
El NPS, un agente vasodilatador independiente del endotelio, en dosis de 10–8, 10–7 y 10–6 M, produjo relajación de los anillos arteriales, de magnitud similar en todos los grupos experimentales (p>0,05) (Fig. 2).
Fig. 2. Porcentaje de relajación de la aorta torácica previamente contraída con noradrenalina en respuesta a la administración de nitroprusiato de sodio. Los datos se representan como la media ± EEM de 6-8 ratas, analizados por ANOVA.
Hallazgos histopatológicos (microscopio de luz)
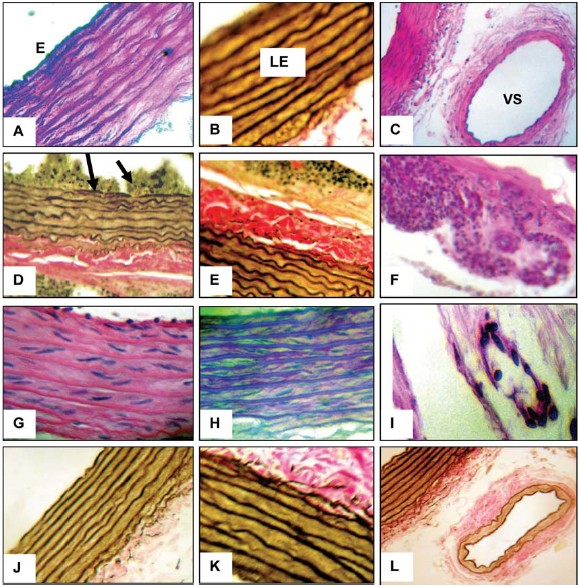
El estudio histológico de la pared aórtica en los cuatro grupos analizados, se realizó en los promedios de 53 secciones histológicas por caso. En todos los grupos se evidenció solo el endotelio como el elemento más observable de la íntima, la capa media y la adventicia. El número de láminas elásticas en todos los grupos estuvo entre 8 y 12. En ningún grupo se observaron alteraciones de las fibras musculares ni de la sustancia fundamental. Los aspectos histopatológicos más relevantes están representados en la Fig. 3.
Fig. 3. Microfotografías que muestran los hallazgos histopatológicos de las aortas de los casos estudiados. Grupo I: (Paneles A, B y C, Coloraciones combinadas de Pas/Azul Alciano, de Verhoeff y Hematoxilina-eosina, 100X, 400 X y 100X). Microfotografías que exponen los aspectos de pared aórtica normal. E (endotelio); VS (vasa-vasorum); LE (láminas elásticas). Las secciones histológicas de aorta del Grupo II, mostraron cambios histopatológicos en las tres capas aórticas: en el endotelio (Panel D, Col de Verhoeff, 200X), disrupción y trombosis reciente (flechas) y en la adventicia (Panel E, Col de Verhoeff, 200X), fibrosis con denso infiltrado inflamatorio (Panel F, Col Hematoxilina-eosina, 200X). Grupo III: (Panel G, col de Hematoxilina- eosina, 400 X); microfotografía que muestra el aspecto normal de las láminas elásticas y fibras musculares lisas (FM). En el Panel H (col de Pas/Azul Alciano, 200X y 400 X) se observa sustancia fundamental normal (azul) y láminas elásticas discretamente engrosadas y elongadas, fuertemente teñidas con azul-Alciano(recuadro), lo que expresa la presencia de glicosaminoglicanos ácidos y escasos neutros, de color rosado). En el Panel I, se observa un vaso venoso adventicial normal (Col Hematoxilina-eosina 200X). Grupo IV: (Paneles J, K y L, col de Verhoeff. 100X, 400X y 100X). Se muestra el aspecto histológico normal de la pared aórtica con discreta disminución de espesor de la capa media y láminas elásticas elongadas.
En el Grupo I (Control): (paneles A, B y C), las secciones histológicas de pared aórtica mostraron estructura normal. En el Grupo II. (Ratas diabéticas): se observaron alteraciones de la estructura de pared aórtica especialmente en el endotelio y adventicia. En uno de los segmentos arteriales, la luz arterial estaba obstruida totalmente por un trombo reciente. El endotelio presentó edema y disrupción focal con adhesión de trombos recientes (Panel D). La capa media era de espesor normal. La adventicia (Panel E), estaba engrosada por fibrosis, áreas de hemorragia e infiltrado inflamatorio linfomononuclear focal densamente dispuesto alrededor de los vasa-vasorum, algunos de los cuales mostraron engrosamiento de la capa media y adventicia (Panel F). Grupo III (Ratas tratadas con sulodexide) las secciones histológicas de pared aórtica mostraron preservación de la estructura parietal y luminal con discretos cambios observados en la capa media, donde las láminas elásticas se muestran aparentemente elongadas y engrosadas (Panel G), las cuales se tiñeron intensamente con el Azul-alciano (recuadro) expresando la presencia de glicosaminoglicanos ácidos con escasa presencia de los neutros (color rosado, Schiff positivo). Grupo IV (Ratas diabéticas tratadas con suloxide). Las secciones histológicas mostraron pared aórtica sin cambios estructurales importantes, con aparente disminución del grosor de la capa media. (Paneles J y K). Las láminas elásticas están discretamente alongadas y en la adventicia, se observaron vasos arteriales y venosos normales.
DISCUSIÓN
Los glicosaminoglicanos (GAGs), principalmente el heparan sulfato, son sintetizados en las células endoteliales y mesangiales, y después de un proceso de sulfatación a nivel del aparato de Golgi, son incorporados en la matriz extracelular de glomérulo y de las grandes arterias donde contribuyen a mantener la integridad estructural de la membrana basal y de la pared vascular (17).
En la diabetes se ha reportado una reducción generalizada de las cargas negativas de la matriz extracelular y de las membranas plasmáticas, asociada a disminución del contenido de heparan sulfato o a cambios en su grado de sulfatación (18-21). Esta alteración en la carga de la membrana basal, se traduciría en la pérdida de selectividad por carga y facilitaría una eliminación incrementada de proteínas en orina (20, 21).
Así en modelos experimentales de diabetes en ratas y en ratones, se ha encontrado una disminución en la síntesis de proteoglicanos en el glomérulo y disminución del contenido de proteoglicanos unidos a heparán sulfato en la membrana basal (22, 23). Igualmente se ha reportado que el contenido de GAGs está disminuido en los riñones y en la íntima de las aortas obtenidas por autopsia en pacientes diabéticos (24, 25), sugiriendo que las alteraciones del metabolismo del heparan sulfato no están restringida al riñón y pueden participar en patogénesis de otras complicaciones de la diabetes.
Se ha demostrado, que las alteraciones en el metabolismo de los GAGs, producidas en un modelo de diabetes experimental en ratas, son susceptibles de ser modificadas mediante la administración exógena de los mismos, con la consecuente restauración del funcionamiento normal del riñón (11, 26, 27). Así, se ha reportado que el tratamiento con SLD mejora la albuminuria y revierte las alteraciones de la permeabilidad de los vasos renales en animales diabéticos. El tratamiento con SLD previene el engrosamiento de la membrana basal glomerular y la reducción de la densidad de cargas aniónicas de esta membrana (11, 28, 29).
Adicionalmente se ha demostrado que bajas dosis de heparina fraccionada, la heparina de bajo peso molecular y el daparanoid, un glicosaminoglicano similar al heparan sulfato, disminuyen la proteinuria en pacientes con diabetes tipo 1 (12-14). La administración de sulodexide ha demostrado disminución de la excreción de albúmina en pacientes con diabetes tipo 1 y tipo 2 (30-36), sin embargo dos estudios recientemente programados para un seguimiento a largo plazo en pacientes con diabetes tipo 2, no corroboraron este efecto (37-39).
Sin embargo, la perdida de glicosaminoglicanos que se observa en la diabetes no se circunscribe exclusivamente al riñón. La hipótesis de Steno (9), sostiene que las alteraciones renales son reflejo de un proceso vascular generalizado que afecta glomérulo, retina y la intima de los grandes vasos simultáneamente.
Nuestros resultados soportan esta posibilidad, ya que el pretratamiento con sulodexide es capaz de prevenir la perdida de la respuesta vasodilatadora inducida por la diabetes en este modelo experimental. Estos hallazgos coinciden con lo reportado por Kristová y col. (40), quienes demostraron que el pretratamiento con sulodexide previene la alteración de la relajación por la administración de acetilcolina inducida por la diabetes, en la aorta y la arteria mesenterica en ratas con diabetes inducida por estreptozotocina, sugiriendo un posible papel protector del endotelio.
Este efecto no puede atribuirse a una modificación del flujo sanguíneo por acción directa del SLD sobre el músculo liso arterial o a la activación de receptores vasculares, ya que no se observaron cambios en la tensión del músculo liso vascular al añadir SLD directamente al baño de incubación, ya sea en condición de reposo o precontraído con fenilefrina.
Adicionalmente, nuestros resultados aportan evidencia de que la reducción en la capacidad de relajación dependiente de endotelio inducida por la diabetes parece ser el resultado de deficiencia en la producción de oxido nítrico (ON), ya que no se observaron diferencias entre los diferentes grupos al utilizar nitroprusiato de sodio, que es un conocido donador de ON. Este hallazgo sugiere que el efecto protector del endotelio ejercido por el sulodexide está relacionado con la preservación de la acción del ON.
Previamente se ha demostrado que el sulodexide estimula la actividad de la enzima sintasa del ON en la corteza renal de ratas controles y con diabetes tipo 1 (41), y que un incremento de ON es el responsable de la vasodilatación inducida por la heparina en la arteria mamaria interna de humanos (42) y en la arteria carótida de cerdo (43). Por otra parte, se ha demostrado que la degradación del ácido hialurónico en el glicocalix induce la pérdida de relajación ante el estrés mediado por el flujo en la arteria femoral aislada de perros y disminuye la liberación de ON (44), indicando una relación entre las funciones mediadas por ON y los GAGs.
El estudio histológico pone en evidencia el efecto protector del tratamiento con SUL sobre los cambios morfológicos producidos por la diabetes en los vasos arteriales, ya que produce la reversión completa de las alteraciones estructurales en las arterias de los animales diabéticos. Previamente se ha reportado un efecto antiproliferativo de la neoíntima en modelos in vitro (45), sin embargo por primera vez se demuestra la correlación entre los hallazgos histológicos y funcionales a nivel vascular, de manera similar a lo que se ha reportado en riñón (11, 26, 27). A este efecto puede estar contribuyendo la acción del sulodexide sobre la disminución del fibrinógeno plasmático y la prolongación del tiempo de coagulación, de acuerdo a lo reportado en la literatura (15, 16, 45-47).
Aun cuando el mecanismo de acción del sulodexide y otros GAGs no está totalmente esclarecido, nuestros resultados demuestran que la administración crónica de sulodexide protege a la aorta de los daños estructurales típicos producidos por la diabetes en este modelo experimental, y que su capacidad de prevenir la pérdida en la respuesta de relajación arterial en los animales diabéticos tratados con el fármaco, depende de la preservación de la acción del ON y puede contribuir en la prevención la disfunción endotelial presente en la diabetes.
AGRADECIMIENTOS
A la histotecnólogo Ayarit Villaroel Peniza y al personal del bioterio de la Escuela de Medicina José María Vargas. A Laboratorios ELMOR SA por la donación del sulodexide. Este proyecto fue financiado parcialmente por los proyectos del Consejo de Desarrollo Científico y Humanístico de la Universidad Central de Venezuela 09-00-6005 -2005 y PI-09-7287-2008.
REFERENCIAS
1. Furchgott RF, Zawadzki JV. The obligatory role of endothelial cells in the relaxation of arterial smooth muscle by acetylcholine. Nature 1980; 288:373-376. [ Links ]
2. Moncada S, Palmer RM, Higgs A. Nitric oxide: physiology, pathophysiology and pharmacology. Pharmacol Rev 1991; 43:109-142. [ Links ]
3. Simón A, Castro A, Kaski JC. Progress in the knowledge of endothelial dysfunction and its application in clinical practice. Rev Esp Cardiol 2001; 54:211-217. [ Links ]
4. Badimón L, Martínez-González J. Endotelio en la protección vascular: nuevos conocimientos. Rev Esp Cardiol 2002; 55:17-26. [ Links ]
5. Ceballos RG, Ramírez SI, Calzada-Mendoza CC, Olivares-Corichi IM. Disfunción endotelial y estrés oxidativo. Rev Endocrinol Nutr 2006; 14:233-236. [ Links ]
6. Power AC. Diabetes Mellitus. En Braundwald E, Wilson J, Fauci A, Kasper D, Hauser S, Longo Djameson JL Eds, Harrison Principios de Medicina Interna, 15a. ed.. Vol. II, McGraw Hill Interamericana Editores, SA de CV, México DF, 2002. P 2467-2500. [ Links ]
7. Hadi HA, Suwaidi JA. Endothelial dysfunction in diabetes mellitus. Vas Health Risk Manag 2007; 3:853-876. [ Links ]
8. Panus C, Mota M, Vladu D, Vanghelie L, Raducanu CL. The endothelial dysfunction in diabetes mellitus. Rom J Intern Med 2003; 41:27-33. [ Links ]
9. Deckert T, Felt-Rasmussen B, Borch-Johnsen K, Jensen T, Kofoed-Enevoldsen A. Albuminuria reflects widespread vascular damage. The Steno hypothesis. Diabetologia 1989; 32: 219-226. [ Links ]
10. Stehouwer C, Henry R, Dekker J, Nijpels G, Heine R, Bouter L. Microalbuminuria is associated with impaired brachial artery, flow mediated vasodilation in the elderly individuals without and with diabetes: further evidence for a link between microalbuminuria and endothelial dysfunction. The Hoorn Study. Kydney Int 2004; 6:S42-44. [ Links ]
11. Gambaro G, van der Woude F. Glycosaminoglycans: use in treatment of diabetic nephropathy. J Am Soc Nephrol 2000; 11:359-368. [ Links ]
12. Myrup B, Hansen P, Jensen T, Kofoed-Enevoldsen A, Feldt-Rasmussen B, Gram J, Kluft C, Jespersen J, Deckert T. Effect of low-dose of heparin on urinary excretion in insulin-dependent diabetes mellitus. Lancet 1995; 345:421-422. [ Links ]
13. Tamsma J, van der Woude Y, Lemkes H. Effect of sulphated glycosaminoglycams on albuminuria in patients with overt diabectic (type 1) nephrophaty. Nephrol Dial Transplant 1996; 11(1):182-185. [ Links ]
14. van der Pijl J, Lemkes H, Frölich M, van der Woude F, van der Meer F, van Es L. Effect of danaparoid sodium on proteinuria, von Willebrand factor, and hard exudates in patients with diabetes mellitus type 2. J Am Soc Neprhol 1999; 10:1331-1336. [ Links ]
15. Ofosu F. Pharmacological actions of sulodexide. Semin Thromb Hemost. 1998; 24:127-138. [ Links ]
16. Crepaldi G, Rossi A, Coscetti G, Abbruzzese E, Calveri U, Calabro A. Sulodexide oral administration influences blood viscosity and fibrinolisis. Drug Exptl. Clin Res 1992; 18:189-195. [ Links ]
17. Gallagher J, Lyon M, Steward W. Structure and function of heparan sulphate proteoglycans. Biochem J 1986; 236:313-325. [ Links ]
18. Wu V, Wilson B, Cohen M. Disturbances in glomerular basement membrane glycosaminoglycans in experimental diabetes. Diabetes 1987; 36:679-683. [ Links ]
19. Deckert T, Kofoed-Enevoldsen A, Borch-Johnsen K, Rasmussen B, Jensen T. Microalbuminuria: Implications for micro and macrovascular diseases. Diabetes Care 1992; 15 (9):1181-1191. [ Links ]
20. Jensen T. Pathogenesis of diabetic vascular disease: evidence for the role of reduced heparan sulfate proteoglycan. Diabetes 1997; 46(S2):S98-S100. [ Links ]
21. Lewis E, Xu X. Abnormal glomerular permeability characteristic in diabetic nephropathy. Implications for the therapeutic use of low-molecular weight heparin. Diabetes Care 2008; 31(S2): S202-206. [ Links ]
22. Rohrbach D, Hassel J, Kleinman H, Martín G. Alterations in the basement membrane (heparan sulfate) proteoglycan in dibetic mice. Diabetes 1982; 31:185-188. [ Links ]
23. Kanwar Y, Rosenzweig L, Linker A, Jakuboswski M. Decreased the novo synthesis of glomerular proteoglycans in diabetes: Biochemical and autoradiographic evidences. Proc Natl Acad Sci USA 1983; 80:2272-2275. [ Links ]
24. Parthasarathy N, Spiro R. Effect of diabetes on the glycosaminoglycans component of the human glomerular basement membrane. Diabetes 1982; 31:738-741. [ Links ]
25. Wasty F, Alavi MZ, Moore S. Distribution of glycosaminoglycans in the intima of human aortas: changes in atherosclerosis and diabetes mellitus. Diabetología 1993; 36(4):316-322. [ Links ]
26. Gambaro G, Baggio B. Role of glycosaminoglycans in diabetic nephropathy. Acta Diabetol 1992; 29:149-155. [ Links ]
27. Gambaro G, Venturini A, Noonam D, Fries W, Re G, Garbisa S, Milanesi C, Pesarini A, Borsatti A, Marchi E, Bruno B. Treatment with a glycosaminoglycans formulation ameliorates experimental diabetic nephropaty. Kidney Int 1994; 46:797- 806. [ Links ]
28. Cortinovis M, Cattaneo D, Perico N, Remuzzi G. Investigational drugs for diabetic nephropathy. Exp Opin Investig Drugs 2008; 17:1487-1500. [ Links ]
29. Weiss R, Niecestro R, Raz I. The role of sulodexide in the treatment of diabetic nephropathy. Drugs 2007; 67:2681-2696. [ Links ]
30. Solini A, Carraro A, Barzon I, Crepaldi G. Therapy with glycosaminoglycans lower albumin excretion rate in non-insulin dependent diabetic patients with macroalbuminuria. Diab Nutr Metab 1994; 7: 304-307. [ Links ]
31. Solini A, Vergnani L, Ricci F, Crepaldi G. Glycosaminoglycans delay the progresión of nephropathy in NIDDM. Diabetes Care 1997; 20(5):819-823. [ Links ]
32. Velussi M, Cernigoi A, Dapas F, De Monte A. Glycosaminoglycans oral therapy reduces microalbuminuria, blood fibrinogen levels and limb arteriopthy clinical signs in patients with non-insulin dependent diabetes mellitus. Diab Nutr Metab 1996; 9:53-58. [ Links ]
33. Dedov I, Shestakova M, Vorontzov A, Palazzini E. A randomized, controlled study of sulodexide therapy for the treatment of diabetic nephropathy. Nephrol Dial Transplant 1997; 12:2295-2300. [ Links ]
34. Achour A, Kacem M, Dibej K, Skhiri H, Bouraoui S, El May M. One year course of oral sulodexide in the management of diabetic nephropathy. J Nephrol 2005; 18(5): 568-574. [ Links ]
35. Gambaro G, Kinalska I, Oksa A, Pont´uch P, Hertlova M, Olsovsky J, Manitius J, Fedele D, Czekalski S, Perusicova J, Skrha J, Taton J, Greszczak W, Crepaldi G. Oral sulodexide reduces albuminuria in microalbuminuric and macroalbuminuric type 1 and type 2 diabetic patients: The Di.N.A.S. randomized trial. J Am Soc Nephrol 2002; 13(6): 1615-1625. [ Links ]
36. Lambers Heerspink HJ, Greene T, Lewis J, Itamas R, Rohde R, Hunsicker G, Schwartz S, Aronoff S, Katz M, Eisner G, Mersey J, Wiegmann T, for the Collaborative group. Effects of sulodexide in patients with type 2 diabetes and persistent albuminuria. Nephrol Dial Transplant 2008; 23:1946-1954. [ Links ]
37. Lambers-Heerspink HJ, Fowel MJ, Volgi J, Reutens AT, Klein I, Herskovits TA, Packham DK, Fraser IR, Schrtz SL, Abeterusso C, Lewis J, Collaborative Study Group. Rationale for and study design of the sulodexide trial in type 2 diabetic, hypertensive patients with microalbuninuria or overt nephropathy. Diabet Med 2007; 24(11):1290-1295. [ Links ]
38. Clinical Trials. NCT001130208 en http:// www.clinicalstrials.gov [ Links ]
39. Clinical Trials. NCT00130312 en http:// www.clinicalstrials.gov [ Links ]
40. Kristova V, Liskova S, Sotnikova R, Vojtko R, Kurtansky A. Sulodexide improves endothelial dysfunction in streptozotosin-induced diabetes in rats. Physiol Rev 2008; 57:491-494. [ Links ]
41. Mathison Y, Garrido MR, Israel A, Quero Z, Fernández H. Efecto del glicosaminoglicano sulodexide sobre la actividad de la sintasa del óxido nítrico en la corteza renal de ratas con diabetes tipo 1. Rev Latinoamer Hiperten 2008; 3(6):182-188. [ Links ]
42. Tasatargil A, Golbasi I, Sadan G, Karasu E. Unfraccionated heparin produces vasodilatory action on human internal mammary artery by endothelium-dependent mechanism. J Cardiovasc Pharmacol 2005; 45:114-119. [ Links ]
43. Li J, Hajarizadeh H, LaRosa C, Rohrer M, Vander-Salm T, Cutler B. Heparin and protamine stimulate the production of nitric oxide. J Cardiovasc Surg. (Torino) 1996; 37:445-452. [ Links ]
44. Mochisuki S, Vink H, Hiramatsu O, Kajita T, Shigeto F, Spaan J, Kajiya F. Role of hyaluronic acid glicosaminoglycans in shear-induced endothelium-derived nitric oxide release. Am J Physiol Heart Circ Physiol 2003; 285:H722- 726. [ Links ]
45. Park HY, Kang S, Kim GY, Jang Y, Know HM, Shim WH, Cho SY, Cho SH. Inhibition of neointimal proliferation of rat carotic artery by sulodexide. J Korean Med Sci 1997; 12:210-214. [ Links ]
46. Iacoviello L, D`Adamo MC, Pawlak K, Polishchurk R, Wollny T, Buczko W, Donati MB. Antithrombotic activity of dermatan sulphates, heparins and their combination in animal models of arterial thrombosis. Thromb Haemost 1996; 76(6): 1102-1107. [ Links ]
47. Ceriello A, Quatraro A, Marchi E, Barbantini M, Giugliano D. Impaired fibrinolytic response to increased thrombin activation in type 1 diabetes mellitus: effects of the glycosaminoglycan sulodexide. Diabete Metab 1993; 19(2): 225-229. [ Links ]












 uBio
uBio