Investigación Clínica
versión impresa ISSN 0535-5133
Invest. clín vol.55 no.1 Maracaibo mar. 2014
Metotrexate como inductor en la producción de citocinas proinflamatorias en células epiteliales.
Alejandra Morón-Medina1, Ninoska Viera1, Thaís Rojas de Morales1, Sirley Alcocer2 y Dinorath Bohorquez3.
1 Instituto de Investigación, Facultad de Odontología.
2 Instituto de Investigaciones Clínicas “Dr. Américo Negrette”, Sección de Virología, Facultad de Medicina.
3 Departamento de Sistemas, Facultad de Odontología.
Universidad del Zulia. Maracaibo, Venezuela.
Autor de correspondencia: Alejandra Morón. Instituto de Investigación, Facultad de Odontología, Universidad del Zulia. Maracaibo 4001, Zulia, Venezuela. Telf: + 58-261-4127346-48. Fax +58-261-4127347. Correo electrónico: alejandraisamm@gmail.com
Resumen. El metotrexate (MTX) es uno de los medicamentos frecuentemente utilizados en el cáncer infantil señalándose además, como agente citotóxico de la mucosa bucal, que puede desencadenar el proceso inflamatorio e incremento de la vascularidad en los tejidos epiteliales durante las fases iniciales de la mucositis oral. El presente trabajo tiene como objetivo determinar la producción de citocinas proinflamatorias IL-1b, IL-6 y TNF-a en cultivos de células epiteliales tratadas con MTX. Se realizaron cultivos de células epiteliales de laringe humana obtenidas de la línea celular Hep-2, con diferentes dosis de MTX en distintos tiempos de incubación, y a su vez se analizó la citotoxicidad del fármaco mediante el ensayo colorimétrico, el cual se basa en la reducción metabólica del bromuro de 3-(4,5- dimetiltiazol-2-ilo)-2,5-difeniltetrazol (MTT), y la producción de citocinas proinflamatorias mediante el ensayo inmuno enzimático indirecto (ELISA). En cuanto a los resultados se observó, que los cultivos de células Hep-2 presentaron aumento en la producción de las citocinas proinflamatorias a las 72 horas al utilizar las dosis de 0.32µM MTX. Estos resultados sugieren que la dosis y el tiempo de exposición del MTX alteran la fisiología de las células epiteliales humanas, lo cual podrían desempeñar un papel importante durante las fases de iniciación y de desarrollo de la mucositis oral.
Palabras clave: células epiteliales, metotrexate, citocinas proinflamatorias
Methotrexate as inducer of proinflammatory cytokines by epithelial cells.
Abstract. Methotrexate (MTX), a drug commonly used in childhood cancer, has also been indicated as a cytotoxic agent of the oral mucosa, which can trigger the inflammatory process and increase the vascularity of epithelial tissues during the early stages of oral mucositis. The aim of this study was to determine the production of proinflammatory cytokines IL-1b, IL-6 y TNF-a in epithelial cell cultures treated with MTX. Epithelial cells of human larynx, obtained from the cell line Hep-2, were cultured with different doses of MTX during different incubation times. The drug cytotoxicity was analyzed by means of the colorimetric test, which is based on the metabolic reduction of the bromide of 3-(4, 5-dimetiltiazol-2-ilo)-2,5-difeniltetrazol (MTT); and the proinflammatory cytokines production by the test enzyme-linked immunosorbent assay (ELISA). Cultures of HEp-2 cells showed increased production of proinflammatory cytokines at 72 hours with 0.32µM of MTX. These results suggest that depending on the dose and exposure time, MTX alters the physiology of human epithelial cells, which may play an important role during the phases of initiation and development of oral mucositis.
Keywords: epithelial cells, methotrexate, proinflammatory cytokines.
Recibido: 19-07-2013. Aceptado: 13-02-2014
INTRODUCCIÓN
El metotrexate (MTX), es uno de los medicamentos citotóxicos frecuentemente utilizados en el tratamiento del cáncer infantil (1), el cual es un antagonista del ácido fólico que inhibe la reproducción celular (2), muestra selectividad parcial por células tumorales y toxicidad contra células normales de rápida proliferación, como ocurre con las células del tracto gastrointestinal señalándose además, como agente citotóxico de la mucosa bucal (3).
Las células epiteliales forman capas continuas, constituyendo la primera barrera de defensa inmunológica y de interacción frente a agresores del mundo exterior, protegiendo, reparando y regulando el paso de sustancias a través de sí mismas (4-6). Las células epiteliales contribuyen activamente con el sistema inmune, secretando varias moléculas relacionadas con la respuesta inmunitaria como son las quimiocinas, citocinas y defensinas, entre otras (7).
El MTX puede interferir con la madurez y el crecimiento de estas células, desencadenando eventos inflamatorios como la liberación de citocinas proinflamatorias (IL-1b, IL-6 y TNF-a), lo cual causaría apoptosis pudiendo llevar esto a la aparición de la mucositis (8-10).
La mucositis oral representa una interacción de las células de la mucosa oral y factores locales, como la saliva, microflora oral y las citocinas proinflamatorias; siendo ésta uno de los efectos secundarios más frecuentes del tratamiento oncológico (11-13).
Sonis (11), describe el desarrollo y resolución de la mucositis en cinco fases: una fase de iniciación y una fase de respuesta de daño primario, no perceptibles clínicamente; una fase de señales de amplificación, una fase ulcerativa o bacteriológica y una fase curativa.
Durante la fase de respuesta de daño primario, se activan factores de transcripción que median la expresión génica, síntesis y liberación de mediadores biológicamente activos que impactan la viabilidad del epitelio basal. Entre los más importantes y bien estudiados en cuanto al desarrollo de la mucositis se encuentra el NF-kB, el cual es un importante regulador de citocinas proinflamatorias, como el TNF-a, IL-1b e IL-6 (14). Estas proteínas son mediadores efectivos de la lesión, y el aumento de los niveles en los tejidos y sangre periférica se correlacionan bien con toxicidad no hematológica inducidas por fármacos administrados durante la quimioterapia como el MTX (11).
Actualmente se discute el papel de las citocinas como iniciadores y amplificadores de la mucositis oral y la influencia potencial de los factores genéticos al establecer el riesgo y modificar el curso de ésta.
Tomando en cuenta la importancia que tiene el MTX como droga citotóxica desencadenante de la mucositis oral en pacientes con cáncer, el presente trabajo de investigación tiene como objetivo determinar el perfil de citocinas proinflamatorias (TNF-a, IL-1b e IL-6) en cultivos de células epiteliales humanas tratadas con diferentes dosis de MTX y a distintos tiempos de incubación para establecer la cinética de producción de estas citocinas.
MATERIALES Y MÉTODOS
Línea celular
Se realizaron cultivos de células epiteliales de carcinoma de laringe humana de la línea celular Hep-2 obtenidas del Instituto Nacional de Higiene “Rafael Rangel” (INHRR) Caracas-Venezuela, las cuales provenían del American Type Culture Collection (ATCC) USA. Estas células fueron cultivadas por el INHRR durante 11 años realizándole alrededor de 368 pasajes. Una vez recibidas las células en nuestro laboratorio se cultivaron en frascos de cultivo de 25 cm2 de área con medio de Dulbecco’s Modified Eagle-Hank’s F-12 (3:1) (DMEM) (Flow Laboratories, Mississauga, Ontario, Canadá), suplementado con 5% suero fetal bovino (Sigma-Aldrich St. Louis, USA), penicilina 100 U/mL y estreptomicina 100 mg/mL (Sigma-Aldrich St. Louis, USA). Se incubaron a 37°C en atmósfera de 5% de CO2 y 100% de humidad relativa, realizándose 2 pasajes antes de sembrarse en las placas de cultivo. Después de 48 h del segundo pasaje, los cultivos celulares con subconfluencia se despegaron utilizando para ello la tripsina (Sigma-Aldrich St. Louis, USA); la suspensión celular resultante se centrifugó durante 5 minutos a 1000rpm. Las células se sembraron en las placas de 24 pozos con área de 2.0 cm2 a una densidad de 5×105 células por pozo, con medio de cultivo suplementado e incubadas como lo señalado anteriormente.
Después de 24 h que las células alcanzaran una subconfluencia, se retiró el medio de cultivo y se les adiciono el medio de cultivo suplementado con el MTX (0,08 y 0,32 µM) (Sigma-Aldrich St. Louis, USA) (15) y se incubaron durante 6, 24 y 72 horas. Se realizaron cuatro experimentos cada uno de ellos por triplicado. Los controles fueron sometidos a las mismas condiciones experimentales pero sin la exposición al MTX.
Determinación de la viabilidad celular
La citotoxicidad y viabilidad celular se realizaron mediante un ensayo colorimétrico el cual se basa en la reducción metabólica del bromuro de 3-(4,5- dimetiltiazol-2-ilo)-2,5-difeniltetrazol (MTT), para lo cual se utilizó el kit comercial (Sigma Chemical Co., St Louis, MO) (16). Las placas fueron leídas en un lector de microplacas (Titertek Multiskan® PLUS) a 570 nm.
Las citocinas proinflamatorias de las células epiteliales fueron determinadas a través del ensayo inmuno enzimático indirecto (ELISA) en los sobrenadantes de los cultivos celulares, para lo cual se utilizaron kits comerciales disponible comercialmente (Thermo scientific, Rockford, IL, USA) siguiendo el protocolo del fabricante. La cantidad de citocinas se cuantificaron en un lector de microplacas (Titertek Multiskan® PLUS). Todas las determinaciones se hicieron por triplicado. Los resultados se expresaron en pg/mg de proteínas.
Determinación de proteínas
Los cultivos de células epiteliales fueron lisados, posteriormente estos se utilizaron para la determinación de proteínas mediante un reactivo comercial basado en el método espectrofotométrico de Bradford (17) (Bio-Rad Protein Assay; Bio-Rad Lab., Germany). Se procedió a cuantificar la absorbancia a 595 nm en un lector automático de microplacas (Titertek Multiskan® PLUS). Con la finalidad de normalizar la concentración de las citocinas con respecto al total de proteínas totales.
Análisis estadístico
El análisis de los resultados obtenidos se realizó utilizando el programa GraphPad Instat versión 3.05 y para la representación gráfica de los datos se utilizó el programa Graph Pad Prisma versión 5. Al hacer el análisis del efecto del MTX en relación a las dosis y a los tiempos de incubación, se utilizó ANOVA con la prueba de Bonferroni y para la asociación se aplicó la prueba de correlación y regresión lineal. Se consideró como valor de significancia estadística una p<0.05. Los resultados se expresaron como media ± error estándar.
RESULTADOS
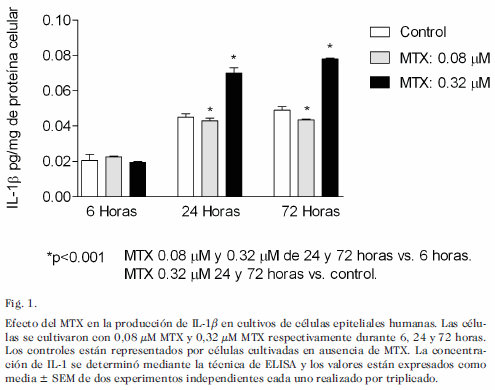
En relación a la IL-1b (Fig. 1) se encontró un incremento estadísticamente significativo en las dos dosis estudiadas de MTX a las 24 y 72 horas con respecto a las 6 horas de incubación. De igual manera, al comparar las dosis utilizadas se pudo observar un incremento estadísticamente significativo con la dosis de 0,32 µM MTX a las 24 y 72 horas en relación al control. Al aplicar la prueba de correlación y regresión lineal, se encontró asociación estadísticamente significativa en la producción de IL-1b a las 24 y 72 horas de incubación. Los valores de r y p fueron los siguientes: 24 horas: r= 0,9854; p<0,05. 72 horas: r= 0,9996; p<0,001.
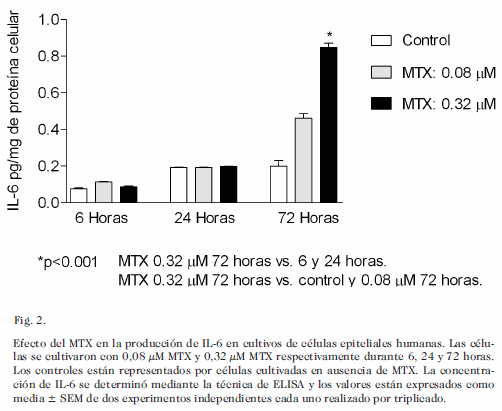
En cuanto a la IL-6 (Fig. 2), se observó un incremento estadísticamente significativo a las 72 horas con respecto a las 6 y 24 horas; en relación a las concentraciones, luego de estar expuesta a las diferentes dosis de MTX, se observó un incremento significativo a las 72 horas. Se encontró asociación estadísticamente significativa en cuanto a la IL-6 a las 72 horas de incubación obteniendo un valor de r= 0,9921; p<0,01.
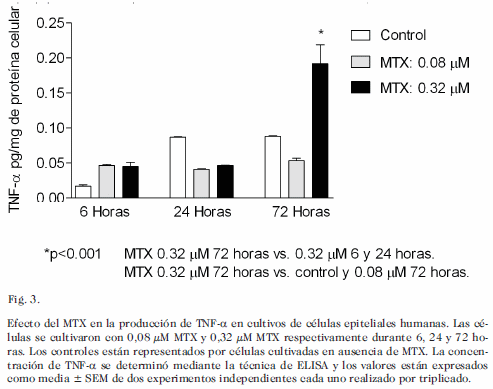
En relación al TNF-a (Fig. 3), se observó aumento de la citocina de manera estadísticamente significativa a las 72 horas donde se utilizó la dosis de 0.32 µM MTX en relación con las 6 y 24 horas. Para TNF-a se encontró asociación estadísticamente significativa a las 24 y 72 horas de incubación. Los valores de r y p fueron los siguientes: 24 horas: r= 0,9611; p<0,05. 72 horas: r= 0,9635; p<0,05.
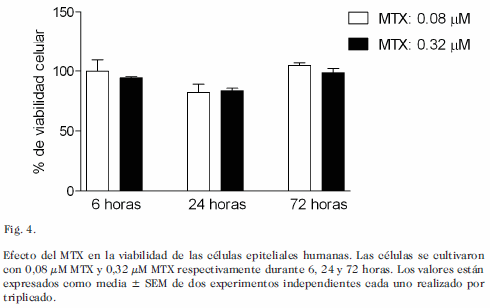
La incubación de células Hep-2 con concentraciones crecientes de MTX no alteraron la viabilidad de las células (Fig. 4).
DISCUSIÓN
Las citocinas son mediadores del crecimiento, diferenciación, reparación e inflamación celular, entre otras funciones, por lo que definen la magnitud y naturaleza de la respuesta inmunitaria (18). El presente estudio evaluó los niveles de citocinas proinflamatorias (IL-1b, IL-6 y TNF-a) y las variaciones de viabilidad en células epiteliales humanas (Hep-2), inducidas por la administración de distintas dosis de MTX en diferentes tiempos de cultivo, para tratar de explicar los eventos que ocurren durante el proceso biológico de las fases iniciales de la mucositis.
En relación a los niveles de citocinas proinflamatorias evaluados en este estudio, se pudo evidenciar que una vez que las células epiteliales estuvieron expuestas al MTX todas las citocinas se comportaron del mismo modo, aumentando de una manera significativa al estar expuestas a la concentración de MTX 0,32 µM durante las 72 horas de incubación, solo la IL-1b presentó una mayor concentración de manera significativa al aumentar la dosis a las 24 horas de incubación, lo que nos indica que tanto la dosis de MTX como el tiempo de exposición pudieran intervenir en la producción de citocinas proinflamatorias.
Existen pocos estudios in vitro en este sentido, sin embargo, nuestros hallazgos podrían apoyar la hipótesis propuesta por Sonis (11) la cual se basa, en que las células de la mucosa oral (epiteliales y fibroblastos) al estar en contacto con los agentes quimioterapéuticos podrían incrementar la producción de citocinas proinflamatorias y resultar en apoptosis, favoreciendo el desarrollo de la fase de daño primario de la mucositis oral. El MTX pudiese ser un fármaco capaz de inducir un alto rango de producción de citocinas en diversos tejidos. En este respecto Yamauchi y col. (19) demostraron que el MTX aumentó la producción de IL-8 en cultivos de células epiteliales bronquiales y alveolares, en función al tiempo y las dosis utilizadas.
En cuanto a los hallazgos de viabilidad celular usando distintas dosis de MTX en diferentes tiempos de exposición, se evidenció que no hubo diferencia estadísticamente significativa entre la concentración del MTX y el tiempo de incubación. Estos resultados, difieren con lo reportado por otros autores (20-22), quienes en cultivos celulares evidenciaron que el daño celular estaba relacionado con la duración de exposición del MTX en lugar de la concentración, esta diferencia podría explicarse debido a que en estos estudios utilizaron mayores tiempos de incubación así como también concentraciones más altas de MTX.
Los hallazgos encontrados en este estudio podrían ser relevantes en la fase de daño primario de la mucositis oral, es bien sabido que la mucositis oral se desarrolla como resultado de una serie de acontecimientos biológicos relacionados, donde la producción de citocinas proinflamatorias (IL-1b, IL-6 y TNF) desempeñan un papel importante en la mediación del daño celular y en las vías de señalización intracelular, culminando en la apoptosis de las células epiteliales basales, lo cual resulta en la pérdida de renovación epitelial, atrofia y finalmente la ulceración lo que caracteriza clínicamente a la mucositis (11).
Dado que los eventos que desencadenan el proceso de mucositis se producen casi inmediatamente después de la administración de la quimioterapia, la inhibición de los eventos moleculares iniciales o su diagnóstico temprano, podrían tener un profundo impacto en la intensidad de la mucositis oral, por lo que se recomienda continuar con futuros estudios que nos permita conocer el mecanismo de acción del MTX en la mucosa oral, lo que permitiría el inicio oportuno de terapias que limiten las alteraciones de las capas del tejido epitelial y conectivo, previniendo la aparición de mucositis o bien que puedan disminuir la duración y evolución de esta complicación.
AGRADECIMIENTO
Al Consejo de Desarrollo Científico y Humanístico (CONDES: CC-0442-10), por su aporte financiero, a la Fundación Hospital Especialidades Pediátricas, a la Sección de Virología del Instituto de Investigaciones Clínicas “Dr. Américo Negrette” y al Laboratorio de Referencia Virológica de la Facultad de Medicina, Universidad del Zulia por el apoyo prestado.
REFERENCIAS
1. Mashhadi MA, Kaykhaei MA, Sanadgol H. Low prevalence of high-dose methotrexate nephropathy in patients with malignancy. Iran J Kidney Dis 2012; 6(2):105-109. [ Links ]
2. Fan C, Georgiou KR, King TJ, Xian CJ. Methotrexate toxicity in growing long bones of young rats: a model for studying cancer chemotherapy-induced bone growth defects in children. J Biomed Biotechnol 2011; 903-907. [ Links ]
3. Schmidt E, Thoennissen NH, Rudat A, Bieker R, Schliemann C, Mesters RM, Zühlsdorf M, Müller-Tidow C, Berdel WE. Use of palifermin for the prevention of high-dose methotrexate-induced oral mucositis. Ann Oncol 2008; 19(9): 1644-1649. [ Links ]
4. Li Y, Wang Y, LiuX. The Role of airway epithelial cells in response to mycobacteria infection. Clin Dev Immunol 2012; 791392. doi: 10.1155/2012/791392. Epub 2012 Apr 18.
5. Ryu JH, Kim CH, Yoon JH. Innate immune responses of the airway epithelium. Mol Cells 2010; 30(3):173-183. [ Links ]
6. Zhao H, Adler KB, Bai C. Epithelial proteomics in multiple organs and tissues: similarities and variations between cells, organs, and diseases. J Proteome Res 2006; 5:743-755. [ Links ]
7. Gómez MI, Prince A. Airway epithelial cell signaling in response to bacterial pathogens. Pediatr Pulmonol 2008; 43(1):11-19. [ Links ]
8. Naidu R, Ramana V, Rani U, Mohan K, Suman A, Roy P. Chemotherapy-induced and/or radiation therapy-induced oral mucositis-complicating the treatment of cancer. Neoplasia 2004; 6:423-431.
9. Al-Dasooqi N, Gibson RJ, Bowen JM, Keefe DM. Matrix metalloproteinases: key regulators in the pathogenesis of chemotherapy-induced mucositis? Cancer Chemother Pharmacol 2009; 64(1):1-9.
10. D’Hondt L, Lonchay C, André M, Canon JL. Oral mucositis induced by anticancer treatments: physiopathology and treatments. Ther Clin Risk Manag 2006; 2(2): 159-168.
11. Sonis ST. Pathobiology of oral mucositis: nvel insights and opportunities. J Support Oncol 2007; 5(9-4):3-11.
12. Scully C, Epstein J, Sonis S. Oral mucositis: a challenging complication of radiotherapy, chemotherapy and radiochemotherapy: Part i: Pathogenesis and prophilaxis of mucositis. Head Neck 2003; 25:1057-1070.
13. Ye Y, Carlsson G, Agholme MB, Karlsson- Sjöberg J, Yucel-Lindberg T, Pütsep K, Modéer T. Pretherapeutic plasma pro- and anti- inflammatory mediators are related to high risk of oral mucositis in pediatric patients with acute leukemia: a prospective cohort study. PLoS One 2013; 8(5): e64918.
14. Morales-Rojas T, Viera N, Morón-Medina A, Alvarez CJ, Alvarez A. Proinflammatory cytokines during the initial phase of oral mucositis in patients with acute lymphoblastic leukaemia. Int J Paediatr Dent 2012; 22(3):191-196.
15. Hwang SJ, Kim SH, Kim HZ, Steinmetz MO, Koh GY, Lee GM. High-level expression and purification of a designed angiopoietin-1 chimeric protein, COMP-Ang1, produced in Chinese hamster ovary cells. Protein J 2008; 27(5):319-326.
16. Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immunol Methods 1983; 16:65 (1-2):55-63.
17. Bradford M. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem 1976; 72:248-254.
18. Christian DA, Hunter CA. Particle-mediated delivery of cytokines for immunotherapy. Immunotherapy 2012; 4(4):425-441.
19. Yamauchi Y, Okazaki H, Desaki M, Kohyama T, Kawasaki S, Yamamoto K, Takizawa H. Methotrexate induces interleukin-8 production by human bronchial and alveolar epithelial cells. Clin Sci (Lond) 2004; 106(6):619-625.
20. Maiguma T, Hayashi Y, Ueshima S, Kaji H, Egawa T, Chayama K, Morishima T, Kitamura Y, Sendo T, Gomita Y, Teshima D. Relationship between oral mucositis and high-dose methotrexate therapy in pediatric acute lymphoblastic leukemia. Int J Clin Pharmacol Ther 2008; 46(11):584-590.
21. Yin J, Meng Q, Zhang G, Sun Y. Differential methotrexate hepatotoxicity on rat hepatocytes in 2-D monolayer culture and 3-D gel entrapment culture. Chem Biol Interact 2009; 180(3):368-375.
22. De Vries HS, de Heij T, Roelofs HM, te Morsche RH, Peters WH, de Jong DJ. Infliximab exerts no direct hepatotoxic effect on HepG2 cells in vitro. Dig Dis Sci 2012; 57(6):1604-1608.












 uBio
uBio