Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Investigación Clínica
Print version ISSN 0535-5133
Invest. clín vol.55 no.3 Maracaibo Sept. 2014
Relación entre los niveles séricos de proteína C reactiva y α1-antitripsina y la resistencia a la insulina en mujeres con obesidad.
María Matilde Ramírez Alvarado1 y César Sánchez Roitz2.
1 Departamento de Bioquímica, Escuela de Ciencias Biomédicas y Tecnológicas, Facultad de Ciencias de la Salud, Universidad de Carabobo.
2 Laboratorio Clínico César Sánchez Font, Centro Médico Dr. Rafael Guerra Méndez. Valencia, Venezuela.
Autor de correspondencia: María Matilde Ramírez Alvarado. Departamento de Bioquímica, Escuela de Ciencias Biomédicas y Tecnológicas, Facultad de Ciencias de la Salud, Universidad de Carabobo. Valencia, Venezuela. Teléfono: 04144307392. Correo electrónico: mmramirez@uc.edu.ve
Resumen. El tejido adiposo produce citocinas implicadas en la resistencia a la insulina (RI) tales como IL-6, IL-8, TNF-α y moléculas proinflamatorias como la proteína C reactiva (PCR). La α1-antitripsina es una proteína plasmática sensible a la inflamación. El objetivo de este estudio fue determinar la correlación existente entre los niveles séricos de PCR ultrasensible (PCRus) y de α1-antitripsina con los índices de RI en mujeres venezolanas obesas. La población del estudio estuvo conformada por 15 mujeres normopeso (IMC 21,8 ± 1,9 kg/m2) y 15 mujeres con obesidad (IMC 35,3 ± 5,3 kg/m2). Se realizó a los grupos la prueba de tolerancia oral a la glucosa (carga de 75g, 2h) y se calcularon los siguientes índices: Modelo de Determinación de la Homeostasis de la resistencia a la insulina (HOMA-IR), Modelo de Determinación de la Homeostasis de la función de la célula-β (HOMA-β), Índice Matsuda e Índice Insulinogénico. Se determinó la relación entre los niveles séricos de PCRus y α1-antitripsina y estos índices. Las mujeres con obesidad presentaron mayores niveles de PCRus (p = 0,001) en comparación con las mujeres normopeso. Los niveles séricos de PCRus se correlacionaron positivamente con HOMA-IR (r= 0,73, p=0,0021), HOMA-β (r= 0,53, p=0,031) y negativamente con el Índice Matsuda (r= –0,60, p=0,017), en las mujeres con obesidad. No se observó ninguna correlación entre los niveles séricos de α1-antitripsina y los índices de RI en el grupo obeso ni en el grupo normopeso. Se encontró una relación entre los niveles séricos de PCRus y la RI, sugiriendo un rol de la inflamación subclínica en la RI.
Palabras clave: proteína C reactiva, a1-antitripsina, resistencia a la insulina, obesidad.
Relationship between serum levels of C-reactive protein and α1-antitrypsin and insulin resistance in obese women.
Abstract. Adipose tissue produces cytokines involved in insulin resistance (IR) such as IL-6, IL-8, TNF-α and proinflammatory molecules such as C reactive protein (CRP). α1-antitrypsin is an inflammation-sensitive plasma protein. The objective of this study is to determine the correlation between serum CRP high-sensitivity (CRPhs) and α1-antitrypsin levels with IR indices in obese Venezuelan women. The study population consisted of 15 normal weight women (BMI 21.8 ± 1.9 kg/m2) and 15 obese women (BMI 35.3 ± 5.3 kg/m2). Obese and lean women underwent a 2 h-75g oral glucose tolerance test and the following indices were calculated: homeostatic model assessment of insulin resistance (HOMA-IR), homeostatic model assessment of β cell function (HOMA-β), Matsuda Index and Insulinogenic Index. The relationship between serum CRPhs and α1-antitrypsin levels and these indices were determined. Obese women had higher CRPhs levels (p = 0.001) compared with normal weight women. In obese women, serum CRPhs levels were positively correlated with HOMA-IR (r=0.73, p=0.0021), HOMA-β (r=0.53, p=0.031) and negatively correlated with the Matsuda Index (r= –0.60, p=0.017). No correlation between serum levels of α1-antitrypsin and IR indices in the obese group and the lean group was observed. There was a relation between serum CRPhs levels and insulin resistance, suggesting a role of subclinical inflammation in IR.
Keywords: C reactive protein, a1-antitrypsin, insulin resistance, obesity.
Recibido: 06-02-2014. Aceptado: 30-04-2014
INTRODUCCIÓN
Se ha descrito que el tejido adiposo puede producir citocinas tales como IL-6, IL-8, TNF-a y moléculas proinflamatorias como la proteína C reactiva (PCR), por lo que los sujetos con obesidad presentan un estado inflamatorio subclínico. Estas citocinas pueden actuar tanto de manera local (autocrina/paracrina) como a nivel sistémico; están implicadas en la disfunción del tejido adiposo y relacionadas bioquímicamente con la resistencia a la insulina (RI), la alteración en la liberación de ácidos grasos libres y el desarrollo de alteraciones del metabolismo asociadas con la obesidad (1-3).
La RI es un estado de respuesta biológica reducida de los tejidos a la acción de la insulina, una de las mayores causas de diabetes tipo 2 y está implicada en la patogénesis de enfermedades cardiovasculares. Se ha descrito que la RI está asociada a un estado de inflamación y que las moléculas proinflamatorias están implicadas en el desarrollo de RI (4, 5). Se han propuesto varios índices para determinar la sensibilidad a la insulina, los cuales se calculan a partir de los niveles de glucemia, insulina y otros parámetros obtenidos en estado de ayuno y durante la Prueba de Tolerancia Oral a la Glucosa (PTOG). Estos son: Modelo de Determinación de la Homeostasis (HOMA-IR), Modelo de Determinación de la Homeostasis de la función de la célula-b (HOMA-b), Índice Matsuda o Índice de Sensibilidad Corporal a la Insulina e Índice Insulinogénico (IGI) (6-9).
La PCR es sintetizada en el hígado durante la fase aguda de la respuesta inmunológica y los niveles séricos de PCR constituyen un indicador muy importante de procesos inflamatorios (10). De la PCR se ha reportado que se encuentra en concentración sérica elevada en sujetos obesos (11); además, los niveles séricos de la PCR y de otros marcadores de inflamación sistémica y de disfunción endotelial son predictores de enfermedad cardiovascular (12). Se ha descrito que tanto el hígado como el tejido adiposo pueden producir PCR en obesos, por lo que ambos tejidos pueden contribuir a los niveles séricos elevados de PCR que se ha observado en obesos (13).
La haptoglobina, el fibrinógeno, el orosomucoide (a1-glicoproteína ácida), la a1-antitripsina (inhibidor endógeno de proteasas de serina) y la ceruloplasmina son cinco proteínas plasmáticas sensibles a inflamación (ISPs) que son usadas en la clínica como marcadores de inflamación. La principal fuente de estas proteínas es la síntesis hepática y su producción es regulada por varias citocinas proinflamatorias (14). Se ha reportado que el incremento de los niveles de ISPs están asociados a un incremento del riesgo de enfermedades cardiovasculares (15).
La PCR se ha relacionado con la RI y el desarrollo de alteraciones del metabolismo (16), pero ninguno de estos estudios se ha realizado en la población suramericana. En los países asiáticos se ha investigado ampliamente la relación entre PCR-RI-Obesidad en sus poblaciones como en Japón (17) y Corea (18), siendo interesante que en Corea, la mayoría de los diabéticos tipo 2 son no-obesos, en contraste con los caucásicos, lo que revela diferencias étnicas en la patogénesis de la resistencia a la insulina y la diabetes.
El objetivo de este estudio fue determinar la correlación existente entre los niveles séricos de PCRus y de a1-antitripsina y los índices de RI y función de las células-b pancreáticas en mujeres venezolanas con obesidad.
SUJETOS Y MÉTODOS
La población del estudio estuvo conformada por un grupo control de 15 mujeres normopeso (IMC inferior a 24,9 kg/m2) y edades comprendidas entre 30 y 39 años que acudieron a una consulta privada de un Centro de Salud, de la ciudad de Valencia, estado Carabobo, Venezuela, y antes de la realización de cualquier procedimiento del estudio, todos los participantes conocieron de la investigación y firmaron un consentimiento, el cual fue aprobado por el comité de ética del referido centro. Para la definición de los grados de obesidad se siguieron los criterios de la Organización Mundial de la Salud (19). El grupo de mujeres con obesidad estuvo conformado por 15 mujeres (IMC superior a 30,0 kg/m2) con edades comprendidas entre 30 y 40 años. Las mujeres del estudio no presentaron antecedentes de enfermedad cardiovascular, diabetes, cáncer, enfermedad renal o hepática, enfermedad hematológica, hipotiroidismo, infarto en el año anterior, revascularización, enfermedad sistémica inflamatoria ni infección. Las mujeres incluidas en el estudio no tomaban medicamentos hipoglucemiantes ni presentaron un cambio de su peso mayor al 10% en los últimos 3 meses. A todas se les realizó una historia médica y un examen físico completo antes de participar en el estudio.
Antropometría
El IMC se calculó como el peso corporal dividido entre la talla al cuadrado y expresado en kg/m2. La circunferencia de la cintura se midió en la menor circunferencia entre el borde de la última costilla y la cresta iliaca con los sujetos en posición erecta. La circunferencia de la cadera se midió en la mayor circunferencia entre la cintura y el muslo. A partir de estos últimos valores se calculó el índice cintura-cadera (ICC).
Prueba de tolerancia oral a la glucosa
El día de la prueba, los sujetos llegaron al laboratorio en ayuno de entre 12 y 14 h. Luego, se tomó la muestra de sangre para las determinaciones bioquímicas (glucemia, insulina, colesterol total, colesterol ligado a lipoproteínas de alta densidad [cHDL], colesterol ligado a lipoproteínas de baja densidad [cLDL] y triglicéridos, PCR, a1-antitripsina y para la hematología completa. Se comprobó que el sujeto presentara una glucemia menor a 100 mg/dL en ayuno para realizar la PTOG. Las mujeres ingirieron 75 g de glucosa en solución en un tiempo máximo de 5 min. Para las determinaciones de glucemia y de insulina se procedió a tomar una muestra de sangre a los 30, 60 y 120 min después del consumo de la carga de glucosa manteniendo estado de reposo. La PTOG se interpretó según los criterios de la Asociación Americana de Diabetes (20). Todas las mujeres con normopeso y las mujeres con obesidad a las que se les realizó el estudio presentaron una glucemia 2 h postcarga menor a 140 mg/dL, lo cual constituyó un criterio de inclusión del estudio.
Análisis bioquímicos
La hematología completa se realizó en muestras tomadas con ácido edético usando un analizador Coulter Counter (Coulter, Miami, FL, EE.UU.). La glucosa sérica, el colesterol y los triglicéridos se determinaron por métodos enzimáticos usando un analizador Vitros Chemistry System 250 (Ortho-Clinical Diagnostics, Jhonson-Jhonson Company, Rochester, NY, EE.UU.). El cHDL se determinó tras la precipitación selectiva de las lipoproteínas que contenían la apolipoproteína B con el reactivo Vitros Magnetic HDL-Cholesterol (Ortho-Clinical Diagnostics, Jhonson-Jhonson Company, Rochester, NY, EE.UU.). Los valores de cLDL se calcularon por medio de la fórmula de Friedewald (21). La concentración de insulina sérica se determinó por un ensayo inmunométrico quimioluminiscente en fase sólida utilizando el analizador Immulite (EURO/DPC, UK). Las concentraciones séricas de PCR ultrasensible (PCRus) y de a1-antitripsina se determinaron utilizando el nefelómetro BN II System (Dade Behring, Alemania).
Cálculos
Los índices de secreción de la insulina y de la resistencia a la insulina se hicieron según los siguientes cálculos (6-9):
- Modelo de Determinación de la Homeostasis (HOMA-IR). HOMA-IR: Io × Go / 22,5, donde Io es la concentración de insulina en ayunas (mU/mL) y Go es la glucemia en ayunas (mmol/L). Los valores bajos de HOMA-IR indican mayor sensibilidad a la insulina, mientras que valores altos de HOMA-IR indican menor sensibilidad a la insulina (resistencia a la insulina).
- Modelo de Determinación de la Homeostasis de la función de la célula-b (HOMA-b). HOMA-b: 20 × Io/(Go-3,5), donde Io es la insulina en ayunas (mU/mL) y Go es la glucemia en ayunas (mmol/L). HOMA-b mide la secreción de insulina y es un indicador la función de la células b pancreáticas.
- Índice Matsuda o Índice de Sensibilidad Corporal a la Insulina. Índice Matsuda: 10.000/(Go.Io.Gm.Im)1/2, donde Gm (mg/dL) es la media de glucemia durante la PTOG, Im (µU/mL) es la media de insulina durante la PTOG. El Índice Matsuda refleja la sensibilidad periférica la insulina, a menor sensibilidad a la insulina menor Índice Matsuda presentará el sujeto (22)
- Índice Insulinogénico (IGI). IGI: (I30-Io)/(G30-Go), donde G30 es la glucemia a los 30 min luego de la carga de glucosa durante la PTOG, I30 es la insulina a los 30 min luego de la carga de glucosa.
Análisis estadístico
Para el análisis estadístico se utilizó el programa Statistix 8.0. Para determinar la distribución normal de las variables se utilizó la prueba Shapiro-Wilk. Las diferencias entre los grupos se evaluó con el t de Student para las variables que presentaron distribución normal. Los valores de edad, IMC, CC, insulina, presión sistólica, presión diastólica, triglicéridos, HOMA-IR, HOMA-b, IGI e Índice Matsuda, PCRus y a1-antitripsina no presentaron una distribución normal por lo que se utilizó el Wilcoxon Rank Sum Test para determinar las diferencias entre los grupos. La relación entre las variables se determinó con un análisis de regresión simple y correlación de Pearson. Para todas las pruebas estadísticas se usó como criterio de significación p < 0,05.
RESULTADOS
Características clínicas de los grupos estudio
Las características antropométricas y bioquímicas de los grupos estudio se presentan en la Tabla I. Los grupos con obesidad y normopeso fueron comparables en edad. Las mujeres con obesidad presentaron mayor IMC (p < 0,0001), mayor CC (p < 0,0001) y mayor ICC (p < 0,0001) que las mujeres normopeso. Las mujeres con obesidad presentaron niveles elevados de insulina en ayuno (p= 0,0001), triglicéridos (p < 0,0001), y presión sistólica (p = 0,01) en comparación con las mujeres normopeso. Además, las mujeres con obesidad presentaron menores niveles de cHDL que las mujeres normopeso (p = 0,015). Las mujeres con obesidad presentaron mayores niveles de PCRus (p = 0,001) en comparación con las mujeres normopeso, pero no hubo diferencias significativas en los niveles séricos de a1-antitripsina entre las mujeres con obesidad y las mujeres normopeso (p = 0,26).
CARACTERÍSTICAS CLÍNICAS DE LOS GRUPOS EN ESTUDIO
|
| Grupo control normopeso (n = 15) | Grupo con obesidad (n = 15) |
| Edad (años) | 33,9 ± 2,9 | 34,4 ± 4,3 |
| IMC (kg/m2) | 21,8 ± 1,9 | 35,3 ± 5,3* |
| CC (cm) | 71,3 ± 4,7 | 102,1 ± 16,9* |
| ICC | 0,73 ± 0,04 | 0,82 ± 0,06* |
| Presión sistólica (mmHg) | 99,0 ± 11,4 | 111,3 ± 13,0* |
| Presión diastólica (mmHg) | 66,0 ± 7,4 | 72,7 ± 10,3 |
| Glucosa en ayunas (mg/dL) | 87,2 ± 4,9 | 91,1 ± 5,4 |
| Insulina en ayunas (µU/mL) | 4,9 ± 2,6 | 14,4 ± 8,2* |
| Colesterol total (mg/dL) | 169,3 ± 18,4 | 171,3 ± 35,1 |
| cHDL (mg/dL) | 59,6 ± 10,3 | 46,1 ± 15,1* |
| cLDL- (mg/dL) | 92,9 ± 17,1 | 103,9 ± 25,3 |
| Triglicéridos (mg/dL) | 80,5 ± 27,9 | 110,9 ± 37,5* |
| Leucocitos × 103/mL | 6,2 ± 1,0 | 6,9 ± 1,0 |
| PCRus (mg/dL) | 0,10 ± 0,10 | 0,72 ± 0,70* |
| a1-antitripsina (g/L) | 1,39 ± 0,37 | 1,30 ± 0,45 |
| HOMA-IR | 1,07 ± 0,62 | 3,30 ± 2,06* |
| HOMA-b | 74,27 ± 37,86 | 177,71 ± 77,85* |
| Índice insulinogénico | 1,73 ± 2,07 | 2,85 ± 2,80* |
| Índice Matsuda | 10,32 ± 3,90 | 4,41 ± 2,41* |
Los datos se expresan como la media ± DS. * p< 0,05 en mujeres con obesidad vs. mujeres normopeso.
Las mujeres con obesidad presentaron mayores niveles de HOMA-IR (p = 0,0001), HOMA-b (p = 0,0001) e IGI (p = 0,014). Un 73,3% (11 de 15) de las mujeres con obesidad presentaron un índice HOMA-IR superior a 2,5, frente a un 6,7% (1 de 15) de las mujeres normopeso que mostraron un índice HOMA-IR superior a 2,5. Las mujeres con obesidad presentaron menores niveles de Índice Matsuda (p = 0,0001) con respecto a las normopeso.
En la Tabla II se muestra que en las mujeres con obesidad los niveles séricos de PCRus se correlacionan positivamente con el IMC y la CC; en cambio, esta correlación no se observó en las mujeres normopeso. No se observó correlación entre los parámetros antropométricos y los niveles séricos de a1-antitripsina en el grupo con obesidad ni en el grupo normopeso.
CORRELACIÓN ENTRE LOS PARÁMETROS ANTROPOMÉTRICOS Y LOS NIVELES SÉRICOS DE PCRus Y a1-ANTITRIPSINA
|
| Grupo normopeso (n=15) | Grupo con obesidad (n=15) | ||
| r | p | r | p | |
| PCRus | ||||
| IMC | 0,11 | 0,70 | 0,84 | 0,0001 |
| CC | –0,20 | 0,47 | 0,83 | 0,0001 |
| ICC | –0,60 | 0,06 | 0,47 | 0,08 |
| a1-antitripsina | ||||
| IMC | –0,15 | 0,59 | –0,30 | 0,28 |
| CC | –0,10 | 0,73 | –0,19 | 0,49 |
| ICC | –0,46 | 0,08 | 0,15 | 0,61 |
En la Tabla III se muestra que en las mujeres con obesidad el HOMA-IR y HOMA-b se correlacionaron positivamente con los niveles séricos de PCRus; mientras que se observó una correlación negativa entre los niveles séricos de PCRus y el Índice Matsuda; sin embargo, estas correlaciones no se observaron en las mujeres normopeso. No se observó correlación entre los niveles séricos de PCRus e IGI en el grupo con obesidad ni en el grupo normopeso. Tampoco se observó correlación entre los niveles séricos de a1-antitripsina y HOMA-IR, HOMA-b, IGI y el Índice Matsuda en el grupo obeso ni en el grupo normopeso.
CORRELACIÓN ENTRE LOS NIVELES SÉRICOS DE PCRus Y a1-ANTITRIPSINA Y LOS ÍNDICES DE SECRECIÓN DE LA INSULINA Y DE LA RESISTENCIA A LA INSULINA
|
| Grupo normopeso (n=15) | Grupo con obesidad (n=15) | ||
| r | p | r | p | |
| PCRus |
| |||
| HOMA-IR | –0,15 | 0,61 | 0,73 | 0,0021 |
| HOMA-b | –0,07 | 0,80 | 0,53 | 0,031 |
| Índice insulinogénico | –0,15 | 0,60 | –0,19 | 0,50 |
| Índice Matsuda | 0,21 | 0,44 | –0,60 | 0,017 |
| a1-antitripsina | ||||
| HOMA-IR | –0,55 | 0,09 | 0,09 | 0,75 |
| HOMA-b | –0,29 | 0,30 | 0,22 | 0,43 |
| Índice insulinogénico | –0,21 | 0,46 | 0,17 | 0,55 |
| Índice Matsuda | 0,41 | 0,13 | –0,15 | 0,59 |
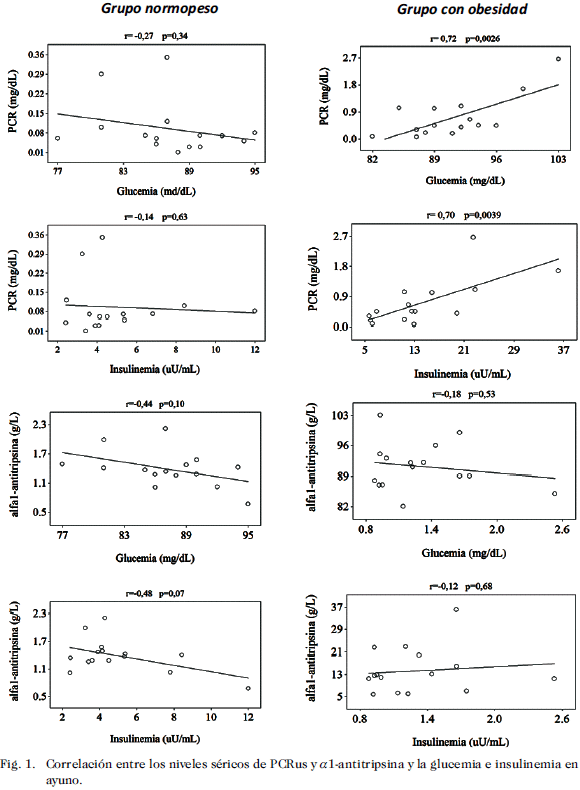
La Fig. 1 muestra la correlación positiva observada entre los niveles séricos de PCRus y los niveles de glucemia e insulinemia en ayuno en las mujeres con obesidad, la cual no se observó en las mujeres normopeso. Cuando se analizaron los niveles séricos de a1-antitripsina y la glucemia e insulinemia en ayuno, no se encontró correlación entre estos parámetros en ninguno de los dos grupos.
DISCUSIÓN
En este estudio, las mujeres con obesidad presentaron mayores niveles séricos de PCRus y éstos se correlacionaron positivamente con el IMC y la CC. Resultados similares han sido reportados (23, 24), por lo que la inflamación subclínica parece estar relacionada con el aumento en los índices de medidas antropométricas en la población suramericana. Por otro lado, no se observó diferencias entre los niveles séricos de a1-antitripsina entre mujeres con obesidad y mujeres normopeso, así como tampoco se observó correlación entre a1-antitripsina con los índices antropométricos. Resultados similares (25), parecen sugerir que el aumento del IMC y de medidas de adiposidad no influyen en los niveles séricos de a1-antitripsina. De acuerdo con lo observado en el presente estudio la RI está asociada a los niveles séricos de PCRus en mujeres venezolanas con obesidad. Las mujeres con obesidad presentaron mayor RI lo que se reflejó en los mayores valores de HOMA-IR, HOMA-b y la glucemia e insulinemia en ayuno, y estos índices se correlacionaron positivamente con los niveles séricos de PCRus, estableciendo una relación entre la inflamación subclínica y la RI. Numerosos estudios han relacionado el tejido adiposo con la inflamación subclinica y el desarrollo de RI. Las citocinas proinflamatorias como IL-6 y TNFa, producidas por el tejido adiposo en obesos (4, 5), afectan la señalización intracelular del receptor de insulina y por tanto la respuesta celular a la insulina (26, 27). Se ha reportado un aumento postprandial de la IL-6 en paralelo con los niveles de glucosa e insulina en el fluido intersticial en el tejido adiposo subcutáneo (28). Debido a que el tejido adiposo puede producir IL-6 y TNFa y la síntesis de la PCR está bajo control de IL-6 y TNFa, la asociación entre PCR y los índices de RI se debe en parte al desarrollo de la respuesta de inflamación subclínica descrita en obesos, siendo esta inflamación un puente que une la obesidad con la resistencia a la insulina.
El HOMA-b mide la secreción de insulina y es un indicador de la función de la células b pancreáticas. Las mujeres con obesidad presentaron mayores niveles de HOMA-b lo cual indica una mayor producción de insulina necesaria para mantener la homeostasis de la glucemia. Adicionalmente, el HOMA-b se correlacionó con los niveles de PCRus, estableciendo una relación entre la inflamación y la mayor producción de insulina por parte de la célula b en mujeres con obesidad, lo cual puede conducir al deterioro de la célula b y a la diabetes clínica.
El Índice Matsuda refleja principalmente la sensibilidad periférica la insulina; a menor sensibilidad a la insulina menor Índice Matsuda presentará el sujeto. Las mujeres con obesidad presentaron una correlación negativa entre los niveles séricos de PCRus y el Índice Matsuda, lo cual demuestra que éstas presentaban menor sensibilidad periférica a la insulina y tienen mayores niveles séricos de PCRus, estableciendo una clara relación entre la menor sensibilidad a la insulina observada en la obesidad y el estado de inflamación subclínica descrito en mujeres con obesidad.
Existen pocos estudios que evalúen la a1-antripsina en obesos. En este estudio no se observó diferencia entre los niveles séricos de a1-antitripsina entre las mujeres con obesidad y las mujeres normopeso; además, tampoco se encontró correlación entre los niveles séricos de a1-antitripsina y los índices de resistencia a la insulina en ninguno de los dos grupos, indicando que no existe relación entre los niveles séricos de a1-antripsina y los desórdenes metabólicos asociados a la obesidad, tal como la resistencia a la insulina. Resultados similares han sido reportados por Swiatkowska-Stodulska y col. (29); sin embargo, Karelis y col. (30) si encontraron mayores niveles de ISPs en mujeres obesas postmenopáusicas con resistencia a la insulina y dislipidemia en comparación con mujeres sin desorden metabólico.
Por otro lado, en este estudio no se observó correlación entre los niveles séricos de a1-antitripsina y los parámetros antropométricos ni en las mujeres con obesidad ni en las mujeres normopeso, lo que también fue reportado por Swiatkowska-Stodulska y col. (29), por lo que los niveles séricos de a1-antitripsina parecen no depender directamente del IMC ni del grado de obesidad en las mujeres.
Son necesarios más estudios para determinar la relación entre PCR y a1-antitripsina y la homeostasis de la glucosa. Este estudio reveló una relación entre los niveles séricos de PCRus y la resistencia a la insulina, sugiriendo un rol de la inflamación subclínica en la resistencia a la insulina y la intolerancia a la glucosa. Las investigaciones a realizar deben ir conducidas a determinar los distintos factores que determinan que un aumento en el IMC se traduzca en el establecimiento de un estado de inflamación subclínica en el individuo. El establecimiento de estos factores, puede llevar a nuevos blancos terapéuticos para prevenir el estado de inflamación subclínica y las complicaciones relacionadas con la obesidad.
REFERENCIAS
1. Lee BC, Lee J. Cellular and molecular players in adipose tissue inflammation in the development of obesity-induced insulin resistance. Biochim Biophys Acta 2014; 1842:446-462. [ Links ]
2. Bruun JM, Pedersen SB, Richelsen B. Regulation of interleukin 8 production and gene expression in human adipose tissue in vitro. J Clin Endocrinol Metab 2001; 86: 1267-1273. [ Links ]
3. Hotamisligil GS, Arner P, Caro JF, Atkinson RL, Spiegelman BM. Increased adipose tissue expression of tumor necrosis factor-α in human obesity and insulin resistance. J Clin Invest 1995; 95: 2409-2415. [ Links ]
4. Karalis KP, Giannogonas P, Kodela E, Koutmani Y, Zoumakis M, Teli T. Mechanisms of obesity and related pathology: linking immune responses to metabolic stress. FEBS J 2009; 276:5747-5754. [ Links ]
5. Wieser V, Moschen AR, Tilg H. Inflammation, cytokines and insulin resistance: a clinical perspective. Arch Immunol Ther Exp 2013; 61: 119-125. [ Links ]
6. Matthews DR, Hosker JP, Rudenski AS, Naylor BA, Treacher DF, Turner RC. Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia 1985; 28: 412-419. [ Links ]
7. Matsuda M, DeFronzo RA. Insulin sensitivity indices obtained from oral glucose tolerance testing: comparison with the euglycemic insulin clamp. Diabetes Care 1999; 22: 1462-1470. [ Links ]
8. Wallace TM, Levy JC, Matthews DR. Use and abuse of HOMA modeling. Diabetes Care 2004; 27: 1487-1495. [ Links ]
9. Hermans MP, Levy JC, Morris RJ, Turner RC. Comparison of tests of beta-cell function across a range of glucose tolerance from normal to diabetes. Diabetes 1999; 48: 1779-1786. [ Links ]
10. Van Leeuwen M, Van Rijswijk MH. Acute phase proteins in monitoring inflammatory disorders. Bailliere's Clin Rheumatol 1994; 8:531-552. [ Links ]
11. Ramírez Alvarado MM, Marcano M, Medina A, De Castillo MM. Evaluación de los niveles séricos de la interleuquina-8 y de la proteína C reactiva en sujetos obesos. Salus 2007; 11: 13-19. [ Links ]
12. Ridker PM, Hennekens CH, Buring JE, Rifai N. C-reactive protein and others markers of inflammation in the prediction of cardiovascular disease in women. N Engl J Med 2000; 342: 836-843. [ Links ]
13. Anty R, Bekri S, Luciani N, Saint-Paul MC, Dahman M, Iannelli A, Amor IB, Staccini-Myx A, Huet PM, Gugenheim J, Sadoul JL, Le Marchand-Brustel Y, Tran A, Gual P. The inflammatory C-reactive protein is increased in both liver and adipose tissue in severely obese patients independently from metabolic syndrome, type 2 diabetes, and NASH. Am J Gastroenterol 2006; 101: 1-10. [ Links ]
14. Gabay C, Kushner I. Acute-phase proteins and other systemic responses to inflammation. N Engl J Med 1999; 340: 448-454. [ Links ]
15. Engström G, Hedblad B, Stavenow L, Jonsson S, Lind P, Janzon L, Lindgärde F. Incidence of obesity-associated cardiovascular disease is related to inflammation-sensitive plasma proteins: a population-based cohort study. Arterioscler Thromb Vasc Biol 2004; 24: 1498-1502. [ Links ]
16. Jeppesen J, Hansen TW, Olsen MH, Rasmussen S, Ibsen H, Torp-Pedersen C, Hildebrandt PR, Madsbad S. C-reactive protein, insulin resistance and risk of cardiovascular disease: a population-based study. Eur J Cardiovasc Prev Rehabil 2008; 15: 594-598. [ Links ]
17. Nakanishi N, Shiraishi T, Wada M. Association between C-reactive protein and insulin resistance in a Japanese population: the Minoh Study. Intern Med 2005; 44:542-547. [ Links ]
18. Chang SA1, Kim HS, Yoon KH, Ko SH, Kwon HS, Kim SR, Lee WC, Yoo SJ, Son HS, Cha BY, Lee KW, Son HY, Kang SK. Body mass index is the most important determining factor for the degree of insulin resistance in non-obese type 2 diabetic patients in Korea. Metabolism 2004; 53:142-146. [ Links ]
19. World Health Organization. Obesity: preventing and managing the global epidemic. Report of a WHO consultation. WHO Technical Report Series 894. Geneva 2000. [ Links ]
20. American Diabetes Association. Diagnosis and classification of Diabetes Mellitus. Diabetes Care. 2014; 37(suppl 1):S81-90. [ Links ]
21. Friedewald WT, Levy RI, Fredickson DS. Estimation of the concentration of low-density lipoprotein cholesterol in plasma, without use of the preparative ultracentrifuge. Clin Chem 1972; 8:499-502. [ Links ]
22. Stern SE, Williams K, Ferrannini E, DeFronzo RA, Bogardus C, Stern MP. Identification of individuals with insulin resistance using routine clinical measurements. Diabetes 2005; 54:333-339. [ Links ]
23. Ramírez Alvarado MM, Sánchez Roitz C. Relación entre los niveles séricos de la proteína C reactiva y medidas antropométricas: una revisión sistemática de los estudios realizados en Suramérica. Nutr Hosp 2012; 27:971-977. [ Links ]
24. Nazmi A, Oliveira OI, Victora CG. Correlates of C-reactive protein levels in young adults: a population-based cohort study of 3827 subjects in Brazil. Braz J Med Biol Res 2008; 41:357-367. [ Links ]
25. Ramírez Alvarado MM, Sánchez Roitz C, Pérez Díaz A, Millán Brito E. Effect of a high saturated fatty acids load on serum concentrations of C-reactive protein, alpha1-antitrypsin, fibrinogen and alpha1-acid glycoprotein in obese women. Nutr Hosp 2010; 25:72-79. [ Links ]
26. Dali-Youcef N, Mecili M, Ricci R, Andrès E. Metabolic inflammation: connecting obesity and insulin resistance. Ann Med 2013; 45:242-253. [ Links ]
27. Harford KA, Reynolds CM, McGillicuddy FC, Roche HM. Fats, inflammation and insulin resistance: insights to the role of macrophage and T-cell accumulation in adipose tissue. Proc Nutr Soc 2011; 70: 408-417. [ Links ]
28. Orban Z, Remaley AT, Sampson M, Trajanoski Z, Chrousos GP. The differential effect of food intake and beta-adrenergic stimulation on adipose-derived hormones and cytokines in man. J Clin Endocrinol Metab 1999; 84:2126-2133. [ Links ]
29. Swiatkowska-Stodulska R, Babińska A, Skibowska-Bielińska A, Sworczak K. Assessment of alpha1-antitrypsin and alpha2- macroglobulin levels in obese patients. Pol Arch Med Wewn 2008; 118: 713-718. [ Links ]
30. Karelis AD, Faraj M, Bastard JP, St-Pierre DH, Brochu M, Prud'homme D, Rabasa-Lhoret R. The metabolically healthy but obese individual presents a favorable inflammation profile. J Clin Endocrinol Metab 2005; 90: 4145-4150. [ Links ]