Investigación Clínica
versión impresa ISSN 0535-5133
Invest. clín vol.57 no.3 Maracaibo set. 2016
Efecto de la adrenomedulina cerebelosa frente al estrés agudo.
Effect of cerebellar adrenomedullin during acute stress.
Leticia Figueira y Anita Israel.
Laboratorio de Neuropéptidos. Facultad de Farmacia. Universidad Central de Venezuela. Caracas - Venezuela. Correo electrónico: astern88@gmail.com
Palabras clave: adrenomedulina; cerebelo; vermis; estímulo eléctrico plantar; estrés.
Resumen.
La adrenomedulina (AM) es un péptido involucrado en la regulación cardiovascular. En el cerebelo, la densidad de los receptores de la AM se encuentra alterada durante la hipertensión, sugiriendo un posible papel del sistema adrenomedulinérgico cerebelar en la regulación de la presión arterial (PA). El objetivo del presente estudio fue evaluar el efecto funcional in vivo de la AM durante el estrés agudo, mediante la administración in situ de AM en el vermis cerebelar de la rata. Se emplearon ratas adultas normotensas Wistar Kyoto (WKY) y Sprague Dawley (SD) y ratas espontáneamente hipertensas (SHR) las cuales fueron anestesiadas y posteriormente canuladas en el vermis cerebelar. El estrés se indujo mediante el uso del estímulo eléctrico plantar (EEP). Los animales fueron divididos en grupos que recibieron AM (0,2 o 200 pmol/5μL) o vehículo (solución fisiológica, 5μL). La PA se determinó antes del experimento y después de la administración del tratamiento respectivo, seguida de la aplicación del EEP (100 V, 5 Hz, 10 mseg, durante 4 minutos). La PA se determinó mediante pletismografía digital no invasiva. Los resultados demuestran que la microinyección de AM (0,2 y 200 pmol) in situ en el vermis cerebeloso en ratas SD, WKY y SHR disminuye significativamente la respuesta presora frente al estrés inducido por el EEP, lo que sugiere que la acción hipotensora está mediada a través de la regulación del eflujo simpático. Estos hallazgos demuestran la participación de la AM cerebelosa en la regulación de la respuesta cardiovascu lar frente al estrés.
Abstract.
Adrenomedullin (AM) is a peptide involved in cardiovascular regulation. In the cerebellum, the density of AM receptors is altered during hypertension, suggesting a pos sible role of cerebellar adrenomedulinergic system in the regulation of blood pressure (BP). The aim of this study was to evaluate the functional role of AM during acute stress, by in situ administration of AM into the cerebellar vermis in rats. Adult normotensive Wistar Kyoto (WKY) and Sprague Dawley (SD) rats and spontaneously hypertensive rats (SHR), were anes thetized and their cerebellar vermis cannulated. Footshock was used as stressor. Animals were divided into groups that received either AM (0.2 and 200 pmol/5μL) or vehicle (physiological saline, 5μL). The BP was determined, using noninvasive digital plethysmography, before and after treatment, followed by footshock (100V, 5 Hz, 10 msec, for 4 minutes). The results show that microinjection of AM (0.2 and 200 pmol) in situ into the cerebellar vermis in SD, WKY and SHR rats, significantly decreased the pressor response induced by footshock stress, sugges ting that the hypotensive action is mediated through regulation of sympathetic outflow. Taken together, our results demonstrate a role of cerebellar AM in the regulation of cardiovascular response to stress.
Key words: adrenomedullin; cerebellum; vermis; footshock; stress.
Recibido: 21-10-2015 . Aceptado: 10-03-2016
INTRODUCCIÓN
El estrés se define como la respuesta no específica del organismo ante cualquier demanda del exterior. En efecto, la vida existe en el organismo gracias a la presencia de un complejo equilibrio dinámico conocido como homeostasis, el cual se encuentra en constante cambio por fuerzas adversas intrínsecas o extrínsecas, los estresores (1). La respuesta a los estímulos estresantes del medio ambiente y las experiencias adversas, involucran la activación de vías complejas en el sistema nervioso central (SNC), que incluyen desde la percepción del estrés hasta respuestas conductuales, autonómicas y endocrinas, y el incremento de las actividades de diversos sistemas fisiológicos que induce la interrupción de la homeostasis (2,3). Las estaciones del control central del sistema de estrés están localizadas en el hipotálamo y en el tallo cerebral e incluyen neuronas parvocelulares que sintetizan y secretan la hormona liberadora de corticotropina (CRH), las neuronas del núcleo paraventricular del hipotálamo que liberan la arginina-vasopresina y el locus coeruleus (LC) (sistema simpático central) (4,5). El eje hipo tálamo-pituitario-adrenal (HPA), junto con el sistema eferente simpático adrenomedular, re presentan en conjunto el órgano efector, los cuales vía estimulación del cerebro influyen en todos los órganos del cuerpo ante la exposición a un estímulo estresor (6). En el cerebro también existe modulación de los eferentes vagales y de la porción eferente parasimpática sacra que median las respuestas del intestino ante el estrés (7). Poco se conoce acerca del papel del cerebelo en la respuesta al estrés. Al respecto, la evidencia muestra que el estrés crónico por inmovilización produce alteraciones del comportamiento que podrían estar relacionados con cambios moleculares en las áreas del SNC que regulan las funciones motoras, tales como el ce rebelo (8). Igualmente, se demostró que en ratas expuestas a estrés por nado forzado durante 7 días, se produce una elevación significativa en la peroxidación de lípidos en el cerebelo, lo que sugiere que el estrés activa los procesos de producción de radicales libres que conducen a un aumento en la peroxidación lipídica en el cerebelo (9).
Algunos factores neuroendocrinos como las catecolaminas, CRH, serotonina, endotelinas, vasopresina y la angiotensina II (ANG II) actúan en los circuitos centrales mediando las respues tas de estrés (6). La participación en la respuesta al estrés de los péptidos pertenecientes a la su perfamilia de la calcitonina/péptido relacionado con el gen de la calcitonina (CGRP)/amilina, entre ellos la adrenomedulina (AM) (10,11), es poco conocida. La AM es un péptido de 52 aminoácidos (humano) o de 50 aminoácidos (rata) que muestra homología con el CGRP (12), con acción hipotensora y vasodilatadora potente. Los niveles de AM se encuentran significativa mente elevados en pacientes con hipertensión (13). De igual manera, se ha descrito que el es trés por restricción de movimiento estimula la actividad simpática, así como del eje HPA, y produce un aumento significativo en los niveles de AM en el plasma, en la glándula pituitaria y glándulas suprarrenales, todos los cuales son componentes clave del eje HPA (14), lo cual sugiere que la AM ejerce funciones regulatorias y de protección para contrarrestar la activación del eje HPA inducida por una variedad de estresores fisiológicos y psicológicos (14). Efectivamente, los efectos endocrinos de la AM están mediados a través de la inhibición de la liberación de la hormona adrenocorticotropa (ACTH), cortisol (15), corticosterona (16) y aldosterona estimu lada ANG II (17).
Parte de las acciones protectoras de la AM ante el estrés podrían estar mediadas a través del SNC; la evidencia apoya esta posibilidad, ya que se ha demostrado la existencia de recepto res de AM y de sus componentes en diferentes estructuras del SNC y específicamente en el ce rebelo (18,19). Igualmente, nuestros hallazgos recientes demuestran la existencia de un sistema adrenomedulinérgico cerebeloso funcional, el cual se encuentra desregulado durante la hipertensión (19-21). Aún más, la administración de AM en el cerebelo en condiciones de hipertensión produce un profundo efecto hipotensor, de pendiente de la dosis y sitio específico, mediado a través de la estimulación del receptor AM1 (21). Aún cuando estos hallazgos demuestran que la AM cerebelosa participa en la regulación de la presión arterial (PA), se desconoce si el sistema adrenomedulinérgico cerebeloso es capaz de regular la respuesta cardiovascular frente al estrés. Es por ello que en el presente estudio nos propusimos evaluar si la AM cerebelosa es capaz de modular la respuesta presora inducida por el estímulo eléctrico plantar (EEP), el cual constituye un modelo de estrés agudo.
MATERIALES Y MÉTODOS
Animales de Experimentación
Se emplearon ratas macho, de 16 semanas de edad, de las cepas Sprague Dawley (SD), Wistar Kyoto (WKY) y espontáneamente hipertensas (SHR) provenientes del Instituto Venezolano de Investigaciones Científicas (IVIC) (Caracas, Venezuela). Los animales fueron mantenidos en parejas en jaulas plásticas, a temperatura am biente con ciclos de 12 horas luz / oscuridad. La dieta de los animales consistió en Ratarina® y agua ad libitum . Los experimentos fueron realizados siguiendo las buenas prácticas para el manejo de animales de laboratorio (22) y la aprobación del Comité de Bioterio de la Facul tad de Farmacia de la Universidad Central de Venezuela.
Administración in situ en el vermis cerebeloso de AM o ANG II en animales sometidos a EEP
Los animales fueron anestesiados con pentobarbital sódico a la dosis de 40 mg/Kg. Poste riormente, mediante el uso de un aparato estereo táxico (David Kopf Instruments) se procedió a la canulación en el vermis del cerebelo de acuer do a las coordenadas estereotáxicas antero-pos terior (AP): -10,3, Lateral (L):0 y ventral (V): 2,4 de acuerdo a Pellegrino y col., y Sacchetti y col., (23,24). Se permitió la recuperación de los animales (3 días) y los mismos fueron divididos en dos grupos cada uno. El día del ensayo se determinó la PA basal de cada animal, y poste riormente se procedió a determinar el efecto de la administración in situ de AM en el vermis de cerebelo sobre la respuesta presora inducida por el EEP in vivo en ratas SD, WKY y SHR. Igual mente, se evaluó el efecto de la administración in situ de ANG II en el vermis de cerebelo sobre la respuesta presora inducida por el EEP en ratas SHR. Para ello, cada cepa de ratas previamente canulada en el vermis, fueron divididas en dos grupos experimentales a los cuales se les deter minó la PA basal. Posteriormente, a un grupo se le administró AM (American Peptide, Company Inc.) (0,2 o 200 pmol/ 5μL) y al otro vehícu lo (solución fisiológica, 5 μL). Inmediatamente después del tratamiento respectivo, cada animal fue transferido a una caja de plexiglas con una rejilla de cobre (dentro de la estufa), donde re cibió una descarga eléctrica en las patas (100 V, 5 Hz, 10 mseg, durante 4 minutos) suminis trada mediante un estimulador Grass (Modelo 48), después de lo cual se les determinó los pa rámetros cardiovasculares. Para evaluar si los cambios en la PA media (PAM) inducido tras la administración de AM fueron específicos de la sustancia, se determinó el efecto de la admi nistración in situ de ANG II (American Peptide, Company Inc) (200 pmol/ 5μL) en el vermis del cerebelo sobre la respuesta presora inducida por el EEP en ratas SHR. Los resultados fueron ex presados como la media ± error estándar de la media del PAM (mmHg) con respecto a sus va lores basales (antes de la administración de AM o vehículo). Se tomaron los datos de aquellos animales en los que el colorante se localizó en el vermis cerebeloso. Para evaluar si los cambios en PAM inducidos tras la administración de AM fueron sitio específico, se determinó el efecto de la administración in situ de AM (200 pmol/ 5μL) fuera del vermis cerebeloso sobre la respuesta presora inducida por el EEP en ratas SD, WKY y SHR. En este caso se tomó en cuenta los datos de aquellos animales en los que el co lorante se localizó fuera del vermis del cerebelo.
Determinación de la PA
El registro de los parámetros cardiovascu lares, presión sistólica (PS) y presión diastólica (PD) se realizó en las ratas conscientes por un método no invasivo mediante el uso de un ple tismógrafo digital de cola (Digital Pressure Me ter LE 5002 LETICA ®, Panlab, S.L. Barcelona - España). Dicho equipo emplea una aproxima ción de la medida de la PA que es básicamente esfigmomanométrica. La PAM fue calculada de la siguiente manera, PAM= PD+1/3 (PS-PD). La semana previa al experimento, se determi nó diariamente la PA y frecuencia cardíaca, para minimizar el estrés asociado al manejo y al mo vimiento de la cola (período de adaptación).
Análisis Estadístico
Los resultados fueron expresados como la media ± error estándar de la media (E.E.M.). Se utilizó la prueba de Kruskall – Wallis para comparar los valores de tres grupos, con análisis posthoc mediante la prueba de U-deMann-Whitney sobre cada par de grupos. Un valor de p<0,05 fue considerado significativo. El análisis de los resultados y la elaboración de los gráficos se realizó empleando el programa Graph Pad Prism versión 5.1.
RESULTADOS
Efecto de la administración in situ intracerebelar de AM sobre la PAM en ratas SD, WKY y SHR adultas sometidas a estrés por EEP
Como se observa en la Fig. 1, el EEP pro dujo una respuesta presora significativa (+35 mmHg). La administración intracerebelar de AM (0,2 pmol/5μL) bloqueó completamente la respuesta presora frente al EEP. Aún más, la administración de AM a una dosis de 200 pmol/5μL no sólo bloqueó la respuesta presora frente al estrés sino que produjo una respuesta hipotensora profunda y significativa. Este efec to de la AM frente a la respuesta presora al EEP fue similar en las tres cepas evaluadas: ratas SD, WKY y SHR. La acción de la AM sobre la respuesta presora se indica en el gráfico del área bajo la curva (AUC) que demuestra clara mente el efecto dependiente de la dosis (N=10, p<0,05).
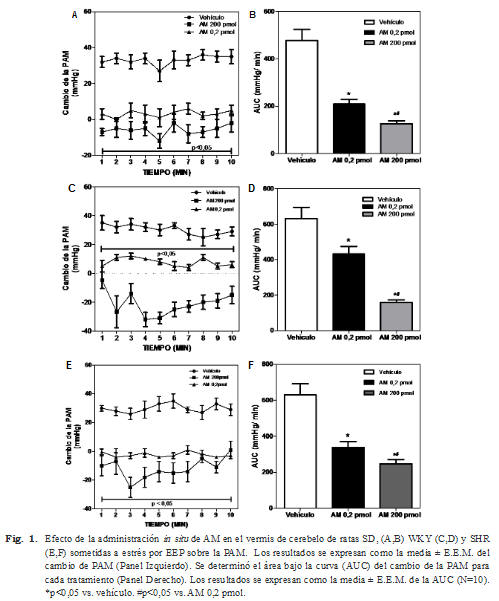
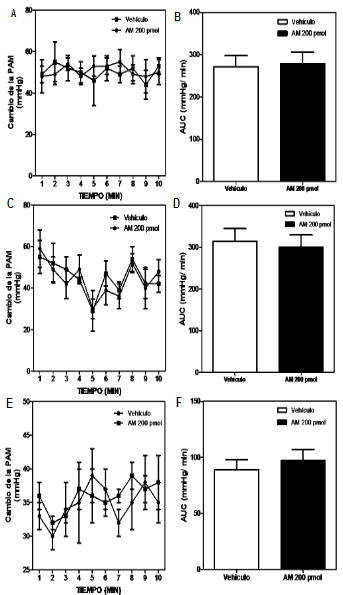
Para evaluar si los cambios en la PAM indu cidos tras la administración de AM son sitio específicos, se evaluó el efecto de la administra ción in situ de AM fuera del vermis de cerebelo sobre la PAM en ratas SD, WKY y SHR in vivo sometidas a estrés por EEP. Como se observa en la Fig. 2, la administración de AM (200 pmol/5μL) fuera del vermis cerebelar de ratas SD, WKY y SHR, no fue capaz de alterar la respuesta presora inducida por el EEP (N=10).

Efecto de la administración intrace rebelar de ANG II sobre la PAM en ra tas SHR adultas sometidas a estrés por EEP
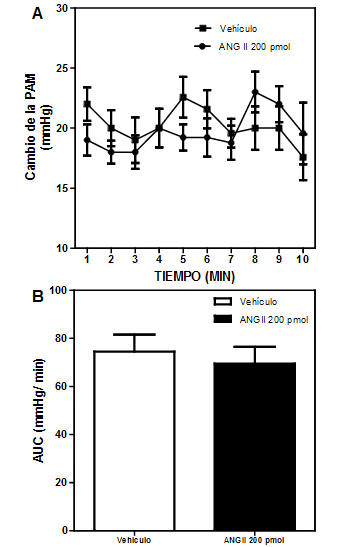
Se evaluó el efecto de la administración in situ de ANG II en el vermis del cerebelo sobre el cambio de PA en ratas SHR sometidas a estrés por EEP in vivo . Como se observa en la figura 3, la administración intracerebelar de vehículo o ANGII (200 pmol/5μL), en las ratas SHR some tidas a EEP, no provocó cambios en la magnitud de la respuesta presora al estrés cuando se compara con el vehículo (N=10).

DISCUSIÓN
Se ha demostrado la presencia de un sistema adrenomedulinérgico en el SNC, el cual posee relevancia funcional. Efectivamente, se ha des crito la presencia de sitios de unión específicos para la AM en áreas del cerebro como la corteza cerebral, el bulbo olfatorio, núcleo accumbens, caudado-putamen, tálamo, hipotálamo, bulbo raquídeo, órganos circunventriculares y el cere belo (18, 25,26). Igualmente, se ha demostrado la expresión de los componentes de los recep tores de AM en diferentes áreas del SNC y entre ellas el cerebelo (27,28). Específicamente, resultados recientes mostraron la presencia de AM y los componentes de su receptor en el ver mis cerebeloso de ratas WKY y SHR, indicando la presencia de receptores del péptido relacio nado al gen de la calcitonina 1 (CGRP1), AM tipo 1 (AM1) y AM tipo 2 (AM2) en esta área (11,18-21, 29,30). Aún más, mediante estudios de microscopía de luz y electrónica se ha de mostrado la presencia de AM inmunoreactiva en las células de Purkinje, en los terminales de las fibras musgosas y en las neuronas de los núcleos cerebelosos (18). Igualmente, se ha descrito en las células de Purkinje la presencia del ARNm de la proteína que modifica la actividad de re ceptor tipo 1 (RAMP1) y tipo 2 (RAMP2), y del ARNm de la proteína que modifica la activi dad de receptor tipo 3 (RAMP3) en las células granulosas (27). Esto indica un papel funcional de la AM cerebelosa y sugiere que este péptido podría participar en funciones cerebelosas como un factor autocrino/paracrino.
Desde que existe el sustrato anatómico y de receptores que responden a la AM en el cere belo, es lógico pensar que la AM administrada directamente en el cerebelo debería ejercer al guna función en la regulación cardiovascular. Al respecto, previamente hemos demostrado que la microinyección de AM en el vermis del cere belo de ratas hipertensas provoca una poderosa respuesta hipotensora, la cual fue específica y dependiente de la dosis (20,21). Por el contra rio, la AM no fue capaz de reducir la PA en las ratas normotensas tras la microinyección en el vermis cerebeloso en ausencia de estímulos estresores. La especificidad de la acción hipo tensora de la AM administrada en el vermis ce rebeloso se apoya aún más por el hecho que la administración del péptido fuera del vermis no ocasionó el efecto hipotensor en las ratas SHR y la administración in vivo de un péptido presor como la ANG II en el vermis de cerebelo tam poco modificó la PA (20,21), aún cuando se sabe que existen receptores para la ANG II en el ce rebelo (31,32). En este sentido, existe estudios que demuestran que la aplicación iontoforética de ANG II en el cerebelo causa depresión de la tasa de disparo de las células de Purkinje (33). Por lo tanto, los resultados del presente estudio constituyen la primera evidencia funcional in vivo del papel de la AM en el vermis cerebeloso en el control de la PA.
El mecanismo hipotensor preciso de la AM en el vermis cerebeloso en ratas hipertensas no se ha podido establecer hasta el presente, pero podría estar asociado a la regulación de la acti vidad o eflujo simpático y parece requerir de un sistema estimulado. Si ello es así, la adminis tración de AM en el vermis cerebeloso debería contrarrestar la respuesta presora producida por el estrés agudo inducido por el EEP en ratas, cuya respuesta efectora neuroendocrina es el sistema simpático – adrenal y que se manifiesta con un incremento en la frecuencia cardíaca, PA y respiración, alteraciones del flujo sanguíneo a los tejidos, aumento de la glicemia y dismi nución de la motilidad intestinal (34). Los re sultados presentes apuntan a esa posibilidad; en efecto, el estrés agudo producido por el EEP incrementó la PA en las ratas SD, SHR y WKY (34-36), posiblemente debido a un incremento en la liberación de catecolaminas a la circula ción (11,37,38). La microinyección de la AM en el vermis cerebeloso fue capaz de disminuir la respuesta presora frente al EEP, tanto en las ratas normotensas como hipertensas, lo cual su giere que la AM intracerebelar puede actuar in hibiendo el eflujo simpático. Nuevamente, este efecto fue sitio dependiente y específico ya que la administración de AM fuera del vermis o de ANG II en el vermis cerebeloso no modificó la respuesta presora al estrés agudo inducido por EEP. En este sentido, existen estudios que de muestran que la aplicación microiontoforética de ANG II en el cerebelo causa depresión de la tasa de disparo de las células de Purkinje (33). Contrario a los hallazgos de este estudio, la literatura indica que la AM en otras regio nes del cerebro aumenta la actividad simpática y el eflujo simpático renal. Efectivamente, se ha demostrado que la administración de AM en la región ventrolateral rostral del bulbo ra quídeo (RVLM) aumenta la PA, lo que sugiere que la AM estimula neuronas de RVLM las cuales controlan la actividad simpática cardía ca (39,40). Asimismo, la administración de AM intracerebroventricular (icv) provocó una eleva ción en la PA, lo cual parece ser mediado por el incremento de la actividad simpática (41-43) ya que fue bloqueado por la administración perifé rica de un bloqueante alfa adrenérgico como la fentolamina (44); esto sugiere que la AM esta involucrada como un neuropéptido en la regu lación central de la función cardiovascular y simpática renal. De igual manera, Taylor y col., (45) encontraron que la administración icv de AM fue capaz de incrementar los niveles plas máticos de corticosterona, sugiriendo que la AM actúa dentro del hipotálamo estimulando la libe ración de la CRH, y por lo tanto incrementando la actividad del eje HPA. Aún más, la adminis tración icv de AM estimula el eflujo simpático y la descarga simpática renal y abdominal (46 49) e incrementa la sensibilidad del baroreflejo (46). Adicionalmente, la administración icv de AM activa neuronas en el núcleo paraventricu lar (NPV), el cual está asociado con regulación cardiovascular y simpática central (43,47). Asi mismo, se ha demostrado que la microinyección de AM icv estimula la expresión del gentirosina hidroxilasa, la enzima limitante de la síntesis de la noradrenalina, a nivel del LC (43); por lo tanto, como las neuronas noradrenérgicas del LC participan en importantes procesos regulando la función cardiovascular, es posible que la AM pueda mediar algunos de sus efectos a través de sus acciones en el sistema catecolaminérgico del LC (48,49).
El efecto hipotensor e inhibidor de la respuesta simpatoadrenal observado en el presente trabajo es difícil de explicar hasta los momentos, pero se podría especular que el cerebe lo a través de sus conexiones neuroanatómicas desde el núcleo fastigio y mediado a través de la vía de señalización del óxido nítrico / guanosina monofostato cíclico (NO/GMPc) podría constituir un sistema contraregulador potente de los efectos excitatorios de los núcleos ce rebrales que participan en la regulación de la PA. Se sabe que el núcleo fastigio cumple un importante papel en la regulación del sistema nervioso autónomo, pues este núcleo proyecta a estructuras del tallo cerebral como el RVLM, el cual a su vez recibe inervación del NPV y núcleo supraóptico (NSO) hipotalámico (50). Aunado a ello, las neuronas que producen NO se encuentran en centros autonómicos que in cluyen el NPV, NSO, núcleo del tracto solita rio (NTS) y la columna ventrolateral (VLM) e intermediolateral de la médula espinal (51). En el NPV, el NO inhibe la actividad simpática a través de la estimulación de interneuronas GA BAérgicas (52,53). Por su parte, en el NTS y VLM, el NO tiene efectos tanto simpato-exci tatorios como simpato-inhibitorios, sugiriendo que en el tallo cerebral, el NO regula el eflujo simpático, a través de un balance de las salidas de estos centros autonómicos (51). Aún más, la AM icv estimula la producción de NO en el hi potálamo y activa neuronas productoras de NO en el NPV (45). La estimulación del eflujo sim pático mediante la administración icv de AM junto con la inhibición del eflujo simpático por el NO en el NPV, sugiere que la estimulación inducida por la AM del sistema nitrérgico en el hipotálamo, puede ser parte de un mecanismo de retroalimentación, que actúa para restablecer el equilibrio homeostático (49). En apoyo a ello, se ha reportado que la administración icv de AM a bajas dosis causa inhibición de la actividad simpática renal (54). Adicionalmente, Fujita y col., (55) encontraron que la AM endógena en el cerebro puede inhibir la activación simpática a través de su acción antioxidante. Por su par te, Xu y Krukoff (56) indicaron que la AM en el RVLM ejerce un efecto inhibitorio sobre la actividad del baroreflejo a través de un meca nismo mediado por los receptores específicos de AM, donde la activación de la proteína quinasa A (PKA) está involucrada.
En conclusión, la evidencia indica que la AM cerebelar constituye un poderoso péptido hipotensor y atenuador del eflujo simpático, y refuerza el concepto novedoso de la existencia de un sistema adrenomedulinérgico cerebelar de importancia fisiológica, sugiriendo su papel protector ante el estrés agudo, con potencial aplicación farmacológica a futuro. Se abren así nuevas rutas para el estudio de vías neuroanató micas y neuropeptidérgicas involucradas en la regulación de la PA y la respuesta cardiovascu lar frente al estrés agudo, aún no descritas en profundidad.
AGRADECIMIENTOS
Los autores agradecen al Sr. Banny Cara ballo por su ayuda técnica en los experimentos. Este trabajo fue subvencionado por el CDCH UCV y por el Ministerio Popular de Ciencia Tecnología e Industrias, Proyecto Misión Cien cia, Sub-proyecto 7, ECCV No. 2007001585 y el Proyecto PEII No. 20122000760.
REFERENCIAS
1. Chrousos GP, Gold PW. The concepts of stress system disorders: overview of be havioral and physical homeostasis. JAMA 1992; 267:1244 – 1252. [ Links ]
2. McEwen BS, Magarinos AM, Reagan LP. Studies of hormone action in the hi ppocampal formation: possible relevance to depression and diabetes. J Psychosom Res 2002; 53(4): 883-890. [ Links ]
3. McEwen BS. Stressed or stressed out: What is the difference? J Psychiatry Neu rosci 2005; 30(5): 315-318. [ Links ]
4. Chrousos GP. Regulation and dysregula tion of the hypothalamic–pituitary–adrenal axis: the corticotropin releasing hormo ne perspective. Endocrinol Metab Clinic North Am 1992; 21:833– 858. [ Links ]
5. Tsigos C, Chrousos GP. Physiology of the hypothalamic–pituitary–adrenal axis in health y dysregulation in psychiatric and autoimmune disorders. Endocrinol Metab Clin North Am 1994; 23:451–466. [ Links ]
6. Johnson EO, Kamilaris TC, Chrousos GP, Gold PW. Mechanisms of stress: A dy namic overview of hormonal and behavio ral homeostasis. Neurosci Biobehav Rev 1992; 16 (2): 115-130. [ Links ]
7. Habib KE, Gold PW, Chrousos GP. Neu roendocrinology of stress. Endocrinol Me tab Clin North Am 2001; 30:695–728. [ Links ]
8. Babenko O, Golubov A, Ilnytskyy Y, Ko valchuk I, Metz GA. Genomic and epige nomic responses to chronic stress involve miRNA-mediated programming. PLoS One 2012; 7(1):e29441. [ Links ]
9. Nayanatara AK, Nagaraja HS, Anupa ma BK. The effect of repeated swimming stress on organ weights and lipid peroxida tion in rats. Ai J Physiol Sci 2005; 18: 3-9. [ Links ]
10. Ichiki Y, Kitamura K, Kangawa K, Kawamoto M, Matsuo H, Eto T. Distri bution and characterization of immunore active adrenomedullin in human tissue and plasma. FEBS Lett 1994; 338: 6-10. [ Links ]
11. Sakata J, Shimokubo T, Kitamura K, Nishizono M, Iehiki Y, Kangawa K, Mat suo H, Eto T. Distribution and characteri zation of immunoreactive rat adrenomedu llin in tissue and plasma. FEBS Lett 1994; 352: 105-108. [ Links ]
12. Kitamura K, Kangawa K, Kawamoto M, Ichiki Y, Nakamura S, Matsuo H, Eto T. Adrenomedullin: a novel hypotensive pep tide isolated from human pheochromocyto ma. Biochem Biophys Res Commun 1993; 192: 553-560. [ Links ]
13. Hu W, Zhou P, Zhang X, Xu C, Wang W. Plasma concentrations of adrenomedullin and natriuretic peptides in patients with es sential hypertension. Exp Ther Med 2015; 9(5): 1901-1908. [ Links ]
14. Khan S, Michaud D, Moody TW, Anis man H, Merali Z. Effects of acute restra int stress on endogeneous adrenomedullin levels. Neuroreport 1999; 10: 2829-2833. [ Links ]
15. Parkes DG, May CN. ACTH-suppressive and vasodilator actions of adrenomedu llin in conscious sheep. J Neuroendocrinol 1995; 7: 923-929. [ Links ]
16. Ziolkowska A1, Budzynska K, Trejter M, Tortorella C, Belloni AS, Malendowicz LK. Effects of adrenomedullin and its frag ment 22-52 on basal and ACTH-stimulated secretion of cultured rat adrenocortical cells. Int J Mol Med 2003; 11:613-615. [ Links ]
17. Albertin G, Malendowicz LK, Tortorell C, Mazzocchi G, Nussdorfer GG. Eviden ce for a paracrine role of adrenomedullin in the physiological resetting of aldosterone secretion by rat adrenal zona glomerulosa. Peptides 2000; 21: 413-417. [ Links ]
18. Serrano J, Uttenthal O, Martínez A, Fernández P, Martínez J, Alonso D, Bentura M, Santacana M, Gallardo J, Martínez R, Cutitta F, Rodrigo J. Distri bution of adrenomedullin – like inmunore activity in the rat central nervous system by light and electron microscopy. Brain Res 2000; 853: 245-268. [ Links ]
19. Figueira L, Israel A. Desregulación del sistema adrenomedulinérgico cerebeloso en la hipertensión arterial. Rev Lat Hipert 2013; 8: 9-15. [ Links ]
20. Figueira L, Israel A. Efecto hipotensor de la adrenomedulina cerebelosa. Rev Lati noamer Hipert 2013; 8: 62-67. [ Links ]
21. Figueira F, Israel A. Role of cerebellar adrenomedullin in blood pressure regula tion. Neuropeptides 2015; 54: 59-66. [ Links ]
22. NIH Guide for the care and use of ani mals. Institute of Laboratory Animal Re sources. National Research Council. Was hington DC, USA. National Academy Press. 1996.
23. Pellegrino L, Pellegrino A, Cushman A. A Stereotaxic Atlas of the rat brain. New York and London. Plenum Press. Springer. 1979.
24. Sacchetti B, Baldi E, Lorenzini C, Bu cherelli C. Cerebellar role in fear – con ditioning consolidation. PNAS 2002; 12: 8406-8411. [ Links ]
25. Juaneda C, Dumont Y, Chabot JG, Fournier A, Quirion R. Adrenomedu llin receptor binding sites in rat brain and peripheral tissues. Eur J Pharmacol 2003; 474:165-174. [ Links ]
26. Macchi V, Porzionato A, Belloni AS, Stecco C, Parenti A, De Caro R. Immuno histochemical mapping of adrenomedullin in the human medulla oblongata. Peptides 2006; 27: 1397-1404. [ Links ]
27. Ueda T, Ugawa S, Saishin Y, Shimada S. Expression of receptor – activity modif ying protein (RAMP) mRNAs in the mou se brain. Brain Res Mol Brain Res 2001; 93: 36-45. [ Links ]
28. Stachniak TJ, Krukoff TL. Receptor acti vity modifying protein 2 distribution in the rat central nervous system and regulation by changes in blood pressure. J Neuroen docrinol 2003; 15: 840-850. [ Links ]
29. Edvinsson L, Eftekhari S, Salvatore CA, Warfvinge K. Cerebellar distribution of calcitonin gene – related peptide (CGRP) and its receptor components calcitonin re ceptor – like receptor (CLR) and receptor activity modifying protein 1 (RAMP1) in rat. Mol Cell Neurosci 2011; 46: 333-339. [ Links ]
30. Juaneda C, Dumont Y, Chabot JG, Qui rion R. Autoradiographic distribution of adrenomedullin receptors in the rat brain. Eur J Pharmacol 2001; 421: R1-R2. [ Links ]
31. Dinh D, Frauman A, Johnston C, Fabia ni M. Angiotensin receptors: distribution, signalling and function. Clin Sci 2001; 100: 481-492. [ Links ]
32. Arce M, Sanchez S, Seltzer A, Ciuffo G. Autoradiographic localization of angioten sin II receptors in developing rat cerebe llum and brainstem. Regul Pept 2001; 99: 53-60. [ Links ]
33. Ito M. Functional roles of neuropeptides in cerebellar circuits. Neuroscience 2009; 162: 666-672. [ Links ]
34. McCarty R, Gold PW. Catecholamine, stress, and disease: A Psychobiological perspective. Psychosom Med 1996; 58: 590-597. [ Links ]
35. Verago J, Grassi D, Spadari R. Metabo lic markers following beta – adrenoceptor agonist infusion in footschok – stressed rat. Braz J Med Biol Res 2001; 34: 1197-1207. [ Links ]
36. Penna L, Bassani R. Increased sponta neous activity and reduced inotropic response to catecholamines in ventricular myocytes from fooshock – stressed rats. Stress 2010; 13 (1): 73-82.
37. Kvetnansky R, Sun C, Lake C, Thoa N, Torda T, Kopin I. Effect of handling and forced immobilization on rat plasma levels of epinephrine, norepinephrine, and do pamine-beta-hydroxylase. Endocrinology 1978; 103: 1868-1874. [ Links ]
38. Sabban E. Catecholamines in stress: mole cular mechanisms of gene expression. En docrine Reg 2007; 41: 61-73. [ Links ]
39. Xu Y, Krukoff T. Adrenomedullin in the rostral ventrolateral medulla increases arte rial pressure and heart rate: roles of gluta mate and nitric oxide. Am J Physiol 2004; 287: R729- R734. [ Links ]
40. Ji SM, He RR. Microinjection of adreno medullin into rostral ventrolateral medulla increases blood pressure, heart rate and renal sympathetic nerve activity in rats. Sheng Li Xue Bao 2002; 54: 460-466. [ Links ]
41. Takahashi H, Watanabe T, Nishimura M, Nakanishi T, Sakamoto M, Yoshimu ra Y, Masuda M, Murakani T. Centra lly induced vasopressor and sympathetic responses to a novel endogenous peptide, adrenomedullin, in anesthezides rats. Am J Hypertens 1994; 7: 478- 482. [ Links ]
42. Saita M, Shimokawa A, Kunitake T, Kato K, Hanamori T, Kitamura K, Eto T, Kannan H. Central actions of adreno medullin on cardiovascular parameters and sympathetic outflow in conscious rats. Am J Physiol 1998; 274: R979-R984. [ Links ]
43. Shan J, Krukoff TL. Distribution of pre proadrenomedullin mRNA in the rat central nervous system and its modulation by physiological stressors. J Comp Neurol 2001; 432: 88-100. [ Links ]
44. Samson W, Murphy T, Resch Z. Central mechanisms for the hypertensive effects of preproadrenomedullin – derived peptides in conscious rats. Am J Physiol 1998; 274: R1505-R1509. [ Links ]
45. Taylor M, Samson W. A possible mecha nism for the action of adrenomedullin in brain to stimulate stress hormone secretion. Endocrinology 2004; 145: 4890-4896. [ Links ]
46. Matsumura K, Abe I, Tsuchihashi T, Fu jishima M. Central adrenomedullin aug ments the baroreceptor reflex in conscious rabbits. Hypertension 1999; 33: 992-997. [ Links ]
47. Xu Y, Krukoff TL. Decrease in arterial pressure induced by adrenomedullin in the hypothalamic paraventricular nucleus is mediated by nitric oxide and GABA. Reg Pept 2004; 119:21-30. [ Links ]
48. Aston G, Shipley M, Chouvet G, Ennis M, Van Bockstaele E, Pieribone V. Affe rent regulation of locus coeruleus neuro nes: anatomy, physiology and pharmacolo gy. Prog Brain Res 1991; 88: 47-75. [ Links ]
49. Shan J, Stachniak T, Jhamandas J, Krukoff T. Autonomic and neuroendcrine actions of adrenomedullin in the brain: me chanisms for homeostasis. Reg Pept 2003; 112: 33-40. [ Links ]
50. Nisimaru N. Cardiovascular modules in the cerebelum. Jpn J Physiol 2004; 54: 431-448. [ Links ]
51. Krukoff TL. Central actions of nitric oxi de in regulation of autonomic functions. Brain Res Rev 1999; 30: 52-65. [ Links ]
52. Bains J, Ferguson A. Nitric oxide regu lates NMDA- driven GABAergic inputs to type I neurons of the rat paraventricular nucleus. J Physiol 1997; 499: 733-746. [ Links ]
53. Zhang J, Patel K. Effect of nitric oxide within the paraventricular nucleus on re nal sympathetic nerve discharge: role of GABA. Am J Physiol 1998; 275: R728- R734. [ Links ]
54. Mitsuhiko S, Shimokawa A, Kunitake T, Kato K, Hanamori T, Kitamura K, Eto T, Kannnan H. Central actions of adreno medullin on cardiovascular parameters and sympathetic outflow in conscious rats. Am J Physiol (Regulatory Integrative Comp Physiol) 1998; 274: R979-R984. [ Links ]
55. Fujita M, Kuwaki T, Ando K, Fujita T. Sympatho – inhibitory action of endoge nous adrenomedullin through inhibition of oxidative stress in the brain. Hypertension 2005; 45: 1165-1172. [ Links ]
56. Xu Y, Krukoff TL. Adrenomedullin in the rostral ventrolateral medulla inhibits baro reflex control of heart rate: a role for pro tein kinase A. Br J Pharmacol 2006; 148: 70-77. [ Links ]












 uBio
uBio 
