Investigación Clínica
versão impressa ISSN 0535-5133
Invest. clín vol.57 no.4 Maracaibo dez. 2016
Expresión de BRCA1 en lesiones benignas y malignas de la mama.
Ángel Fernández1,2 y Aldo Reigosa1
1 Centro de Investigaciones Médicas y Biotecnológicas de la Universidad de Carabobo. Facultad de Ciencias de la Salud. Universidad de Carabobo. Valencia, Venezuela.
2 Departamento de Ciencias Fisiológicas. Escuela de Ciencias Biomédicas y Tecnológicas. Facultad de Ciencias de la Salud. Universidad de Carabobo. Valencia, Venezuela.
Autor de correspondencia: Ángel Fernández. Centro de Investigaciones Médicas y Biotecnológicas de la Universidad de Carabobo. Facultad de Ciencias de la Salud. Universidad de Carabobo. Valencia, Venezuela. Correo electrónico: angelbiouc@gmail.com. Teléfono: +58-0241-8666243.
Resumen. La mayor parte de los carcinomas de mama son cánceres esporádicos; sin embargo, existe una proporción, estimada entre el 5 y el 10%, en la cual aparece una predisposición hereditaria al cáncer, asociado principalmente a mutaciones germinales en los genes BRCA1 y BRCA2; tales mutaciones incrementan la predisposición para el desarrollo de la enfermedad durante el transcurso de la vida. El objetivo general de este trabajo fue valorar la expresión del gen BRCA1 por inmunohistoquímica (IHQ). El estudio se realizó en mujeres diagnosticadas con lesiones benignas o con carcinoma ductal infiltrante de mama en seguimiento en el Instituto de Oncología Dr. Miguel Pérez Carreño de Valencia, Venezuela. Se analizó la expresión de la proteína BRCA1 y los resultados obtenidos se compararon con la clasificación de las lesiones benignas propuesta por Dupont y Page y los subtipos moleculares intrínsecos definidos por IHQ. De este análisis se obtuvo que tanto en las lesiones no infiltrantes (proliferativas y carcinoma in situ), así como en los carcinomas infiltrantes, predominaron los casos con un marcaje nuclear de BRCA1 por IHQ ≤10%. Además, la relación de la expresión de BRCA1 con la media de la supervivencia global, obtuvo valor pronóstico desfavorable, cuando la expresión nuclear y citoplasmática de BRCA1 fue ≤10%, con p<0,05. Finalmente, en base a los resultados, se sugiere que en el algoritmo de abordaje de mujeres con riesgo de padecer cáncer de mama, se incluya la valoración de la expresión de BRCA1 por IHQ.
Palabras clave: cáncer de mama; BRCA1; inmunohistoquímica.
BRCA1 expression in benign and malignant breast lesions.
Abstract. The majority of breast cancers are sporadic cancers; however, there is an estima¬ted proportion of 5% to 10%, where a hereditary predisposition appears, mainly associated with germline mutations in the BRCA1 and BRCA2 genes. Such mutations increase the predis-position to develop the disease during the course of life. The overall objective of this work was to evaluate the expression of the BRCA1 gene by immunohistochemistry (IHC). The study was conducted in women diagnosed with benign lesions or invasive breast ductal carcinoma in follow-up care at the Institute of Oncology Dr. Miguel Perez Carreño in Valencia, Venezuela. Expression of the BRCA1 protein was analyzed and the results were compared with the benign lesions classification given by DuPont and Page and the intrinsic molecular subtypes defined by IHC. From this analysis it was found that in both, non-infiltrative lesions (proliferative and carcinoma in situ), as well as in infiltrating carcinomas, predominated the cases with BRCA1 nuclear labeling by IHC (≤10 %). Furthermore, the relationship of expression of BRCA1 with the average overall survival, showed a poor prognostic value obtained when the nuclear and cytoplasmic expression of BRCA1 was ≤10%, with p<0.05. Finally, based on the results, it is suggested that the assessment of BRCA1 expression by IHC should be included in the approach algorithm of women at risk of developing breast cancer.
Key words: breast cancer; BRCA1; immunohistochemistry.
Recibido: 01-02-2016 . Aceptado: 30-06-2016
INTRODUCCIÓN
BRCA1 es un gen supresor de tumores humanos, que regula el ciclo celular y evita la proliferación incontrolada. La proteína BRCA1, producto de este gen, forma parte del sistema de detección y reparación de los daños del ácido desoxirribonucleico (ADN). BRCA1 está situado en el brazo largo del cromosoma 17 (1-3). En las mujeres portadoras de mutaciones en el gen, el riesgo acumulado hasta los 70 años se estima entre 50 y 95% para cáncer de mama y entre 22 y 66% para cáncer de ovario. El varón portador de la mutación BRCA1 tienen un 1% de riesgo aproximado para desarrollar cáncer de mama (4-6).
Los genes BRCA son miembros de una compleja red de proteínas asociadas en múltiples funciones, tales como la regulación de la transcripción, remodelado de la cromatina, control del ciclo celular, regulación de centrosomas, inducción de la apoptosis, ubiquitinización y degradación proteica, entre otros (7,8).
El BRCA1 se expresa en distintos epitelios del organismo durante el desarrollo; y su expresión se ve aumentada durante el embarazo y disminuye tras el parto. La inhibición de BRCA1 causa un aumento de la proliferación de células del epitelio mamario tanto normales como cancerosas. Se ha detectado una menor expresión de la proteína BRCA1 normal en los cánceres de mama hereditarios y en algunos esporádicos; en estos últimos, debido a la hipermetilación del promotor del gen (5-9).
La expresión del gen normal, pero no de las formas mutadas, inhibe el crecimiento de células tumorales de mama y ovario. La delección o pérdida de los diez últimos aminoácidos de la proteína BRCA1 es suficiente para abolir su capacidad de inhibir el crecimiento tumoral (7,10). La mayoría de las mutaciones que se encuentran en los genes BRCA son pequeñas eliminaciones o inserciones de algunos nucleótidos, que generan un codón de parada por cambio en el marco de lectura de aminoácidos, lo que produce una proteína truncada, incapaz de cumplir con su función (6,8,11).
Finalmente, y debido a la alta supervivencia de las mujeres con cáncer cuando son tratados en estadios tempranos de la enfermedad, poder identificar aquéllas que posean un alto riesgo de desarrollar la enfermedad, basado en la expresión de BRCA1, tiene una implicación valiosa, ya que permite incrementar la expectativa y calidad de la vida de las afectadas.
PACIENTES Y MÉTODOS
El presente estudio se realizó en mujeres en seguimiento en el Instituto de Oncología Dr. Miguel Pérez Carreño (IOMPC) de Valencia, Venezuela. Se analizó la expresión de BRCA1 por inmunohistoquímica (IHQ) y se compararon los resultados obtenidos con la clasificación de las lesiones benignas, subtipos moleculares intrínsecos y variables clínico-patológicas (edad, estadio clínico, grado histológico y supervivencia).
Para la clasificación de las lesiones benignas, se tomó en cuenta la categorización propuesta por Dupont y Page (12) que incluye: a) lesiones proliferativas sin atipias (hiperplasia ductal usual o típica, adenosis esclerosante, cicatriz radiada y papiloma intraductal) y b) lesiones proliferativas con atipias (hiperplasia ductal atípica e hiperplasia lobulillar atípica).
En base a los resultados obtenidos del análisis IHQ de la expresión del receptor de estrógeno (RE), receptor de progesterona (RP) y receptor del factor de crecimiento epidérmico humano 2 (HER2), y de acuerdo a los criterios aceptados (13-15) se clasificaron los casos de cáncer como sigue: a) Luminal A: RE+ RP+; b) Luminal B: RE+ HER2+ RP (>20%) o Ki-67 (<20%) o RE+ HER2- RP (>20%) o Ki-67 (≥20%); c) HER2+: RE- RP- HER2+ y d) TN: RE- RP- HER2-.
Sujetos del estudio
Se conformó una muestra no aleatoria, de tipo intencional, que cumpliera con los siguientes criterios de inclusión: a) serie benigna: diagnóstico de lesión benigna de mama proliferativa con y sin atipia; b) serie maligna: diagnóstico de carcinoma ductal infiltrante de mama sin otra especificación, o mixto, con componente ductal predominante y c) disponibilidad de las preparaciones histológicas y bloques de parafina respectivos, correspondientes al diagnóstico inicial en el archivo del Servicio de Anatomía Patológica del Instituto.
Para la realización de la investigación, se contó con la aprobación del Comité de Ética y de la Comisión de Investigación del IOMPC. Asimismo, se obtuvo el Aval Inicial Favorable de la Comisión de Bioética y Bioseguridad del Centro de Investigaciones Médicas y Biotecnológicas de la Universidad de Carabobo (CIMBUC).
Definición de variables clínico-patológicas
a) Edad: al momento del diagnóstico, como variable cuantitativa. Además se analizaron diferentes grupos etarios (≤40; 41-50; 51-65; ≥66).
b) Estadio clínico (EC): se tomó el que figura en la historia clínica de cada mujer, establecido por el Servicio de Patología Mamaria del IOMPC. Se consideraron los cuatro EC mayores: I, II, III y IV.
c) Grado histológico (GH): se establecieron las tres categorías clásicas de Bloom-Richardson con las modificaciones de Elston y Ellis (16), correspondiendo el GH I a los tumores bien diferenciados y el GH III a los pobremente diferenciados y
d) Supervivencia global (SG) (meses): se consideró como punto de corte un seguimiento de 60 meses (5 años), con un mínimo de 36 meses. Se evaluó únicamente la SG. Se estableció el tiempo de supervivencia como el tiempo transcurrido desde el diagnóstico hasta la fecha de la muerte en caso de haber ocurrido antes de los 60 meses.
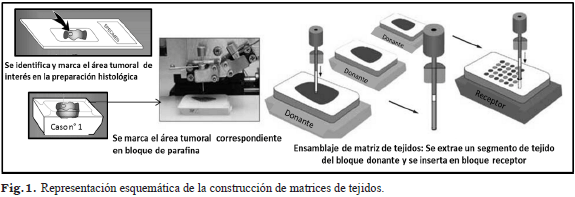
Construcción de la matriz de tejidos
Las muestras tisulares se fijaron en formol y se incluyeron en parafina siguiendo los métodos convencionales. De los bloques de parafina se obtuvieron secciones histológicas de 4 μm de espesor que, posteriormente, se tiñeron con hematoxilina-eosina. Se revisaron las preparaciones histológicas y se seleccionaron cuidadosamente las zonas con tumor, marcando esas mismas áreas en el bloque de parafina, a fin de construir las matrices de tejido. Las matrices de tejido se realizaron en el CIMBUC (Fig.1). Finalmente, se procedió a realizar la técnica de Inmunohistoquímica (IHQ).
Inmunohistoquímica.
Luego de la desparafinación e hidratación de las muestras, la recuperación antigénica se realizó en baño de agua (Isotemp Water Bath, modelo Isotemp 205, Fisher Scientific®), colocando las preparaciones en vasos coplin con tampón citrato pH 6 por 40 min, precalentado a 95-99ºC.
Una vez terminada la recuperación antigénica, se realizó la incubación con el anticuerpo primario, previamente diluido con la solución Van Gogh Yellow. Las muestras se lavaron con tampón fosfato salino y se añadió el anticuerpo secundario conjugado. Por último, el revelado de la reacción se realizó con la aplicación del cromógeno diaminobencidina durante 5 min. Con el fin de visualizar los núcleos, se realizó la tinción nuclear con hematoxilina.
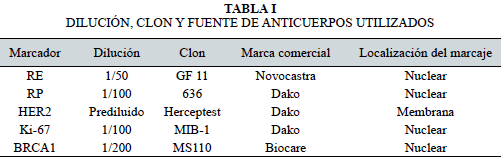
Los anticuerpos utilizados, la dilución, clon y fuente se muestran en la Tabla I.
Interpretación de los resultados del estudio inmunohistoquímico
Para realizar la valoración de la expresión de la proteína BRCA1 en lesiones de mama, se tomaron en cuenta los estándares establecidos en diversas publicaciones internacionales (17-21), considerando un resultado positivo cuando existía >10% de inmunoexpresión nuclear y refiriendo el resultado negativo cuando había expresión en ≤10% en los núcleos de las células tumorales.
A pesar que la expresión normal del marcador es nuclear, diversos trabajos han indicado la presencia de BRCA1 en el citoplasma de las células de la glándula mamaria. En este sentido y en base a criterios publicados en varias investigaciones (17-20,22,23), se consideró, de igual forma al marcaje nuclear, un resultado positivo cuando existía >10% de inmunoexpresión citoplasmática y negativo cuando ocurría expresión en ≤10% de los citoplasmas de las células tumorales.
Con una especificidad mayor al 90%, en la literatura se ha publicado una correlación entre la amplificación del gen BRCA1 utilizando reacción en cadena de la polimerasa (PCR) y la expresión de BRCA1 por IHQ. Asimismo, la ausencia de amplificación debido a un gen anómalo (inducido por alteración de la metilación del promotor del gen o por mutaciones) se ha relacionado con una pérdida de la expresión de la proteína utilizando el anticuerpo monoclonal BRCA1 (clon MS110) (24-29).
Análisis estadístico
El análisis de los datos recogidos se realizó mediante el paquete estadístico SPSS versión 22 (IBM Statistical Package for Social Sciences, Inc., Chicago, IL). Los resultados se expresaron como media y desviación estándar en el caso de variables cuantitativas y como número absoluto y porcentaje en las cualitativas.
La asociación entre las variables clínico-patológicas, subtipos moleculares y marcador inmunohistoquímico se analizó con la prueba de Chi cuadrado y el test exacto de Fisher. Cuando las variables no se ajustaron a la normalidad, se usó la U de Mann-Whitney. El estudio de supervivencia se realizó mediante el método de Kaplan-Meier y el ajuste de modelos de regresión de Cox. Se consideraron significativos valores de p<0,05.
RESULTADOS
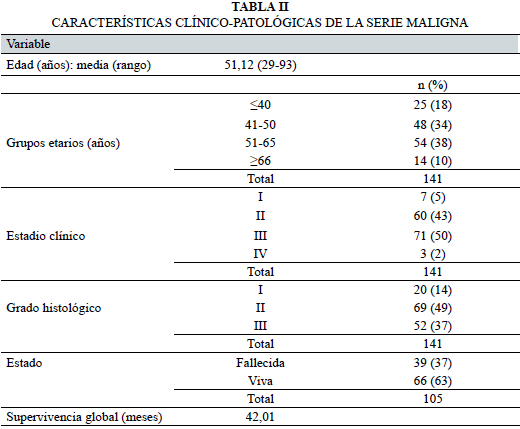
La serie maligna estuvo constituida por 141 casos totales y la benigna por 94 casos. La edad media de las mujeres con patología maligna de la mama en el momento del diagnóstico fue de 51,12 años, con un rango de 64 años (29-93 años). Por su parte, en las mujeres con patología benigna fue de 37,82 años, con un rango de 68 años (12-80 años). En esta última serie, el 41% presentaba antecedentes familiares de cáncer, de los cuales un 28% era de mama y/u ovario.
En las mujeres con cáncer, el estadio clínico más frecuente fue el III (50%), seguido por el II (43%), abarcando entre ambos el 93% de los casos. Histológicamente, un 14% fueron grado I, un 49% grado II y un 37% grado III.
Se logró obtener el seguimiento de 105 mujeres. El tiempo de seguimiento para las mujeres no fallecidas varió de 36 a 112 meses. La supervivencia global media fue de 42,01 meses, con rango de 58 meses (2 a 60) y desviación típica de ± 19,86 meses.
Un 37% de las mujeres fallecieron por la neoplasia a lo largo del seguimiento, mientras que un 63% permanecieron vivas durante el lapso del mismo.
Los principales datos clínico-patológicos de las mujeres incluidas en este estudio se detallan en la Tablas II y III.

Subtipos moleculares intrínsecos
En la serie maligna de 141 tumores, se valoró la expresión de RE, RP y HER2. En base a estos resultados se establecieron los subtipos moleculares de acuerdo a los siguientes porcentajes: Luminal A 30% (42/141), Luminal B 25% (35/141), HER2 10% (14/141) y TN 35% (50/141).
Análisis de la expresión de BRCA1 por inmunohistoquímica
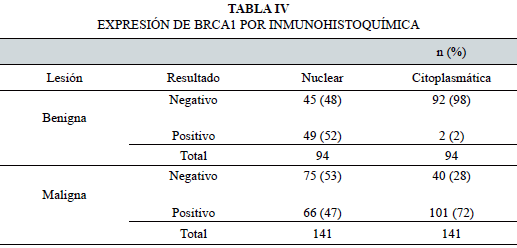
La expresión del marcador por inmunohistoquímica, con sus respectivos porcentajes (nuclear y citoplasmática), en los diferentes tipos de lesiones de mama (benigna o maligna), se muestra en la Tabla IV.
El porcentaje de positividad de expresión citoplasmática de BRCA1 varió del 2 al 72%. Por su parte, la expresión nuclear positiva del marcador presentó poca variación en ambas lesiones (52% en la serie benigna y 47% en la maligna).
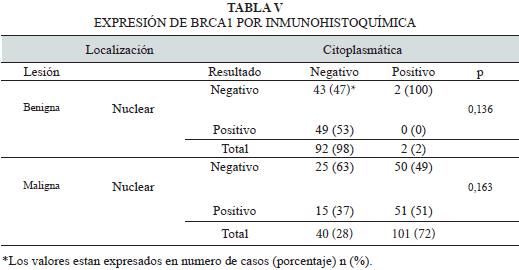
La comparación de la expresión (negativo o positivo) en las diferentes ubicaciones subcelulares (nuclear y citoplasmática) en ambas lesiones, se muestra en la Tabla V. En la serie benigna, el 47% de los tumores resultó negativo a la expresión de BRCA1 en ambas localizaciones; por su parte, en la serie maligna fue de 63%.
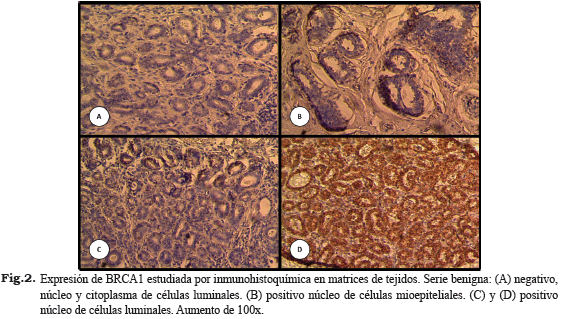
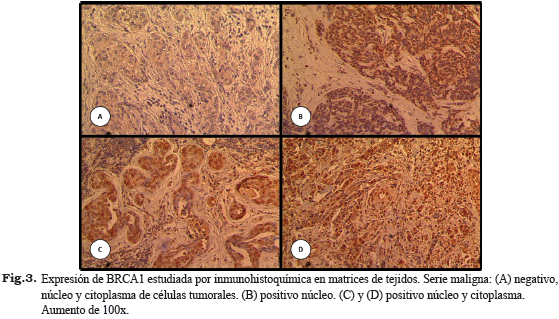
Las Figs. 2 y 3 muestran ejemplos representativos de los patrones de expresión inmunohistoquímica de BRCA1 observados en ambas series.
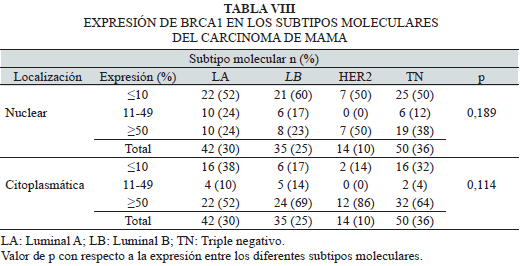
Análisis de la relación de los porcentajes de expresión de BRCA1 por inmunohistoquímica con las lesiones benignas proliferativas y los subtipos moleculares del carcinoma de mama
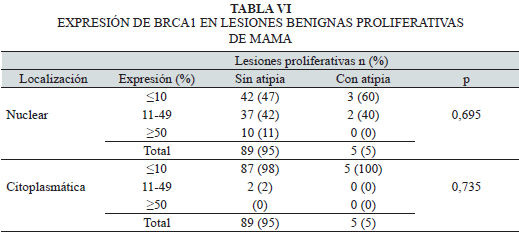
En la Tabla VI se muestra que los intervalos de porcentaje de expresión de BRCA1 para cada lesión benigna de la mama (sin y con atipia), fueron p>0,05. Sin embargo, se observa expresión nuclear y citoplasmática de BRCA1 ≤10 en ambos tipos de lesiones proliferativas.
En algunos porcentajes de expresión y para algunas de las variables, tales como las lesiones con atipia y expresión nuclear y citoplasmática de BRCA1 >10%, el número de casos fue muy bajo (cero o dos mujeres).
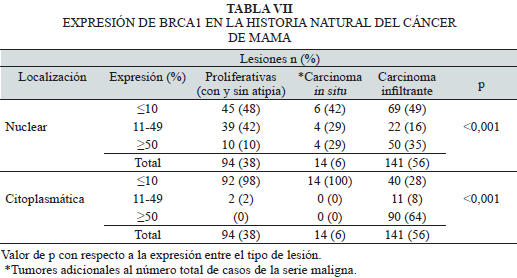
La expresión de BRCA1 y su relación con la historia natural del cáncer de mama se presenta en la Tabla VII. En la misma se observa que, tanto en las lesiones no infiltrantes (proliferativas y carcinoma in situ) como para los carcinomas infiltrantes, predominaron los casos con un marcaje nuclear de BRCA1 por inmunohistoquímica ≤10% de las células, así como una disminución de la expresión (11-49%) del marcador a medida que aumenta la atipicidad en las células de la mama, con p<0,001. La expresión de BRCA1 citoplasmática también se relacionó, aunque en este caso fue el aumento de expresión (>10%), en los tumores infiltrantes.
La Tabla VIII muestra la expresión de BRCA1 en los subtipos moleculares del carcinoma de mama. Aunque los resultados indican que no hubo diferencia estadísticamente significativa de la expresión de BRCA1 con los subtipos moleculares del carcinoma de mama, se observa un mayor número de casos con expresión nuclear ≤10% y citoplasmática ≥10% de BRCA1 en los tumores TN.
Análisis de la supervivencia en relación a la expresión de BRCA1
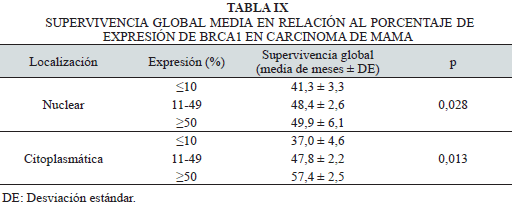
En la Tabla IX se aprecia la supervivencia global media en relación al porcentaje de expresión de BRCA1 en carcinoma de mama. Se observa un valor pronóstico desfavorable; la expresión nuclear y citoplasmática de BRCA1 es ≤10%, con p<0,05.
Análisis de la supervivencia en relación a la expresión de BRCA1 analizada por inmunohistoquímica y el subtipo molecular
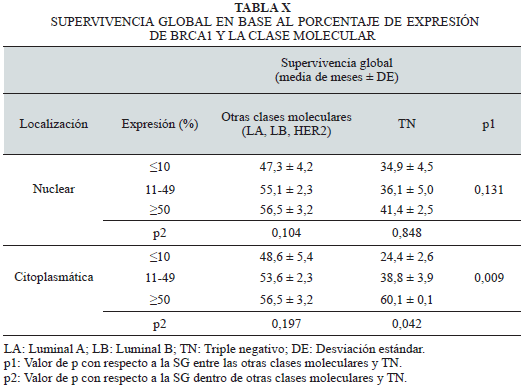
Al relacionar la SG en cada subtipo molecular según la expresión de BRCA1, se observó una relación de la expresión citoplasmática en el subtipo TN con SG significativamente menor para las mujeres cuyos tumores presentaron expresión negativa del marcador, igualmente la reducción de la expresión nuclear del marcador en los subtipos moleculares se asoció con menor SG, pero sin significancia estadística (p=0,131) (Tabla X).
DISCUSIÓN
De los diversos tejidos donde se desarrolla la enfermedad, el mamario es uno de los más frecuentemente afectados en las mujeres. Esta patología ha sido relacionada en algunos casos con un componente hereditario, la mayoría asociados con alteraciones en los genes BRCA.
Es por ello, que el estudio de la predisposición genética para esta enfermedad ha tomado gran interés a nivel mundial (30-32). Por tal motivo, se han incrementado los esfuerzos en la detección de las alteraciones en estos genes, con el propósito de identificar la población con riesgo incrementado de padecer la enfermedad.
En relación a la frecuencia de mutaciones en los genes BRCA en la población con cáncer de mama en Venezuela, sólo existe publicado el trabajo de Lara y col. (33), quiénes identifican algunas mutaciones BRCA1 mediante PCR en mujeres con cáncer de mama. Sin embargo, hasta el momento, no se han divulgado estudios sobre la expresión de la proteína BRCA1 por IHQ, en mujeres con cáncer o con patología mamaria benigna.
Expresión de BRCA1 por inmunohistoquímica
Los estudios inmunohistoquímicos del cáncer de mama revelan la expresión de determinadas proteínas en las células tumorales, por lo que se podrían considerar como un reflejo válido de los estudios de biología molecular, así como una alternativa a los análisis de microarrays génicos o secuenciación genómica, todavía prohibitivos por el costo y la complejidad metodológica para su uso rutinario (34-37).
Muchos autores han encontrado relación entre ambas; es decir, los subtipos moleculares según la expresión génica y la basada en la expresión de proteínas determinadas por IHQ. Entre ellos, en el año 2004, Nielsen y col. (13) utilizando un panel de cuatro anticuerpos (RE, HER2, EGFR y CK 5/6) observaron que existía una buena correlación entre el perfil génico y el perfil inmunohistoquímico. En otro estudio, la sensibilidad de la IHQ en la clasificación de los tumores fue de un 76% y la especificidad de un 100% (38).
La tinción e interpretación de secciones tisulares completas ofrece ventajas sobre los estudios de matrices de tejido, pero limitan el número de muestras a ser evaluadas. Además, la fijación y procedimientos de tinción varían de un caso a otro en la rutina clínica, al usarse diferentes compuestos químicos, anticuerpos y observadores, lo cual se minimiza al utilizar matrices (39-41). En este estudio se utilizó la IHQ para la clasificación molecular y la valoración de la expresión de BRCA1 en lesiones de mama, siempre teniendo presente que no es lo mismo que los estudios génicos y que incluso estos últimos pueden presentar un alto grado de variabilidad y baja reproducibilidad interobservador.
En el presente trabajo se describe por primera vez la frecuencia y características de la expresión del gen BRCA1 en la población venezolana, con el objetivo de establecer los criterios de expresión de BRCA1 con valor pronóstico para las diferentes lesiones de mama.
Uno de los primeros pasos para investigar la función de la proteína BRCA1 fue definir su localización subcelular. Al respecto, diversos estudios han presentados datos contradictorios, como por ejemplo una localización nuclear en las células normales y citoplasmática en células tumorales de tejido mamario, nuclear tanto en células normales como cancerígenas, citoplasmática y secretada al espacio extracelular, localizada en invaginaciones en el núcleo, entre otros (22,42-44).
Hoy en día se conoce que, a pesar que BRCA1 se identificó por primera vez como una fosfoproteína nuclear, ésta contiene diferentes secuencias de transporte, incluyendo señales de exportación nuclear, que le permiten desplazarse entre el núcleo y el citoplasma, ubicándose en los centrosomas de este último (17,22).
En el presente trabajo, la expresión citoplasmática de BRCA1 fue de 2 y 72% en la serie benigna y maligna, respectivamente. Por su parte, la expresión nuclear del marcador presentó poca variación en las lesiones (52% en la serie benigna y 47% en la maligna). Cuando se comparó la expresión en las diferentes ubicaciones subcelulares (nuclear y citoplasmática), se apreció que en la serie benigna el 47% de los tumores resultó negativo a la expresión de BRCA1 en ambas localizaciones; por su parte, en la serie maligna fue de 63%. Si bien los porcentajes de expresión no coinciden con publicaciones previas (17-20,22,23), si concuerda con la capacidad de la IHQ en detectar la expresión de la proteína tanto en el núcleo y citoplasma de las células de la mama, lo cual ha sido reportado en diversas investigaciones (23-26).
En esta investigación se incluyeron casos de mujeres con carcinomas de mama esporádicos y algunos con criterios relacionados a cáncer hereditario, tales como los tumores TN en mujeres menores de 40 años.
En diversas investigaciones, han detectado que los cánceres de mama hereditarios y en algunos esporádicos, existe una menor expresión nuclear de la proteína BRCA1 normal (17-20,22,23), lo cual coincide con lo encontrado en nuestra serie, en donde se evidenció que más del 50% de los casos de cáncer carecían de expresión nuclear de BRCA1.
En la literatura médica, se ha reportado que la disminución de la expresión de BRCA1 en ciertos tipos de cáncer de mama esporádico se debe a la metilación aberrante del promotor del gen, que ocasiona la pérdida de su expresión y por ende de su función dentro de la célula. Tanto en los casos hereditarios, como esporádicos, la reducción de la expresión, nuclear y citoplasmática, se han asociado a un peor pronóstico y a una menor supervivencia (26-29), tal como se evidenció en este estudio. El BRCA1 constituyó en nuestra serie maligna un factor de mal pronóstico, al presentar los casos con expresión negativa nuclear y citoplasmática, una supervivencia global media significativamente menor en comparación a los casos con expresión positiva de la proteína BRCA1 (p=0,028 y p=0,013, respectivamente).
Esto último es debido a que se han encontrado diferencias apreciables entre los tumores de mama asociados a mutaciones en BRCA1, con respecto a aquellos que ocurren en ausencia de dichas mutaciones (45,46). Los tumores asociados a mutaciones, con mayor frecuencia aparecen a una edad temprana, se asocian a un alto grado histológico, no expresan receptores hormonales y tienen mayor grado de aneuploidía, lo cual coincide con lo observado en nuestra serie maligna y otros estudios reportados (46-49).
Hasta la fecha, se han identificado más de 1600 mutaciones asociadas al gen, muchas de las cuales están relacionadas con un mayor riesgo de cáncer (3,50). Estas mutaciones pueden consistir en cambios en una o un pequeño número de pares de bases de ADN, las cuales pueden ser identificadas mediante la técnica de PCR y secuenciación del ADN (7,11).
El uso de cualquiera de estas técnicas ya sea en solitario o combinadas, no asegura la detección de todas las mutaciones, debido a que muchas de éstas se localizan en regiones no codificantes que normalmente no son analizadas en su totalidad; por ende, escapan del cribado (51-53). Además, todos estos análisis son muy costosos y, por lo tanto, su disponibilidad es limitada, así como su aplicación a gran escala, lo que ha determinado el empleo de otras técnicas, como por ejemplo, la IHQ.
En el presente trabajo, la IHQ mostró ser una técnica capaz de detectar satisfactoriamente la expresión nuclear y citoplasmática de BRCA1 en lesiones de mama de mujeres venezolanas. Diversos estudios, han reportado conclusiones similares, además de establecer una correlación entre los resultados encontrados por IHQ y los estudios de biología molecular (23-35).
Se sabe que el análisis genético de BRCA1 es laborioso y complejo, ya que es un gen grande y son pocas las mujeres a quiénes finalmente se les identifica una mutación. Por ello, es necesario realizar una selección de aquéllas que se pueden considerar realmente de alto riesgo y en las que está indicado el estudio, basado en técnicas más accesible, como la IHQ.
A pesar de que no representa una evaluación de rutina, el estudio inmunohistoquímico de la proteína BRCA1 proporciona información importante en lo que se refiere al desarrollo y progresión de la enfermedad. La validación de los resultados de IHQ utilizando una mayor muestra y confirmación molecular, permitirá que la técnica pueda ser utilizada para decidir cuáles son las mujeres de alto riesgo a desarrollar cáncer de mama, al determinar una reducción de la expresión de la proteína normal en el tejido mamario.
La caracterización morfológica e inmunohistoquímica de los tumores asociados a una reducción de la expresión de BRCA1 en la población venezolana, podría ser de ayuda para el seguimiento clínico de las mujeres afectadas. De allí la importancia de esta investigación.
El uso de la IHQ y la aparición futura de nuevas técnicas de valoración genética, serían la herramienta ideal para que el estudio de BRCA1 sea rutinario entre las mujeres con patología mamaria, igual que ocurre hoy en día con la determinación de receptores hormonales y HER2.
Eventualmente, la IHQ pudiera ser aplicada en masa para la valoración de BRCA1 a cualquier biopsia de mama y, de esta manera, ser utilizada en la escogencia de mujeres con posibilidad de tener la mutación del gen, con verificación posterior por otras técnicas moleculares, pero ya limitando considerablemente el número de mujeres para estos últimos estudios.
Con los resultados obtenidos, se puede considerar que el estudio histológico detallado de la pieza tumoral, junto a los criterios clínicos personales y/o familiares y la presencia de características inmunohistoquímicas, incluida la expresión de BRCA1 por IHQ, podría ayudar a predecir la probabilidad de ser portador de mutación en el gen BRCA1.
Relación de las lesiones benignas proliferativas de mama con la expresión de BRCA1
En la serie benigna de este estudio no observamos relación estadísticamente significativa en los intervalos de porcentaje de expresión de BRCA1 para cada lesión benigna de la mama (sin y con atipia). Sin embargo, hay que considerar, que en algunos porcentajes de expresión y para algunas de las variables, tales como las lesiones con atipia y expresión nuclear y citoplasmática de BRCA1 >10%, el número de casos fue muy bajo (cero o dos mujeres). Esto pudiera ser debido a la poca cantidad de casos encontrados en este estudio para esas categorías.
La expresión de BRCA1 y su relación con la historia natural del cáncer de mama mostró una alta significancia estadística (p<0,001). Se observó que tanto en las lesiones no invasivas (proliferativas y carcinoma in situ), así como para los carcinomas infiltrantes, predominaron los casos con un marcaje de BRCA1 por IHQ ≤10% en las células tumorales, con menor número de casos con inmunotinción superior al 10%. Cabe destacar que no se encontraron trabajos similares en la literatura consultada. Es posible que hagan falta más estudios para llegar a conclusiones sobre su posible utilidad pronóstica y/o predictiva en este tipo de lesiones.
A pesar de no contar con estudios similares en la literatura consultada, la expresión de BRCA1 en lesiones benignas y el hallazgo de su relevancia pronóstica merecen especial atención, considerando que existen diferencias con respecto al abordaje terapéutico de las mujeres portadoras de mutaciones, tanto desde el punto de vista quirúrgico como sistémico (54,55).
Por estas razones, se considera que un seguimiento de mujeres con lesiones proliferativas de la mama con mutación en BRCA o expresión negativa de la proteína, permite desarrollar un abordaje clínico apropiado, basado en el asesoramiento, educación, vigilancia y prevención de la enfermedad, lo cual es fundamental para aumentar la supervivencia de las mujeres afectadas.
Por tanto, en las mujeres con expresión negativa de BRCA1 se debe realizar un despistaje de cáncer de mama y de ovario de forma más precoz e intensivo que en el resto de las mujeres, y valorar las medidas profilácticas (mastectomía y ooforectomía, respectivamente) aconsejables en cada caso y de forma personalizada.
Relación de los subtipos moleculares de cáncer de mama con la expresión de BRCA1
En los últimos años, numerosos estudios han relacionado el cáncer de mama en mujeres portadoras de mutación en BRCA1 a los tumores TN. Este es el subtipo molecular que ha recibido mayor atención en la literatura, en parte por el mal pronóstico que tiene, así como por la ausencia de terapia específica, a diferencia de lo que ocurre con los otros subtipos moleculares (56-60).
En la serie maligna de este estudio no existió relación estadísticamente significativa de la expresión de BRCA1 con los subtipos moleculares del carcinoma de mama. Cabe destacar, las escasas publicaciones que hacen referencia a su asociación con los tipos moleculares (57-59). Por tal motivo, hoy en día son necesarios más estudios para determinar su utilidad pronóstica en mujeres afectadas con la enfermedad.
Considerando lo anterior, valoramos la supervivencia, encontrando que la expresión citoplasmática de BRCA1, fue la que mostró valor pronóstico individual en el subtipo TN (p=0,009), con SG media significativamente menor para las mujeres cuyos tumores presentaron expresión negativa del marcador. Igualmente, la reducción de la expresión nuclear de BRCA1 en los subtipos moleculares se asoció con menor SG, pero sin significancia estadística (p=0,131). Estos resultados coinciden ampliamente, por ejemplo, con lo reportado por Kim y col. (61), quiénes reportaron un pronóstico desfavorable al disminuir la expresión de BRCA1 en el núcleo y citoplasma de las células tumorales de la mama.
Al respecto, existen datos contradictorios en la literatura, dado que muchos estudios realizados incluyen un número poco amplio de mujeres con cáncer o carecen del análisis del significado de la localización subcelular de la proteína y su relación con la supervivencia. Por ejemplo, en el estudio de Stoppa-Lyonnet y col. (62) encontraron diferencias significativas en cuanto a la supervivencia, siendo peor en portadoras de la mutación BRCA con respecto a los controles sin mutación del gen. Otros estudios como Johannsson y col. (63) y Rennert y col. (64) no encontraron diferencias entre ambos grupos y otros como el de Marcus y col. (65), identificaron una mayor supervivencia en las mujeres portadoras de la mutación. Existe un metaanálisis realizado por Lee y col. (66), el cual concluye que existe una peor supervivencia global de la enfermedad en mujeres con cáncer de mama portadoras de BRCA1 mutado.
Por estas razones, cada vez más se pone de manifiesto la necesidad de incorporar el patrón fenotípico del cáncer de mama a los modelos actuales de predicción de mutación germinal BRCA1. Para tal fin, se puede decir que la IHQ es una técnica viable de aplicar para la determinación de la expresión de BRCA1 en muestras de tejido de carcinoma mamario. Uniendo esta técnica con la implementación de las matrices de tejidos, se reduce considerablemente el costo de la prueba, haciéndola bastante accesible a la población.
En base a los resultados de expresión en lesiones proliferativas de la mama y considerando lo reportado por diversos investigadores (67-71), quienes han descrito que un componente intraductal es menos probable de ser observado en mujeres con carcinoma de mama asociados a BRCA1 mutado, se hace necesario realizar el análisis de la expresión de BRCA1, principalmente en aquellas lesiones que lleven implícita un riesgo aumentado de cáncer de mama, como por ejemplo, la hiperplasia ductal atípica e hiperplasia lobulillar atípica.
En Venezuela, deben adecuarse los criterios utilizados para seleccionar a las mujeres con predisposición genética a desarrollar cáncer de mama, al observar disminución de la expresión de BRCA1 y peor supervivencia en mujeres con carcinoma de mama.
A las mujeres diagnosticadas de cáncer de mama TN antes de los 50 años, incluso en ausencia de historia familiar de riesgo, se les debe ofrecer la realización de estudio de expresión de BRCA1. La presencia de un cáncer de mama TN aumentaría la probabilidad de detectar una mutación en BRCA1 y justificaría la realización del estudio en determinado tipo de mujeres en las que por los criterios habituales no serían candidatas.
Finalmente y considerando los resultados obtenidos en el presente estudio, similares a los encontrados en algunas otras publicaciones y de acuerdo a lo anteriormente expuesto, se sugiere contemplar la posibilidad que en el algoritmo para el abordaje de mujeres con riesgo de padecer cáncer de mama, se incluya el estudio de la expresión de BRCA1 por IHQ, para ofrecer un seguimiento estricto que permita un diagnóstico precoz de la enfermedad.
AGRADECIMIENTOS
A los Licenciados Carlos Escalona y Mai Lyng Hung, por la realización de los cortes histológicos de las matrices de tejidos y la ejecución de la técnica de inmunohistoquímica, respectivamente. Asimismo, a todo el personal que labora en el Servicio de Anatomía Patológica del IOMPC.
REFERENCIAS
1. Van der Groep P, van der Wall E, van Diest PJ. Pathology of hereditary breast cancer. Cell Oncol (Dordr) 2011; 34:71-88. [ Links ]
2. Engel C, Fischer C. Breast cancer risks and risk prediction models. Breast Care (Basel) 2015; 10:7-12. [ Links ]
3. Lynch HT, Snyder C, Casey MJ. Hereditary ovarian and breast cancer: what have we learned? Ann Oncol 2013; 24:83-95. [ Links ]
4. Friebel TM, Domchek SM, Rebbeck TR. Modifiers of cancer risk in BRCA1 and BRCA2 mutation carriers: systematic review and meta-analysis. J Natl Cancer Inst 2014; 106:91. [ Links ]
5. Paul A, Paul S. The breast cancer susceptibility genes (BRCA) in breast and ovarian cancers. Front Biosci (Landmark Ed) 2014; 19:605-618. [ Links ]
6. Barcellos-Hoff MH, Kleinberg DL. Breast cancer risk in BRCA1 mutation carriers: insight from mouse models. Ann Oncol 2013; 24:8-12. [ Links ]
7. Apostolou P, Fostira F. Hereditary breast cancer: the era of new susceptibility genes. Biomed Res Int 2013; 2013:747318. [ Links ]
8. Wittersheim M, Büttner R, Markiefka B. Genotype/Phenotype correlations in patients with hereditary breast cancer. Breast Care (Basel) 2015; 10:22-26. [ Links ]
9. Shiovitz S, Korde LA. Genetics of breast cancer: a topic in evolution. Ann Oncol 2015; 26:1291-1299. [ Links ]
10. Larsen MJ, Thomassen M, Gerdes AM, Kruse TA. Hereditary breast cancer: clinical, pathological and molecular characteristics. Breast Cancer (Auckl) 2014; 8:145-155. [ Links ]
11. Economopoulou P, Dimitriadis G, Psyrri A. Beyond BRCA: new hereditary breast cancer susceptibility genes. Cancer Treat Rev 2015; 41:1-8. [ Links ]
12. Dupont WD, Page DL. Risk factors for breast cancer in women with proliferative breast disease. N Engl J Med 1985; 312:146-151. [ Links ]
13. Nielsen TO, Hsu FD, Jensen K, Cheang M, Karaca G, Hu Z, Hernandez-Boussard T, Livasy C, Cowan D, Dressler L, Akslen LA, Ragaz J, Gown AM, Gilks CB, van de Rijn M, Perou CM. Imunohistochemical and clinical characterization of the basal-like subtype of invasive breast carcinoma. Clin Cancer Res 2004; 10:5367-5374. [ Links ]
14. Carey LA, Perou CM, Livasy CA, Dressler LG, Cowan D, Conway K, Karaca G, Troester MA, Tse CK, Edmiston S, Deming SL, Geradts J, Cheang MC, Nielsen TO, Moorman PG, Earp HS, Millikan RC. Race, breast cancer subtypes, and survival in the Carolina Breast Cancer Study. JAMA 2006; 295:2492-2502. [ Links ]
15. Livasy CA, Karaca G, Nanda R, Tretiakova MS, Olopade OI, Moore DT, Perou CM. Phenotypic evaluation of the basal-like subtype of invasive breast carcinoma. Mod Pathol 2006; 19:264-271. [ Links ]
16. Elston CW, Ellis IO. Pathological prognostic factors in breast cancer I. The value of histological grade in breast cancer: experience from a large study with long-term follow-up. Histopathology 1991; 19:403-410. [ Links ]
17. Zhang Q, Zhang Q, Cong H, Zhang X. The ectopic expression of BRCA1 is associated with genesis, progression, and prognosis of breast cancer in young patients. Diagn Pathol 2012; 7:181. [ Links ]
18. Shimizu Y, Luk H, Horio D, Miron P, Griswold M, Iglehart D, Hernandez B, Killeen J, ElShamy WM. BRCA1-IRIS overexpression promotes formation of aggressive breast cancers. PLoS One 2012; 7:e34102. [ Links ]
19. Madjd Z, Karimi A, Molanae S, Asadi-Lari M. BRCA1 protein expression level and CD44(+) phenotype in breast cancer patients. Cell J 2011; 13:155-162. [ Links ]
20. Kim D, Jung W, Koo JS. The expression of ERCC1, RRM1, and BRCA1 in breast cancer according to the immunohistochemical phenotypes. J Korean Med Sci 2011; 26:352-359. [ Links ]
21. Ansquer Y, Mandelbrot L, Lehy T, Salomon L, Dhainaut C, Madelenat P, Feldmann G, Walker F. Expression of BRCA1, HER-1 (EGFR) and HER-2 in sporadic breast cancer and relationships to other clinicopathological prognostic features. Anticancer Res 2005; 25:4535-4541. [ Links ]
22. Santivasi WL, Wang H, Wang T, Yang Q, Mo X, Brogi E, Haffty BG, Chakravarthy AB, Xia F. Association between cytosolic expression of BRCA1 and metastatic risk in breast cancer. Br J Cancer 2015; 113:453-459. [ Links ]
23. Mylona E, Melissaris S, Nomikos A, Theohari I, Giannopoulou I, Tzelepis K, Tzelepis K, Nakopoulou L. Effect of BRCA1 immunohistochemical localizations on prognosis of patients with sporadic breastcarcinomas. Pathol Res Pract 2014; 210:533-540. [ Links ]
24. Vilmar A, Garcia-Foncillas J, Huarriz M, Santoni-Rugiu E, Sorensen JB. RT-PCR versus immunohistochemistry for correlation and quantification of ERCC1, BRCA1, TUBB3 and RRM1 in NSCLC. Lung Cancer 2012; 75:306-312. [ Links ]
25. Al-Mulla F, Abdulrahman M, Varadharaj G, Akhter N, Anim JT. BRCA1 gene expression in breast cancer: a correlative study between real-time RT-PCR and immunohistochemistry. J Histochem Cytochem 2005; 53:621-629. [ Links ]
26. Li Q, Wei W, Jiang YI, Yang H, Liu J. Promoter methylation and expression changes of BRCA1 in cancerous tissues of patients with sporadic breast cancer. Oncol Lett 2015; 9:1807-1813. [ Links ]
27. Yamashita N, Tokunaga E, Kitao H, Hitchins M, Inoue Y, Tanaka K, Hisamatsu Y, Taketani K, Akiyoshi S, Okada S, Oda Y, Saeki H, Oki E, Maehara Y. Epigenetic inactivation of BRCA1 through promoter hypermethylation and its clinical importance in triple-negative breast cancer. Clin Breast Cancer 2015; 15:498-504. [ Links ]
28. Hsu NC, Huang YF, Yokoyama KK, Chu PY, Chen FM, Hou MF. Methylation of BRCA1 promoter region is associated with unfavorable prognosis in women with early-stage breast cancer. PLoS One 2013; 8:e56256. [ Links ]
29. Pinto R, De Summa S, Pilato B, Tommasi S. DNA methylation and miRNAs regulation in hereditary breast cancer: epigenetic changes, players in transcriptional and post- transcriptional regulation in hereditary breast cancer. Curr Mol Med 2014; 14:45-57. [ Links ]
30. The Lancet Oncology Commission. La planificación del control del cáncer en América Latina y el Caribe. Lancet Oncol 2013; 14: 391-436. [ Links ]
31. Paul A, Paul S. The breast cancer susceptibility genes (BRCA) in breast and ovarian cancers. Front Biosci (Landmark Ed) 2014; 19:605-618. [ Links ]
32. Wittersheim M, Büttner R, Markiefka B. Genotype/Phenotype correlations in patients with hereditary breast cancer. Breast Care (Basel) 2015; 10:22-26. [ Links ]
33. Lara K, Consigliere N, Pérez J, Porco A. BRCA1 and BRCA2 mutations in breast cancer patients from Venezuela. Biol Res 2012; 45:117-130. [ Links ]
34. Donepudi MS, Kondapalli K, Amos SJ, Venkanteshan P. Breast cancer statistics and markers. J Cancer Res Ther 2014; 10:506-511. [ Links ]
35. Kittaneh M, Montero AJ, Glück S. Molecular profiling for breast cancer: a comprehensive review. Biomark Cancer 2013; 5:61-70. [ Links ]
36. Barry WT, Kernagis DN, Dressman HK, Griffis RJ, Hunter JD, Olson JA, Marks JR, Ginsburg GS, Marcom PK, Nevins JR, Geradts J, Datto MB. Intratumor heterogeneity and precision of microarray-based predictors of breast cancer biology and clinical outcome. J Clin Oncol 2010; 28:2198-2206. [ Links ]
37. Malhotra GK, Zhao X, Band H, Band V. Histological, molecular and functional subtypes of breast cancers. Cancer Biol Ther 2010; 10:955-960. [ Links ]
38. Irigoyen MA, García FV, Iturriagagoitia AC, Beroiz BI, Martínez MS, Grima FG. Molecular subtypes of breast cancer: prognostic implications and clinical and immunohistochemical characteristics. An Sist Sanit Navar 2011; 34:219-233. [ Links ]
39. Fasching PA, Heusinger K, Haeberle L, Niklos M, Hein A, Bayer CM, Rauh C, Schulz-Wendtland R, Bani MR, Schrauder M, Kahmann L, Lux MP, Strehl JD, Hartmann A, Dimmler A, Beckmann MW, Wachter DL. Ki67, chemotherapy response, and prognosis in breast cancer patients receiving neoadjuvant treatment. BMC Cancer 2011; 11:486. [ Links ]
40. Mackay A, Weigelt B, Grigoriadis A, Kreike B, Natrajan R, AHern R, Tan DS, Dowsett M, Ashworth A, Reis-Filho JS. Microarray-based class discovery for molecular classification of breast cancer: analysis of interobserver agreement. J Natl Cancer Inst 2011; 103:662-673. [ Links ]
41. Pinder SE, Brown JP, Gillett C, Purdie CA, Speirs V, Thompson AM, Shaaban AM. Translational Subgroup of the NCRI Breast Clinical Studies Group. The manufacture and assessment of tissue microarrays: suggestions and criteria for analysis, withbreast cancer as an example. J Clin Pathol 2013; 66:169-177. [ Links ]
42. Henderson BR. The BRCA1 breast cancer suppressor: regulation of transport, dynamics, and function at multiple subcellular locations. Scientifica (Cairo) 2012; 2012:796808. [ Links ]
43. Lee WY, Jin YT, Chang TW, Lin PW, Su IJ. Immunolocalization of BRCA1 protein in normal breast tissue and sporadic invasive ductal carcinomas: a correlation with other biological parameters. Histopathology 1999; 34:106-112. [ Links ]
44. Aloraifi F, Boland MR, Green AJ, Geraghty JG. Gene analysis techniques and susceptibility gene discovery in non-BRCA1/BRCA2 familial breast cancer. Surg Oncol 2015; 24:100-109. [ Links ]
45. Boyle P. Triple-negative breast cancer: epidemiological considerations and recommendations. Ann Oncol 2012; 23:7-12. [ Links ]
46. Yadav BS, Sharma SC, Chanana P, Jhamb S. Systemic treatment strategies for triple-negative breast cancer. World J Clin Oncol 2014; 5:125-133. [ Links ]
47. Le Du F, Eckhardt BL, Lim B, Litton JK, Moulder S, Meric-Bernstam F. Is the future of personalized therapy in triple-negative breast cancer based on molecular subtype?. Oncotarget 2015; 6:12890-12908. [ Links ]
48. Zhang L, Fang C, Xu X, Li A, Cai Q, Long X. Androgen receptor, EGFR, and BRCA1 as biomarkers in triple-negative breast cancer: a meta-analysis. Biomed Res Int 2015; 2015:357485. [ Links ]
49. Elsawaf Z, Sinn HP. Triple-negative breast cancer: clinical and histological correlations. Breast Care (Basel) 2011; 6:273-278. [ Links ]
50. Julian-Reynier C. Genetic predisposition to breast and ovarian cancer: importance of test results. Med Sci (Paris) 2011; 27:657-661. [ Links ]
51. Sheikh A, Hussain SA, Ghori Q, Naeem N, Fazil A, Giri S, Sathian B, Mainali P, Al Tamimi DM. The spectrum of genetic mutations in breast cancer. Asian Pac J Cancer Prev 2015; 16:2177-2185. [ Links ]
52. Howell A, Anderson AS, Clarke RB, Duffy SW, Evans DG, Garcia-Closas M, Gescher AJ, Key TJ, Saxton JM, Harvie MN. Risk determination and prevention of breast cancer. Breast Cancer Res 2014; 16:446. [ Links ]
53. Goncalves R, Warner WA, Luo J, Ellis MJ. New concepts in breast cancer genomics and genetics. Breast Cancer Res 2014; 16:460. [ Links ]
54. Severson TM, Peeters J, Majewski I, Michaut M, Bosma A, Schouten PC, Chin SF, Pereira B, Goldgraben MA, Bismeijer T, Kluin RJ, Muris JJ, Jirström K, Kerkhoven RM, Wessels L, Caldas C, Bernards R, Simon IM, Linn S. BRCA1-like signature in triple negative breast cancer: Molecular and clinical characterization reveals subgroups with therapeutic potential. Mol Oncol 2015; 9:1528-1538. [ Links ]
55. Phillips KA, Lindeman GJ. Breast cancer prevention for BRCA1 and BRCA2 mutation carriers: is there a role for tamoxifen?. Future Oncol 2014; 10:499-502. [ Links ]
56. Ratanaphan A. A DNA repair BRCA1 estrogen receptor and targeted therapy in breast cancer. Int J Mol Sci 2012; 13:14898-14916. [ Links ]
57. Martins FC, De S, Almendro V, Gönen M, Park SY, Blum JL, Herlihy W, Ethington G, Schnitt SJ, Tung N, Garber JE, Fetten K, Michor F, Polyak K. Evolutionary pathways in BRCA1-associated breast tumors. Cancer Discov 2012; 2:503-511. [ Links ]
58. Triantafyllidou O, Vlachos IS, Apostolou P, Konstantopoulou I, Grivas A, Panopoulos C, Papadopoulos O, Zientara S, Karatzias H, Boscos C. Epidemiological and clinicopathological characteristics of BRCA-positive and BRCA-negativebreast cancer patients in Greece. J BUON 2015; 20:978-984. [ Links ]
59. Sharma S, Barry M, Gallagher DJ, Kell M, Sacchini V. An overview of triple negative breast cancer for surgical oncologists. Surg Oncol 2015; 24:276-283. [ Links ]
60. Stevens KN, Vachon CM, Couch FJ. Genetic susceptibility to triple-negative breast cancer. Cancer Res 2013; 73:2025-2030. [ Links ]
61. Martín M, Domingo J. Carcinogénesis. Salud Pública Mex 2011; 53:405-414. [ Links ]
62. Stoppa-Lyonnet D, Ansquer Y, Dreyfus H, Gautier C, Gauthier-Villars M, Bourstyn E, Clough KB, Magdelénat H, Pouillart P, Vincent-Salomon A, Fourquet A, Asselain B. Familial invasive breast cancers: worse outcome related to BRCA1 mutations. J Clin Oncol 2000; 18:4053-4059. [ Links ]
63. Johannson OT, Ranstam J, Borg A, Olsson H. Survival of BRCA1 breast and ovarian cancer patients: a population based study from southerm Sweden. J Clin Oncol 1998; 16:397-404. [ Links ]
64. Rennert G, Bisland-Naggan S, Barnett-Griness O, Bar-Joseph N, Zhang S, Rennert HS, Narod SA. Clinical outcomes of breast cancer in carriers of BRCA1 and BRCA2 mutations. N Engl J Med 2007; 357:115-123. [ Links ]
65. Marcus JN, Watson P, Page DL, Narod SA, Lenoir GM, Tonin P, Linder-Stephenson L, Salerno G, Conway TA, Lynch HT. Hereditary breast cancer pathobiology, prognosis, and BRCA1 and BRCA2 gene linkage. Cancer 1996; 77:697-709. [ Links ]
66. Lee EH, Park SK, Park B, Kim SW, Lee MH, Ahn SH, Son BH, Yoo KY, Kang D; KOHBRA Research Group; Korean Breast Cancer Society. Effect of BRCA1/2 mutation on short term and longterm breast cancer survival: a systematic review and metaanalysis. Breast Cancer Res Treat 2010; 122:11-25. [ Links ]
67. Mazzola E, Cheng SC, Parmigiani G. The penetrance of ductal carcinoma in situ among BRCA1 and BRCA2 mutation carriers. Breast Cancer Res Treat 2013; 137:315-318. [ Links ]
68. Bayraktar S, Elsayegh N, Gutierrez Barrera AM, Lin H, Kuerer H, Tasbas T, Muse KI, Ready K, Litton J, Meric-Bernstam F, Hortobagyi GN, Albarracin CT, Arun B. Predictive factors for BRCA1/BRCA2 mutations in women with ductal carcinoma in situ. Cancer 2012; 118:1515-1522. [ Links ]
69. Warner E, Hill K, Causer P, Plewes D, Jong R, Yaffe M, Foulkes WD, Ghadirian P, Lynch H, Couch F, Wong J, Wright F, Sun P, Narod SA. Prospective study of breast cancer incidence in women with a BRCA1 or BRCA2 mutation under surveillance with and without magnetic resonance imaging. J Clin Oncol 2011; 29:1664-1669. [ Links ]
70. Jackson SA, Davis AA, Li J, Yi N, McCormick SR, Grant C, Fallen T, Crawford B, Loranger K, Litton J, Arun B, Vande Wydeven K, Sidani A, Farmer K, Sanders M, Hoskins K, Nussbaum R, Esserman L, Garber JE, Kaklamani VG; Northwestern Cancer Genetics Group. Characteristics of individuals with breast cancer rearrangements in BRCA1 and BRCA2. Cancer 2014; 120:1557-1564. [ Links ]
71. Hall MJ, Reid JE, Wenstrup RJ. Prevalence of BRCA1 and BRCA2 mutations in women with breast carcinoma in situ and referred for genetic testing. Cancer Prev Res (Phila) 2010; 3:1579-1585. [ Links ]












 uBio
uBio