INTRODUCCIÓN
El carcinoma de mama (CM), consiste en una proliferación acelerada e incontrolada de células del epitelio glandular, las cuales han aumentado enormemente su capacidad reproductiva 1. Los tumores de la mama pueden ser benignos o malignos; la diferencia radica en que los primeros están formados por células de aspecto normal y carecen de la capacidad de invadir tejidos circundantes y difundirse a otras partes del cuerpo. En cambio, los tumores malignos están conformados por células de aspecto anormal, capaces de invadir tejidos cercanos y propagarse a otras partes del cuerpo 2.
El cáncer es la segunda causa de muerte en el mundo, y en países desarrollados, el carcinoma de mama ocupa el primer lugar en cuanto a muertes femeninas. Solo en 2020 ocasionó 684.944 defunciones. El CM constituye una de las principales causas de morbi-mortalidad del mundo con 2.261.416 nuevos casos diagnosticados para el año 2020, lo que representa 11,7% de los cánceres en mujeres de todas las edades 3. En Latinoamérica y el Caribe, se registraron 199.734 pacientes afectadas en el año 2018, lo que representa 27,4% de los cánceres en pacientes femeninas, con una tasa de mortalidad de 13 por cada 100.000 habitantes. En Venezuela, el CM ha superado en frecuencia al cáncer en cuello uterino. Para el año 2018 se registraron 9.215 nuevos casos (28,3% de casos en mujeres), con una tasa de mortalidad de 16,9 por cada 100.000 habitantes 4,5.
En la práctica clínica se usa ampliamente la clasificación de los subtipos intrínsecos del carcinoma de mama determinados mediante inmunohistoquímica. Los tumores de mama poseedores de receptores de estrógeno (RE) o de progesterona (RP) se clasifican como luminal A o luminal B, con o sin expresión del receptor HER2. La caracterización fenotípica de estos tumores se basa en los criterios del Consenso de Saint Gallen, a partir del análisis de los receptores descritos y la medición del Ki-67, un marcador nuclear de la proliferación celular que se expresa en todas las fases del ciclo celular, excepto en la G0. En el Consenso de Saint Gallen del 2015, la mayoría del panel aceptó un umbral con un rango de 20 a 29% para distinguir entre los subtipos luminal A y B 6. El subtipo HER2 enriquecido presenta ausencia de RE y RP, con expresión de HER2.
El carcinoma de mama del subtipo triple negativo (CMTN) es aquel que no expresa RE, RP y HER2, además es el subtipo que afecta frecuentemente a mujeres jóvenes, posee un peor pronóstico y puede producir metástasis a distancia rápidamente, a pesar del tratamiento neoadyuvante 7. En el 2011, Lehmann y col. 8 propusieron una nueva clasificación para el CMTN, a partir del análisis de la expresión genética de estos tumores, la cual se conforma de 6 subtipos: basal-like 1 (BL1), basal-like 2 (BL2), inmunomodulador (IM), mesenquimal (M), mesenquimal stemlike (MSL) y receptor de andrógenos luminal (LAR). A partir de esta clasificación, Burstein y col. 9, realizaron una revisión en el 2015 y establecieron cuatro subtipos: subtipo 1 que incluye a los LAR, subtipo 2 conformado por los dos grupos mesenquimales, subtipo 3 que engloba a los BL inmunosuprimidos y subtipo 4, constituido por los BL inmunoactivados y algunos tumores inmunomoduladores. Uno de estos, el LAR tendría sensibilidad a antagonistas androgénicos (bicalutamide) 8.
Gracias a estudios recientes, se han descubierto factores predictivos que presentan las pacientes con CMTN 10. Uno de ellos, es RA, la expresión de este se asocia según Gasparini y col. 11, con mayores índices de sobrevida global (SG); sin embargo, los datos relativos a la SG y supervivencia libre de enfermedad (SLE) aún requieren de más estudios prospectivos, ya que diversos estudios señalan no encontrar significancia pronóstica a la expresión positiva de RA 12. Por su parte, Gerratana y col. 13 refieren que los estudios iniciales sugerían un posible papel pronóstico negativo del RA en el CMTN, pero cada vez hay más pruebas que indican que la expresión del biomarcador está asociada a un pronóstico favorable.
Asímismo, Anestis y col. 14 indican que los CMTN LAR (RA positivo, receptor del factor de crecimiento epidérmico negativo) pertenecen a un grupo de bajo riesgo con mejor pronóstico y menor tasa de proliferación. Este subgrupo podría ser el que más se beneficie de la terapia antiandrógenos. Al respecto, Lamb y col. 15 observaron que las pacientes poseen una menor SLE en respuesta a tratamientos convencionales. Sin embargo, la expresión positiva de RA en estos tumores podría hacerlos susceptibles a un tratamiento con antiandrógenos. En resumen, la modulación de los RA puede mejorar la quimio resistencia en el CMTN RA+ mediante un mejor control local de la enfermedad (inhibición de crecimiento tumoral y apoptosis) y del bloqueo de la transformación epitelial-mesenquimal que precede al desarrollo de las metástasis 16,17.
En Venezuela los estudios recientes muestran una frecuencia variable de 25- 28,2% del CMTN 18,19. En el país, se desconoce la frecuencia de expresión de los receptores de andrógeno en pacientes con carcinoma de mama de fenotipo triple negativo. Por esta razón, en el presente estudio se conformó una serie de mujeres venezolanas con CMTN, con el objetivo de determinar la expresión inmunohistoquímica del RA, lo que podría contribuir a identificar aquellas pacientes que puedan beneficiarse de los antagonistas androgénicos en la práctica clínica.
MATERIALES Y MÉTODOS
El presente trabajo se realizó en mujeres con diagnóstico de CMTN, a quienes se les realizó estudio inmunohistoquímico (IHQ) para RA en la Unidad de Anatomía Patológica del Hospital Metropolitano del Norte (HMN), Valencia, Venezuela entre los años 2017 y 2020. Con la aprobación del Comité de Ética del Instituto de Investigaciones Médicas y Biotecnológicas de la Universidad de Carabobo (IIMBUC) y de la Comisión de Investigación del HMN, se conformó una serie no aleatoria, de tipo intencional con 191 pacientes, quienes no habían recibido tratamiento previo a la extirpación del tumor. Los datos clínico patológicos de la serie [edad, grado histológico (GH) y expresión de Ki-67] se obtuvieron del informe de biopsia y estudio IHQ previos.
Construcción de la matriz de tejidos. Las muestras tisulares previamente habían sido fijadas en formol e incluidas en parafina siguiendo los métodos convencionales. De los bloques de parafina se obtuvieron secciones histológicas de 4 μm de espesor que, posteriormente, se tiñeron con hematoxilina-eosina. Se revisaron las preparaciones histológicas y se seleccionaron cuidadosamente las zonas con tumor, marcando esas mismas áreas en el bloque de parafina, a fin de construir las matrices de tejido según lo descrito en la literatura 19.
Inmunohistoquímica. De los bloques de parafina de cada matriz se obtuvieron secciones histológicas de 4 μm de espesor. Luego de la desparafinación de los cortes histológicos, se realizó la técnica IHQ con el anticuerpo primario RA (dilución 1/150, clon AR441, casa comercial BioSystems). Posteriormente, un médico especialista en anatomía patológica efectuó la lectura de los casos en un microscopio óptico Zeiss Axiostar plus con cámara Canon incorporada y conectada a un ordenador, determinando la positividad o negatividad y porcentaje de células teñidas para cada caso. La presencia de coloración nuclear indicó la positividad del biomarcador. Se consideró positiva la expresión, cuando hubo marcaje igual o mayor a 1% en las células neoplásicas.
Análisis estadístico. El análisis de los datos recogidos se realizó mediante el paquete estadístico SPSS versión 20 (IBM Statistical Package for Social Sciences, Inc., Chicago, IL). Se expresaron los resultados como media, número absoluto y porcentaje. La asociación entre las variables clínico-patológicas según la expresión de RA se analizó con la prueba no paramétrica de Chi cuadrado. Se consideraron significativos valores de p<0,05.
RESULTADOS
La edad media de las mujeres al momento del diagnóstico fue de 54,91 años, con un rango de 61 años (27 a 88). Histológicamente, los tumores en su mayoría (81,2%) eran GH II o III. El índice de proliferación Ki-67 fue igual o mayor a 30% en 75,9% de los tumores. El porcentaje de expresión positiva de RA fue 22% (42 de 191) (Tabla 1).
Tabla 1 Características clínico-patológicas de la serie.
| Variable | n (%) | |
|---|---|---|
| Edad en años media (rango) | 54,91 (27-88) | |
| Grupos etarios | ≤40 | 34 (17,8) |
| 41-50 | 36 (18,8) | |
| 51-65 | 76 (39,8) | |
| ≥66 | 45 (23,6) | |
| Punto de corte 50 años | Total | 191 (100) |
| ≤ 50 | 74 (38,7) | |
| ≥ 51 | 117 (61,3) | |
| Grado histológico | Total | 191 (100) |
| I | 36 (18,8) | |
| II | 76 (39,8) | |
| III | 79 (41,4) | |
| Ki-67 (%) | Total | 191 (100) |
| ≤19 | 13 (6,8) | |
| 20-29 | 33 (17,3) | |
| ≥30 | 145 (75,9) | |
| Ki-67 (%) | Total | 191 (100) |
| <40 | 101 (52,9) | |
| ≥40 | 90 (47,1) | |
| Receptores de andrógeno | Total | 191 (100) |
| Negativo | 149 (78) | |
| Positivo | 42 (22) | |
| Total | 191 (100) | |
En la relación entre los grupos etarios y la expresión de RA se evidenció que la mayor parte de los casos positivos correspondió a pacientes con edades entre 51 y 65 años o ≥51 años (con punto de corte en 50), sin diferencia estadísticamente significativa (Tablas 2 y 3). Al relacionar la expresión RA con el GH, se apreció un mayor porcentaje de casos positivos en el grado histológico III; sin embargo, esta diferencia no presentó significado estadístico (Tabla 4). El mayor número de casos con RA positivo tenía una expresión de Ki-67 igual o mayor al 30%, con p<0,05 al considerar los otros porcentajes de expresión (Tabla 5). Finalmente, en la asociación entre la expresión de RA y Ki-67 con punto de corte en 40%, se observó un mayor número de casos RA positivos en los tumores con expresión de Ki-67 menor a 40%, sin llegar a representar significancia estadística (Tabla 6).
Tabla 2 Relación entre receptores de andrógeno (RA) y grupos etarios, en pacientes con cáncer de mama triple negativo.
| Variable | RA | Total n (%) | ||
|---|---|---|---|---|
| Negativo n (%) | Positivo n (%) | |||
| Grupos etarios | ≤40 | 27 (79,4) | 7 (20,6) | 34 (17,8) |
| 41-50 | 29 (80,6) | 7 (19,4) | 36 (18,9) | |
| 51-65 | 57 (75) | 19 (25) | 76 (39,7) | |
| ≥66 | 36 (80) | 9 (20) | 45 (23,5) | |
| Total | 149 (78) | 42 (22) | 191 (100) | |
p=NS.
Tabla 3 Relación entre receptores de andrógeno (RA) y edad con punto de corte 50, en pacientes con cáncer de mama triple negativo.
| Variable | RA | Total n (%) | ||
|---|---|---|---|---|
| Negativo n (%) | Positivo n (%) | |||
| Grupo etario (en años) | ≤50 | 59 (79,7) | 15 (20,3) | 74 (38,7) |
| ≥51 | 90 (76,9) | 27 (23,1) | 117 (61,3) | |
| Total | 149 (78) | 42 (22) | 191 (100) | |
p=NS.
Tabla 4 Relación entre receptores de andrógeno (RA) y el grado histológico, en pacientes con cáncer de mama triple negativo.
| Variable | RA | Total n (%) | ||
|---|---|---|---|---|
| Negativo n (%) | Positivo n (%) | |||
| Grado histológico | I | 28 (77,8) | 8 (22,2) | 36 (18,8) |
| II | 64 (84,2) | 12 (15,8) | 76 (39,8) | |
| III | 57 (72,2) | 22 (27,8) | 79 (41,4) | |
| Total | 149 (78) | 42 (22) | 191 (100) | |
p=NS.
Tabla 5 Relación entre receptores de andrógeno (RA) y Ki-67, en pacientes con cáncer de mama triple negativo.
| Variable | RA | Total n (%) | ||
|---|---|---|---|---|
| Negativo n (%) | Positivo n (%) | |||
| Ki-67 (%) | ≤19 | 11 (84,6) | 2 (15,4) | 13 (6,8) |
| 20-29 | 20 (60,6) | 13 (39,4) | 33 (17,3) | |
| ≥30 | 118 (81,4) | 27 (18,6) | 145 (75,9) | |
| Total | 149 (78) | 42 (22) | 191 (100) | |
p=0,028.
Tabla 6 Asociación entre receptores de andrógeno (RA) y Ki-67 con punto corte en 40%, en pacientes con cáncer de mama triple negativo.
| Variable | RA | Total n (%) | ||
|---|---|---|---|---|
| Negativo n (%) | Positivo n (%) | |||
| Ki-67 (%) | <40 | 74 (73,3) | 27 (26,7) | 101 (52,8) |
| ≥40 | 75 (83,3) | 15 (16,7) | 90 (47,2) | |
| Total | 149 (78) | 42 (22) | 191 (100) | |
p=NS.
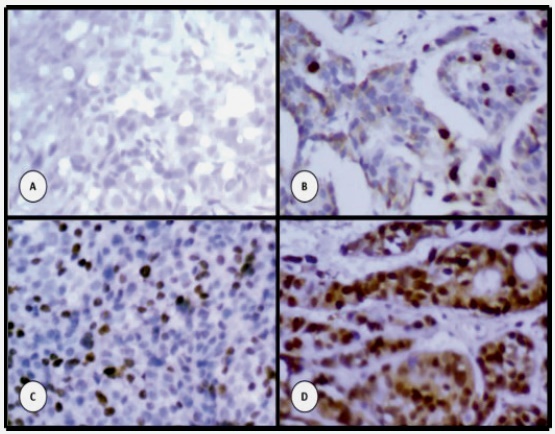
La Fig. 1 muestra ejemplos representativos de los patrones de expresión inmunohistoquímica observados en el biomarcador analizado en este estudio.
DISCUSIÓN
El abordaje clínico de una mujer con CMTN constituye un reto importante para el clínico, debido a que este tipo de tumor se caracteriza por ser una entidad heterogénea de difícil manejo 20. Los actuales trabajos se centran en subclasificar al CMTN y buscar tratamientos más específicos. Uno de estos subtipos es el LAR, que al ser positivo para RA puede ser susceptible al tratamiento antiandrógeno 8,9,21.
Yin y col. 22 evaluaron la subtipificación molecular del cáncer de mama, evidenciando que el RA se expresa tanto en el tejido mamario normal como en CM, pero con niveles significativamente diferentes. En el presente estudio se observó una expresión de RA en 22% (42 de 191 casos) de los tumores. No obstante, Barton y col. 23 en su revisión refieren un porcentaje de positividad de RA que oscila entre 12 a 55% en CMTN. De forma similar, un estudio realizado por Bhattarai y col. 24, informa que la expresión del biomarcador presentó una gran variación, desde 8,3% en los CMTN nigerianos hasta 55% en la cohorte de Reino Unido.
En un trabajo diseñado en Colombia por Melo y col. 25, la expresión de RA se detectó en 41,6% de las biopsias (62 de 149 pacientes), sin encontrar diferencias estadísticamente significativas entre las variables clínico-patológicas de la serie en estudio y el receptor de andrógeno. En otra investigación realizada por McGhan y col. 26, el RA fue positivo en 23% (22 de los 94 casos) de CMTN, similar a lo obtenido en nuestro trabajo.
En relación a la edad, la mayoría de las pacientes tenían más de 51 años (61,3%), sin diferencia estadísticamente significativa con la positividad o negatividad de RA. Otros autores han descrito que la expresión del receptor se relacionó con una mayor edad (igual o mayores de 50 años) 26-28, lo que parece reflejar una tendencia de edad mayor a 50 años en CMTN RA+25. Por el contrario, otro trabajo refiere que las mujeres que tienen una expresión de RA superior al 50%, son más jóvenes. Respecto al grado histológico, Astvatsaturyan y col.27 obtuvieron que 89% de los CMTN RA+ presentaron un GH III, similar a lo encontrado en este trabajo. Sin embargo, otras investigaciones reportan una asociación significativa entre la positividad de RA y un menor GH del tumor 28-30.
En la actualidad, el Ki-67 constituye uno de los antígenos más estudiados en IHQ. Es una proteína que se expresa en el núcleo de las células durante diferentes fases del ciclo celular, excepto en el estado quiescente G0. Se ha propuesto como medida de la proliferación celular en muestras de CM 31. En general, los niveles elevados de expresión de Ki-67 se correlacionan fuertemente con una mayor multiplicación tumoral y mal pronóstico en CMTN 32. No obstante, el índice de proliferación es uno de los biomarcadores con menor expresión en el subtipo LAR del CMTN 33-35. En nuestra serie, la mayoría de los carcinomas RA positivos mostraron un índice de proliferación menor al 40%, similar a lo referido en otras investigaciones 36-39. De igual forma, Dieci y col. 40, observaron en su investigación que la expresión de RA se asoció significativamente con menor Ki-67 (p<0,001), lo que puede deberse al efecto antiproliferativo de la estimulación de RA 37.
En conclusión, la positividad de RA encontrada en este estudio representa una frecuencia intermedia en relación a otras investigaciones. No se encontraron diferencias estadísticamente significativas con la edad de las pacientes y GH de los tumores, aunque el índice proliferativo Ki-67 fue menor para los tumores RA+, comparado con los CMTN en general.












 uBio
uBio