Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT v.21 n.1 Caracas ene. 2002
Papel Permisivo de la Angiotensina II en la respuesta simpática al Estrés
B Sosa2 y A Israel1.
-
Facultad de Farmacia, Universidad Central de Venezuela, Caracas.
-
Escuela de Medicina Universidad CentroOccidental Lisandro Alvarado, Barquisimeto, Venezuela.
RESUMEN
Empleando un modelo experimental en el cual el sistema renina-angiotensina se encuentra reducido o bloqueado, se evaluó el papel de la angiotensina II (ANG) endógena en la respuesta simpática cardiovascular en ratas conscientes. El estímulo eléctrico plantar incrementó la presión arterial media (PAM) y la frecuencia cardíaca (FC). La inhibición de la enzima convertidora con captopril o el bloqueo de los receptores AT1 con losartan, atenuaron la respuesta vasopresora al estrés, mientras que la frecuencia cardíaca no fue alterada. La aplicación del estímulo eléctrico plantar a ratas con nefrectomía bilateral mostró inhibición en la respuesta vasopresora, así como en la elevación de la norepinefrina y epinefrina plasmática inducida por el estrés. La administración de una dosis subpresora de angiotensina II a las ratas nefrectomizadas restauró la respuesta cardiovascular frente al estrés. Nuestros resultados demuestran que en ratas conscientes, la respuesta cardiovascular frente al estímulo eléctrico plantar dependen de la integridad y actividad del sistema renina-angiotensina, e indican que la angiotensina II endógena ejerce un papel permisivo en la respuesta vasopresora simpática frente al estrés.
Palabras Clave: Estímulo eléctrico plantar, Nefrectomía, Losartan, Captopril.
ABSTRACT
The present study was carried out to assess whether endogenous angiotensin II (ANG) supports sympathetically mediated cardiovascular response to stress in conscious unrestrained rats, using experimental models in which the renin-angiotensin-system was reduced or blocked. Footshock-stress increased mean arterial pressure (MAP) and heart rate (HR). Inhibition of angiotensin converting enzyme with captopril or blockade of AT1 angiotensin receptor with losartan, attenuated vasopressor responses to footshocks, while heart rate response was not altered. Bilateral nephrectomy suppressed vasopressor response as well the elevation of plasma norepinephrine (NE) and epinephrine (EPI) induced by footshocks, and reduced heart rate response. Cardiovascular response to stress in nephrectomyzed rats was restored by exogenous administration of a subpressor dose of angiotensin II. Our results demonstrate that in conscious rats cardiovascular response to footshocks is dependent on an active renin-angiotensin system and they indicate that endogenous ANG supports the sympathetically mediated vasopressor response to footshocks.
Key Words: Footshock, Nephrectomy, Losartan, Captopril
INTRODUCCIÓN
Es bien conocida la relación que existe entre en sistema renina angiotensina (SRA) y la respuesta frente al estrés. En efecto, una serie de modelos de estrés incrementan la secreción de renina y consecuentemente los niveles plasmáticos de angiotensin II (ANG)(1,2). Estudios realizados tanto en modelos animales como en humanos han sugerido que la ANG participa en la regulación del sistema nervioso simpático y que la misma podría tener una papel crucial en la respuesta cardiovascular inducida por el estrés, al menos en parte debido a un efecto permisivo sobre el eflujo simpático(3). Este concepto se ve sustentado por los reportes acerca del efecto de la inhibición del SRA y la respuesta cardiovascular frente a la activación simpática. Se han empleado varios inhibidores de la cascada sintética del SRA a fin de establecer la relación entre estos dos sistemas vasopresores(4), siendo uno de los modelos más comúnmente empleado el de la rata descerebrada. En efecto, se ha demostrado que en ratas descerebradas, que la inhibición aguda del SRA bloquea la respuesta cardiovascular a la estimulación simpática(5,6,7,8). Estos resultados han sido interpretados como el resultado del bloqueo de la ANG generada a nivel vascular o bien del SRA circulante. En otro modelo experimental como es la disminución de la presión negativa corporal en gatos anestesiados, una maniobra que activa el reflejo simpático, se demostró que la inhibición de la enzima corvertidora o el bloqueo de los receptores de ANG incrementaron la respuesta hipotensora a la reducción de la presión negativa corporal, sugiriendo que la ANG incrementa la actividad del sistema nervioso simpático(9).
Numerosas evidencias soportan el concepto de que la ANG facilita la transmisión simpática. Sin embargo la mayoría de los estudios han sido realizados en órganos aislados, en ratas anestesiadas o descerebradas, modelos estos, en los que la presión sanguínea es baja o el SRA se encuentra estimulado. Igualmente se han empleado dosis farmacológicas de ANG exógena o se han aplicado estímulos eléctricos en forma directa a los nervios simpáticos(10,11). De manera que es escasa la evaluación que se ha realizado acerca de la interacción entre la ANG y el sistema nervioso simpático en condiciones de niveles normales de ANG y con un control central del sistema nervios simpático intacto. Por ello, la interrogante de que si la ANG endógena, en animales conscientes, es capaz de influenciar la respuesta cardiovascular a estímulos estresores es materia de debate.
En el presente estudio evaluamos la posible interrelación entre el SRA y la estimulación del sistema nervioso simpático, en un modelo de estrés agudo aplicado a ratas conscientes con libre movilidad. Nuestro propósito fue determinar si la presencia de un SRA intacto es determinante para la respuesta simpática frente al estrés. Si la ANG soporta la respuesta cardiovascular simpática en ratas conscientes con libre movimiento, la interferencia con el SRA debería reducir la actividad simpática y en consecuencia la respuesta cardiovascular frente al estímulo eléctrico plantar (EEP). Con el fin de reducir o eliminar el SRA, las ratas fueron sometidas a nefrectomía bilateral, inhibición de la actividad de la enzima convertidora con captopril o al bloqueo de los receptores AT1 con losartan.
MATERIALES Y MÉTODOS
Se emplearon ratas macho de la cepa Sprague-Dawley (200 a 250 g), procedentes del bioterio de la Facultad de Farmacia, U.C.V., Caracas, mantenidas con Ratarina® y agua ad libitum. El registro de los parámetros cardiovasculares, presión arterial (PA) y frecuencia cardíaca (FC) se realizó en ratas conscientes, por un método no invasivo, mediante un pletismógrafo digital de cola (DIGITAL PRESSURE METER LE 5000 y un PRESSURE CYLINDER LE 5100, LETICA®, Barcelona, España) como fue descrito previamente(12,13). Las ratas se mantuvieron en una estufa a 42°C, durante quince minutos y luego se procedió a la cuantificación de los parámetros cardiovasculares(frecuencia cardíaca, presión arterial sistólica (PAS) y presión arterial diastólica (PAD). Los valores de presión arterial y FC fueron determinados antes de cada tratamiento y 5 minutos antes de la aplicación del estímulo eléctrico, este último valor fue considerado como el basal. En grupos separados de animales se realizaron los siguientes tratamientos: solución salina, captopril (10 mg/kg, i.p.)o losartan (3 or 10 mg/kg, s.c.) (The DuPont Merck Pharmaceutical Co, Wilmington DE), una hora antes del estímulo eléctrico plantar.
Un grupo de ratas fueron sometidas a nefrectomía bilateral, 20-22 horas antes de la aplicación del estrés. La nefrectomía bilateral es un modelo experimental de ratas con niveles plasmáticos de renina baja. Con el fin de revertir el efecto cardiovascular de la nefrectomía, un grupo de ratas con nefrectomía bilateral se les administró una dosis subpresora de ANG (12,5 mg/kg, sc). Con el fin de evaluar la hipercalemia inducida por la nefrectomía bilateral, otro grupo de ratas con nefrectomía bilateral se les administró por vía oral una solución de kayesalato, preparada en solución de glucosa al 5% y a la dosis de 2 g/kg.
Determinación de los niveles de noradrenalina y adrenalina
Las ratas fueron divididas en dos grupos experimentales: operación simulada (OS) y nefrectomizadas (NFX). La mitad de las ratas de cada grupo fueron sometidas al estímulo eléctrico plantar. Se tomaron muestras de sangre arterial (aorta abdominal) bajo anestesia con pentobarbital sódico (80 mg/kg). Las muestras de sangre fueron recogidas (4 ml) en tubos que contenían 5% de EDTA y 0.2 ml de metabisulfito de sodio (5%) y centrifugadas inmediatamente a 15.000 r.p.m. por 10 min a 5°C para separar el plasma. Las muestras de plasma fueron almacenadas a -70°C para su análisis en un período no mayor de una semana. Los niveles sanguíneos de las catecolaminas, noradrenalina y adrenalina, fueron determinados mediante cromatografía líquida de alta eficiencia de fase reversa y por detección electroquímica(14,15). La fase móvil consistió en una solución de: ácido fórmico 100 mM, ácido cítrico 1 mM, EDTA 1 mM, octilsulfato sódico 0,075 mM y metanol al 8% en 1000 ml, ajustada a un pH final de 3,8 con NaOH 1 M. Los niveles de noradrenalina y adrenalina fueron calculados por el método del estándar externo con un integrador automático de doble canal modelo 746. Para los estándares externos de noradrenalina y adrenalina se preparó una solución madre con una concentración de 10 mg/ml en HCL 0.1 N. La solución madre del estándar se realizó diariamente, inyectándose un volumen de 20 ml/ 250 pg del estándar. Los niveles plasmáticos de catecolaminas se expresaron en pg/ml de plasma. Se identificaron los picos comparando el tiempo de retención de cada pico en la solución estándar.
Análisis estadístico: Todos los resultados se expresaron como la media ± EEM. La presión arterial se expresó como presión arterial media (PAM) aplicando la siguiente fórmula: PAD + 1/3 (PAS-PAD). La significancia estadística fue determinada usando las prueba t de Student o el análisis de varianza de una vía (ANOVA) y por el rango estadístico de Student-Newman-Keuls. Se consideraron significativos los valores de p< 0.05.
RESULTADOS
El bloqueo de los receptores alfa-adrenérgicos con fentolamina, antagonizó la respuesta presora frente al estrés eléctrico plantar (2 Hz) (Aumento en la PAM, mmHg: control-salina: 21.2 ± 1.4 y fentolamina 5.05 ± 0.59; N=10).
Como se muestra en la figura 1, en ratas con operación simulada (OS) el EEP produjo un aumento significativo en la presión arterial media (19.1 ± 2.1 mmHg) y la frecuencia cardíaca (86.2 ± 8.6 l.p.m.). La administración de captopril (10 mg/kg, i.p.) o losartan (3 o 10 mg/kg, s.c.) bloqueó la respuesta presora al EEP (2 Hz) si se compara con la respuesta de los animales control. La respuesta de la FC no se alteró con los tratamientos (no se muestra).
La nefrectomía bilateral disminuyó significativamente la respuesta presora al EEP, sin alterar la respuesta de la FC. (Incremento en la PAM (en mmHg): OS + EEP= 20.85 + 3 y NFX + EEP= -7.3 + 3. Incremento en la FC (l.p.m.): OS + EEP = 65.0 + 2 y NFX + EEP = 65.5 + 5, N= 14). Adicionalmente, como se muestra en la Tabla 1, en ratas con operación simulada el EEP produjo un incremento significativo de la noradrenalina y adrenalina plasmática. Mientras que en ratas con nefrectomía bilateral se abolió la respuesta simpática reflejada como una inhibición del incremento de la noradrenalina plasmática frente al EEP. Cuando las ratas NFX fueron inyectadas con una dosis subpresora de angiotensina II sintética (12.5 mg/kg) inmediatamente antes de la aplicación del EEP, se observó una reversión de la falta de respuesta cardiovascular al estrés eléctrico plantar (Figura 2). Los niveles de potasio plasmático incrementaron significativamente después de la NFX y este incremento fue prevenido mediante el tratamiento con kayexalato. (Potasio plasmático en mEq/L= OS: 3.29 + 0.1 (N=9); NFX: 6.64 + 0.3 (N=8) y NFX+ky: 4.7 + 0.44 (N=4). La reducción de los incrementos en los niveles plasmáticos de potasio inducidos por la NFX, no revirtieron la falta de respuesta cardiovascular frente al estrés eléctrico plantar en la ratas con nefrectomía bilateral (Figura 2).
Tabla 1: Efecto de la nefrectomía bilateral sobre los cambios en los niveles de las catecolaminas plasmáticas frente al estímulo eléctrico plantar.
| Grupo experimental | Catecolaminas Plasmáticas (pg/ml) | ||
|
| NA | A | NA+A |
| OS | 509,8 + 81 | 395.49 + 50 | 814.65 + 120 |
| OS+EEP | 2110.2 + 347* | 833.64 + 362* | 3008.92 + 658* |
| NFX | 445.2 + 57 | 433.15 + 149 | 878.31 + 150 |
| NFX+EEP | 371.6 + 29 | 277.78 + 52 | 649.37 + 75 |
*p<0.01 comparado con OS-control
Figura 1: Respuesta vasopresora al EEP en ratas tratadas con losartan, captopril, o sometidas a Nefrectomía bilateral.
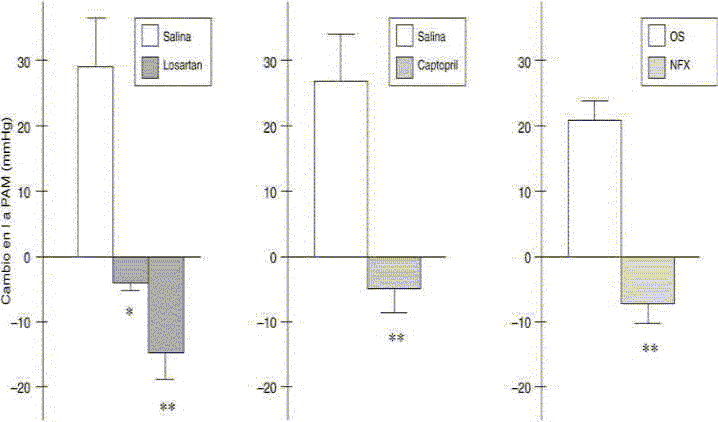
Los resultados se expresan como presión arterial media (PAM) en mmHg y ellos representan la media + EEM.
Solución salina: N=20-27; OS: N= 7; LOS: N= 15 y 27; CAP: N= 8; NFX: N= 7. *p< 0.01 y **p< 0.001, comparado con el control.
Figura 2: Respuesta cardiovascular al estímulo eléctrico plantar en ratas con nefrectomía bilateral (NFX).
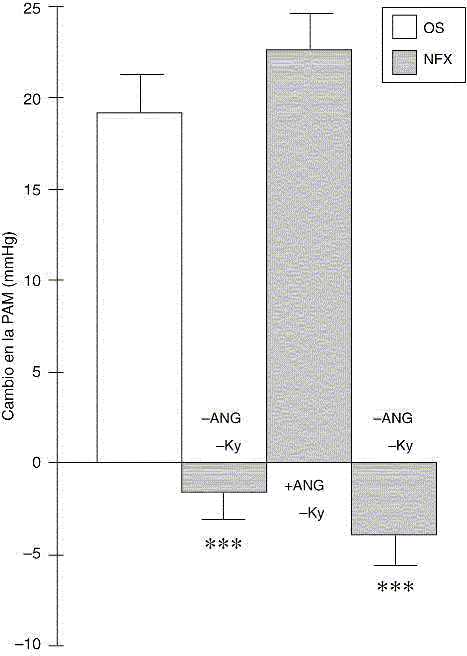
Efecto de la administración de angiotensina II exógena y el tratamiento con kayexalato. Los resultados como presión arterial media (PAM) en mmHg y ellos representan la media + EEM. OS: N= 11; NFX: N= 13; NFX+ANG: N=7; NFX+Ky: N=6. ***p< 0.0001 comparado con el control.
DISCUSIÓN
El estrés agudo inducido por el estímulo eléctrico plantar causa activación simpatoadrenal e incrementos en la presión arterial y la frecuencia cardíaca(16). Varios modelos de estrés se encuentran asociados al incremento de la secreción de renina y el consecuente aumento de los niveles circulantes de angiotensina II(1,2). Ahora bien, la ANG podría contribuir a la respuesta vasopresora frente al EEP, a través de mecanismos distintos a la contracción del músculo liso vascular. La ANG podría incrementar el papel de otros sistemas presores como el sistema nervioso simpático. En efecto, se sabe que la ANG modula la respuesta del sistema nervioso simpático frente a la estimulación cardiovascular refleja mediante un mecanismo central(17) y facilita la transmisión simpática a nivel de varios órganos(18,19). La ANG circulante podría interactuar con núcleos del sistema nervioso central implicados en la regulación cardiovascular a través de su acceso a estructuras circunventriculares carentes de barrera hematoencefálica y así incrementar la actividad nerviosa simpática(20). En la periferia, se sabe que la ANG facilita la liberación de noradrenalina desde los terminales nerviosos(21). Por ello, el bloqueo de la conversión de ANG I a ANG II, el bloqueo de los receptores de angiotensina II con losartan o la reducción de los niveles plasmáticos de renina mediante la remoción de ambos riñones(6), debería reducir la acción facilitatoria de la angiotensina endógena durante la estimulación simpatoadrenal. Con el fin de demostrar esta hipótesis, sometimos a ratas conscientes, con libre movimiento, al estímulo eléctrico plantar, un modelo experimental que aumenta la actividad simpatoadrenal.
Nuestros resultados extienden reportes previos, y demuestran que el bloqueo agudo del SRA con captopril o losartan inhibe la respuesta vasopresora frente al estrés, sugiriendo que en condiciones en el sistema renina-angiotensina se encuentra elevado como en el estrés agudo(22), la respuesta vasopresora adrenérgica estaría soportada o intensificada por la angiotensina endógena. Resultados similares se observaron en gatos con sobrecarga de sodio y tratados con mineralocorticoides(23). Estos hallazgos parecen indicar que es necesario un nivel adecuado de los diferentes componentes del SRA para que se exprese la respuesta simpática ante el estrés. Podemos postular que se requiere de la integridad del SRA para que la respuesta simpática se manifieste en toda su plenitud en estados de estrés agudo. El bloqueo del receptor AT1 con el losartán o la inhibición de la enzima convertidora de angiotensina; situaciones en que se reduce el SRA, ocasionan una atenuación marcada de la respuesta de origen simpático, en tanto que la respuesta presora fue completamente abolida por el bloqueo alfa-adrenérgico con fentolamina. Nuestros hallazgos aportan evidencia adicional que indica que la ANG modula la respuesta vasopresora al estrés a través del receptor AT1. La interacción entre la ANG y el SNS probablemente ocurre a nivel de los receptores AT1 presinápticos localizados en los terminales nerviosos simpáticos, donde su acción facilitatoria sería antagonizada por el losartan(13). La acción inhibitoria del losartan en la facilitación de la transmisión simpática inducida por la ANG podría ser atribuida al bloqueo de cualquier interacción de la misma con los receptores AT1. En apoyo a nuestra hipótesis están nuestros hallazgos en ratas nefrectomizadas. El modelo de nefrectomía bilateral es un modelo de renina baja. Se sabe que la fuente principal de renina circulante es el riñón. La nefrectomía produce una disminución de la actividad de la renina plasmática y de los niveles circulantes de angiotensina II(23,24). El bloqueo total observado en la respuesta presora y en la frecuencia cardíaca frente al EEP en ratas con 20-22 horas de nefrectomía bilateral apoya nuestra hipótesis y nos permiten plantear que el SRA, a través de su péptido activo: ANG II actúa como un sistema de interruptor que permite, o no, la respuesta simpática ante un estímulo estresor, como el eléctrico plantar.
Ahora bien, se conoce que en las ratas nefrectomizadas se produce un aumento en los niveles extracelulares de potasio que podría ser responsable de la ausencia de respuesta simpática al estrés. Para descartar esta posibilidad las ratas fueron tratadas con una resina de intercambio catiónico (kayesalato), la cual disminuyó de manera significativa los niveles plasmáticos del potasio al compararlas con las ratas nefrectomizadas no tratadas con la resina. Desde que la respuesta cardiovascular en ratas nefrectomizadas tratadas con kayesalato fue similar a las ratas no tratadas, descartamos la posibilidad que la ausencia de respuesta simpática en ratas nefrectomizadas se relacione con aumentos del potasio circulante. Esto nos permite afirmar que la ausencia de respuesta frente al estrés eléctrico plantar en ratas nefrectomizadas no está relacionada con las alteraciones de los niveles plasmáticos de potasio.
Si la angiotensina II juega un papel crítico en la manifestación de la respuesta simpática frente a un estrés agudo, la administración exógena de angiotensina II debería revertir la ausencia de respuesta cardiovascular en las ratas nefrectomizadas. Nuestros resultados en ratas con nefrectomía bilateral a las que se les administró una dosis subpresora de angiotensina II apoyan esta posibilidad. En efecto, la angiotensina II exógena revirtió el efecto de la nefrectomía con incrementos en la presión arterial media y de la frecuencia cardíaca frente al EEP; lo que nos permite afirmar que la ausencia de respuesta simpática en animales nefrectomizados se debe a la falta de integridad del SRA. En apoyo a nuestros hallazgos están los resultados de Feuerstein y col.(23) quienes demostraron en gatos, que la nefrectomía bilateral desaparece la respuesta adrenomedular (liberación de catecolaminas) a la hemorragia. Igualmente, en gatos con sobrecarga de sodio y administración de mineralocorticoides se reportó un bloqueo del aumento de las catecolaminas en sangre posterior a una hemorragia experimental. Asimismo, en pacientes hipertensos con insuficiencia renal crónica se ha demostrado una disminución de las descargas simpáticas luego de la nefrectomía bilateral asociada con disminución de la presión arterial media(25).
La falta de respuesta vasopresora frente a un estímulo estresante en ratas tratadas con captopril o losartan, junto con la carencia de respuesta en las ratas nefrectomizadas, permite proponer que la expresión de la respuesta simpática frente al estrés agudo requiere la integridad del sistema renina-angiotensina. La angiotensina II endógena ejercería un papel permisivo frente al sistema nervioso simpático regulando así el eflujo simpático.
Agradecimientos
Los autores agradecen al Dr. Ronald Smith de Duppont por el obsequio de losartan. Este estudio fue subvencionado por el Proyecto CDCH PI-06-30-4267-98 de la Universidad Central de Venezuela
REFERENCIAS bibliográficas
1. Jindra A Jr, Kvetnansky R. Stress-induced activation of inactive renin. J. Biol. Chem. 1982; 257: 5997-5999. [ Links ]
2. Ganong WF, Barbieri C. Neuroendrocrine components in the regulation of renin secretion. In Frontiers in Neuroendocrinol. W.F. Ganong and L. Martini eds. Raven Press. New York. 1982; 231-262 [ Links ]
3. Xu L, Brooks VL. ANG II chronically supports renal and lumbar sympathetic activity in sodium-deprived, conscious rats. Am J Physiol 1996; 271 (Heart Circ. Physiol. 40): H2591-H2598. [ Links ]
4. Brunner HR, Nussberger J, Waeber B. Angiotensin II blockade compared with other pharmacological methods of inhibiting the renin-angiotensin system. J Hypertension 1993; 11 (Suppl 3): 553-558. [ Links ]
5. Antonaccio MJ, Kervin L. Pre and postjunctional inhibition of vascular sympathetic function by captopril in SHR implication of vascular angiotensin-II in hypertension and antihypertensive actions of captopril. Hypertension 1981; (Suppl. 8): 1-54. [ Links ]
6. Wong PB, Hart SD, Timmermans PBMWM. Effect of angiotensin II antagonism on canine renal sympathetic nerve function. Hypertension 1991; 17: 1127-1134. [ Links ]
7 Wong PB, Bernard R, Timmermans PBMWM. Effect of blocking angiotensin II receptor subtype on rat sympathetic nerve function. Hypertension 1992; 19: 663-667. [ Links ]
8. Vollmer RR, Meyers SA, Ertel RJ, Murthy VS. Diminished sympathetic responsiveness in nephrectomized rats. Role of the brain angiotensin system. Clin Exp Theory and Practice 1984; A6(5): 993-1009. [ Links ]
9. Hatton R, Clough DP, Adigun SA, Conway J. Functional interaction between angiotensin and sympathetic reflexes in cats. Clin Sci 1982; 62: 51-56. [ Links ]
10. Böke T, Malik V. Enhancement of locally generated angiotensin II of release of adrenergic transmitter in the isolated rat kidney. J Pharmacol Exp Ther 1987; 226: 900-907. [ Links ]
11. Johns EJ. The role of angiotensin II in the antidiuresis and antinatriuresis induced by stimulation of the sympathetic nerves to the kidney. J Auton Pharamacol 1987; 7: 205-214. [ Links ]
12. Israel A, Cierco M, Sosa B. Angiotensin AT2 receptors mediate vasodepressor response to footshock in rats: role of kinins, nitric oxide and prostaglandins. European J Pharmacol 2000; 394: 103-108. [ Links ]
13. Cierco M, Israel A. Role of AT1 receptor in the cardiovascular response to footshock. European J Pharmacol 1994; 251: 103-106. [ Links ]
14. DiBussolo JM, Gant JR, Kerber D. Instrumental considerations in catecholamine analysis using liquid chromatography with electrochemical detection. Chromatography Newsletter 1983; 11: 27-29. [ Links ]
15. Anton AH, Sayre DF. A study of the factors affecting the aluminum oxidetrihydrozyindole procedure for the analysis of catecholamines. J Pharmacol Exp Ther 1962; 138: 360-375. [ Links ]
16. Lee J, Konarska M, McCarty R. Physiological responses to acute stress in alloxan and streptozotocin diabetic rats. Physiol Behav 1989; 45: 483-489. [ Links ]
17. Reid IA. Interactions between Ang II, sympathetic nervous system, and baroreceptor reflexes in regulation of blood pressure. Am J Physiol 1992; 262: E763-E778. [ Links ]
18. Liao JC, Zimmerman BG. Effect of angiotensin on uptake of 3H-norepinephrine in dog cutaneous arteries. Proc Soc Exp Biol Med 1972; 139: 216-219. [ Links ]
19. Johns B, Aalkjaer C, Mulvany MJ. Response of femoral resistance vessels to angiotensin in vitro. Eur J Pharmacol 1993; 135: 61-68. [ Links ]
20. Ferrario CM, Gildenberg PL, McCubbin JW. Cardiovascular effects of angiotensin mediated by central nervous system. Cir Res 1972; 30: 257-262. [ Links ]
21. Roth RH. Actions of angiotensin on adrenergic nerve endings: enhancement of norepinephrine biosynthesis. Fed Proc. 1972; 31: 1358-1361. [ Links ]
22. Burkenburg B, Schnell CH, Baum HP, Cumin F, Wood JM. Prolonged angiotensin II antagonism in spontaneously hypertensive rats. Hemodynamic and biochemical consequences. Hypertension 1991; 18: 278-288. [ Links ]
23. Feuerstein G, Boonyaviroj P, Gutman Y. Renin-angiotensin mediation of adrenal catecholamine secretion induced by hemorrhage. European J Pharmacol 1977; 44: 131-142. [ Links ]
24. Grant TL, McGrath JC. Interactions between angiotensin II, sympathetic nerve-mediated pressor response and cyclo-oxygenase. products in pithed rat. Br J Pharmacol 1988; 95: 1220-1228. [ Links ]
25. Converse RL, Jacobsen TN, Toto RD, Jost CMT, Consentino F, Fouad-Tarazi F, Victor RG. Sympathetic overactivity in patients with chronic renal failure. New England J Med 1992; 327: 1912-8. [ Links ]













