Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT v.21 n.1 Caracas ene. 2002
Papel de los receptores de la Adrenomedulina y del Péptido relacionado con el Gen de la Calcitonina en la acción renal de la adrenomedulina administrada centralmente
E Diaz1 y A Israel1.
-
Facultad de Farmacia, Laboratorio de Neuropéptidos, Universidad Central de Venezuela, Caracas, Venezuela.
RESUMEN
Con el fin de establecer el subtipo de receptor que media la acción diurética y natriurética inducida por la adrenomedulina (AM) intracerebroventricular (IVT), se evaluó esta respuesta en ratas pretratadas con AM(22-52), un antagonista específico del receptor de la AM (AM-R), o con CGRP(8-37), un antagonista de los receptores tipo 1 del péptido relacionado con el gen de la calcitonina (CGRP1). Además, se evaluó el efecto de la administración IVT del péptido relacionado con el gen de la calcitonina (CGRP) sobre el volumen urinario y la excreción de sodio y potasio urinarios. En ratas conscientes e hidratadas, la AM-IVT produce un aumento significativo en el volumen urinario y en la excreción de sodio durante todo el período de recolección de orina (6 horas), observándose el mayor efecto a las 3 y 6 hrs. De igual manera, la administración central del CGRP produce diuresis y natriuresis, sin embargo éste péptido fue menos potente que la AM. El pretratamiento con AM(22-52) o CGRP(8-37) bloquea significativamente el efecto diurético y natriurético de la AM-IVT. Nuestros resultados sugieren que ambos subtipos de receptores, AM-R y CGRP1, median la acción diurética y natriurética de la AM administrada centralmente. Nuestro trabajo soporta la hipótesis de que la AM endógena participa en el control central de la homeostasis hidromineral.
Palabras Clave: Excreción de sodio, Adrenomedulina, Péptido relacionado con el gen de la calcitonina.
ABSTRACT
To determine pharmacological specificity of intracerebroventricular (IVT) administration of adrenomedullin (AM) on water and sodium excretion, studies were performed in rats pretreated with AM(22-52), a putative AM-receptor antagonist or CGRP(8-37), a ligand that preferentially antagonizes the CGRP1-receptor subtype. In addition, the effects of IVT injection of calcitonin-gene-related-peptide (CGRP) on urinary water and electrolyte excretion was assessed. Intracerebroventricular administration of rat adrenomedullin to conscious hydrated rats, resulted in a significant increase in urinary volume and sodium excretion during the 6-hour period of urine collection and was most effective during the 3 and 6 hrs. Although less effective than AM, central administration of CGRP induced diuresis and natriuresis. Pretreatment with AM(22-52) or CGRP(8-37) significantly suppressed the diuretic and natriuretic effect of IVT-AM. These data suggest that both, CGRP1 and AM receptors, are involved in the centrally mediated diuretic and natriuretic action of the AM. Our results provide evidence supporting the hypothesis that endogenous AM plays a role in the central nervous control of fluid and electrolyte homeostasis.
Key Words: Sodium excretion, Adrenomedullin, Calcitonin gene-related peptide.
INTRODUCCIÓN
La adrenomedulina (AM) es un péptido de 52 aminoácidos en el humano y 50 aminoácidos en la rata, el cual ejerce potentes acciones vasodilatadoras e hipotensoras cuando se administra sistémicamente. Además de sus efectos periféricos, ciertas acciones de la AM están mediadas centralmente. La AM se encuentra distribuida ampliamente en todo el sistema nervioso central (SNC), encontrando las concentraciones más elevadas del péptido en la glándula pituitaria, tálamo, hipotálamo, tallo cerebral y otras regiones(1,2,3). Mediante técnicas de immunohistoquímica se demostró la localización discreta de la AM en varias regiones del cerebro, y dentro del hipotálamo la inmunoreactividad a la AM se localizó en neuronas de los núcleos paraventricular y supraóptico(1,2,3). El gen de la AM se expresa y se transcribe en el cerebro(1,4) sugiriendo que las acciones centrales de este péptido podrían ser complementarias de sus efectos periféricos. Los receptores específicos de la AM (AM-R), los cuales difieren del CGRP1, se encuentran en varios tejidos de la rata incluyendo el cerebro y la médula espinal(5) y en el cerebro humano (corteza cerebral, cerebelo, tálamo, hipotálamo, pedúnculos cerebrales y bulbo raquídeo)(6). Sin embargo, a diferencia de la médula espinal, los sitios AM-R son mas escasos que los del CGRP en el SNC, los cuales se encuentran de manera más abundante y extensa en el cerebro(7).
La localización de los receptores de la AM en el SNC, en áreas involucradas con el equilibrio hidromineral y la liberación de vasopresina sugiere un papel para este péptido en la regulación de la homeostasis de fluidos y electrolitos. Es interesante destacar que alguna de las estructuras donde se localizan los sitios de unión de la AM contienen densidades altas de receptores para la angiotensina II, el péptido natriurético autricular (ANP)(8) y la endotelina(9). La localización anatómica común de sitios de unión para estos péptidos sugiere un papel para la AM en el control de la secreción de vasopresina y en la regulación de la excreción de sal y agua, y de la presión arterial. Aun más, se ha demostrado que la AM puede influir en una variedad de sistemas fisiológicos, actuando tanto periféricamente como centralmente, para regular el volumen sanguíneo(4), la secreción de hormonas(10), la homeostasis de fluidos y electrolitos(11,12) y el sistema nervioso autónomo(13). La principal acción de la AM es, en general, promover la reducción del volumen plasmático y del fluido extracelular produciendo diuresis y natriuresis(14) e inhibiendo la secreción de aldosterona desde la corteza suprarrenal estimulada por angiotensina II o potasio(7). La AM inhibe la liberación de adrenocorticotropina actuando en la pituitaria anterior(15). Además, existe evidencia de un efecto inhibitorio de la AM administrada IVT, sobre la inducción de la ingesta de agua y sal producida farmacológica o fisiológicamente(11,12,10). Además, la administración de la AM-IVT inhibe la liberación de arginina vasopresina(16,17), aumenta la liberación del péptido natriurético auricular(18), activa el sistema nervioso simpático(19) y aumenta el volumen urinario y excreción de sodio(20).
La AM muestra homología en su estructura química con el péptido relacionado con el gen de la calcitonina (CGRP)(4). Sin embargo ha sido complicado definir los sitios de unión de la AM, y numerosos estudios han sugerido que sus acciones pueden estar mediadas a través del receptor CGRP1. En efecto, el antagonista del receptor CGRP1, el CGRP(8-37) bloquea el incremento del AMPc inducido por la AM en células de músculo liso vascular(15). Aun mas, un gran número de sitios de unión del CGRP se encuentran presentes en el cerebro(21) y algunas acciones centrales de la AM sobre la presión arterial(13) y la ingesta de alimento(22) son abolidas por un antagonista del CGRP1, CGRP(8-37), sugiriendo que estos efectos de la AM están mediados por el receptor CGRP1. Contrariamente, se han descrito sitios de unión específicos para la AM que difieren de los del CGRP en el cerebro humano(6); y se ha demostrado que el efecto vasopresor de la AM-IVT no es abolido por el antagonista de los receptor tipo 1 del CGRP(16).
En vista de estos hallazgos, en el presente estudio evaluamos la participación de los sitios de unión del CGRP o la AM en los efectos renales de la AM administrada centralmente. Investigamos el efecto de la AM(22-52), antagonista del receptor putativo de la AM, y el CGRP(8-37), un antagonista de los receptores CGRP1, sobre la diuresis y natriuresis inducida por la administración intracerebroventricular (IVT) de la AM. Igualmente, se evaluó el efecto de la administración central del CGRP sobre la función renal.
MATERIALES Y MÉTODOS
Se usaron ratas macho, de la cepa Sprague-Dawley (200-250 g), en condiciones controladas de temperatura y fotoperíodo (luz desde las 06:00 am a las 18:00 pm), con libre acceso al agua y la comida. Se implantó una cánula(23) en el ventrículo lateral izquierdo de acuerdo a lo descritos previamente(20). Tres días después de la canulacion IVT los animales fueron distribuidos al azar en los siguientes grupos:
Efecto de la adrenomedulina-IVT
Control: recibieron solución fisiológica intracerebro-ventricular (5ml) (N=24); AM: recibieron adrenomedulina de rata (rat adrenomedullin 1-50, American Peptides, Inc., Sunnyvale, CA) (100 pmol/5ml, IVT)(N=12).
Efecto del CGRP-IVT
Control: recibieron solución fisiológica intracerebro-ventricular (5ml) (N=26); CGRP: recibieron el péptido relacionado con el gen de la calcitonina (CGRP, American Peptides, Inc., Sunnyvale, CA) (100 pmol/5ml, IVT) (N=13).
Efecto del pretratamiento con el AM(22-52) sobre la acción renal de la AM
V: pretratados IVT con vehículo (5 ml) + solución fisiológica IVT (5 ml) (N=22); AM: pretratadas con vehículo IVT (5 ml) + AM-IVT (100 pmol/5 ml) (N = 26); AM(22-52): pretratadas con AM(22-52) (3,4 nmol/10 ml, IVT) + solución fisiológica IVT (5 ml) (N=8); AM(22-52)+AM: pretratadas IVT con AM(22-52) + AM-IVT (N=8).
Efecto del pretratamiento con el CGRP(8-37) sobre la acción renal inducida por la AM
V: pretratadas con vehículo (5 ml)+ solución fisiológica IVT (5 ml) (N=14); AM: pretratadas con vehículo (5 ml)+ AM-IVT (100 pmol/5 ml) (N = 13); CGRP(8-37): pretratadas con CGRP(8-37) (2nmol/5ml, IVT)+ solución fisiológica IVT (5 ml) (N=13); CGRP(8-37)+AM (N=23): pretratadas con CGRP(8-37) + AM-IVT.
El pretratamiento IVT fue 10 minutos antes de la AM-IVT o de la solución fisiológica. Inmediatamente después cada rata recibió una carga oral de agua (20 ml/kg, p.o). Los animales se colocaron en jaulas metabólicas y se recolectó la orina a la 1, 3 y 6 hr; a las 6 hr la vejiga fue vaciada mediante un masaje suprapúbico. Los animales tuvieron libre acceso al agua y la comida durante todo el experimento. Se verificó la canulación post-mortem con la administración de un colorante (5 ml de fast-green, IVT) antes del sacrificio del animal. Sólo se usaron los datos de los animales en los que el colorante se distribuyó en los ventrículos laterales, tercero, cuarto. Se midió el volumen de orina y se determinó la concentración de sodio y potasio mediante fotometría de llama. Los resultados se expresaron como mEq/100 g de peso corporal.
Las diferencias estadísticas entre los grupos fueron evaluadas mediante el análisis de varianza de dos vías (ANOVA) y por la prueba de Newman-Keul. Un valor de p< 0.05 se consideró estadísticamente significativo.
RESULTADOS
Efecto urinario de la administración central de adrenomedulina o CGRP
La respuesta urinaria a la administración IVT del péptido se ilustra en figura 1. La AM y el CGRP aumentaron significativamente el volumen urinario a las 3 y 6 hr (ANOVA de dos vías, p<0.01 y p<0.001, respectivamente); este efecto resultó ser similar en magnitud para ambos péptidos. El aumento del volumen urinario estuvo asociado con natriuresis a las 3 y 6 hr. En efecto, la excreción de sodio urinaria inducida por la AM (mEq/100g) aumentó significativamente en el período de las 3 y 6 hr (ANOVA de dos vías, p< 0.001). El CGRP también incrementó la excreción de sodio, sin embargo este efecto fue sólo significativo en el período de las 6 hr y fue menor que el producido por la AM (-36.53%).
Figura 1: Efecto renal inducido por la administración intracerebroventricular de adrenomedulina o CGRP en ratas hidratadas y conscientes
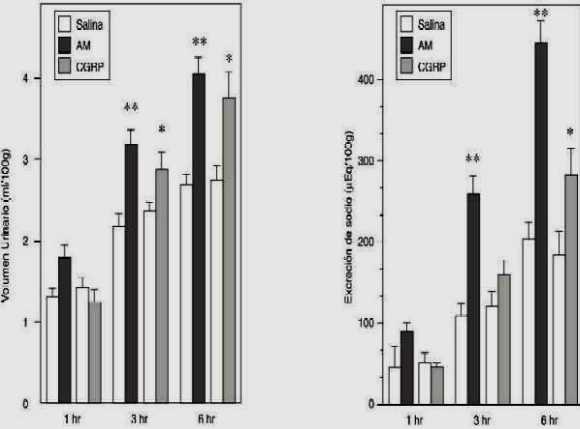
Ratas tratadas con AM o CGRP (100 pmol/5 µl, cada uno) o solución fisiológica-vehículo (5 µl) recibieron inmediatamente después del tratamiento una carga oral de agua (20 ml/kg, p.o.). La orina fue recolectada a las 1, 3 y 6 hr (n= 12-26, por grupo). Se muestran las medias ± EEM. *p<0.01; **p<0.001 comparado con el grupo control (solución fisiológica).
Figura 2: Efecto renal de la administración intracerebro-ventricular de AM en ratas pretratadas con AM(22-52), un antagonista del receptor de la AM
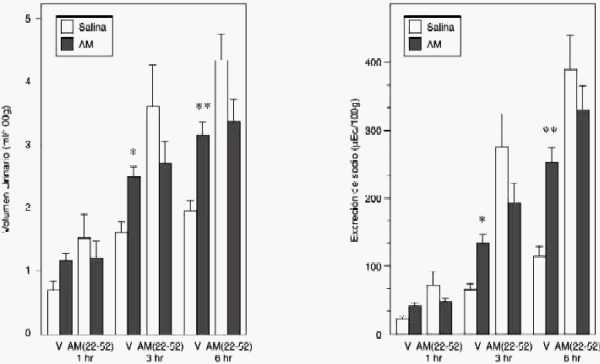
Los grupos de ratas recibieron vehículo (V) o AM(22-52) (3.4 nmol/10µl, IVT), diez minutos antes de la administración de AM (100 pmol/5 µl) o solución fisiológica (5 µl) seguido de una carga oral de agua (20 ml/kg, p.o.). La orina fue recolectada a las 1, 3 y 6 hr (n=6-26 por grupo). *p<0.01, **p<0.001 comparado con el control.
Figura 3: Efecto del CGRP(8-37), sobre la diuresis y la natriuresis inducida por la administración intracerebroventricular de AM
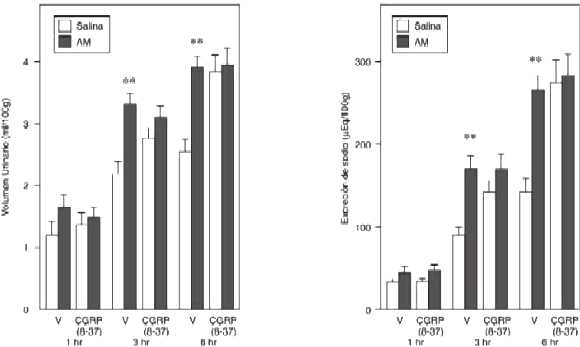
Los animales recibieron vehículo (V) o CGRP(8-37), antagonista del de receptor CGRP1 (2 nmol/5 µl, IVT), diez minutos antes de la administración IVT de AM o solución fisiológica (5 µl) seguido por una carga oral de agua (20 ml/kg). La orina fue recolectada a las 3 y 6 hr (n=13-23 por grupo). *p<0.01, **p<0.001 comparado con el grupo control.
Efecto del pretratamiento con el AM(22-52) sobre la diuresis y natriuresis inducida por la AM-IVT
El efecto de AM(22-52) se muestra en figura 2. El pretratamiento con AM(22-52) aumenta significativamente el volumen urinario y la excreción de sodio. El análisis de varianza de dos vías y la prueba de Newman-Keul reveló que la AM(22-52), antagonista del receptor putativo de la AM, disminuye significativamente la diuresis y la natriuresis inducida por la AM.
Efecto del pretratamiento con CGRP(8-37) sobre la excreción urinaria de agua y sodio inducida por la AM-IVT
La AM IVT aumentó el volumen urinario y la excreción de sodio, a las 3 y 6 hr (ANOVA de dos vías, p < 0.001). El pretratamiento con CGRP(8-37) IVT, un antagonista selectivo del receptor CGRP1, afectó los parámetros basales urinarios. De hecho, el CGRP(8-37) aumenta significativamenta el volumen urinario basal, la excreción de sodio a las 3 y 6 hr. Además, la administración del CGRP(8-37)-IVT bloqueó el incremento en el volumen urinario y la excreción de sodio inducida por la AM (Figura 3).
DISCUSIÓN
Se ha demostrado que la administración central de AM inhibe la ingesta de agua y el apetito por la sal en la rata(12) y la oveja(18) e incrementa la excreción de sodio y agua de una manera dependiente de la dosis(20). Estos hallazgos indican que la administración exógena de la AM en el sistema nervioso central afecta marcadamente el control de los fluidos y electrolitos, y sugieren que el sistema cerebral de la adrenomedulina puede actuar de manera paracrina y/o autocrina para defender al organismo contra estados de hipervolemia e hipernatremia.
Se desconoce el sitio exacto en el SNC donde la AM ejerce sus acciones para producir la diuresis y la natriuresis. Las drogas cuando son administradas IVT actúan en estructuras periventriculares como son el hipotálamo y la superficie ventral del bulbo raquídeo. La síntesis de AM y la presencia de sus receptores ha sido descrita en el cerebro del humano y de la rata(19,2). Se ha encontrado inmunoreactividad a la AM en el núcleo paraventricular, supraóptico e infundibular del hipotálamo humano y de la rata, donde el péptido se colocaliza con fibras inmunorecativas a la oxitocina y la vasopresina(3). Igualmente, se ha demostrado la expresión de RNAm de la AM en el cerebro y la glándula pituitaria del humano(24). Se ha postulado que la acciones cardiovasculares de la AM se encuentran relacionadas con el área postrema(25) y el hipotálamo. Aun más, se ha demostrado que la actividad eléctrica de las neuronas dentro del área postrema son directamente afectadas por la AM(25). Es por ello que se ha propuesto al área postrema y el núcleo paraventricular como las principales estructuras del sistema nervioso involucradas en la acción central de la AM, donde este péptido puede actuar como neurotransmisor, neuromodulador o neurohormona.
Los resultados obtenidos en el presente trabajo apoyan los estudios de ligadura para la AM en los que se demuestra que sus receptores se encuentran y son expresados en el SNC. Además, proporciona evidencias a la hipótesis de que la AM endógena posee un papel importante en el control central de la homeostasis de fluidos y electrólitos(10). El mecanismo central podría facilitar la reducción del volumen sanguíneo aumentando la excreción de agua y soluto, y reduciendo la ingesta de sal(10) y agua(11). Todos estos efectos centrales, además de las bien conocidas acciones natriuréticas y diuréticas del péptido(14), formarían parte del papel regulador de la AM en la en homeostasis de los fluidos. Se ha propuesto que el efecto natriurético podría deberse, en parte, a la capacidad de la AM de producir la liberación del péptido natriurético auricular (PNA)(18) y a la inhibición temprana de la actividad nerviosa simpática renal(19).
Varias líneas de evidencias sugieren que la AM en el CNS podría tener receptores y mecanismos de acción plurales. Los sitios específicos de unión de la AM se han demostrado en varios tejidos de la rata, incluyendo el cerebro(5), los vasos sanguíneos(26) y en las células del músculo liso vascular(27). Se ha demostrado la presencia de receptores específicos de la AM difiere de la de los receptores del CGRP en el cerebro del humano(6) y en el cerebro de la rata utilizando astrocitos de cultivo primario de células híbridas de neuroblastoma x glioma de ratón/rata(28). Además, los sitios de unión para el péptido calcitonina (CT) y el CGRP se han caracterizado en la región del hipotálamo y en el cerebelo, respectivamente(29,30). Se han descrito sitios de unión a CT, CGRP y la amilina en el núcleo accumbens(31). Aunque es controvercial, parece que los efectos cardiovasculares centrales de la AM son mediados a través de los receptores CGRP1 ya que, la respuesta vasopresora de la AM central es anulada con el pretratamietno con hCGRP(8-37) en ratas conscientes y anestesiadas(19,13). Por el contrario, Samson(10) reporta que la administración de la AM en el ventrículo lateral o en el cuarto ventrículo cerebral eleva la presión sanguínea en ratas conscientes y este efecto no es bloqueado por el antagonista del receptor CGRP1.
La AM en el cerebro puede ejercer acciones diuréticas y natriuréticas a través de la interacción con sitios de unión específicos. La expresión de tres receptores huérfanos acoplados a proteína G indica que la AM puede interactuar con múltiples receptores de afinidad y selectividad variable(32,33,34,35), sugiriendo que la comunicación cruzada entre la AM y CGRP puede ocurrir vía uno o más de estos sitios receptores. En el presente estudio determinamos el efecto de los antagonistas putativos de dos receptores, CGRP(8-37) y AM(22-52) en la diuresis y la natriuresis inducida por la administración central de AM. Nuestros hallazgos demuestran que las acciones renales de la AM fueron significativamente bloqueadas por ambos antagonistas, indicando que la AM ejerce sus acciones a través de ambos tipos de receptores en el SNC(el AM y el CGRP1).
Está claro que la AM puede unirse al receptor CGRP1, aunque con afinidad más baja que el CGRP(32); sin embargo, no ha sido estudiada la unión del CGRP al receptor putativo de la AM(36). Entonces, si la AM induce diuresis y natriuresis a través de su interacción con los receptores específicos de la AM y los CGRP1, nosotros podríamos suponer que la estimulación del receptor CGRP1 con su ligando natural debería aumentar el volumen urinario y la excreción de sodio. Al evaluar esta posibilidad, demostramos por primera vez, que la activación directa del receptor CGRP1 cerebral afecta el control de los fluidos y electrolitos. En efecto, aunque menos potente que la AM, la administración central de CGRP aumentó el volumen urinario y la excreción de sodio.
Estudios muy recientes establecen categóricamente que el receptor semejante al receptor de la calcitonina (CRLR) puede funcionar como un receptor selectivo de la AM o como un receptor de CGRP, dependiendo de su co-expresión con nuevas proteínas accesorias que han sido llamadas proteínas modificadoras de la actividad del receptor (RAMP)(37). Aunque, se ha demostrado que la AM afecta las funciones cerebrales, actualmente se desconocen los factores que regulan la expresión del gen de las RAMPs en el SNC. Sin embargo, basados en nuestros resultados podríamos especular que la expresión de RAMP1/RAMP2 en el cerebro puede participar en los efectos de la AM sobre el control de agua y el balance de electrolitos.
Finalmente, el papel específico de estos receptor en las acciones centrales de la AM no puede ser definido actualmente con precisión por métodos farmacológicos debido a la falta de ligandos selectivos de estos receptores.
En conclusión, la acción diurética y natriurética de la AM intracerebroventricular, indica que además de sus acciones periféricas en el riñón, la AM puede actuar en el cerebro para controlar la homeostasis de fluidos electrolitos, vía la estímulación de ambos receptores, el receptor putativo de AM y el CGRP1.
Agradecimientos
Los autores agradecen a María Silva y Olga Milena Torres por su asistencia técnica y al Consejo Nacional de Investigaciones Científicas y Tecnológicas (CONICIT) Proyecto No. S1 2000000503, Caracas, Venezuela.
REFERENCIAS bibliográficas
1. Hwang IS, Tang F. The distribution and gene expression of adrenomedullin in the rat brain: peptide/mRNA and precursor/active peptide relationships. Neurosci. Lett. 1999; 267: 85-88. [ Links ]
2. Satoh F, Takahashi K, Murakami O, Totsune K, Sone M, Ohneda M, Susano H, Mouri T. Immunocytochemical localization of adrenomedullin-like immunoreactivity in the human hypothalamus and the adrenal gland. Neurosci. Lett. 1996; 203: 207-210. [ Links ]
3. Ueta Y, Kitamura K, Isse T, Shibuya I, Kabashima N, Yamamoto S, Kangawa K, Matsuo H, Eto T, Yamashita H. Adrenomedullin-immunoreactive neurons in the paraventricular and supraoptic nuclei of the rat. Neurosci. Lett. 1995; 202: 37-40. [ Links ]
4. Kitamura K, Sakata J, Kangawa K, Kojima H, Matsuo H, Eto T. Cloning and characterization of cDNA encoding a precursor for human adrenomedullin. Biochem. Biophys. Res. Commun. 1993; 194: 720-725. [ Links ]
5. Nuki C, Kawasaki H, Kitamura K, Takrnaga M, Kangawa K, Eto T, Wada A. Vasodilator effect of adrenomedullin and calcitonin gene-related receptors in rat mesenteric vascular bed. Biochem. Biophys. Res. Commun. 1993; 196: 245-251. [ Links ]
6. Sone M, Takahashi K, Satoh F, Murakami O, Totsune K, Ohneda M, Sasano H, Ito H, Mouri T. Specific adrenomedullin binding sites in human brain. Peptides 1997; 18: 1125-1129. [ Links ]
7. Wimalawansa SJ. Calcitonin gene-related peptide and its receptors: molecular, genetics, physiology, pathophysiology, and therapeutic potentials. Endocrin. Rev. 1996; 17: 533-585. [ Links ]
8. Saavedra JM, Correa FMA, Plunkett LM, Israel A, Kurihara M, Shiguematsu K. Binding of angiotensin and atrial natriuretic peptide in brain of hypertensive rats. Nature 1986; 320: 758-761. [ Links ]
9. Koseki C, Imai M, Hirata Y, Yanagisawa M, Masaki MT. Binding sites for endothelin-1 rat tissues: an autoradiographic study. J. Cardiovasc. Pharmacol. 1989; 13: S153-S154. [ Links ]
10. Samson WK. Adrenomedullin and the control of fluid and electrolyte homeostasis. Annu. Rev. Physiol. 1999; 61: 363-389. [ Links ]
11. Murphy TC, Samson WK. The novel vasoactive hormone, adrenomedullin, inhibits water drinking in the rat. Endocrinology. 1995; 136: 2459-2463. [ Links ]
12. Samson WK, Murphy TC. Adrenomedullin inhibits salt appetite. Endocrinology 1997; 138: 613-616. [ Links ]
13. Takahashi H, Watanabe T, Nishimura M, Nakanishi T, Sakamoto M, Yoshimura M, Komiyama Y, Masuda M, Murakami T. Centrally induced vasopressor and sympathetic responses to a novel endogenous peptide, adrenomedullin, in anesthetized rats. Am. J. Hypertension. 1994; 7: 478-482. [ Links ]
14. Majid DSA, Kadowitz PJ, Coy DH, Navar LG. Renal responses to intra-arterial administration of adrenomedullin in dogs. Am. J. Physiol. (Renal Fluid Electrolyte Physiol. 39) 1996; 270: F200-F206. [ Links ]
15. Samson WK, Murphy TC, Schell DA. A novel vasoactive peptide, adrenomedullin, inhibits pituitary adrenocorticotropin release. Endocrinology 1995; 136: 2349-2352. [ Links ]
16. Samson WK, Murphy TC, Schell DA. Central mechanisms for the hypertensive effects of preproadrenomedullin derived peptides in conscious rats. Am. J. Physiol. 1998; 274: R1505-R1509. [ Links ]
17. Yokoi H, Arima T, Kondo K, Iwasaki Y, Oiso Y. Intracerebroventricular injection of adrenomedullin inhibits vasopressin release in conscious rats. Neurosci. Lett. 1996; 216: 65-67. [ Links ]
18. Charles CJ, Rademaker MT, Richards AM, Cooper GJ, Coy DH, Nicholls MG. Hemodynamic, hormonal, and renal effects of intracerebroventricular adrenomedullin in conscious sheep. Endocrinology 1998; 139: 1746-1751. [ Links ]
19. Saita M, Shimokawa A, Kunitake T, Kato K, Hanamori T, Kitamura K, Eto T, Kannan H. Central actions of adrenomedullin on cardiovascular parameters and sympathetic outflow in conscious rats. Am. J. Physiol. (Regulatory Integrative Comp. Physiol. 43) 1998; 274: R979-R984. [ Links ]
20. Israel A, Díaz E. Diuretic and natriuretic action of adrenomedullin administered intracerebroventricularly in conscious rats. Regulatory Peptides 2000; 89: 13-18. [ Links ]
21. Oliver KV, Wainwright A, Heavens RP, Hill RG, Sirinathsinghji DJS. Distribution of novel CGRP1 receptor and adrenomedullin receptor mRNAs in the rat central nervous system. Molecular Brain Res. 1998; 57: 149-154. [ Links ]
22. Taylor GM, Meeran K, OShea D, Smith DM, Ghatei MA, Bloom, SR. Adrenomedullin inhibits feeding in the rat by a mechanism involving calcitonin gene-related peptide receptors. Endocrinology 1996; 137: 3260-3264. [ Links ]
23. Severs WB, Summy-Long J, Taylor JS, Connor JD. A central effect of angiotensin: release of pituitary pressor material. J. Pharmacol. Exp. Ther. 1970; 174: 27-34. [ Links ]
24. Takahashi K, Satoh F, Sone M, Murakami O, Sasano H, Mouri T, Shibahara S. Expression of adrenomedullin mRNA in the human brain and pituitary. Peptide 1997; 18: 1051-1053. [ Links ]
25. Allen MA, Ferguson AV. In vitro recording from area postrema neurons demonstrate responsiveness to adrenemedullin. Am. J. Physiol. (Regulatory Integrative Comp. Physiol. 39) 1996; 270: R920-R925. [ Links ]
26. Nandha KA, Taylor GM, Smith DM, Owji AA, Byfield PG, Ghatei MA, Bloom SR. Specific adrenomedullin binding sites and hypotension in the rat systemic vascular bed. Regulatory Peptides 1996; 62: 145-151. [ Links ]
27. Ishizaka Y, Ishizaka Y, Tanaka M, Kitamura K, Kangawa K, Minamino N, Matsuo H, Eto T. Adrenomedullin stimulates cyclic AMP formation in rat vascular smooth muscle cells. Biochem. Biophys. Res. Commun. 1994; 200: 642-646. [ Links ]
28. Zimmerman U, Fischer JA, Frei K, Fischer AH, Reinscheid RK, Muff R. Identification of adrenomedullin receptors in cultured rat astrocytes and in neuroblastoma x glioma hybrid cells (NG108-15). Brain Res. 1996; 724: 238-245. [ Links ]
29. Fischer JA, Sagar SM, Martin JB. Characterization and regional distribution of calcitonin binding sites in the rat brain. Life Sci. 1981; 29: 663-671. [ Links ]
30. Stangl D, Muff R, Schmolck C, Fischer JA. Photoaffinity labeling of rat calcitonin gene- related peptide receptors and adenylate cyclase activation: identification of receptor subtypes. Endocrinology 1993; 132: 744-750. [ Links ]
31. Sexton PM, McKenzie JS, Mendelsohn FAO. Evidence for a new subclass of calcitonin/calcitonin gene-related peptide binding site in rat brain. Neurochem. Int. 1988; 12: 323-335. [ Links ]
32. Aiyar H, Rand K, Elshourbary NA, Zeng A, Adamau JE, Bergsma DJ, Li Y. A cDNA encoding the calcitonin gene-related peptide type 1 receptor. J. Biol. Chem. 1996; 271: 11325-11329. [ Links ]
33. Han ZQ, Coppock HA, Smith DM, Van Noorden S, Makgoba MW, Nicholl CG, Legon S. The interaction of CGRP and adrenomedullin with a receptor expressed in the rat pulmonary vascular endothelium. J. Mol. Endocrinol. 1997; 18: 267-272. [ Links ]
34. Kapas S, Catt KJ, Clark AJ. Cloning and expression of cDNA encoding a rat adrenomedullin receptor. J. Biol. Chem. 1995; 270: 25344-25347. [ Links ]
35. Kapas S, Clark AJL. Identification of an orphan receptor gene as a type 1 calcitonin gene-related peptide receptor. Biochem. Biophys. Res. Commun. 1995; 217: 832-838. [ Links ]
36. Owji AA, Smith DM, Coppock HA, Morgan GA, Bhogal R, Ghatei MA, Bloom SR. An abundant and specific binding site for the novel vasodilator adrenomedullin in the rat. Endocrinology 1995; 136: 2127-2134. [ Links ]
37. McLatchie LM, Fraser NJ, Main MJ, Wise A, Brown J, Thompson N, Solari R, Lee MG, Foord SM. RAMPs regulate the transport and ligand specificity of the calcitonin-receptor-like receptor. Nature (London) 1998; 393: 333-339. [ Links ]













