Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT v.21 n.1 Caracas ene. 2002
Los Fosfoinositidos como señalización de las Endotelinas en la eminencia media y el órgano subfornical de la Rata
M del R Garrido1 y A Israel1.
-
Laboratorio de Neuropéptidos, Facultad de Farmacia, Universidad Central de Venezuela, Caracas-Venezuela.
RESUMEN
La endotelina-1 es un péptido derivado del endotelio con potentes efectos vasoconstrictores. Existen tres isoformas de endotelinas (ETs): ET-1, ET-2 y ET-3 que actúan en receptores designados como ETA y ETB. Se ha demostrado que la administración central de los isopéptidos de ETs produce efectos autonómicos y cerebrovasculares, lo que sugiere la existencia de un papel clave para las ETs en el SNC. Las endotelinas son capaces de activar diferentes sistemas de segundos mensajeros. Se ha descrito que los receptores de ETs en el SNC están acoplados a la activación de la fosfolipasa C y el subsecuente incremento de los niveles de trifosfato de inositol (IP3). Consistente con la presencia de una alta densidad de receptores específicos para las ETs en el órgano subfornical (OSF) y la eminencia media (EM) del cerebro de la rata, nuestros resultados muestran que el incremento en la hidrólisis de fosfoinosítidos (PI) de membrana inducido por las ET-1 y ET-3 en el OSF y la EM, es dependiente de la dosis y muestra valores de DE50 similares, lo que sugiere que este efecto es mediado por el subtipo de receptor ETB. Se caracterizaron los receptores que median dicho efecto, mediante el uso de agonistas y antagonistas selectivos de ambos subtipos de receptores. El BQ 123 y BQ 610, antagonistas selectivos del receptor ETA, no afectaron significativamente el incremento en el recambio de inositoles de membrana inducidos por las ETs en las estructuras cerebrales. Mientras que el IRL 1620, un agonista selectivo del subtipo de receptor ETB, incrementó la acumulación de InsP1 en el OSF y la EM de modo comparable al producido por las endotelinas, siendo este efecto bloqueado por el BQ 788, un antagonista selectivo de este subtipo de receptor. Nuestros hallazgos demuestran que el receptor ETB media el incremento del recambio de fosfoinosítidos inducido por la ET-1 y la ET-3 en el OSF y la EM del cerebro de la rata.
Palabras Clave: Endotelina, órgano subfornical, Eminencia media, Receptores, Señalización.
ABSTRACT
Endothelin-1 is an endothelium derived peptide with potent vasoconstrictor effects. There are three endothelin (ETs) isoforms: ET-1, ET-2 and ET-3 which have the capacity to bind to two receptor subtypes designated as ETA and ETB. It has been demonstrated that central administration of endothelin isoforms induces autonomic and cerebrovascular actions, which suggest a key role for these peptides in the SNC. Endothelins are able to activate different second messengers systems. It has been shown that the ETs receptors in the SNC are coupled to the activation of the phospholipase C and the subsequent increase of inositol trisphosphate (IP3) levels. Consistent with the presence of a high density receptors in the subfornical organ (SFO) and the median eminence (ME) of the rat brain, our results show an increase in phosphoinositides (PI) hydrolysis induced by endothelins in the SFO and ME, in a dose-dependent manner and with similar ED50 values, suggesting that this effect is mediated by the ETB receptor. The receptor mediating this effect was further characterized, with the use of selective agonists and antagonists of both receptor subtypes. BQ 123 and BQ 610, two selective antagonists of ETA receptor, did not altered the ETs-induced increase in the PI turnover. Meanwhile, IRL 1620, a selective agonist of the ETB receptor subtype, increased the InsP1 accumulation in the SFO and the ME in a similar degree as endothelins, and this effect was completely blocked by BQ 788, a selective antagonist of this receptor subtype. Our results demonstrate that in the SFO and the ME of the rat brain, ET-1- and ET-3-induced phosphoinositides turnover in mediated through the ETB receptor.
Key Words: Endothelin, Subfornical organ, Median eminence, Receptors, Signaling.
INTRODUCCIÓN
Las endotelinas (ETs), originalmente aisladas del sobrenadante del medio de cultivo de células endoteliales aórticas de bovino(1), son un grupo de péptidos vasoconstrictores de 21 aminoácidos que comprende tres isopéptidos estructuralmente diferentes: endotelina-1 (ET-1), endotelina-2 (ET-2) y endotelina-3 (ET-3). Las endotelinas no son solo producidas por el endotelio, sino que presentan una amplia distribución corporal. Además de sus acciones vasculares, las endotelinas ejercen un amplio espectro de acciones cardiovasculares, renales y endocrinas, incluyendo efectos inotrópicos y cronotrópicos, liberación de eicosanoides, EDRF/NO, y péptido natriurético auricular, inhibición de la secreción de renina y proliferación del músculo liso vascular, fibroblastos y glía(2). Este amplio espectro de acciones parece indicar la existencia de subtipos de receptores. En efecto, se han descrito dos subtipos receptores: ETA y ETB. El subtipo ETA presenta afinidades relativas por el receptor de ET1 > ET2 > ET3, y el subtipo ETB, se muestra con igual afinidad para todas las isoformas de endotelina(3,4).
Adicionalmente a sus efectos sistémicos, un gran número de reportes indican que las endotelinas también pueden actuar en el SNC(5). Así, mediante técnicas de análisis de Northern blot e hibridización in situ se ha demostrado la presencia de inmunorreactividad a ET de origen no vascular y de localización neuronal en diversas áreas cerebrales(6,7). Adicionalmente, se ha reportado la presencia de receptores para las ETs en áreas localizadas del SNC(7,8,9). En el SNC, las endotelinas y sus receptores están ampliamente distribuidos y acoplados a diversas vías de segundos mensajeros. Así, la estimulación de receptores de alta afinidad para la ET-1 están asociados a la activación de la fosfolipasa C en áreas del cerebro de la rata(10) y en cultivos de células endoteliales de capilares cerebrales humanos(11,12), a la hidrólisis de los fosfoinosítidos y a la movilización de calcio intracelular(13,14). Se han reportado acciones de la ET-3 sobre el sistema de intercambio Na+/H+ en células endoteliales de capilares cerebrales(15,16,17). Recientemente se han involucrado a las endotelinas en la fosforilación de proteínas específicas en capilares cerebrales humanos intactos(18) y en astrocitos intactos(19). Hasta el presente no se han establecido con claridad las vías de transducción de las endotelinas en el SNC.
En el presente trabajo evaluamos la vía de señalización asociada a la estimulación por las endotelinas 1 y 3, y así como el subtipo de receptor que media dicha señalización, en dos áreas discretas del SNC como son el órgano subfornical (OSF) y la eminencia media (EM) del cerebro de la rata, estructuras situadas fuera de la barrera hemato-encefálica, que participan en la regulación del balance hidromineral y en el control neuroendocrino.
MATERIALES Y MÉTODOS
Ratas Sprague-Dawley, machos (200-250g), provenientes del bioterio de la Facultad de Farmacia, mantenidas en un ciclo de 12 h de luz:oscuridad y con libre acceso al agua y a la comida, fueron sacrificados por decapitación entre las 8:30 y 11:00 horas. El OSF y la EM fueron obtenidas mediante microdisección bajo control estereomicroscópico en un tiempo no superior a los tres minutos. Una vez removidas, las estructuras fueron mantenidas en buffer Krebs-Ringer (BKR) conteniendo: NaCl 125 mM, KCl 3.5 mM, KH2PO4 1.25 mM, MgSO4 1.2 mM, CaCl2 0.75 mM, NaHCO3 25 mM y glucosa 10 mM. La hidrólisis de los fosfoinosítidos fue determinada como la acumulación de monofosfato de inositol (InsP1) en presencia de LiCl 10 mM. Para su marcaje, el OSF y la EM, fueron incubados durante dos horas a 37°C, en 2 ml de BKR conteniendo 0.5 mCi de myo-[2-3H]-inositol (actividad específica 18.8 Ci/mmol) gasificado continuamente con O2 (95%): CO2 (5%). Después del marcaje, los tejidos fueron lavados en BKR fresco gasificado y transferidos a BKR conteniendo LiCl 10 mM. Cada estructura fue transferida a tubos Eppendorf de 1.5 ml conteniendo 360 ml de buffer LiCl y preincubados por 10 minutos a 37°C con o sin drogas. El buffer (para el grupo control), las isoformas de endotelinas y los agonistas o antagonistas, según el experimento, fueron añadidos y los tejidos estimulados por 60 minutos a 37°C. La reacción se detuvo mediante la adición de 100 ml de ácido tricloroacético (concentración final: 6%) y las muestras fueron transferidas a hielo. Los tejidos fueron sometidas a ultrasonido en hielo y centrifugados a 10.000 g durante 15 min., a 4°C. En el sobrenandante se cuantificó la acumulación del InsP1 mediante cromatografía de intercambio aniónico. Las fracciones (5 ml) que contenían el InsP1 fueron recolectadas y la radioactividad cuantificada mediante espectrometría de centelleo líquido. La radioactividad asociada a las membranas fue extraída con cloroformo-metanol y cuantificada. Para cada tejido individual, la cantidad de InsP1 acumulado se expresó como el porcentaje de la radioactividad relativa a la presente en la membrana (InsP1/InsP1 + lípidos).
Para la determinación de los subtipos de receptores se utilizaron bloqueantes selectivos como son: el BQ-123 y el BQ-610 (10-5 M) (antagonistas selectivos del receptor ETA); el IRL-1620 (10-7 M) (agonista selectivo del receptor ETB) y el BQ 788 (10-5 M) (antagonista selectivo del receptor ETB).
Los resultados fueron expresados como las medias ± EEM. Las diferencias estadísticas entre los grupos se analizaron mediante el análisis de variancia de una vía (ANOVA) y la prueba de Newman Keul.
RESULTADOS
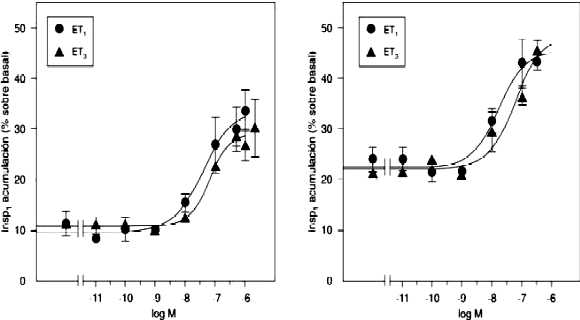
Curvas de dosis-respuesta para el recambio de los fosfoinosítidos de membrana inducido por las isoformas de endotelina en el OSF y la EM del cerebro de la rata
Se realizaron las curvas de dosis-respuesta para el efecto de las isoformas de endotelinas. La figura 1 muestra que la adición de ET-1 y ET-3 a los tejidos previamente marcados con 3H-myo-inositol en presencia de litio, incrementó la acumulación de InsP1, en forma dependiente de la dosis, en un rango de concentración de 10-9 M a 10-6 M. Los valores de DE50 fueron, para el OSF: 3.86 x 10-8 M (ET-1) y 6.398 x 10-8 M (ET-3) y para la EM: 1.55 x 10-8 M (ET-1) y 5.56 x 10-8 M (ET-3). El máximo incremento de la acumulación de InsP1 fue de un 30% de incremento sobre el basal para el OSF y de un 45% para la EM.
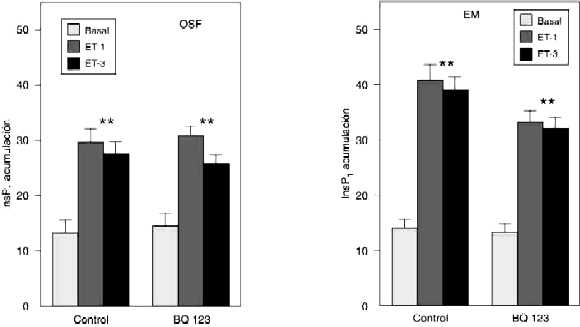
Efecto del BQ 123 y el BQ 610 sobre la acumulación de InsP1 inducida por la ET-1 y ET-3 en el OSF y la EM
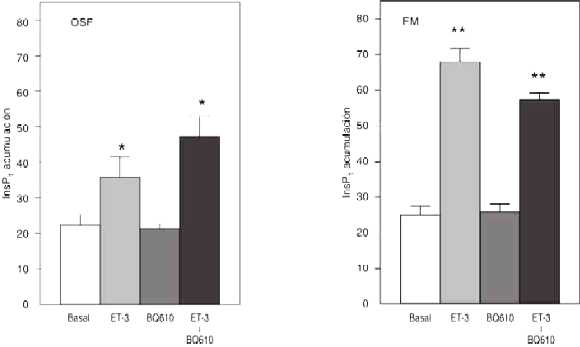
Como se muestra en la figura 2, la preincubación de las estructuras centrales en estudio, con el BQ 123 (10-5 M), un bloqueante selectivo del receptor ETA, no alteró la producción basal de InsP1 ni afectó significativamente la inducida por la ET-1 o ET-3, tanto en el OSF como en la EM. El BQ 610 (10-5 M), un antagonista del receptor ETA, diez veces más potente que el BQ 123, tampoco alteró significativamente la producción basal de InsP1 o la inducida por la ET-3 (10-7 M) en ninguna de las estructuras del SNC (figura 3).
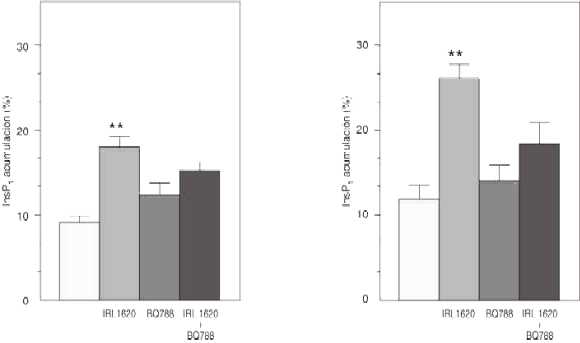
Efectos del IRL 1620 y del BQ 788 sobre la acumulación de InsP1 en el OSF y la EM de la rata
La estimulación de los tejidos con el IRL 1620 (10-7 M), un agonista selectivo del receptor ETB, incrementó significativamente la acumulación de InsP1 tanto en el OSF como en la EM (figura 4). La adición de BQ 788 (10-5 M), antagonista selectivo del receptor ETB, bloqueó el recambio de fosfoinosítidos de membrana inducido por el IRL 1620 en ambas estructuras centrales.
Figura 1: Curvas de dosis-respuesta de la acumulación de InsP1 inducidas por la ET-1 y ET-3 en el OSF y la EM del cerebro de la rata
Se muestran las medias ± EEM (n = 10).
Figura 2: Efecto del BQ 123 (10-5 M), un bloqueante específico del receptor ETA, sobre la acumulación de InsP1 inducida por la ET-1 (10-7 M) o la ET-3 (10-7 M), en el OSF (panel izquierdo) y la EM (panel derecho) de la rata-5 M), un bloqueante específico del receptor ETA, sobre la acumulación de InsP1 inducida por la ET-1 (10-7 M) o la ET-3 (10-7 M), en el OSF (panel izquierdo) y la EM (panel derecho) de la rata
Se muestran las medias ± EEM. ** p<0.001 comparado con el basal.
Figura 3: Efecto del BQ 610 (10-5 M), un bloqueante específico del receptor ETA, sobre la acumulación de InsP1 inducida por la ET-3 (10-7 M), en el OSF y la EM de la rata-5 M), un bloqueante específico del receptor ETA, sobre la acumulación de InsP1 inducida por la ET-3 (10-7 M), en el OSF y la EM de la rata
Se muestran las medias ± EEM. ** p <0.001, * p<0.01 comparado con el basal.
Figura 4: Efecto del BQ 788 (10-5 M), un bloqueante específico del receptor ETB, sobre la acumulación de InsP1 inducida por el IRL 1620 en el OSF (panel izquierdo) y la EM (panel derecho) de la rata-5 M), un bloqueante específico del receptor ETB, sobre la acumulación de InsP1 inducida por el IRL 1620 en el OSF (panel izquierdo) y la EM (panel derecho) de la rata
Se muestran las medias ± EEM. ** p <0.001, * p<0.01 comparado con el basal
DISCUSIÓN
Los estudios iniciales en los que se demostró la existencia de fenómenos autonómicos y cerebrovasculares producidos por la administración central de los isopéptidos de endotelinas, han sugerido un papel clave para las endotelinas en el SNC(17). En el SNC, las neuronas y las células gliales expresan tanto la ET-1 como la ET-3. Adicionalmente a sus acciones paracrinas o autocrinas, las endotelinas pueden influir sobre el sistema nervioso central mediante la transferencia aferente de información desde la periferia al cerebro. Como hormonas peptídicas, las endotelinas no son capaces de atravesar la barrera hematoencefálica. Así, una de las rutas de acción de estos péptidos es mediante la interacción con receptores en las estructuras circunventriculares tales como el órgano subfornical y la eminencia media, carentes de barrera hematoencefálica(20).
En varios modelos experimentales se ha demostrado que las endotelinas estimulan la liberación de diversos mediadores, que a su vez, son responsables de la activación de sistemas diferentes de segundos mensajeros. En ese sentido, se ha demostrado que las endotelinas activan diversas cascadas de señalización originadas en los fosfolípidos de membrana(21,22). En ese contexto, se ha descrito que los receptores de endotelinas en el SNC, están acoplados a la activación de la fosfolipasa C en diversos tipos de tejidos y líneas celulares(23,24).
Consistente con la presencia de receptores específicos, en alta densidad, para las endotelinas en el órgano subfornical y la eminencia media del cerebro de la rata, nuestra observación de un incremento de la acumulación del InsP1 en esas estructuras localizadas del cerebro, demuestra que las ETs ejercen su acción activando a receptores acoplados a un sistema de segundos mensajeros que involucra la hidrólisis de los fosfoinosítidos de membrana. Nuestros resultados coinciden con reportes previos sobre la estimulación del recambio de los PI de membrana en células de la hipófisis(25), en células de neuroblastoma-glioma(26), en células endoteliales de capilares cerebrales(12), en vasos cerebrales(27), en células gliales(28), en células grano cerebelares(29) y en la glándula pineal de la rata(30,31), sugiriendo que el recambio de inositoles de membrana inducido por la activación de los receptores de endotelinas, está involucrado en las actividades biológicas inducidas por estos péptidos.
Todas las isoformas de endotelina, son capaces de inducir la activación de la PLC, a través de la interacción con ambos subtipos de receptores, sin embargo, se desconoce el subtipo de receptor acoplado a la activación de la PLC en las estructuras estudiadas.
Al realizar las curvas dosis-respuesta a las ET-1 y ET-3 en las estructuras del SNC, encontramos que ambas isoformas de endotelinas estimularon el recambio de los fosfoinosítidos de membrana con potencia y eficacia similares, no observándose diferencias significativas en la dosis efectiva 50 (DE50) para la acumulación de InsP1 entre ambas isoformas del péptido, tanto en el OSF como en la EM de la rata. Así, la potencia similar entre ambas endotelinas en su capacidad de incrementar la acumulación de InsP1 en el OSF y la EM del cerebro de la rata, sugiere la participación del subtipo de receptor ETB en esta acción. Nuestros resultados concuerdan con los reportados en la literatura. En efecto, se ha demostrado la existencia de receptores de alta afinidad para la ET-3 en cultivos de células endoteliales humanas, acoplados a la activación de la PLC(32) y la estimulación de la hidrólisis de fosfoinosítidos inducida por las ET-1 y ET-3 con potencia similar en cultivos primarios de astrocitos de la corteza cerebral de rata(28). De modo similar, en cultivos primarios de astrocitos estriatales de ratón, se encuentra una fuerte estimulación de la acumulación de inosítidos marcados, por ET-1(33). Sin embargo, los resultados obtenidos en otras preparaciones son contradictorios. Así, se ha reportado un fuerte incremento del recambio de inositoles en cultivos de células granulosas cerebelares con mayor potencia para la ET-1, así como en astrocitos cerebelares y en células C6 de glioma(34). Aun más, en cultivos de células híbridas de neuroblastoma-glioma NG 108-15 se encuentra un incremento en la concentración intracelular de calcio, así como de la acumulación de inositoles fosfato con un orden de potencia de ET-1 > ET-2 > ET-3(26).
Al evaluar los efectos de agonistas y antagonistas selectivos de los dos subtipos de receptores para las endotelinas, mostramos que la formación del InsP1 inducida por las ET-1 y ET-3 en las estructuras centrales, no fue inhibida por los antagonistas selectivos del receptor ETA, el BQ 123 y el BQ160, indicando que el subtipo de receptor acoplado a la estimulación de la PLC en dichas estructuras no es del subtipo ETA. Ahora bien, el hecho de que el IRL 1620, un agonista selectivo del receptor ETB, estimuló la acumulación del InsP1 en forma similar a la obtenida con las isoformas de endotelinas y que el BQ 788, antagonista selectivo del receptor ETB, previno el incremento del recambio de fosfoinosítidos de membrana inducido por el IRL 1620, sugiriere que el subtipo de receptor acoplado a la vía de señalización del recambio de inositoles de membrana en el OSF y la EM, pertenece al subtipo ETB.
Aunque numerosos estudios han demostrado la presencia de ambos subtipos de receptores en regiones diferentes y en distintos tipos celulares del SNC, el papel de los receptores para ETs en el SNC tanto en condiciones fisiológicas como fisiopatológicas, no está dilucidado. Se ha reportan que el subtipo de receptor ETB juega un papel importante en el aclaramiento de la ET-1(35). Así, es plausible que los astrocitos como células reguladoras en el SNC, desempeñen funciones relevantes en el aclaramiento de endotelinas del medio circundante. Otras posibles funciones para las endotelinas en el SNC incluye un papel en la neurotransmisión, afectando la excitabilidad neuronal(36). En rebanadas estriatales, las ETs disparan una liberación bifásica de dopamina, mediada por calcio y el receptor ETB, que puede ser relevante durante condiciones de hipoxia e hipoglicemia en el estriado e hipocampo(37,38).
La evidencia sugiere que las ETs están involucradas en el control hipotalámico de la neurosecreción, el balance de fluidos y electrolitos y en el control de la presión arterial. Así, se ha demostrado la presencia de inmunoreactividad y de ARNm para las ETs y para sus receptores en áreas del sistema hipotálamo-hipófisis tales como el núcleo supraóptico y el paraventricular, la eminencia media, hipófisis posterior y órgano subfornical(39). Se ha propuesto que la ET-3, presente en neuronas magnocelulares del sistema hipotálamo-neurohipófisis, ejerce un importante efecto inhibitorio sobre la ingesta de agua en respuesta a estímulos tanto exógenos como endógenos, cuando es administrada centralmente. Se ha sugerido que el sitio de acción de la ET-3 estaría localizado cercano a la pared del tercer ventrículo(40). El OSF como una de las estructuras circunventriculares, está idealmente situado para cumplir un papel primordial como sitio receptor tanto para la información sistémica como para la central. En efecto, se ha demostrado que la estimulación eléctrica de neuronas del OSF, pueden inducir la ingesta de bebida en la rata(41). Además, las endotelinas sistémicas se unen a estructuras circunventriculares con el incremento de la concentración plasmática de vasopresina asociada a un incremento en la descarga de frecuencia de neuronas vasopresinérgicas y oxitocinérgicas(42). Adicionalmente, se ha demostrado efectos excitatorios de la ET sobre neuronas del OSF que proyectan al núcleo paraventricular (NPV), con un incremento paralelo en la presión arterial sistémica. Aun mas, la ET-1 microinyectada directamente en el OSF, evoca efectos presores y bradicárdicos, dependientes de la dosis y atenuados por el uso de un antagonista de vasopresina, lo que apunta hacia un mecanismo vasopresinérgico en la mediación de los efectos presores de la ET-1(5).
Poco se conoce sobre el subtipo de receptor involucrado en las acciones de las endotelinas presente en el OSF. Se ha descrito la expresión de ambos subtipos de receptores para las endotelinas en el OSF, sin embargo, la localización celular de estos subtipos de receptores no esta claramente definida(43). La evidencia sugiere la mediación de un receptor ETA en los efectos presores evocados por las endotelinas en esta estructura, ya que estos fueron parcialmente reducidos en presencia del BQ 123(44). Sin embargo, el estudio topográfico de la distribución de neuronas que contienen el subtipo de receptor ETA no incluye al OSF(45). Por otra parte, se ha demostrado que la respuesta depresora evocada por la ET-1 en el colículo superior, una estructura del cerebro medio que participa en el control cardiovascular central, es mediada por el subtipo de receptor ETB(46).
Nuestros resultados de la presencia de un receptor funcional para endotelinas del subtipo ETB, acoplado al recambio de inosítidos de membrana en el OSF, sugiere un papel para este receptor en las acciones postuladas para las endotelinas en esta estructura circunventricular.
En contraste con el OSF el cual es una estructura rica en cuerpos neuronales, la EM es una estructura circunventricular que consiste principalmente en axones. La carencia de barrera hemato-encefálica en esta estructura permite la liberación de los péptidos producidos por las neuronas neurosecretoras a la circulación general y neurohipofisiaria. Sin embargo, es importante reconocer el significado potencial de factores circulantes y paracrinos, que actuando en esta región, puedan modular los procesos celulares específicos a través de los cuales esos terminales nerviosos secreten sus neurohormonas a la circulación(47).
Las endotelinas son producidas por una diversidad de células neuroendocrinas(47). La mayor expresión de ARNm para las endotelinas, así como de la enzima convertidora de endotelinas, ocurre en el hipotálamo, particularmente en cuerpos neuronales y axones de los núcleos paraventricular y supraóptico con terminales en la hipófisis porterior(48,49). Igualmente, axones con inmunorreactividad positiva a ECE-1 presentes en el área basal del hipotálamo rostral, se extienden hacia la EM(49). Diversos autores demuestran que la aplicación de ET-3 y ET-1 a cultivos celulares de hipófisis anterior induce la secreción de gonadotrofinas, hormona del crecimiento, hormona estimulante del tiroides y prolactina(14,46,50). Igualmente, se ha descrito la presencia de inmunoreactividad al receptor ETB asociado a fibras inmunoreactivas a la hormona liberadora de hormona luteinizante (LHRH) en la eminencia media y el órgano vasculoso de la lámina terminal (OVLT) en la rata(51). De modo interesante, esta inmunoreactividad no está asociada a los cuerpos neuronales sino que se encuentra localizada en los campos neuronales terminales de las fibras en estas áreas. Estas observaciones sugieren que las ETs afectan a las fibras de LHRH en la EM y el OVLT, vía el receptor ETB. Esta hipótesis se ve sustentada por el hecho de que la ET-3 incrementa la secreción de LHRH en fragmentos de núcleo arcuato-eminencia media y en líneas celulares neuronales secretoras de LHRH (GT1 y GT1-7), que expresan receptores para ETs(52,53).
Los resultados obtenidos en el presente trabajo indican que el subtipo de receptor responsable por el recambio de fosfoinosítidos de membrana presente en el OSF y en la EM pertenece al subtipo ETB. Esto está sustentado por diferentes evidencias tales como: 1) tanto la ET-1 como la ET-3 presentan la misma potencia y eficacia en la acumulación de InsP1. 2) Antagonistas selectivos del receptor ETA, del tipo BQ 123 y BQ 610, fueron inefectivos en la prevención de la modulación de los niveles de segundos mensajeros inducidos por la estimulación de ambas isoformas de endotelinas. 3) El IRL 1620, un agonista selectivo del receptor ETB, fue capaz de inducir incrementos en el recambio de los inositoles de membrana de modo similar al obtenido con la ET-1 y ET-3. 4) El BQ 788, un antagonista selectivo del receptor ETB, fue capaz de prevenir la acumulación del InsP1 inducida por el IRL 1620 en ambas estructuras estudiadas.
REFERENCIAS BIBLIOGRÁFICAS
1. Yanagisawa M, Kurihara H, Kimura S, Tomobe Y, Kobayashi M, Mitsui Y, Goto K y Masaki T. A novel potent vasoconstrictor peptide produced by vascular endothelial cells. Nature 1988; 332: 411-415. [ Links ]
2. Rubanyi GM y Polokoff MA. Endothelins: molecular biology, biochemistry, pharmacology, physiology and pathophysiology. Pharmacol Rev. 1994; 46: 325-415. [ Links ]
3. Arai H, Hori S, Aramori I, Ohkubo H y Nakanishi S. Cloning and expression of a cDNA encoding an endotelin receptor. Nature 1990; 348: 730-732. [ Links ]
4. Sakurai T, Yanagisawa M, Takuwa Z y col. Cloning of a cDNA encoding a non-isopeptide-selective subtype of the endothelin receptor. Nature 1990; 348: 732-735. [ Links ]
5. Mosqueda-García R, Inagami T, Appalsemy M, Sugiura M y Robertson RM. Endothelin as a neuropeptide cardiovascular effects in the brainstem of normotensive rats. Circ. Res. 1993; 72: 20-35. [ Links ]
6. Lee ME, De la Monte SM, NG SC, Bloch KD y Quertermous T. Expression of the potent vasoconstrictor endothelin in the human central nervous system. J. Clin. Invest., 1990; 86: 141-147. [ Links ]
7. McCumber MW, Ross CA y Snyder SH. Endothelin in brain: receptors, mitogenesis and biosynthesis in glial cells. Proc. Natl. Acad. Sci. USA. 1990; 87: 2358-2363. [ Links ]
8. Koseki C, Imai M, Hirata Y, Yanagisawa M y Masaki T. Autoradiographic localization of [125I] endothelin binding sites in rat brain. Neurosci. Res. 1989; 6: 581-585. [ Links ]
9. Gulati A y Rebello S. Characteristics of endothelin receptors in the central nervous system of spontaneously hypertensive rats. Neuropharmacol. 1992; 31: 243-250. [ Links ]
10. Yokokawa K, Kohno M, Yasunari K, Murukawa K y Takeda T. Endothelin-3 regulates endothelin-1 production in cultured human endothelial cells. Hypertension 1991;18: 304-315. [ Links ]
11. Purkiss JR, West D, Wilkes LC, Scott C, Yarrow P, Wilkinson GF y Boarder MR. Stimulation of phospholipase C in cultures microvascular endothelial cells from human frontal lobe by histamine endothelin and purinoceptor agonists. Br. J. Pharmacol.1994; 111: 1041-1046. [ Links ]
12. Stanimirovic DB, Yamamoto T, Uematsu S y Spatz M. Endothelin-1 receptor binding and cellular signal transduction in cultured human brain endothelial cells. J. Neurochem. 1994; 62: 592-601. [ Links ]
13. Goldman SR, Finkbeiner MS y Smith JS. Endothelin induces a sustained rise in intracellular calcium in hipocampal astrocytes. Neurosc. Lett. 1991; 123: 4-8. [ Links ]
14. Tomic M, Zivadinovic D, Van Goor F, Yuan D, Koshimizu T y Stojilkovic SS. Expression of Ca2+-movilizing endothelin A receptors and their role in the control of Ca2+ influx and growth hormone secretion in pituitary somathotrophs. J. Neurosc. 1999; 19: 7721-7731. [ Links ]
15. Vigne P, Ladoux A y Frelin C. Endothelins activate Na+/H+ exchange in brain capillary endothelial cells via a high affinity endothelin-3 receptor that is not coupled to phospholipase C. J. Biol. Chem. 1991; 266: 5925-5928. [ Links ]
16. Vigne P, Desmartes J, Guedin D y Frelin C. Properties of an endothelin-3 sensitive ETA-like endothelin receptor in brain capillary endothelial cells. Biochem. Biophys. Res. Commun. 1996; 220: 839-842. [ Links ]
17. Kawai N, McCarron RM y Spatz M. Endothelins stimulate sodium uptake into rat brain capillary endothelial cells through endothelin A-like receptors. Neuosci. Lett. 1995;190: 85-88. [ Links ]
18. Catalán RE, Martínez AM, Aragonés MD, Hernández F y Díaz G. Endothelin stimulates protein phosphorylation in blood-brain barrier. Biochem. Biophys. Res. Commun., 1996; 210: 366-369. [ Links ]
19. Kubes M, Cordier J, Glowinski J, Girault JA y Chneiweiss H. Endothelin induces a calcium-dependent phosphorylation of PEA-15 in intact astrocytes: identification of SR 104 and Ser 116 phosphorilated, respectively, by protein kinase C and calcium/calmodulin kinase II in vitro. J. Neurochem. 1998; 71: 1307-1314. [ Links ]
20. Gross PM, Beninger RJ, Shaver SW, Wainman DS, Espinosa FJ y Weaver DF. Metabolic and neuroanatomical correlates of barrel-rolling and oculoclonic convultions induced by intraventricular endothelin-1: a novel peptidergic signaling mechanism in visuovestibular and oculomotor regulation. Exp. Brain Res, 1992; 95: 397-408. [ Links ]
21. Koter K y Klein J. Ethanol inhibits astroglial cell proliferation by disruption of phospholipase D-mediated signaling. J. Neurochem. 1999; 73: 2517-2523. [ Links ]
22. Berti-Mattera LN, Wilkins PL, Harwalkar S, Madhun Z, Almahanna K y Mattera R. Endothelins regulate arachidonic acid release and mitogen-activated protein kinase activity in Schwann cells. J. Neurochem. 2000; 75: 2316-2326. [ Links ]
23. Goto K, Hama H y Kasuya Y. Molecular pharmacology and patophysiological significance of endothelin. Jap. J. Pharmacol. 1996; 72: 261-290. [ Links ]
24. Kuwaki T, Kurihara H, Cao WH, Kurihara Y, Unekawa M, Yazaki Y y Kumada M. Physiological role of brain endothelin in the central autonomic control: from neuron to Knockout mouse. Prog. Neurobiol. 1997; 51: 545-579. [ Links ]
25. Davidson JS, Wakefield IK, Sohnius U, Van der Merwe PA, Millar RP. A novel extracellular nucleotide receptor coupled to phosphoinositidase-C in pituitary cells. Endocrinology 1990; 126: 80-87. [ Links ]
26. Chau LY, Lin TA, Chang WT, Chen CH, Shue MJ, Hsu YS, Hu CY, Tsai WH y Sun GY. Endothelin-mediated calcium response and inositol 1,4,5-trisphosphate release in neuroblastoma-glioma hybrid cells (NG 108-15): cross talk with ATP and bradykinin. J. Neurochem. 1993; 60: 454-460. [ Links ]
27. Gorlach C, Benyo Z y Wahl M. Endothelin-1-induced contraction in cerebral vessels mediated by phospholipase C/protein kinase C cascade. Kidney Int. 1998; 67(Suppl): S224-225. [ Links ]
28. Marsault R, Vigne P, Breittmayer JP y Frelin C. Astrocytes are target cells for endothelins and sarafotoxin. J. Neurochem. 1990; 54: 2142-2144. [ Links ]
29. Lin WW, Lee CY y Chuang DM. Endothelin and sarafotoxin-induced phosphoinositide hydrolysis in cultured cerebellar granule cells: biochemical and pharmacological characterization. J. Pharmacol. Exp. Ther. 1991; 257: 1053-1061. [ Links ]
30. Garrido MR e Israel A. Endothelin-1 stimulates phosphoinositide hydrolysis in the rat pineal gland. Arch Physiol Biochem. 1999; 107(2): 138-143. [ Links ]
31. Garrido MR e Israel A. Los receptores ETA y ETB y el recambio de fosfoinosítidos de membrana en la glándula pineal de la rata. Arch. Ven. Farmacol. Ter. 2001; 20: S32-S37. [ Links ]
32. Yokokawa K, Johnson J, Kohno M, Mandal AK, Yanagisawa M, Horio T, Yasunari K y Takeda T. Phosphoinositide turnover signaling stimulated by ET-3 in endothelial cells from spontaneously hypertensive rats. Am. J. Physiol. 1994; 267: R635-R644. [ Links ]
33. Tencé M, Cordier J, Glowinski J y Prémont J. Endothelin-evoked release of arachidonic acid from mouse astrocytes in primary culture. Eur. J. Neurosci. 1992; 4: 993-997. [ Links ]
34. Lin WW, Lee CY y Chuang DM. Comparative studies of phosphoinositide hydrolysis induced by endothelin-related peptides in cultured cerebellar astrocytes, C6-glioma and cerebellar granule cells. Biochem. Biophys. Res. Commun. 1990; 168: 512-519. [ Links ]
35. Fukuroda T, Fujikawa T, Ozaki S, Ishikawa K, Yano M y Nishikibe M. Clearance of circulation endothelin-1 by ETB receptors in rats. Biochem. Biophys. Res. Commun., 1994; 199: 1461-1465. [ Links ]
36. Yoshizawa T, Kimura S, Kanazawa I, Uchiyama Y, Yanagisawa M y Masaki T. Endothelin localizes in the dorsal horn and acts on the spinal neurones: possible involvement of dihydropyridine-sensitive calcium channels and substance P release. Neurosci. Lett. 1989; 102: 179-184. [ Links ]
37. Kohzuma M, Kataoka Y, Koizumi S, Shibagushi H, N-Nakashima M, Yamashia K, Niwa M y Taniyama K. ETB receptor involvement in stimulatory and neurotoxic action on dopamine neurons. Neuroreport 1994; 5: 2653-2656. [ Links ]
38. Kataoka Y, Koizumi S, Niwa M, Shibagushi H, Shigematsu K, Kudos Y y Taniyama K. Endothelin-3 stimulates inositol 1,4,5-triphosphate production and Ca2+ influx to produce biphasic dopamine release from rat striatal slices. Cell. Mol. Neurobiol. 1994; 14: 271-280. [ Links ]
39. Jones RC, Hiley CR, Pelton TJ y Mohr M. Autoradiographic visualization of the binding sites for [125I]endothelin in rat and human brain. Neurosci. Lett. 1989; 97: 276-279. [ Links ]
40. Samson WK, Skala KD, Alexander BD y Huang F-LS. Possible neuroen-docrine actions of endothelin-3. Endocrinology 1991; 128: 1465-1473. [ Links ]
41. Smith PM, Beninger RJ y Ferguson AV. Subfornical organ stimulation elicits drinking. Brain Res. Bull. 1995; 38: 209-213. [ Links ]
42. Wall KM, Nasr M y Ferguson AV. Actions of endothelin at the subfornical organ. Brain Res. 1992; 570: 180-187. [ Links ]
43. Gebke E, Müller AR, Pehl U y Gerstberger R. Astrocytes in sensory circumventricular organs of the rat brain express functional binding sites for endothelin. Neurosciense 2000; 97: 371-381. [ Links ]
44. Mosqueda-García R, Fernandez-Violante R, Hamakibo T y Stainback R. Vasopressin mediates the pressor effects of endothelin in the subfornical organ of the rat. J Pharmacol. Exper. Ther. 1996; 277: 1034-1042. [ Links ]
45. Kurokawa K, Yamada H y Ochi J. Topographical distribution of neurons containing endothelin type a receptor in the rat brain. J. Comp. Neurol. 1997; 389: 348-360. [ Links ]
46. D’Amico M, Di Filippo C y Rossi F. Depressor responses to endothelin-1 into the superior colliculus of rats: predominant role of ETB receptors. Eur. J. Pharmacol. 1998; 347: 71-75. [ Links ]
47. Stojilkovic SS y Catt KJ. Expression and signal transduction pathways of endothelin receptors in neuroendocrine cells. Frontiers in Neuroendocrinology 1996; 17: 327-369. [ Links ]
48. Sluck JM, Lin RCS, Katolik LI, Jeng AY y Lehmann JC. Endothelin converting enzime-1, endothelin-1 and endothelin-3 like immunoreactivity in the rat brain. Neuroscience 1999; 91: 1483-1497. [ Links ]
49. Kurokawa K, Yamada H, Liu Y y Kudo M. Immunohistochemical distribution of the endothelin-converting enzyme-1 in the rat hypothalamo-pituitary axis. Neurosci. Lett., 2000; 284(1-2): 81-84. [ Links ]
50. Kanyicska B, Burris TP y Freeman ME. Endothelin-3 inhibits prolactin and stimulates LH, FSH and TSH secretion from pituitary cell culture. Biochem. Biophys. Res. Commun. 1991; 174: 338-343. [ Links ]
51. Yamamoto T, Suzuki H y Uemura H. Endothelin B receptor-like immunoreactivity is associated with LHRH-immunoreactive fibers in the rat hypothalamus. Neurosc. Lett. 1997; 223: 117-120. [ Links ]
52. Kramanovic LZ, Tojilkovic SS, Balla T, Al-Damluji S, Weiner RI y Catt KJ. Receptors and neurosecretory actions of endothelin in hypothalamic neurons. Proc. Natl. Acad. Sci. 1991; 88: 11124-11128. [ Links ]
53. Moretto M, López FJ y Negro-Vilar A. Endothelin-3 stimulates luteinizing hormone-releasing hormone (LHRH) secretion from LHRH neurons by a prostaglandin-dependent mechanism. Endocrinology 1993; 132: 789-794. [ Links ]













