Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT v.21 n.1 Caracas ene. 2002
Determinación de Lp(a) Sérica en individuos de Maracaibo y Casigua el Cubo, Estado Zulia
V Bermúdez1, C Cano1, M Medina1, M Nuñez1, A Amell1, J Andrade1, M Ambard1, S Cruz1, A Souki1, E Leal1, M Lemus1, L Sorell2, C Rodríguez1 y F Bermúdez1.
-
Centro de Investigaciones Endocrino-Metabólicas Dr. Félix Gómez, Facultad de Medicina, Universidad del Zulia, Maracaibo, Venezuela
-
Instituto Cubano de Angiología y Cirugía Vascular, Centro de Ingeniería Genética y Biotecnología, La Habana, Cuba.
RESUMEN
Uno de los marcadores de mayor importancia y que al mismo tiempo representa un factor independiente de riesgo para enfermedad coronaria es la Lipoproteína (a) [Lp(a)]. Actualmente se desconocen los valores normales de Lp(a) en nuestra población, por lo que el objetivo del presente estudio fue determinar la concentración sérica de la misma, en una muestra poblacional de las localidades de Maracaibo y Casigua El Cubo, Estado Zulia. Para ello se seleccionaron al azar 184 individuos (98 hombres y 86 mujeres) de ambos sexos, mayores de 10 años, de ambas localidades, sin antecedentes personales o familiares de cardiopatía isquémica prematura, a los cuales se les realizó historia clínica completa y toma de muestra sanguínea por venipunción previo ayuno de 8 horas. Para la determinación de Lp(a) sérica se utilizó un kit comercial ELISA de doble anticuerpo monoclonal. Los niveles séricos de Lp(a) no mostraron diferencia significativa con relación al sexo en la población de Casigua El Cubo (Hombres 29 mg/dl vs. Mujeres 30 mg/dl) pero sí en la ciudad de Maracaibo (Hombres 30 mg/dl vs. Mujeres 27 mg/dl; p<0,05). No hubo diferencia significativa al comparar ambas localidades (Maracaibo 29 mg/dl vs. Casigua 30 mg/dl), por lo que se realizó la distribución por grupos etarios, no encontrándose diferencia significativa al realizar la comparación múltiple. Podemos concluir que la concentración de Lp(a) sérica en individuos sanos de la ciudad de Maracaibo y la población de Casigua El Cubo se encuentra en el límite superior de los valores considerados como normales. Se recomienda por tanto que en individuos con niveles de Lp(a) por encima de 30 mg/dl tengan un control estricto de los factores de riesgo modificables para enfermedades cardiovasculares, en orden de disminuir la morbi-mortalidad por cardiopatía isquémica en estos individuos.
Palabras Clave: Lipoproteína (a) [Lp(a) ], Enfermedad cardiovascular, Aterosclerosis.
ABSTRACT
Lipoprotein (a) is an independent risk factor for coronary artery disease. In this sense, the main purpose of this study was to determine Lp(a) serum concentration in a population sample from Maracaibo and Casigua el Cubo (Zulia, Venezuela), where origin prevailed. Eighty-six male and female individuals, older than 10 years, and 184 adults, both men and women, of white race, from Maracaibo (Zulia, Venezuela) were chosen at random. Lp(a) serum concentration was determined by means of a commercial Kit of double monoclonal antibody against Apo-B100 and Apo(a). Serum levels of Lp(a) in people from Casigua el Cubo of all ages and both genders had a minimum value of 38.0 mg/dl and a maximum value of 99.0 mg/dl, with a median value of 57.0 mg/dl. Lp(a) concentrations for the 10, 25, 50, 75, and 90 percentiles were 10.0 mg/dl, 49.0 mg/dl, 57.0 mg/dl, 67.0 mg/dl and 72.0 mg/dl respectively. No significant differences related to sex or age distribution were found. A significant difference (p>0.05) was found when comparing the serum concentration of Lp(a) in individuals from Casigua and a sample of White individuals from Maracaibo.
Key Words: Lipoprotein (a), Coronary Disease, Atherosclerosis.
INTRODUCCIÓN
La lipoproteína (a) [Lp(a)], identificada por primera vez en el plasma humano en 1963 por Karl Berg(1), es una partícula muy parecida a las lipoproteínas de baja densidad (LDL) en cuanto a su composición lipídica y por la presencia de apoproteína B-100 (apo B-100) pero, a diferencia de la LDL, contiene una apoproteína extra, la apoproteína (a), que se une a la apo B-100 a través de un enlace disulfuro(2,3,4).
El papel fisiológico de la Lp(a) aún es desconocido. Sin embargo, el aspecto mas estudiado hasta la fecha es su rol en la fisiopatología de la aterosclerosis, hecho que cobró gran importancia a partir de los estudios de Mc Lean y colaboradores en los cuales se secuenció el gen de la apo(a) encontrándose que existía una gran similitud con el gen del plasminógeno(5-7).
Un considerable número de estudios señalan a la Lp(a) como un indicador de riesgo independiente para las enfermedades cardiovasculares(6-8). Elevados niveles de Lp(a) se han asociado con la enfermedad arterial coronaria(9-14), con el infarto del miocardio(8,15-20), con la enfermedad cerebrovascular(20-24), con la aterosclerosis periférica(25), con la aterosclerosis acelerada post-transplante cardiaco(26-28) y con la reestenosis post-angioplastia(29).
El nivel de Lp(a) en sangre está condicionado fuertemente por factores genéticos y resulta poco influenciado por la edad, el sexo y la dieta. Por esta razón, resulta un importante indicador de riesgo aterogénico en personas jóvenes e incluso niños cuyos padres han sufrido infarto prematuro del miocardio(13,25,30-32).
La distribución de la concentración de Lp(a) varía de acuerdo al origen étnico de las poblaciones estudiadas. Es altamente asimétrica entre caucásicos y asiáticos, con una tendencia marcada hacia los valores bajos y menos asimétrica y con una tendencia a valores altos, en las poblaciones negras de origen africano o afro-americanas(33-35). Se considera, a la luz de la mayoría de los estudios epidemiológicos que valores por encima de los 30 mg/dl confieren un riesgo 2,5 veces mayor de sufrir cardiopatía isquémico-metabólica(5-7).
Recientemente se ha postulado la importancia del tamaño o talla de la apo (a) dentro de la Lp(a). Se conoce desde hace tiempo el hecho que el tamaño de la apo (a) es muy variable de un individuo a otro y hasta la fecha se han identificado 34 diferentes isoformas de apo(a)(36-38). Esta diferencia se debe al número de repeticiones del gen del Kringle IV de la apo(a) en cada persona, lo cual se asocia con el riesgo de aterosclerosis prematura. De hecho, frecuentemente las isoformas de mayor tamaño se asocian con niveles de Lp(a) bajos (como ocurre en la mayoría de las poblaciones caucásicas) y de manera inversa, las isoformas pequeñas o medianas se correlacionan con niveles totales de Lp(a) altos (como se observa en la raza negra)(33,34,39,40). Sin embargo, se debe hacer notar que esta correlación inversa no es estricta y una misma isoforma puede estar asociada con niveles de Lp(a) que pueden ir desde 2 mg/dl hasta 200 mg/dl, fenómeno que claramente indica que otros factores están influyendo en el control de la concentración de Lp(a)(41).
En la actualidad, se considera que el efecto de la Lp(a) sobre el sistema cardiovascular y entidades asociadas es a través de dos mecanismos básicos:
1) Como la Lp(a) es una partícula estructuralmente muy relacionada con las LDL, puede sufrir los mismos cambios de la anterior, que la pueden convertir en una lipoproteína directamente pro-aterogénica, cuando es modificada oxidativamente y no oxidativamente(4,5).
2) Como posee estructuras repetidas que le hacen semejante al plasminógeno (Kringle 4), puede competir con éste por sus activadores naturales, de manera que, en la medida que la Lp(a) aumenta, ésta puede unirse a una mayor cantidad del activador tisular del plasminógeno (tPA) por lo cual, el plasminógeno no encontrará una concentración adecuada de sus activadores naturales. Se puede concluir que a través de este mecanismo, la Lp(a) se comporta como un agente anti-trombolítico(42-45).
En Venezuela no se han realizado estudios sobre la concentración de Lp(a) y sus isoformas, ni tampoco sobre su relación con la enfermedad vascular por aterosclerosis. Por este motivo, nuestro Centro se ha abocado a realizar un proyecto a gran escala, sobre la determinación de los niveles normales de Lp(a) en nuestra población urbana y rural, grupos indígenas, y poblaciones cerradas de origen afro-americano y su relación con la enfermedad coronaria y cerebrovascular, gracias a la colaboración del Instituto de Biotecnología de La Habana, Cuba, que ha desarrollado la tecnología para la preparación de los reactivos para la determinación de Lp(a) sérica mediante técnica de Elisa con doble anticuerpo (monoclonal contra Lp(a) y monoclonal contra Apo B-100)(46).
El objetivo de este estudio fue la cuantificación de los niveles séricos de Lp(a) en una muestra de individuos de un área urbana (Maracaibo, Estado Zulia), e individuos de un área rural como lo es Casigua El Cubo (Municipio Jesús Maria Semprún, Estado Zulia).
MATERIALES Y MÉTODOS
Selección de los pacientes
Para la realización del presente estudio se escogieron al azar 184 individuos de ambos sexos (98 hombres y 86 mujeres) mayores de 10 años de las localidades de Maracaibo y Casigua El Cubo (Municipio Jesús Maria Semprún, Estado Zulia), a los cuales se les realizó historia clínica completa a fin de descartar procesos patológicos agudos o crónicos que pudiesen influir sobre los niveles de Lp(a), ya que según publicaciones recientes, se ha determinado un cambio en la concentración de esta biomolécula durante procesos infecciosos agudos, la fase aguda del infarto del miocardio o después de actos quirúrgicos, considerándose por lo tanto como un posible reactante de fase aguda(4,41).
Determinación de Lp(a) sérica
Todos los pacientes fueron sometidos a ayuno de 8 a 12 horas antes de la toma de muestra sanguínea por venopunción, la cual fue realizada a la misma hora para todos los individuos (8:00–9:00 am). Cada muestra fue colocada en tubos de ensayo y centrifugada a 4.000 r.p.m por 10 minutos después de la cual fue extraído el suero y colocado en tubos de ensayos de polipropileno y congelada a –70°C.
El tiempo transcurrido entre la toma de la muestra y su procesamiento nunca excedió los tres meses. Para la determinación de la concentración de Lp(a) sérica se utilizó un Kit comercial basado en ELISA de doble anticuerpo monoclonal contra Apo-B100 y contra Apo(a) suministrados gentilmente por el Instituto de Angiología y Cirugía Vascular de la Habana, Cuba (Heber Biotech BioSCREEN Lp(a), La Habana, Cuba). Para esta prueba, la intensidad del color es directamente proporcional a la concentración de Lp(a). La concentración de Lp(a) en cada microplato fue determinada en un lector ELISA a 492 nm y calculada contra una curva estándar(46).
Análisis estadístico
Las estadísticas descriptivas para cada localidad se presentaron en tablas que contenían la media, la moda, la mediana, los valores mínimo y máximo, y los percentiles 75, 90 y 95. Las diferencias para cada grupo de sexo y para cada localidad en cuanto a las concentraciones séricas de Lp(a) fueron determinadas por medio de la U de Mann-Whitney, conside-rándose como significativos aquellos valores donde p<0,05.
RESULTADOS
Niveles de Lp(a) en una muestra de la ciudad de Maracaibo
Características de la población estudiada: Fue estudiada una muestra de 137 individuos de la localidad de Maracaibo, de los cuales 61 fueron del sexo femenino y 76 del sexo masculino, el promedio de edad en las mujeres fue de 42,7±1,9 años y para los hombres 43,5±1,4 años. Todos los individuos fueron desde el punto de vista fenotípico, blancos criollos o de raza mezclada. Es importante hacer notar que 25 mujeres estaban por encima de los 45 años y todas recibían terapia hormonal sustitutiva ya que fueron pacientes que consultaron al Centro de Investigaciones Endocrino - Metabólicas Dr. Félix Gómez de la Universidad del Zulia.
Distribución de los niveles séricos de Lp(a) en habitantes de la ciudad de Maracaibo
Los niveles séricos de Lp(a) de la muestra de los habitantes de Maracaibo para todas las edades y ambos sexos se encontraron con un valor mínimo de 10 mg/dl y un valor máximo de 40 mg/dl, con una media de 29 mg/dl. La concentración de Lp(a) para los percentiles 75, 90 y 95 fueron de 17 mg/dl, de 29 mg/dl, 32 mg/dl y 36 mg/dl respectivamente.
Niveles séricos de Lp(a) según el sexo en habitantes de la ciudad de Maracaibo
Al comparar los niveles de Lp(a) según el sexo de la población estudiada se encontró una diferencia significativa entre el sexo masculino (30 mg/dl) y el sexo femenino (27mg/dl), (Gráfico 1).
Niveles de Lp(a) en una Muestra de la población de Casigua El Cubo, Municipio Jesús María Semprún
Características de la población estudiada: Se estudió una muestra de 47 individuos de la localidad de Casigua El Cubo, de los cuales 25 fueron del sexo femenino y 22 del sexo masculino, el promedio de edad fue de 33,7 años para las mujeres y 38,1 años para los hombres. Todos los individuos estudiados fueron desde un punto de vista fenotípico de raza mezclada.
Distribución de los niveles séricos de Lp(a) en una muestra de la población de Casigua El Cubo, Municipio Jesús María Semprún
Los niveles séricos de Lp(a) de la muestra de los habitantes la localidad de Casigua para todas las edades y ambos sexos se encontraron con un valor mínimo de 20 mg/dl y un valor máximo de 45 mg/dl, con una media de 30 mg/dl. La concentración de Lp(a) para los percentiles 75, 90 y 95 fueron de 23 mg/dl, de 30 mg/dl, 32 mg/dl y 38 mg/dl respectivamente.
Niveles séricos de Lp(a) según el sexo en habitantes de la Localidad de Casigua El Cubo, Municipio Jesús María Semprún
Al comparar los niveles de Lp(a) según el sexo en esta población no se encontró diferencia significativa entre el sexo masculino (29 mg/dl) y el sexo femenino (30mg/dl), (Gráfico 2).
Comparación de los niveles de Lp(a) entre la población de Maracaibo y la población de Casigua El Cubo, Municipio Jesús María Semprún
Los niveles de Lp(a) en la población de Casigua El Cubo no fueron significativamente diferentes a los encontrados en la muestra de individuos de la Ciudad de Maracaibo. (29 mg/dl vs. 30 mg/dl), (Gráfico 3).
Distribución de los niveles séricos de Lp(a) según grupos etarios entre los habitantes de la localidad de Casigua El Cubo, Municipio Jesús María Semprúm y los habitantes de la ciudad de Maracaibo, Municipio Maracaibo
El rango de edades de los individuos estudiados estuvo entre los 10–79 años. Al dividir el rango de edades en intervalos de 10 años no se observó diferencias significativas en la concentración de Lp(a) entre los diferentes intervalos en cada población respectivamente. Al comparar los niveles séricos de Lp(a) según grupos etarios de ambas poblaciones los valores no fueron significativamente diferentes, (Gráfico 4).
Gráfico 1: Niveles de Lp(a) en Maracaibo según sexo
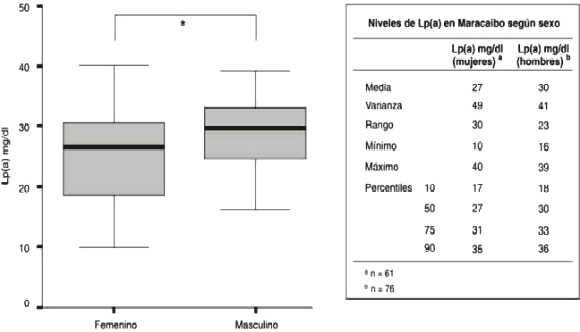
* Diferencia Significativa U Mann-Whitney p<0,05
Gráfico 2: Niveles de Lp(a) en Casigua El Cubo según sexo
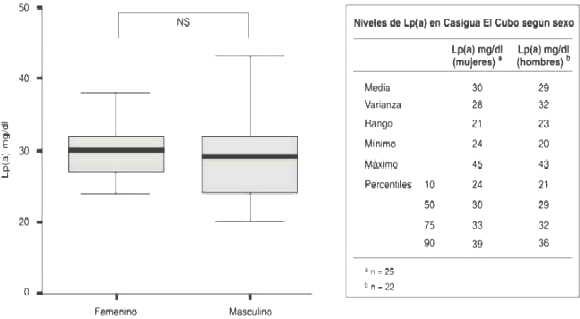
NS = Diferencia No Significativa
Gráfico 3: Niveles de Lp(a) en Casigua El Cubo y Maracaibo
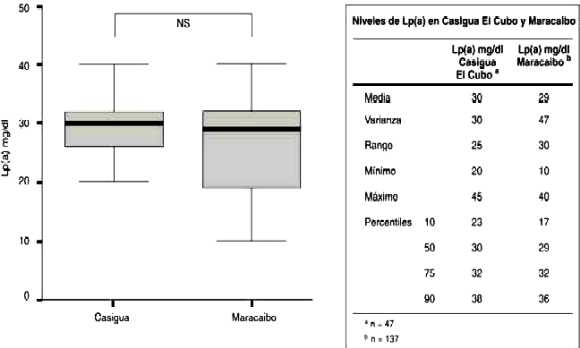
NS = Diferencia No Significativa
Gráfico 4: Niveles de Lp(a) por grupos etarios en Casigua El Cubo y Maracaibo
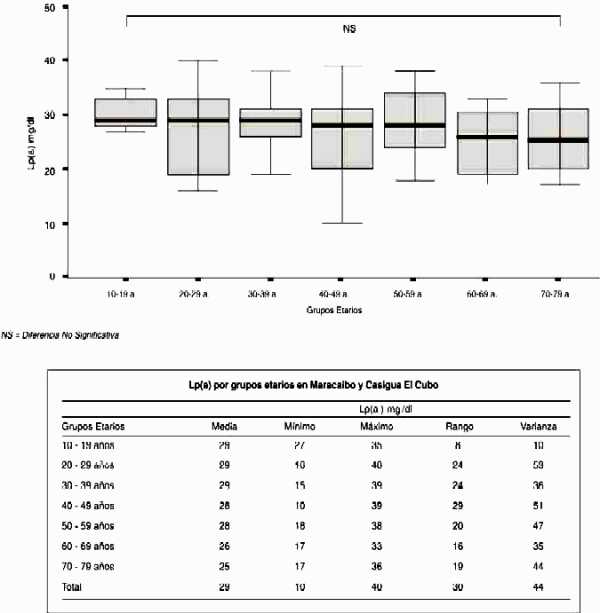
NS = Diferencia No Significativa
DISCUSIÓN
La concentración de Lp(a) bajo la luz de este estudio se encuentra dentro de los valores considerados como normales, aunque en el limite superior para la población de raza mezclada/ blancos criollos de la Ciudad de Maracaibo y de la población de Casigua El Cubo, pues investigaciones precedentes realizados en caucásicos con cardiopatía isquémica refieren un aumento de riesgo para enfermedad cardiovascular (2,5 veces mayor) cuando la concentración plasmática de Lp(a) esta por encima de 30 mg/dl(7,8,20). En nuestro estudio, la muestra de la Ciudad de Maracaibo tiene una media de Lp(a) sérica de 29 mg/dl lo cual es cercano a este límite. Un estudio reciente llevado a cabo en Brasil demostró una concentración de Lp(a) sérica promedio de 23,9 mg/dl en personas sanas y de raza mezclada (sin antecedentes de enfermedad coronaria prematura) en comparación con 41,9 mg/dl en pacientes con enfermedad coronaria aterosclerótica puesta en evidencia por cinecoronariografía(47). De esta forma, es posible que exista cierta homogeneidad en los niveles de Lp(a) en la población latina, aunque se requieren de más estudios en nuestros países para aclarar este punto.
Es un hecho la necesidad de tener nuevas herramientas predictoras de eventos isquémicos vasculares para mejorar la estratificación de individuos según el riesgo de padecer cardiopatía isquémico-metabólica, accidentes cerebro-vasculares o enfermedad vascular periférica.
La presencia de marcadores para alteraciones del metabolismo lipidico, del metabolismo de la vitamina B12, de la fibrinólisis, coagulación, inflamación, infección, disfunción endotelial, del sistema renina-angiotensina y balance oxidación/ antioxidación, se han asociado a enfermedad coronaria subclínica o clínica en grandes estudios poblacionales(5). Siendo la aterosclerosis una condición multifactorial, es muy probable entonces que deban converger varios determinantes mayores para que un individuo manifieste enfermedad coronaria. Es por esto que se necesita una mejor definición de lo que significa un perfil de riesgo cardiovascular para ayudar al mejor manejo de individuos susceptibles, bien sea desde el punto de vista de prevención primaria o secundaria(8,21).
Uno de los indicadores de mayor importancia y que lamentablemente permanece oculto entre nosotros (debido a que no se cuantifica de manera rutinaria) es la Lp(a), la cual representa un factor independiente de riesgo para la enfermedad coronaria(3,18,24,40).
A pesar de la elevada relación epidemiológica que une a la Lp(a) con la enfermedad vascular por aterosclerosis, aún no están completamente claros los mecanismos moleculares involucrados para la aterogenicidad de esta partícula lipoproteica. Hasta la fecha se han postulado tres hipótesis basadas en estudios sobre el papel de la Lp(a) 1) En el transporte del colesterol hacia los vasos dañados, 2) La interferencia de la Lp(a) con la formación de plasmina (y su actividad) y 3) la estimulación de la proliferación de la células vasculares. Estos estudios se han realizado en cultivos celulares, en animales transgénicos y estudios clínicos(6,20,21,48).
Los estudios mas tempranos sobre la Lp(a) resaltaron su papel potencial en el metabolismo y transporte del colesterol. Varios investigadores han comprobado que la Lp(a) se une de manera específica a los receptores para LDL y a receptores tipo scavenger de los macrófagos. En ratones transgénicos que sobre-expresan el receptor humano para LDL se puede observar un aumento en la catabolia de la Lp(a) administrada de manera exógena. Por otro lado, otros estudios realizados también en ratones transgénicos pero que sobre-expresaban Apo(a), demostraron que el fenómeno aterogénico puede ser favorecido por la Lp(a), bien sea al interferir con la degradación normal de la LDL, o por su incorporación en la placa aterosclerótica vía receptor scavenger en los macrófagos(38,39).
El descubrimiento de la homología que presenta la Apo(a) con el plasminógeno ha llevado a la postulación de varias hipótesis sobre la trombo-aterogenicidad de la Lp(a). Estos estudios explican, una relación potencial entre la hipofibrinolisis y la aterosclerosis, sugiriendo que eventos trombóticos repetidos y subclínicos pueden promover el daño arterial en puntos de formación de placas incipientes. En efecto, la secuencia de repeticiones de dominios tipo Kringle 4 ha conducido a la hipótesis de que la Lp(a) puede mimetizar al plasminógeno en su interacción con la fibrina receptores de superficie celular y otras proteínas. Estudios recientes han demostrado la alteración de la activación del plasminógeno por la estreptocinasa y el activador tisular del plasminógeno(36,37,42).
Muchos tipos celulares expresan proteínas y biomoléculas que pueden interactuar con el plasminógeno como son los gangliósidos y a-enolasa en células monocitoides, el antígeno de Nefritis Heymann en células epiteliales renales, gliceraldehído-3-fosfato deshidrogenasa de estreptococos, la glucoproteína IIb/IIIa de las plaquetas y los fibroblastos sinoviales y la anfoterina de las células de neuroblastoma(36,37,48). Aparentemente, todas las proteínas que se enlazan al plasminógeno tienen una Lisina carboxilo terminal que interactúa con los Kringle 4 del plasminógeno y de la plasmina, protegiéndolos de su principal inhibidor la a2-antiplasmina. Finalmente, un tercer potencial mecanismo por el cual la Lp(a) puede inducir la aterogénesis se relaciona con su potencial efecto sobre la actividad de factores de crecimiento y la subsecuente proliferación de células musculares lisas del vaso sanguíneo(49). Se ha demostrado in vitro que la Lp(a) inhibe la activación del factor de crecimiento transformador beta (TFG-b). Este hallazgo ha sido de gran interés debido a que estudios in vitro indican que la plasmina activa la conversión de pro-TGF-b a TGF-b activo, un inhibidor endógeno de la proliferación de células musculares lisas. Estudios posteriores demostraron que la Lp(a) altera la activación del TGF-b y como consecuencia, aumenta la proliferación de células musculares lisas(49).
Hasta la fecha no se habían realizado estudios en Venezuela sobre los niveles de Lp(a) sérica, de manera que, este es el primer estudio donde se pone en evidencia su concentración plasmática en individuos de raza mezclada de una población urbana e individuos de raza mezclada de una población rural.
A pesar que las poblaciones estudiadas pertenecen a áreas socioculturalmente distintas no hubo diferencias significativas en los niveles de Lp(a). Estos hallazgos confirman el hecho de que los niveles de Lp(a) son determinados genéticamente y sus valores no se ven afectados por factores ambientales como los hábitos alimentarios, el ejercicio y el estilo de vida entre otros.
CONCLUSIONES Y RECOMENDACIONES
La concentración de Lp(a) sérica en individuos sanos de la ciudad de Maracaibo y la población de Casigua El Cubo sin antecedentes personales o familiares de cardiopatía isquémica prematura se encuentran en el límite superior de los valores considerados como normales.
Se recomienda que en individuos con niveles de Lp(a) por encima de 30 mg/dl tengan un control estricto de los factores de riesgo modificables (LDL-col elevadas, HDL-col disminuida, tabaquismo, sedentarismo entre otros), para enfermedades cardiovasculares en orden de disminuir la morbi-mortalidad por cardiopatía isquémica en estos individuos.
Finalmente, se recomienda profundizar las investigaciones sobre esta lipoproteína, en especial, sobre la distribución de sus diferentes isoformas de manera de tener una mejor caracterización y categorización de los factores de riesgo para enfermedades cardiovasculares en nuestro Estado.
REFERENCIAS BIBLIOGRÁFICAS
1. Berg K. A new serum type system in man: The Lp(a) system. Acta Phatol Microbiol Scand 1963; 59: 369-382. [ Links ]
2. McLean J, Tomlinson J, Kuang E. cDNA secuence of human apolipoprotein (a) is homologous to plasminogeno. Nature 1987; 300: 132-137. [ Links ]
3. Dahlen G. Lp(a): lipoprotein in cardiovascular disease. Atherosclerosis 1994; 108: 111-126. [ Links ]
4. Berg K. Lp(a) lipoprotein: An overview. Chem Phys Lipids 1994; 67: 9-16. [ Links ]
5. Naito H. Atherosclerosis: Current topics of etiology and risk factors. Clin Chem 1995; 41: 132-133. [ Links ]
6. Armstrong VW, Cremer P, Eberle E. The association between serum Lp(a) concentration and angiographically assessed atherosclerosis. Atherosclerosis 1986; 62: 249-257. [ Links ]
7. Rodriguez C, Seman L, Ordovas J. Lipoprotein (a) and coronary Heart disease. Clin Chem Lipids 1994; 67: 389-398. [ Links ]
8. Rhoads G, Dahlen G, Berg. Lp(a): lipoprotein as a risk factor for myocardial infarction. JAMA 1986; 256: 2540-2544. [ Links ]
9. Rosengren A, Wilhelmsen L, Eriksson E, Risberg B, Wedel H. Lipoprotein(a) and coronary heart disease: a prospective case-control study in the general population of middle aged men. BMJ 1990; 301: 1248-1251. [ Links ]
10. Jauhiainen M, Koskinen P, Ehnhom C. Lipoprotein(a) and coronary heart disease risk: a nested case-control study of the Helsinki Heart Study participants. Atherosclerosis 1991; 89: 59-67. [ Links ]
11. Sigurdsson G, Baldursdottir A, Sigvaldason H, Agnarsson U, Thorgeirsson G, Sigfusson M. Predictive value of apolipoproteins in a prospective survey of coronary artery disease in men. Am J Cardiol 1992; 69: 1251-1254. [ Links ]
12. Delaney GH, Guyton JR, Attar M, Farmer JA, Kantz JA, Gotto AM Jr. Association of levels of lipoprotein (a), plasma lipids, and other lipoproteins with coronary artery disease documented by angiography. Circulation 1986; 74: 758-765. [ Links ]
13. Sandkamp M, Funke H, Schulte H, Kohler E, Assman G. Lipoprotein(a) is an independent risk factor for myocardial infarction at a young age. Clin Chem 1990, 36: 20-23. [ Links ]
14. Genest J Jr, Jenner JL, McNamara JR, Ordovas JM, Silberman SIR, Wilson PWF. Prevalence of lipoprotein (a) [Lp(a)] in coronary artery disease. Am J Cardiol 1991; 67: 1039-1045. [ Links ]
15. Ridker PM, Hennekens CH, Stampfer MJ. A prospective study of lipoprotein(a) and the risk of myocardial infarction. JAMA 1993; 270: 2195-2199. [ Links ]
16. Stampfer MJ, Sacks FM, Salvini S, Willett WC, Hennekens CH. A prospective study of cholesterol, apolipoproteins, and the risk of myocardial infarction. N Engl J Med 1991; 325: 373-381. [ Links ]
17. Kostner GM, Avogaro P, Cazzolato G, Marth E, Bittolo-Bon G, Quinci GB. Lipoprotein Lp(a) and the risk for myocardial infarction. Atherosclerosis 1981; 38: 51-61. [ Links ]
18. Von Eckardstein A, Assmann S. Clinical implications of elevated lipoprotein (a). Curr Atheroscler Rep 2001 ; 3: 267-270. [ Links ]
19. Gaw A. Lipoproteins and the risk of myocardial infarction. JAMA 1994; 271: 1077-1078. [ Links ]
20. Zenker G, Koltringer P, Bone G. Lipoprotein (a) as a strong indicator for cerebrovascular disease. Stroke 1986; 17: 942-945. [ Links ]
21. Shintani S, Kikushi S, Hamagushi H. High serum Lp(a) is a an independent risk factor for cerebral infarction. Stroke 1993; 24: 965-969. [ Links ]
22. Ritter MM, Geiss HC, Richter WO, Schwandt P. Lipoproteins and the risk of myocardial infarction. JAMA 1994; 271: 1077. [ Links ]
23. Jurgens G; Taddei-Peters WC; Koltringer P; Petek W; Chen Q; Greilberger J; Macomber PF; Butman BT; Stead AG; Ransom JH. Lipoprotein(a) serum concentration and apolipoprotein(a) phenotype correlate with severity and presence of ischemic cerebrovascular disease. Stroke 1995; 26: 1841-1848. [ Links ]
24. Murai A, Miyahara T, Fujimoto N, Matsuda M, Kameyama M. Lp(a) lipoprotein as a risk factor for coronary heart disease and cerebral infarction. Atherosclerosis.1986; 59: 199-204. [ Links ]
25. Valentine R, Graybum P, Vega G, Grundy S. Lp(a) lipoprotein is a independent discriminating risk factor for premature peripheral atherosclerosis among white men. Arch Intern Med 1994; 154: 801-806. [ Links ]
26. Hoff HF, Beck GKJ, Skibinski CI Jurgens G, ONeil J, Lytle B. Serum Lp(a) level as a predictor of vein graft stenosis after coronary artery bypass surgery in patients. Circulation 1988; 77: 1238-1244. [ Links ]
27. Maher VM, Brown BG. Lipoprotein(a) and coronary heart disease. Curr Opin Lipidol 1995; 6: 229-235. [ Links ]
28. Barbir M, Kushwaha S, Hunt B. Lipoprotein (a) and accelerated coronary artery disease in cardiac transplant recipients. Lancet 1992; 340: 1500-1502. [ Links ]
29. Tenda K, Saikawa T, Maeda T. The relationship between serum lipoprotein (a) and reestenosis after initial efectivie percutaneous transluminar coronay angioplasty. Jpn Circ J 1993; 57: 789-795. [ Links ]
30. Loscaizo J. Lipoprotein(a): a unique risk factor for atherothrombic disease. Arteriosclerosis 1990; 10: 672-679. [ Links ]
31. Marquez A, Mendoza S, Carrasco H. High lipoprotein (a) in children from kindred with parenteral premature myocardial infarction. Pediatr Res 1993; 30: 670-674. [ Links ]
32. Srinivasan SR, Delaney GH, Jarpa RA, Webber LS, Berenson GS. Racial (black-white) differences in serum lipoprotein(a) distribution and its relation to parental myocardial infarction in children. Circulation 1991; 84: 160-167. [ Links ]
33. Pearson T, Davidson L, Jenkins P, Rybicki B, Klag M, Thomas J. Lipoprotein(a) levels in blacks vs whites: marked differences in levels and correlations with other lipids. Circulation 1990, 82: 475A. [ Links ]
34. Cobbaert C, Kesteloot H. Serum lipoprotein (a) levels in racially different populations. Am J Epidemiol 1992; 16: 755-758. [ Links ]
35. Havel RJ, Kane JP. Structure and metabolism of plasma lipoproteins. In: Scriver CR, Beaudet AL, Sly WS, et al, editors. The metabolic basis of inherited disease. 6th ed. New York: McGraw-Hill; 1989. p. 1129. [ Links ]
36. Scanu AM, Edelstein C. Kringle-dependent structural and functional polymorphism of apolipoprotein(a). Biochem Biophys Acta 1995; 1256: 1-12. [ Links ]
37. Scanu AM, Ofaffinger D, Lee JC, Hinman J. A single point mutation in human apo(a) kringle 4-37 associated with lysine binding defect in Lp(a). Biochem Biophys Acta 1994; 1227: 41-45. [ Links ]
38. Klezovitch O, Edelstein C, Scanu AM. Evidence that the fibrinogen binding domain of apo(a) is outside the lysine binding site (LBS) of kringle IV-10: a study involving naturally occurring lysine binding defective lipoprotein(a) phenotypes. J Clin Invest 1996; 98: 185-191. [ Links ]
39. Mooser V, Seabra MC, Abedin M, Landschultz KT, Marcovina S, Hobbs HH. Apolipoprotein(a) kringle 4-containing fragments in human urine: relationship to plasma levels of lipoprotein(a). J Clin Invest 1996; 97: 858-864. [ Links ]
40. Scanu AM, Fless GM. Lipoprotein(a) heterogeneity and biological relevance. J Clin Invest 1990; 85: 1709-1715. [ Links ]
41. Fless GM, Trolih CA, Scanu AM. Heterogeneity of human plasma lipoprotein (a). Isolation and characterization of the lipoprotein subspecies and their apoproteins. J Biol Chem 1984; 259: 11470-11478. [ Links ]
42. Miles LA, Plow EF. Binding and activation of plasminogen on the platelet surface. J Biol Chem 1985; 260: 4303-4311. [ Links ]
43. Wilhelmsen L, Svardsudd K, Korsan-Bengsten K, Larson B, Welin L, Tibblin G. Fibrinogen as a risk factor for stroke and myocardial infarction. N Engl J Med 1984; 311: 501-505. [ Links ]
44. Stone MC, Thorp JM. Plasma fibrinogen: a major coronary risk factor. JAMA 1985; 291: 1312-1314. [ Links ]
45. Kannel WB, Wolf PA, Castelli WP, DAgostino RB. Fibrinogen and risk of cardiovascular disease: the Framingham Study. JAMA 1987; 258: 1183-1186. [ Links ]
46. Sorell L, Rojas G, Rodríguez M. A Sandwich ELISA based on anti-Apo(a) and anti Apo-B monoclonal antibodies for lipoprotein(a) measurement. Clin Chem Acta 1995; 236: 59-70. [ Links ]
47. Maranhao R, Arie S, Vinagre CG, Guimaraes JB. Lipoprotein (a) plasma Levels in normal subjects and patients with coronary disease confirmed by cinecoronariography. Arq Bras Cardiol 1991. 56(2): 121-125. [ Links ]
48. Scanu AM, Miles LA, Fless GM, Pfaffinger D, Eisenhart J, Jackson E. Rhesus monkey lipoprotein binds to lysine sand U937 monocytoid cells less efficiently than human lipoprotein(a): evidence for the role of kringle 4. J Clin Invest 1993; 44: 283-291. [ Links ]
49. Graninger DJ, Kirschenlohr HL. Proliferation of human smooth muscle cells promoted by Lp(a). Science 1993; 260: 1655-1658. [ Links ]













