Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT v.23 n.1 Caracas 2004
Pamidronato en la enfermedad metastásica ósea
MD Ventín1 y C León1.
1 Hospital General del Oeste "Dr. José Gregorio Hernández", Caracas, Venezuela.
RESUMEN
Antecedentes: La metástasis ósea es una complicación común de muchos tipos de cáncer. Estas predisponen al desarrollo de: dolor, fracturas patológicas e hipercalcemia que reducen la calidad de vida del paciente. Existe evidencia de destrucción ósea aumentada en la enfermedad metastásica. Los bifosfonatos como el Pamidronato, inhiben la actividad osteoclástica y reducen la reabsorción ósea. Métodos: Pacientes con metástasis ósea determinada por gammagrama, recibieron Pamidronato endovenoso (90 ó 60 mg) y placebo, se evaluaron marcadores de reabsorción ósea y calidad de vida antes del tratamiento y a través del estudio. Resultados: Calcio sérico y en orina de 24 horas no varió en ningún grupo. La fosfatasa alcalina descendió no significativamente en los grupos de tratamiento. La DPD (colágenos cross-linked: Piridolina y Deoxipiridolina), corregida, disminuyó no significativamente en todos los grupos de tratamiento. En la subescala de bienestar físico se observó mejoría clínica en el grupo de 90 mg (p 0,05). Conclusiones: Las infusiones mensuales de Pamidronato, mejora el dolor óseo en pacientes con metástasis ósea.
Palabras Clave: Cáncer, Metástasis, Pamidronato, Calidad de vida, Marcadores óseos.
ABSTRACT
Background: The bony metastasis is a common complication of many cancer types. These predispose to the development of: pain, pathological fractures and hypercalcaemia, that reduce the quality of the patients life. Evidence of bony destruction increased in the illness metastasic exists. The biphosphonates like the Pamidronate, inhibit the activity osteoclastic and reduce the bony reasorption. Methods: Patient with bony metastasis determined by gammagrama, received Pamidronate endovenous (90 or 60 mg) or placebo, markers of bony reasorption and quality of life were evaluated before the treatment and through the study. Results: The level of calcium plasmatic and calcium urinary of 24 hours it didnt vary in any group. The alkaline fosfatase descended not significantly in the treatment groups. The corrected DPD (cross-linked: Piridoline y Deoxipiridoline colagen), diminished not significantly in the groups. In the subscale of physical well-being clinical improvement was observed in the group of 90 mg (p 0,05). Conclusions: The monthly infusions of Pamidronate, improve the bony pain in patient with bony metastasis.
Key Words: Cancer, Metastasis, Pamidronate, Quality of life, Bony markers.
INTRODUCCIÓN
El cáncer se ha convertido en un problema sanitario de primer orden, se puede estimar que se producen más de 6 millones de casos nuevos de cáncer al año, constituyendo la causa de una de cada 10 muertes anuales producidas y la tercera causa de muerte mundial(1).
Siendo la mayoría de estos pacientes incurables cuando se diagnostica la enfermedad(2,3).
El esqueleto es comúnmente afectado en pacientes con cáncer y las complicaciones resultantes están asociadas con una morbilidad significativa. Estas complicaciones incluyen: dolor en los sitios de las metástasis, fracturas patológicas en los sitios donde se encuentra el hueso adelgazado, síndromes de compresión nerviosa e hipercalcemia(2,3).
Los enfermos de cáncer necesitan medidas de alivio del dolor, el cual se produce en alrededor de la tercera parte de los pacientes en todas las fases de la enfermedad, las medidas de alivio del dolor han de ser paralelas a las de tratamiento ya que el alivio del dolor es un factor fundamental para la determinación de su calidad de vida(2).
El incremento en la atención hacia la calidad de vida, la ha colocado como principal punto final en los estudios fase III(4). Una de las escalas desarrolladas para evaluar la calidad de vida, es "Functional Assesment of Cancer Therapy Scale-General" (FACT-G). La escala FACT-G es un instrumento de autoreporte que mide la calidad de vida relacionada con la salud en los pacientes con cáncer que reciben terapia. Está constituida por cinco subescalas que evalúan aspectos relacionados con el bienestar físico, funcional, social, emocional y relación médico-paciente. Esta escala presenta una serie de ventajas, como lo es el hecho, de que abarca importantes aspectos de la calidad de vida, en segundo lugar las subescalas permiten evaluar aspectos específicos de la calidad de vida y en tercer lugar es una escala simple que puede ser contestada fácilmente por los pacientes(5,6,7).
El desarrollo de las metástasis ósea no es solamente al azar, mas bien es el resultado de la combinación de una serie de fenotipos de la célula tumoral, características anatómicas y la susceptibilidad del sitio de la metástasis para permitir el crecimiento del tumor(8).
Una vez que las células del cáncer de mama son retenidas en el hueso, este microambiente que contiene altas concentraciones de citoquinas y factores de crecimiento, proporciona un terreno fértil para su crecimiento. En adición, la actividad de la proteína relacionada a la parathormona (PTHrP), producida por las células tumorales estimula la lisis ósea por los osteoclastos, y puede ser potenciada por citoquinas del huésped y factores de crecimiento. Mayor degradación del hueso, añade más factores de crecimiento al microambiente local que estimula las células tumorales. El factor de crecimiento transformante b (TGF-b) causa aumento del péptido de PTH, en células de cáncer de mama in vitro. El factor de crecimiento similar a la insulina II (IGF-II) liberado por el hueso reabsorbido, puede también estimular el crecimiento del tumor. Otros factores liberados por el hueso reabsorbido pueden actuar como factores quimiotácticos que atraen células tumorales al hueso; tales factores incluyen TGF-b, colágeno tipo I sus fragmentos y IGFs(8).
Se ha demostrado que un número de factores asociados con el tumor y derivados del hueso incrementan la expresión de la PTHrP por el tumor, así como, aumenta el efecto de la PTH sobre el hueso. Tales factores derivados del tumor incluyen: factor de crecimiento epidérmico (EGF), TGF-b, interleuquina 6(IL-6), factor de necrosis tumoral a (FNT-a), IGF I y II. Esto lleva a un continuo ciclo de destrucción ósea y desarrollo de la metástasis ósea lítica(8).
En otros tipos de cáncer como el de próstata se evidencian metástasis osteoblásticas, cuyo mecanismo responsable no es del todo conocido.
Los bifosfonatos son análogos sintéticos del pirofosfato, un regulador endógeno del remodelado óseo. Se unen rápidamente a la hidroxiapatita ya que ellos alteran la carga superficial de la misma, ejerciendo un marcado efecto físico-químico sobre los cristales de hidroxiapatita. La composición iónica de la capa acuosa alrededor de los cristales en proceso de formación es cambiada por la repulsión del ortofosfato y la atracción del calcio(9,10,11). Esta alta afinidad por el mineral óseo, determina que a pesar de concentraciones sistémicas iniciales bajas, existen altas concentraciones locales en las lagunas de reabsorción osteoclástica(10).
No obstante, el mecanismo celular directo solo, puede explicar el efecto de los bifosfonatos sobre la reabsorción ósea inducida por osteoclastos. La ultraestructura de los osteoclastos de animales tratados con bifosfonatos, ha revelado una reducción en el volumen del borde plegado, así como anormalidades en la estructura y actividad enzimática de los lisosomas(12). Ha sido demostrado que los bifosfonatos pueden afectar el pool de progenitores osteoclásticos en la médula ósea. Es posible que el efecto inhibitorio sobre los osteoclastos pueda ser: vía efectos sobre los osteoblastos, por prevención de secreción de factor estimulante de los osteoclastos o por estimulación de la producción de un factor inhibidor de los osteoclastos(13).
Algunos autores han reportado que los bifosfonatos pueden causar apoptosis de los osteoclastos y osteoblastos in vitro e in vivo, recientemente se ha demostrado que pueden inhibir la adhesión de las células tumorales a la matriz ósea mineralizada y no mineralizada sin efecto sobre la adhesión celular normal(9,14).
Los bifosfonatos son productos seguros con pocos efectos colaterales que no son metabolizados por el cuerpo humano. Entre el 25 y 40% de una dosis intravenosa es excretada a través de los riñones y el resto es acumulado en el hueso. La duración media de los bifosfonatos en el hueso es muy larga(9,10).
El pamidronato es un bifosfonato de los llamados aminobifosfonatos que contienen un grupo amino primario lo que le da 100 veces más potencia que los que no lo contienen. Corrientemente, han demostrado ser efectivos en desórdenes clínicos asociados con reabsorción ósea incrementada. Enfermedad de Paget, hipercalcemia de malignidad, osteoporosis y metástasis ósea(10).
Durante el proceso de reabsorción ósea son liberados a la sangre, marcadores bioquímicos producto de la actividad de los osteoblastos y osteoclastos. Estas sustancias reflejan diferentes estadíos del proceso de reabsorción, su depuración metabólica y su sensibilidad son variables. La evaluación de los marcadores es basada en su capacidad para reflejar cambios en el metabolismo óseo inducido por drogas, permitiendo una medición no invasiva y secuencial del remodelado óseo(15,16,17).
La fosfatasa alcalina es el marcador clásico de formación ósea especialmente en pacientes con cáncer en ausencia de enfermedad hepática(17,18).
Durante la reabsorción ósea el hueso se desintegra en pequeñas fibras de colágeno y otras sustancias. Los colágenos cross-linked: Piridolina y Deoxipiridolina (DPD), han sido propuestos como marcadores más específicos del metabolismo óseo. La DPD puede ser usada como marcador alternativo de la hydroxyprolina, se excreta completamente en la orina y no es afectado por la dieta. Se ha sugerido que existe una relación entre el descenso de los niveles de moléculas cruzadas y mejoría en la respuesta subjetiva a tratamiento(19,20).
El calcio urinario ha sido usado tradicionalmente para evaluar la reabsorción ósea y es considerado el marcador de reabsorción ósea estándar en oncología, aun cuando no refleja exclusivamente la reabsorción ósea(20).
La medición del remodelado óseo por marcadores bioquímicos es el método más objetivo para evaluar el efecto de los bifosfonatos sobre el hueso(20).
El objetivo de este trabajo es evaluar la respuesta bioquímica (Calcio sérico, Calcio en orina de 24 horas, Fosfatasas Alcalinas y DPD) y clínica del Pamidronato endovenoso en la enfermedad metastásica ósea de cualquier primario.
PACIENTES Y MÉTODOS
Pacientes
Se realizó un estudio prospectivo, al azar, doble ciego, en el período de junio de 1998 a mayo de 1999, en el que se incluyeron 21 pacientes con enfermedad metastásica ósea procedentes del Hospital Oncológico Padre Machado y del Hospital General del Oeste, los cuales se distribuyeron aleatoriamente en tres grupos de pacientes para recibir el tratamiento con Pamidronato endovenoso (Aminomux®) y placebo, constituidos los grupos por: 8 pacientes en el grupo de 90 mg, 7 pacientes en el grupo de 60 mg y 6 pacientes en grupo placebo.
Criterios de inclusión:
1.Pacientes con enfermedad metastásica ósea demostrada por gammagrama óseo en los que se evidencia por lo menos una lesión metastásica.
2. Pacientes con estado mental adecuado para responder el test de calidad de vida.
Criterios de exclusión:
1. Pacientes que hayan recibido tratamiento con bifosfonatos por lo menos tres meses previos a la inclusión en el estudio.
2. Pacientes con enfermedad concurrentes: enfermedad ulcero-péptica, hepatopatía, enfermedad renal, hiperparatiroidismo y enfermedad de Paget.
3. Pacientes que reciban radioterapia un mes previo al estudio.
4. Expectativa de vida menor de 6 meses.
Diseño del estudio
Se realizó una historia clínica a cada paciente donde se incluían: diagnóstico, tratamiento recibido, dosis, laboratorio de rutina (hematología completa, glicemia, BUN, creatinina, electrolitos, funcionalismo hepático), y efectos secundarios del tratamiento.
Se realizaron controles de laboratorio al inicio del estudio, en la mitad (3 meses) y al final del mismo (6 meses), los cuales se realizaron en el Laboratorio Médico de Referencia. Las pruebas a determinar fueron:
1. Fosfatasas alcalinas
2. Calcio sérico
3. Calcio en orina de 24 horas
Los cuales se realizaron por método standard.
4. Deoxypiridolina en orina, la cual se realizó por método de radioinmunoensayo, con Kit Inmunolite (DPC, Diagnostic Products Corporation)(21).
Después de la evaluación inicial, los pacientes se distribuyeron aleatoriamente para recibir el tratamiento con Pamidronato endovenoso (Aminomux®) en dosis de 60 mg, 90 mg o placebo.
El tratamiento se colocó cada 4 semanas por 6 ciclos, en infusión en 500 cc de solución salina al 0,9% a pasar vía endovenosa en 2 horas.
En cada visita se realizó evaluación clínica y se registró cualquier modificación en el tratamiento anticanceroso, efectos colaterales y eventos esqueléticos.
Los pacientes respondieron el test de calidad de vida al inicio del estudio, en la mitad y al final del mismo siendo el test utilizado la Escala FACT-G(7,8), la cual consta de 33 preguntas que engloban aspectos relacionados con:
a. Bienestar físico.
b. Bienestar social y familiar.
c. Relación con su doctor.
d. Bienestar emocional.
e. Bienestar funcional.
Para su inclusión en el estudio todos los pacientes firmaron una carta de aceptación. Los mismos podían retirarse del estudio en el momento que lo desearan.
Método estadístico
Los resultados obtenidos fueron expresados en media aritmética, se aplicó "t" de Student para comparar cambios en las diferentes variables evaluadas en cada grupo independiente.
Se aplicó igualmente "t" de Student para la escala FACT-G, en relación al score total y la sub-escala de bienestar físico que evalúa intensidad del dolor.
RESULTADOS
El estudio se inició con 21 pacientes que fueron distribuidos en forma aleatoria en 3 grupos, 2 de tratamiento y uno placebo. Concluyeron el estudio 15 pacientes. Se retiraron 6 pacientes: 2 pacientes por cada grupo. En el grupo placebo los dos pacientes tenían Ca de mama, uno salió del estudio por fallecimiento por causa accidental y el otro por presentar síndrome ictero-obstructivo por recaída ganglionar. En el grupo de 60 mg de Pamidronato (Aminomux®) salieron del estudio 2 pacientes, uno con Ca de mama por fractura de fémur y otro con Ca de próstata falleció por cardiopatía isquémica, (Tabla 1 y 2).
Características demográficas
|
| Placebo Nº 6 | 60 mg Nº 7 | 90 mg Nº 8 |
| Sexo Femenino/Masculino |
5/1 |
5/2 |
5/3 |
| Edad | 56+/-10,05 | 52,28+/-2,77 | 58,87+/-9,09 |
| Diagnóstico | Mama 4 Transcicional de Vejiga 1 Melanoma 1 | Mama 5 Próstata 2 | Mama 3 Próstata 1 Hipernefroma 1 Pulmón 1 Cuello uterino 1 Parótida 1 |
| Tratamiento | Tamoxifen 2 Quimioterapia 1 Ninguno 1 | Etaconil 1 Nevernine 1 Quimioterapia 1 | Anastrazol 1 Quimioterapia 1 Ninguno 4 |
| Retiros | Síndrome ictero obstructivo Fallecimiento | Insuficiencia medular Retiro por petición familiar | Fractura de fémur Fallecimiento |
Evolución de los parámetros evaluados
|
|
| Placebo | 60 mg | 90 mg |
| Calcio sérico |
| Sin modificaciones | Sin modificaciones | Sin modificaciones |
| Calcio urinario | Basal | Sin modificaciones | Sin modificaciones | Sin modificaciones |
| Fosfatasas alcalinas (50.136 U/L) | Basal 1ra. 2da. | 102 Sin modificaciones | 181,84 156,08 133,24 | 129,86 Sin modificaciones
|
| Dehidropirolidona Corregida 2,3 ~ 7,4 nM | Basal 3 meses 6 meses | Normal | 34,125 11,96 10,79 | 10,72 9,076 7,79 |
En la evaluación de la respuesta clínica por medio de la Escala FACT-G, (Gráfico 1), la media del score general en el grupo de 90 mg de Pamidronato (Aminomux®) reportó 52,66; 51,83 y 53 al inicio, a los 3 y 6 meses, sin cambios estadísticamente significativos.
Escala FACT-G
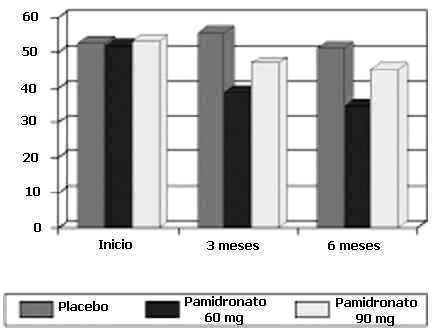
En el grupo de 60 mg de Pamidronato (Aminomux®) el score total reportó 51; 42,8 y 41,2 al inicio, 3 y 6 meses y en el grupo placebo los resultados en el score total fueron de 53,75; 55,45 y 51 al inicio, a los 3 y 6 meses.
El grupo que recibió 90 mg, en la sub-escala de bienestar físico reportó: 12; 7,16 y 5,33 respectivamente, se evidenció mejoría estadísticamente significativa (p 0,05). (Gráfico 2).
Sub-escala de bienestar físico
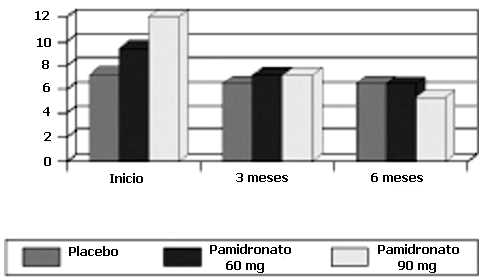
El que recibió 60 mg reportó 9,4; 7,2 y 6,4 respectivamente, sin cambios estadísticamente significativos durante el estudio. El grupo placebo reportó 7,25; 6,5 y 6,75; sin modificaciones estadísticamente significativas durante el estudio.
Tolerabilidad
De los 15 pacientes que completaron el estudio ninguno presentó efectos adversos relacionados con el tratamiento.
DISCUSIÓN
Estudios previos han reportado la eficacia de los bifosfonatos en el tratamiento de la morbilidad esquelética y en la mejoría de la calidad de vida de los pacientes con cáncer y metástasis óseas, en especial del cáncer de mama. En el presente estudio se buscó evaluar si los hallazgos descritos pueden ser reproducidos en los pacientes que sufren cáncer metastásico de otros primarios.
Al evaluar los cambios en los grupos de tratamiento y sus efectos a nivel de marcadores óseos evidenciamos que no hay modificación significativa en el calcio sérico si comparamos con estudios con bifosfonatos en pacientes con cáncer y metástasis óseas como el realizado por Lipton, et al en 1994 con 61 pacientes con cáncer de mama que recibieron tratamiento con pamidronato a dosis de 30 y 60 mg donde se evidenció un descenso del calcio sérico en los pacientes tratados(22). Hallazgos similares fueron reportados por Hortobagyi en 1996 que evaluó la eficacia del pamidronato en 380 pacientes de los cuales 185 recibieron pamidronato 90 mg y 195 placebo(23) al igual que en 1996, Berenson publicó resultados de un estudio doble ciego con 392 pacientes que recibieron pamidronato a dosis de 90 mg con los mismos resultados(24). Esto puede ser explicado por el estricto mecanismo de regulación de los niveles de calcio sérico por la parathormona (PTH) que no permite variaciones mayores de 0,025 mmol/1 de este ión en sangre(20).
Hallazgo similar fue registrado en las determinaciones de calcio urinario, los cuales concuerdan con los resultados publicados en otros estudios, en los que se compararon controles normales con pacientes con cáncer metastásico sin mostrar elevación significativa de calcio urinario entre los pacientes con cáncer(20,25). Lo que contrasta con los resultados reportados en los estudios anteriormente mencionados donde se evidenció un descenso en el calcio urinario(23,24,26). Esto puede explicarse porque su determinación se encuentra influenciada por diversos factores como son la dieta, función renal, hormona parotiroidea y este parece reflejar el balance del retorno óseo más que un marcador de reabsorción ósea específicamente y por lo tanto no parece ser un marcador sensible de reabsorción ósea(20).
El marcador de formación ósea evaluado fue la fosfatasa alcalina. Se encontró al inicio del estudio elevada en 33,33% de los pacientes, lo que concuerda con otros estudios que reportan niveles elevados de fosfatasas alcalinas en 50% o menos de los pacientes con cáncer y metástasis ósea(13,14). Durante el estudio hubo un descenso de los valores en los pacientes del grupo de 60 mg que no fue estadísticamente significativo, esto se correlaciona con estudios realizados en pacientes con metástasis óseas que recibieron pamidronato(23,24,26) y que pueden explicarse por el efecto farmacológico del medicamento, como inhibidor de la actividad osteoclástica(20).
El 66,66% de los pacientes del estudio presentaron niveles de deoxipiridolina por encima del rango normal, durante el mismo hubo descenso de los valores en los grupos tratamiento en comparación con los pacientes que recibieron placebo, aunque este descenso no fue estadísticamente significativo, lo que coincide con un estudio realizado con pacientes tratados con pamidronato y placebo(15), y se contradice con otros estudios realizados en pacientes con cáncer tratados con pamidronato y placebo en los que se evidenció un descenso significativo en el grupo tratado(28,20,27). Esta discrepancia puede deberse al tamaño de la muestra y al hecho que la deoxipiridolina es un marcador de alta especificidad pero de baja sensibilidad(18).
Al evaluar la respuesta clínica al tratamiento a través de la Escala FACT-G, el score total no mostró diferencias estadísticamente significativas. Cuando se evaluó la subescala de bienestar físico, que incluye la intensidad del dolor, se evidenció cambios significativos en la misma en el grupo tratado con 90 mg de pamidronato. Hallazgo este semejante a estudios que evalúan la respuesta sintomática en pacientes con cáncer y metástasis óseas que reciben pamidronato(9,20,23,24,26,27,28,29). Pero no podemos hacer comparaciones con otros estudios debido a que existen una gran cantidad de escalas para la evaluación de calidad de vida y de respuesta al tratamiento que limitan la comparación con otros estudios y al mismo tiempo entre los mismos estudios reportados, además es importante recordar que el concepto de calidad de vida es multifactorial y abarca aspectos variados como son bienestar familiar, social entre otros, sobre las cuales no se actuó.
CONCLUSIONES
En el presente estudio se pudo evidenciar que el Pamidronato a dosis de 90 mg cada 4 semanas por vía endovenosa produjo mejoría clínica, evaluada por la subescala de bienestar físico, aunque no se registró descenso estadísticamente significativo en los marcadores de reabsorción ósea.
Esto nos hace pensar que el Pamidronato puede ser utilizado como tratamiento coadyuvante del dolor en pacientes no solo con cáncer de mama metastásico, sino en pacientes con cáncer metastásico de cualquier primario.
REFERENCIAS BIBLIOGRÁFICAS
1. González J, Ascunce E. Epidemiología y Prevención en: Farreras P, Rozman C. Medicina Interna. Editorial Mosby – Doyma Libros, S.A. España. 1995; 1138-1141. [ Links ]
2. Murphy G, Laurence W, Lenhard R. Oncología Clínica Manual de la American Cancer Society. 2da Ed. Organización Panamericana de la Salud 1996; 559. [ Links ]
3. Organización Mundial de la Salud. Alivio del dolor en Cáncer con guía sobre la disponibilidad de opioides. Ginebra 1996. [ Links ]
4. Quality of life and clinical trials (Editorial). Lancet 1995; 346:1-2. [ Links ]
5. Cella DF, Tulsky D, Gray G, Sarafian B, Linn E, Bonomi A, et al. The Functional Assessment of Cancer Therapy Scale: Development and Validation of the General Measure. J Clin Oncol 1993; 11(3): 570-579. [ Links ]
6. Winstead – Fly P and Schultz A. Psychometric Analysis of the Functional Assessment of Cancer Therapy - General (FACT-G) Scale in a Rural Sample. Cancer 1997; 79 (12): 2446-2452. [ Links ]
7. McMillan S. Quality- of- life Assessment in Palliative Care. Cancer Control. J. 1996; 3(3): 15-20. [ Links ]
8. Hirte HW, Major PP and Singh G. Bone metastases: A review of their pathogenenesis. Current Oncology 1998; 5(3): 21-22. [ Links ]
9. Fulfaro F, Casuccio A, Ticozzi C and Ripamonti C. The role of bisphosphonates in the treatment of painful metastasic bone disease: a review of phase III trials. Pain 1998; 78: 157-169. [ Links ]
10. Rogers M, Watts D and Rusell G. Overview of Bisphosphonates. Cancer 1997; 80(Suppl 8): 1652-1660. [ Links ]
11. Boddy JJ, Burckhardt P, Bartl R, Delmas P, Diel IJ, Kanis JA, et al. Current Use of Bisphosphonates in Oncology. J Clin Oncol 1998; 116(12): 3890-3899. [ Links ]
12. Fleisch H. Biphosphonates. Pharmacology and Use in the treatment of tumor –induced hypercalcemic and metastatic bone disease. Drugs 1991; 42: 919-944. [ Links ]
13. Sahni M, Guenther HL, Fleisch H, Collin P and Martin TJ. Bisphosphionates Act on Rat Bone resorting through the mediation of osteoblast. J Clin Invest 1993; 91: 2004-2011. [ Links ]
14. Van der Pluijm G, Vloedgraven H, Van Beek E, Van der Wee-pals L, Löwik C and Papapulos S. Bisphosponates Inhibit the Adhesión of Breast Cancer Cells to Bone Matrices in Vitro. J Clin Invest 1996; 98(3): 698-705. [ Links ]
15. Martínez ME, Del Campo MT, Plaza MA, Torrijos A, Gijón J. Pamidronate and biochemical markers of bone turnover. Scand J Clin Lab Invest 1997; 57: 581-586. [ Links ]
16. Hanson D, Weis MA, Bollen AM, Maslan SL, Singer F, Eyre DA. Specific Immunoassay for Monitoring Human Bone Resoption: Quantitation of Type I Collagen Cross-Linked N. Telopeptides in Urine. J Bone Mineral Res 1992; 17(11): 1251-1258. [ Links ]
17. Body J, Dumon J, Blocklet D, Darte C. The bone isoenzime of alkaline phosphatase in Hypercacaemic Cancer Partiens. Eur J Cancer 1997; 33(10): 1578-1582. [ Links ]
18. Delmas P. Biochemical Markers for the Assessment of Bone turnover. Lippinvott-Raven Publishers, 2da Ed. Philadelphia. 1995; p315. [ Links ]
19. Lipton A, Demers L, Curley E, Chinchilli V, Gaydos L, Hortobagyi G, et al. Markers of Bone Resorption in Patients Treated with Pamidronate. Eur J Cancer 1998; 34(13): 2021-2026. [ Links ]
20. Winholes J, Guo C-Y, Purohit OP, Coleman RE. Metabolic Effects of Pamidronate in Patients with Metastasic Bone Disease. Br J Cancer 1996; 74: 1089-1095. [ Links ]
21. Diagnostic Products Corporation. Inmulite Pyilinks – D. Los Ángeles, 1997. [ Links ]
22. Lipton A, Glover D, Harvey H. Pamidronate in the treatment of bone metastases: results of 2 dose-ranging trials in patients with breast or prostate cancer. Ann Oncol 1994; 5: S31-S35. [ Links ]
23. Hortobagyi GN, Theriault RL, Porter L, Blayney D, Lipton A, Sinoff C, et al. Efficacy of Pamidronate in reducing skeletal complications in patients with breast cancer and lytic bone metastases. N Engl J Med 1996; 335: 1785-1791. [ Links ]
24. Berenson JR, Lichtenstein A, Porter L, Dimipoulos M, Bordoni R, George S, et al. Efficacy of Pamidronate in reducing skeletal events in patients with advanced multiple myeloma. N Engl J Med 1996; 334: 488-493. [ Links ]
25. Percherstorfer M, Ludwing H, Zimmer-Roth. The diagnostic value or Urinary Pyridium Cross – Lingks of Collagen, Alkalline Phosphatase and Urinary Calcium Excretion in Neoplastic Bone Disease. J Clin Endocrino Metab 1995; 80: 97-103. [ Links ]
26. Conte PF, Latreille J, Mauriac L, Calabresi F, Santos R, Campos D, et al. Delay in Progresison of Bone Metastases in Breast Cancer Patients Treated with Intravenous Pamidronate: Results From a Multinational Randomized Trial. J Clin Oncol 1996; 14 (9): 2552-2559. [ Links ]
27. Body JJ, Dumon JC, Gineyts E, Delmas PD. Comparative evaluation of Markers of Bone Resoption in Patients with Breast Cancer-induced Osteolysis Before and After Bisphosphonates Therapy. Br J Cancer 1997; 75(3): 408-412. [ Links ]
28. Hortobagyi G, Theriault R, Lipton A, Porter L, Blaney D, Sinoff C, et al. Long-Term Prevention of Skeletal Complications of Metastatic Breast Cancer with Pamidronate. J Clin Oncol 1998; 16(6): 2038-2044. [ Links ]
29. Theriault R, Lipton A, Hortobagyi G, Leff R, Glück S, Stewward J, et al. Pamidronate Reduces Skeletal Morbidity in Women with Advanced Breast Cancer and Lytic Bone Lesions: A Randomized, Placebo – Controlled Trial. J Clin Oncol 1999; 17(3): 846-854. [ Links ]













