Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT v.23 n.1 Caracas 2004
El Sistema Nervioso Simpático Cerebral y la natriuresis inducida por la administración central de endotelinas
A Israel1, E Díaz1, E Camacho1, OM Torres1 y M Pastorello1.
1 Facultad de Farmacia, Laboratorio de Neuropéptidos, Universidad Central de Venezuela.
E-mail: astern88@hotmail.com
RESUMEN
Se evaluó el papel de los receptores a1- a2- y b-adrenérgicos cerebrales en la acción renal de las endotelinas (ETs). La administración intracerebroventricular (ICV) de ETs a ratas macho conscientes resultó en un incremento en la excreción urinaria de sodio a la 1, 3 y 6 horas del período de recolección de orina. La administración ICV de prazosin, un antagonista selectivo del receptor a1-adrenérgico, inhibió la respuesta natriurética de las ETs-ICV. Por el contrario, el pretratamiento central con yohimbina (un antagonista del receptor a2-adrenérgico) o con atenolol (un antagonista del receptor b1-adrenérgico) no alteró significativamente la respuesta urinaria a la ET-ICV. Nuestros resultados demuestran que las endotelinas cerebrales se encuentran involucradas en los procesos que regulan el balance electrolítico e indican que el sistema nervioso simpático cerebral, a través del receptor a1-adrenérgico, participa en la acción natriurética de las ETs.
Palabras Clave: Excreción de sodio, Endotelina, Intracerebroventricular, Receptores adrenérgicos.
ABSTRACT
Experiments were conducted to investigate the role of brain the a1- a2 and b-adrenergic receptors on the renal effects elicited by central injection of ETs. Cerebroventricular administration of endothelins (ETs) to conscious male hydrated rats resulted in an increase in urinary sodium excretion at 1, 3 and 6 hr period of urine collection. Central administration of prazosin (an a1-adrenergic receptor antagonist) inhibited the increase in sodium and urine excretion induced by ICV-ETs. Yohimbine (an a2-adrenergic receptor antagonist) or atenolol (an b-adrenergic receptor antagonist) did not altered the urinary response to ET-IVT. Our results demonstrate a role for brain endothelin in the regulation of electrolyte balance and indicate that the sympathetic nervous system, through the a1-adrenergic receptor subtype, is involved in the natriuretic action of ETs.
Key Words: Sodium excretion, Endothelin, Cerebroventricular, Adrenergic receptors.
INTRODUCCIÓN
Las endotelinas forman parte de una familia de péptidos vasoactivos, estructuralmente constituidos por 21 aminoácidos que presentan en su estructura dos puentes disulfuro. Se han descrito tres isoformas de endotelinas (ET-1, ET-2 y ET-3), las cuales están ampliamente distribuidas. También forman parte de esta familia, el péptido Constrictor Intestinal Vasoactivo (aislado del genoma del ratón y presente en el intestino del mismo) y el grupo de las Sarafotoxinas (a, b, c, y d) aisladas todas ellas del veneno de una serpiente israelí (Atracttaspis enggadensis)(1,2).
Las ETs ejercen un amplio espectro de acciones. Se sabe que las ETs son potentes vasoconstrictores tanto in vivo como in vitro(1,3). En vasos sanguíneos aislados, producen una contracción de larga duración, siendo la ET-2 la isoforma que presenta mayor potencia (ET-2>ET-1>ET-3)(1,3,4). La respuesta presora produce un incremento generalizado de la resistencia vascular periférica e incremento de la presión arterial, que se asocia a un incremento en la resistencia vascular coronaria y disminución del gasto cardíaco(5). Sin embargo, cuando son inyectadas en la circulación, producen inicialmente un efecto vasodepresor transitorio, seguido de una respuesta vasopresora sostenida; se ha sugerido que este efecto vasodilatador inicial es mediado por liberación de óxido nítrico y de prostaciclina(6).
Estas acciones de las endotelinas, sugieren la existencia de subtipos de receptores. En efecto, se ha demostrado que las ETs ejercen sus efectos mediante la interacción con, al menos, dos subtipos de receptores caracterizados bioquímicamente, para los cuales han sido clonados sus ADNc(7,8,9). Estos subtipos de receptores han sido clasificados de acuerdo a su especificidad por ligandos: el receptor ETA que presenta mayor afinidad por ET-1 y ET-2 que por ET-3, localizado en las células del músculo liso vascular donde ejerce su efecto constrictor e involucrado en las acciones de las ETs en la pituitaria anterior, y el receptor ETB, que presenta igual afinidad por las tres isoformas de ETs, predominantemente localizado en las células endoteliales vasculares y está relacionado con la vasodilatación a través de la liberación de óxido nítrico(8,9,10,11).
Parte de las acciones de las endotelinas podrían estar mediadas a través del sistema nervioso central. En efecto, se ha descrito la presencia de neuronas que contienen inmunorreactivadad para ETs en diferentes estructuras cerebrales(12,13,14) siendo mayor la concentración en áreas hipotalámicas(15). Adicionalmente, se ha identificado el ARNm para las ETs en áreas del sistema nervioso central (SNC) y en la glándula pituitaria, así como la presencia de receptores para el péptido(14,16,17,18,19).
Mediante técnicas de hibridización in situ se ha reportado la presencia de ARNm para la ET-1 y la ET-3 en diferentes regiones del cerebro de la rata, y esta evidencia se acompaña de la presencia de inmunorreactividad para la ET-1 en neuronas y células gliales(16,20). Yoshizawa y colaboradores(15) han mostrado la presencia de inmunorreactividad para ET en neuronas de los núcleos supraóptico y paraventricular y en sus axones que proyectan hacia la neurohipófisis, así como la presencia de ARNm para ET-1 en neuronas del núcleo paraventricular de porcino y de rata. Adicionalmente, se ha demostrado la existencia de actividad de enzima convertidora de endotelinas (ECE)(21) y la presencia de ARNm para la ECE-1 y la ECE-2 en neuronas localizadas en diferentes regiones de cerebro(22,23). La ECE-2 predomina en el hipotálamo y en núcleos catecolaminérgicos, mientras que la ECE-1 se localiza preferencialmente en núcleos talámicos(22,24).
Mediante autorradiografía se ha demostrado la presencia de alta densidad de sitios de unión para ETs en órganos circunventriculares como la eminencia media del hipotálamo, el órgano subfornical y los plexos coroideos y en áreas localizadas dentro de la barrera hematoencefálica tales como los núcleos talámicos e hipotalámicos, la región lateral ventricular, el globo pallidus y el caudado-putamen(20,25). Adicionalmente, se ha reportado la presencia de ARNm y la expresión de ambos subtipos de receptores, ETA y ETB en diferentes regiones del cerebro(20,26).
La localización de estos receptores en el sistema nervioso central en áreas relacionadas con el control del balance hidromineral y la secreción de vasopresina sugiere un papel de las ETs en la regulación de la homeostasis de los fluidos y electrolitos(27,28). Interesantemente, mucho de los sitios donde se encuentran presentes los receptores para las ETs también contiene alta densidad de receptores para el péptido natriurético auricular(29,30) y angiotensina II(31). Esta coincidencia de receptores para tres péptidos diferentes, apoya la idea del papel de las ETs en el control de la secreción de vasopresina, la ingesta de agua y sal, y la regulación de la presión arterial(32). Así, la privación de agua induce la liberación de ET desde la neurohipófisis, lo que sugiere un papel potencial de este polipéptido en la homeostasis del volumen(15). Aun más, la administración ICV de ET incrementa la presión arterial(33), la liberación de arginina-vasopresina, oxitocina y del péptido péptido natriurético auricular(17,29,33,34), activa el sistema nervioso simpático(33) e incrementa la excreción urinaria de sodio(34). Se ha especulado que la natriuresis inducida por las ETs resulta de la activación del sistema natriurético cerebral, la cual es seguida de un incremento en la liberación de PNA desde el corazón y el cerebro hacia la circulación(34).
Se ha demostrado una relación anatómica y funcional entre las endotelinas y las catecolaminas cerebrales. En efecto, se ha mostrado la presencia de una alta inmunoreactividad para la enzima convertidora de endotelina (ECE) en el locus coeruleus, lo que sugiere la co-localización con norepinefrina. El análisis inmunohistoquímico ha demostrado que la ET-1 y la tirosina-hidroxilasa, la enzima limitante en la síntesis de catecolaminas, se encuentran co-localizadas en algunas neuronas hipotalámicas y en la amígdala. Adicionalmente, se ha demostrado que los niveles hipotalámicos de ET-1 y el metabolito de las catecolaminas 3-metoxi-4-hidroxi-fenilglicol (MHPG) se incrementan en ratones salvajes sometidos a estrés, mientras que los niveles de MHPG no se alteran en los ratones con deleción del gen que codifica para ET-1; lo que sugiere que la ET-1 es capaz de modular la coordinación central de la respuesta al estrés asociada al metabolismo de catecolaminas(35).
Se sabe que la ET-3 es capaz de liberar dopamina desde el estriado, sin embargo los efectos de las ETs sobre la síntesis y liberación de catecolaminas, así como la posible interacción entre estos dos sistemas cerebrales en la regulación de los fluidos corporales y el metabolismo electrolítico aun se desconocen. Es por ello, que mediante el uso de antagonistas selectivos de los receptores adrenérgicos cerebrales, como lo son el prazosin, la yohimbina y el atenolol, evaluamos la posible participación del sistema nervioso simpático central en la natriuresis inducida por la administración ICV de ETs.
MATERIALES Y MÉTODOS
Se utilizaron ratas macho de la cepa Sprague-Dawley, de 180 a 220 g de peso corporal procedentes del Bioterio de la Facultad de Farmacia de la UCV, las cuales fueron mantenidas con agua y alimento estándar para animales de laboratorio (Ratarina®) a libre demanda hasta el día de los experimentos. Bajo anestesia con pentobarbital sódico (40 mg/kg, i.p.), a los animales se les colocó una cánula en el ventrículo lateral izquierdo con la ayuda de un aparato estereotáxico (David Kopf Instruments®)(36). Tres días después de la canulación ventricular, los animales fueron distribuidos al azar en los siguientes grupos experimentales: (I) Tres grupos de ratas que recibieron: ET-1 (5 pmol/5 ml); ET-3 (50 pmol/5 ml) o vehículo (V) (0.9% NaCl, 5 ml), en forma de bolo. (II) Otro grupo de ratas fueron divididas en los siguientes grupos: pretratadas con prazosin (381 ng/5 ml, ICV), yohimbina (191 ng/5 ml), atenolol (2.25 mg/10 ml) o solución salina (5 o 10 ml, ICV). Se administró un solo antagonista por animal y los pre-tratamientos se efectuaron media hora antes de ICV-ETs o salina. A las 09:00 hrs, un tercio de las ratas que recibieron cada uno de los tratamientos fueron inyectadas con ET-1, ET-3 o solución salina. Inmediatamente después los animales recibieron una carga oral de agua (20 ml/kg) y fueron colocados en jaulas metabólicas para la recolección de orina a las 1, 3 y 6 hrs; a las 6 horas la vejiga fue vaciada mediante masaje suprapúbico. Los animales no tuvieron acceso al agua o alimento durante el experimento. Al finalizar cada experimento, se confirmó la canulación ICV mediante la administración de 5 ml del colorante Fast Green® (Sigma Chemicals Co. MO, USA). Sólo se utilizaron los datos de aquellos animales en los que se distribuyó uniformemente el colorante en los ventrículos laterales, en el tercer y cuarto ventrículos. Se determinó la cantidad de sodio en las muestras de orina recolectadas mediante fotometría de llama. Los resultados se expresaron en mEq/100 g de rata.
Los datos se presentan como las medias ± E.S.M. Las diferencias estadísticas entre los grupos fueron evaluadas mediante el análisis de varianza de una o dos vías (ANOVA) y la prueba de Newman-Keul.
RESULTADOS
Efecto de la administración ICV de endotelinas sobre la excreción urinaria de sodio
Los efectos de la administración central de ET-1 o ET-3 sobre la excreción urinaria de sodio en ratas se muestra en la figura 1. La administración intracerebroventricular de ETs aumenta la excreción urinaria de sodio a la hora (p<0.05), a las 3 horas (ET-1 (p<0.05) y ET-3 p<0.01) y a las 6 horas (ET-2 (p< 0.001) y ET-3 p<0.01) de recolección.
Excreción urinaria de sodio inducida por la administración intracerebroventricular de ET-1 y ET-3
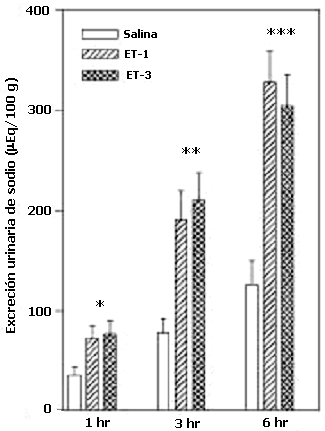
Las ratas fueron inyectadas ICV con ET-1, ET-3 o solución salina (NaCl 0.9%). Se recolectaron muestras de orina a las 1, 3 y 6 hrs (N= 7-12, por grupo). Los valores representan las medias ± ESM. *p< 0.05, **p<0.01 y ***p<0.001.
Efecto del pretratamiento intracerebroventricular con prazosin, yohimbina o atenolol sobre el incremento en la excreción urinaria de sodio inducida por las ETs-ICV
El análisis de varianza de dos vías y la prueba de Newman-Keul reveló que el antagonista del receptor a1-adrenérgico, prazosin, inhibe la natriuresis inducida por la ET-1 y la ET-3, a los tres períodos de recolección de las muestras de orina (p< 0.01) (Figura 2). Los efectos de la administración central de yohimbina se la muestra en la figura 3. Como se puede observar, la acción natriurética de ET-1 o ET-3-ICV no fue alterada significativamente por la administración central de los antagonistas de los receptores a2-adrenérgicos durante la 1 y 3 horas; sin embargo a las 6 horas en los animales pretratados con YOH, se observó una reducción significativa en el incremento de la excreción de sodio inducida por la ETs. Adicionalmente se observó que la yohimbina incrementó la excreción basal de sodio a las 6hrs. En la figura 4 se muestra el efecto del pretratamiento con el antagonista del receptor b1-adrenérgico, atenolol. El bloqueo central de los receptores b1-adrenérgicos no afectó significativamente la excreción basal de sodio urinario, ni la respuesta natriurética a las ETs.
Efecto de la administración central de prazosin sobre la excreción urinaria de sodio
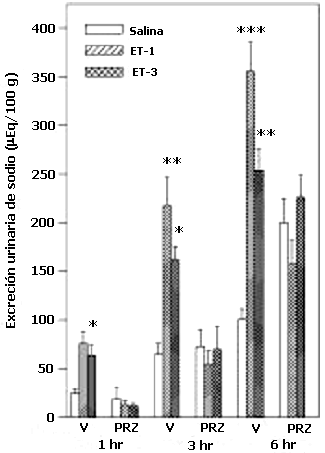
Un grupo de ratas fueron tratadas ICV con prazosin (PRZ) o vehículo (V). Media hora después, un tercio de cada grupo recibió ET-1, ET-3 o solución salina (NaCl 0.9%), seguido de una carga oral de agua (20 ml/kg). Las muestras de orina fueron recolectadas a las 1, 3 y 6 hrs (N= 16-24, por grupo). Los datos son las medias ± ESM. *p< 0.05, **p<0.01 y ***p<0.001.
Efecto de la yohimbina-ICV sobre la excreción urinaria de sodio
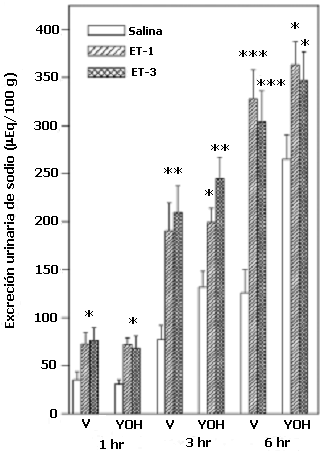
Un grupo de ratas fueron tratadas con yohimbina (YOH) o vehículo (V). Media hora después, un tercio de cada grupo recibió ET-1, ET-3 o solución salina (NaCl 0.9%). Las muestras de orina fueron recolectadas a las 1, 3 y 6 hrs (N= 12-20, por grupo). Los datos son las medias ± ESM. *p< 0.05, **p<0.01 y ***p<0.001.
Efecto del bloqueo central de los receptores b1-adrenégicos sobre el incremento de excreción urinaria de sodio
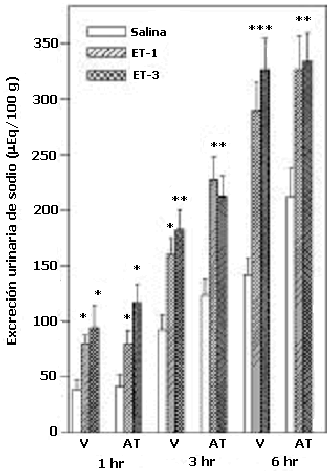
Un grupo de ratas fueron tratadas con atenolol (AT) o solución salina como vehículo (V). Media hora después, un tercio de cada grupo recibió ET-1, ET-3 o solución salina (NaCl 0.9%), seguido de 20 ml/kg de agua, por vía intragástrica. Las muestras de orina fueron recolectadas a las 1, 3 y 6 hrs (N= 12-20, por grupo). Los datos son las medias ± ESM. *p< 0.05, **p<0.01 y ***p<0.001.
DISCUSIÓN
Además de los efectos presores y neuroendocrinos de las endotelinas, se ha observado que la administración de endotelinas al sistema nervioso central afecta marcadamente la hidratación corporal. En efecto, nuestros resultados muestran claramente que la administración ICV de ET-1 y ET-3 aumenta significativamente la excreción de sodio urinario. Estos hallazgos confirman estudios previos en los que se demuestra que la infusión ICV de ET-3 al área ventrolateral del tercer ventrículo (AV3V) produce una rápida liberación de PNA, la cual presumiblemente induce la natriuresis(37) y apoya el concepto que el sistema endotelinérgico cerebral defiende al organismo frente a estados de hipernatremia.
Se ha postulado que el efecto natriurético de las endotelinas se debe exclusivamente a la capacidad de las endotelinas de liberar PNA(34). Esto se sustenta por el hecho que el incremento de los niveles plasmáticos de PNA inducidos por la expansión de volumen es similar al observado por la administración de ET-3(38). Aun más, se ha demostrado previamente que el sistema PNA neuronal cerebral juega un papel importante y esencial en la producción de natriuresis inducida por la expansión de volumen.
Se desconocen los posibles sistemas cerebrales involucrados en la acción natriurética de las endotelinas. La evidencia sugiere que la ET-1 y ET-3 actúan como neurotransmisores o neuromoduladores dentro del SNC y soporta los hallazgos que muestran una interacción directa entre las endotelinas y las neuronas cerebrales. La interrelación anatómica y funcional entre las endotelinas y el sistema noradrenérgico cerebral apunta a la posible participación de éstos últimos en las acciones renales de las endotelinas. Así, se ha demostrado la existencia de una alta densidad de receptores para ET en las neuronas catecolaminérgicas en el hipotálamo y en el locus coeruleus(39,40) y que la ET-1 induce la liberación de dopamina, mediada por el receptor ETB, en el estriado de la rata(41). Además, la ET-3 evoca la liberación de catecolaminas desde rebanadas de cerebro cortical y estriatal(42). Recientemente se ha demostrado un efecto modulador excitatorio de la ET-1 y ET-3 sobre la liberación de norepinefrina desde el hipotálamo posterior, a través de la estimulación de receptores ETA/ETB atípicos(43), lo que sugiere un papel de las ETs en la regulación cardiovascular y electrolítica. Nuestros resultados, en los que se muestra que la inyección ICV de prazosin inhibe completamente la respuesta natriurética a la administración central de la ET-1 y la ET-3, mientras que el bloqueo de los receptores a2- o b1-adrenérgicos no produce cambios significativos en el incremento de la excreción de sodio urinario producido por las endotelinas, contribuye a sustentar el concepto que las catecolaminas cerebrales median, al menos en parte, la acción renal de las ETs, a través de la estimulación del receptor a1-adrenérgico. El sitio exacto de acción de las ETs en el SNC para producir la natriuresis no se puede establecer a partir de nuestros resultados. Sin embargo al respecto se sabe que las drogas al ser administradas dentro de los ventrículos cerebrales actúan predominantemente sobre las estructuras periventriculares como lo son el hipotálamo y la superficie ventral del bulbo raquídeo(44). Adicionalmente, se ha implicado al órgano subfornical, al área postrema, al núcleo del tracto solitario(45), al hipotálamo(46) y a la superficie ventral del bulbo(47), en las acciones cardiovasculares e hidrominerales de la endotelina.
En conclusión, la administración central de ET-1 y ET-3, produce un incremento de la excreción urinaria de sodio, mediada por la posible liberación de catecolaminas y la estimulación de los receptores a1-adrenérgicos cerebrales.
AGRADECIMIENTOS
Este trabajo fue subvencionado por el FONACIT y la Facultad de Farmacia, Universidad Central de Venezuela.
REFERENCIAS BIBLIOGRÁFICAS
1.Yanagisawa M, Inoue A, Ishikawa T, Kasuya Y, Kimura S, Kumagaye S, Nakajima K, Watanabe TX, Sakakibara S, Goto K. Primary structure, synthesis, and biological activity of rat endothelin, an endothelin derived vasoconstrictor peptide. Proc Natl Acad Sci USA 1988; 85: 6964-67. [ Links ]
2. Rubanyi GM, Polokoff MA. Endothelins: molecular biology, biochemistry, pharmacology, physiology, and pathophysiology. Pharmacol Rev 1994; 46: 325-415. [ Links ]
3. Yanagisawa M, Kurihara H, Kimura S, Tomobe Y, Kobayashi M, Mitsui Y, Yazaki Y, Goto K, Masaki T. A novel potent vasoconstrictor peptide produced by vascular endothelial cells. Nature 1988; 332: 411-15. [ Links ]
4. Inoue A, Yanagisawa M, Kimura S, Kasuya Y, Miyauchi T, Goto K, Masaki T. The human endothelin family: three structurally and pharmacologically distinct isopeptides predicted by three separate genes. Proc Natl Acad Sci USA 1989; 86: 2863-67. [ Links ]
5. Miller WJ, Redfield MM, Burnett JC. Integrated cardiac, renal and endocrine actions of endothelin. J Clin Invest 1989; 83: 317-20. [ Links ]
6. De Nucci G, Thomas R, D´Orleans-Juste P, Antunes E, Walder C, Warner T y Vane J. Pressor effects of circulating endothelin are limited by its removal in the pulmonary circulation and by the release of prostacyclin and endothelium-derived relaxing factor. Proc Natl Acad Sci USA 1988; 85: 6767-6800. [ Links ]
7. Arai H, Hori S, Aramori I, Ohkudo H, Nakanishi S. Cloning and expression of a cDNA encoding an endothelin receptor. Nature 1990; 348: 730-35. [ Links ]
8. Bard K, Munger K, Sugiura M, Snajdar R, Schwartzberg M, Inagami T, High and low affinity binding sites for endothelin on cultured rat glomerular mesangial cells. Biochem Biophys Res Commun 1989; 178: 656-63. [ Links ]
9. Sakurai T, Yanagisawa M, Takuwa Y, Miyasaki H, Kimura S. The ETA receptor, a new binding site for the endothelins isoformes. Nature 1990; 348: 730-32. [ Links ]
10. Davenport A. International Union of Pharmacology. XXIX. Update on endothelin receptor nomenclature. Pharmacol Rev 2002; 54: 219-226. [ Links ]
11. Masaki T, Vane J, Vanhoutte P. International Union of Pharmacology Nomenclature of endothelin receptors. Pharmacological Rev 1994; 46: 137-42. [ Links ]
12. Matsumoto H, Suzuki N, Onda H, Fujino M. Abundance of endothelin-3 in rat intestine, pituitary gland and brain. Biochem Biophys Res Commun 1989; 164: 74-80. [ Links ]
13. Yoshimi H, Hirata Y, Fukuda Y, Kawano Y, Emori T, Kuramochi M, Omae T, Marumo F. Regional distribution of immunorreactive endothelin in rats. Peptides 1989; 10: 805-8. [ Links ]
14. Lee M, de la Monte S, Bloch K, Quertermous T. Expression of the potent vasoconstrictor endothelin in the human central nervous system. J Clin Invest 1990; 86: 141-47. [ Links ]
15. Yoshizawa T, Shinmi O, Giaid A, Yanagisawa M, Gibson SJ, Kimura S, Uchiyama Y, Polak JM, Masaki T, Kanazawa I. Endothelin a novel peptide in the posterior pituitary system. Science 1990; 247: 462-64. [ Links ]
16. MacCumber M, Ross C, Snyder S. Endothelin in brain: receptors, mitogenesis and biosynthesis in glial cells. Proc Natl Acad Sci USA 1990; 87: 2358-63. [ Links ]
17. Samson WK, Skala KD. Alexander BD, Steven F. Possible neuroendocrine actions of endothelin-3. Endocrinology 1991; 128: 1465-1573. [ Links ]
18. Takahashi K, Ghatei M, Jones P, Murphy J, Lam H, OHalloran A, Bloom S. Endothelin in human brain and pituitary gland: presence of immunorreactive endothelin, endothelin messenger ribonucleic acid, and endothelin receptor. J Clin Endocrinol Metab 1991; 72: 693-99. [ Links ]
19. Mortensen L. Endothelin and the central and peripheral nervous system: A decade of endothelin research. Clin Exp Pharmacol Physiol 1999; 26: 980-84. [ Links ]
20. Kuwaki H, Cao W, Kumada M. Endothelin in the brain and its effect on central control of the circulation and other function. Japan J Physiol 1994; 44: 1-18. [ Links ]
21. Warner TD, Mitchell JA, D´Orleans-Juste P, Ishii K, Forstermann U, Murad F. Characterization of endothelin-converting enzyme from endothelial cells and rat brain: detection of formation of biologically active endothelin-1 by rapid bioassay. Mol Pharmacol 1992; 41: 399-403. [ Links ]
22. Sluck J, Lin R, Katolik L, Jeng A, Lehmann J. Endothelin converting enzyme-1, endothelin-1 and endothelin-3-like immunoreactivity in the rat brain. Neuroscience 1999; 91: 1483 – 97. [ Links ]
23. Nakagomi S, Kiryu-Seo S, Kiyama H. Endothelin-converting enzymes and endothelin receptor B messenger RNAs are expressed in different neural cell species and these messenger RNA are coordinately induced in neurons and astrocytes respectively following nerve injury. Neuroscience 2000; 101: 441-49. [ Links ]
24. Kurokawa K, Yamada H, Liu Y, Kudo M. Immunohistochemical distribution of the endothelin-converting enzime-1 in the rat hypothalamo-pituitary axis. Neuroscience Letters 2000; 284: 81-4. [ Links ]
25. Koseki C, Imai M, Hirata Y, Yanagisawa A, Masaki MT. Binding sites for endothelin-1 rat tissues: an autoradiographic study. J Cardiovasc Pharmacol 1989; 13: S153-S154. [ Links ]
26. Hori S, Komatsu Y, Shigemoto R, Mizuno N, Nakanishi S. Distinct tissue distribution and cellular localization of two messenger ribonucleic acids encoding different subtypes of rat endothelin receptors. Endocrinology 1992; 130: 1885-95. [ Links ]
27. Krsmanovic L, Stojilkovic S, Balla T, Al-Damluji S, Weiner R, Catt K. Receptors and neurosecretory actions of endothelin in hypothalamic neurons. Proc Natl Acad Sci USA 1991; 88: 11124-28. [ Links ]
28. Fuxe K, Anggard E, Lundgren K, Cintra A, Agnati LF, Galton S, Vane J. Localization of [125 I]endothelin-1 and [125 I]endothelin-3 binding sites in the rat brain. Acta Physiol Scand 1989; 137: 563-64. [ Links ]
29. Makino S, Hashimoto K, Hirasawa R, Hattori T, Ota Z. Central interaction between andothelin and brain natriuretic peptide on vasopressin secretion. J Hypertens 1992; 10: 25-28. [ Links ]
30. Saavedra JM, Correa FMA, Plunkett LM, Israel A, Kurihara M, Shiguematsu K. Binding of angiotensin and atrial natriuretic peptide in brain of hypertensive rats. Nature 1986; 320: 758-61. [ Links ]
31. Gehlert DR, Speth RC, Wamsley JK. Distribution of [125 I]angiotensin II binding sites in the rat brain: a quantitative autoradiographic study. Neurosci. 1986; 18: 837-56. [ Links ]
32. Wall KM, Ferguson AV. Endothelin acts at the subfornical organ to influence the activity of putative vasopressin and oxytocin-secreting neurons. Brain Res 1992; 586: 111-6. [ Links ]
33. Yamamoto T, Kimura T, Ota K, Shoji M, Inoue M, Sato K, Ohta M, Yoshinaga K. Central effects of endothelin-1 on vasopressin release, blood pressure, and renal solute excretion. Am Physiol Soc 1992; E856-E862. [ Links ]
34. McCann SM, Antunes-Rodrigues J, Jankowski M, Gutkowska J. Oxytocin, vasopressin and atrial natriuretic peptide control body fluid homeostasis by action on their receptors in brain, cardiovascular system and kidney. Prog Brain Res 2002; 139: 309-28. [ Links ]
35. Kurihara Y, Kurihara H, Morita H, Cao W, Ling G, Kumada M, Kimura S, Nagai R, Yazaki Y, Kuwaki T. Role of endothelin-1 in stress response in the central nervous system. Am J Physiol Integrat Comp Physiol 2000; R515-21. [ Links ]
36. Severs WB, Severs-Daniels AE. Effects of angiotensin on the central nervous system. Pharmacol Rev 1973; 22: 415. [ Links ]
37. Antunes-Rodrigues J, Ramalho MJ, Reis LC, Picanco-Diniz DW, Favaretto AL, Gutkowska J, McCann SM. Possible role of endothelin acting within the hypothalamus to induce the release of atrial natriuretic peptide and natriuresis. Neuroendocrinology. 1993; 58: 701-8. [ Links ]
38. Antunes-Rodrigues J, Ramalho MJ, Reis LC, Menani JV, Turrin MQ, Gutkowska J, McCann SM. Lesions of the hypothalamus and pituitary inhibit volume-expansion-induced release of atrial natriuretic peptide. Proc Natl Acad Sci USA. 1991; 88: 2956-60. [ Links ]
39. Morrison SF. Differential control of sympathetic outflow. Am J Physiol Regul Integr Comp Physiol 2001; 281: R683-98. [ Links ]
40. Oparil S, Chen YF, Berecek H, Calhoun DA, Wyss JM. The role of the central nervous system in hypertension. In: Hypertension: Phatophysiology, Diagnosis, and management, edited by Laragh JH, Brenner BH. New York: Raven 1995; p 713-40. [ Links ]
41. Van den Buuse and Webber KM. Endothelin and dopamine release. Prog Neurobiol 2000; 60: 385-405. [ Links ]
42. Koizumi S, Kataoka Y, Niwa M, Kumakura K. Endothelin-3 stimulates the release of catecholamines from cortical and striatal slices of the rat. Neurosci Lett 1992; 134: 219-22. [ Links ]
43. Di Nuncio AS, Legaz G, Rodano V, Bianciotti LG, Vatta MA. Modulatory effect of endothelin-1 and -3 on neuronal norephinephrine release in the rat posterior Hypothalamus. Regulatory Peptides 2004; 15: 51-9. [ Links ]
44. Rebello S, Roy S, Saxena PR, Gulati A. Systemic hemodynamic and regional circulatory effects of centrally administered endothelin-1 are mediated through ET receptors. Brain Res 1995; 676: 141-50. [ Links ]
45. Ferguson AV, Smith P. Cardiovascular responses induced by endothelin micro- injection into area postrema. Regulatory Peptides 1990; 27: 75-85. [ Links ]
46. Gulati A, Rebello S. Characteristics of endothelin receptors in the central nervous system of spontaneously hypertensive rats. Neuropharmacology 1992; 31: 243-50. [ Links ]
47. Gulati A, Rebello S. Down-regulation of endothelin receptors in the ventrolateral medulla of spontaneously hypertensive rats. Life Sci 1991; 48: 1207-15. [ Links ]













