Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT v.23 n.1 Caracas 2004
Efectos de los Antagonistas de los Receptores NK1 y de la Dexametasona sobre la inflamación neurogénica inducida por ciclofosfamida y por radiación X, en la rata
AB Alfieri1 y LX Cubeddu1,2.
1 Cátedra de Farmacología, Facultad de Farmacia, UCV, Caracas, Venezuela. E-mail: alfieria@rect.ucv.ve
2 College of Pharmacy, Health Professions Division, Nova Southeastern University, Ft. Lauderdale, Florida, USA.
Resumen
Los agentes antineoplásicos ciclofosfamida (CFM) y radiación X (RAD) pueden producir inflamacion neurogenica en vejiga urinaria y en el tracto gastrointestinal, respectivamente. Fármacos antagonistas de los receptores NK1 han demostrado ser capaces de reducir el daño inflamatorio causado por diversos antineoplásicos. Igualmente, los glucocorticoides incrementan la eficacia de agentes empleados para controlar efectos adversos del tratamiento antineoplásico. Este estudio fue realizado a fin de determinar si la dexametasona (DEX) modifica la eficacia de antagonistas NK1 en inhibir la extravasación de proteínas plasmáticas (EPP) inducida por CFM o RAD. Se utilizaron ratas macho, a los cuales se les administró bien sea vehículo (sol. salina, 1 ml/kg), GR203040 (0.3 mg/kg), GR205171(0.3 mg/kg), DEX (1mg/kg) o la combinación de los antagonistas NK1+DEX, antes de administrar CFM o RAD. La citotoxidad en diferentes tejidos (vejiga, duodeno, yeyuno y riñón) fue determinada mediante la cuantificación de la EPP por el método del azul de Evans y por evaluación histológica. Los pretratamientos individuales con los GR o con DEX inhibieron significativamente la EPP inducida por CFM en vejiga y por RAD en duodeno y en yeyuno; esta inhibición se incrementó cuando se utilizó la combinación de un GR + DEX, indicando que la inflamación inducida por CFM y por RAD está mediada por receptores NK1, pero tiene otros componentes importantes, sensibles a esteroides.
Palabras Clave: Ciclofosfamida, Radiación, Receptores NK1, Glucocorticoides.
Abstract
The antineoplastic agents cyclophosphamide (CFM) and radiation X (RAD) can produce neurogenic inflammation in the urinary bladder and in the gastrointestinal tract, respectively. NK1 receptor- antagonists reduce plasma protein extravasation (EPP) caused by diverse antineoplastic drugs; and glucocorticoids increase the efficacy of agents used to treat adverse effects of anti-cancer treatments. In this study we determined whether dexametasone (DEX) modifies the efficacy of NK1 antagonists to inhibit the EPP induced by CFM or RAD. Male rats received one of the following treatments: saline (1 ml/kg), GR203040 (0.3 mg/kg), GR205171 (0.3 mg/kg), DEX (1mg/kg) or the combination of antagonists NK1+DEX, before the administration of CFM or RAD. Cytotoxicity in different tissues (bladder, duodenum, jejune and kidney) was determined by quantification of EPP by the Evans blue method and by histological evaluation. The individual pre-treatments with a GR or DEX significantly inhibited the EPP induced by CFM in the bladder and by RAD in duodenum and jejune; and that this inhibition was increased when the combination of a GR+DEX was used. The results suggest that both NK1 receptors and steroid-sensitive mechanisms are involved in CFM or RAD-induced inflammation.
Key Words: Cyclophosphamide, Radiation, NK1 Receptors, Glucocorticoid.
INTRODUCCIÓN
El progreso reciente en la investigación básica y clínica se ha traducido en una mejora substancial en el tratamiento de los diferentes tipos de cáncer. Agentes como la ciclofosfamida (CFM) y la radiación X (RAD) se han convertido en armas invalorables para tratar y curar dichas patologías; sin embargo, y a pesar de su innegable efectividad, son bien conocidos los efectos adversos asociados a estos citotóxicos, entre los cuales destacan la émesis y la toxicidad inespecífica, asociada con inflamación y daño de diferente magnitud en diversos tejidos(1).
Por ejemplo, la CFM es efectiva para el tratamiento de una serie de enfermedades malignas y no malignas; sin embargo la terapia con CFM produce toxicidad de diferente tipo, incluyendo cistitis neurogénica, con una incidencia de hasta un 78%(2). Se sabe que dicho efecto es debido a la acción de su principal metabolito, la acroleína(1,3). Similarmente, la radioterapia que algunos pacientes reciben localmente, como parte del tratamiento de tumores malignos pélvicos, retroperitoneales o abdominales, puede producir desde un síndrome gastrointestinal agudo, que aparece en los pacientes en las primeras 24-48 horas(4), hasta enteropatías subagudas o crónicas, que pueden aparecer meses o años después(5); estos fenómenos inflamatorios han sido observados también en animales(6,7).
Diversos estudios han establecido que la sustancia P (sP) y el óxido nítrico juegan un papel relevante en la inflamación neurogénica asociada al uso de diversos agentes antineoplásicos, como la CFM y el cisplatino(8-11). Similarmente, se ha demostrado que la extravasación de proteínas plasmáticas y el daño inducido por agentes como la capsaicina, la sP o el cisplatino pueden ser parcialmente prevenidos por los esteroides antiinflamatorios(12,13). Bacci y colaboradores (1994) estudiaron el efecto de la administración del glucocorticoide budesonida contra la EPP inducida por la capsaicina y la sP, en la mucosa nasal y en la traquea de la rata, demostrando que el esteroide es capaz de inhibir parcialmente dicha extravasación, en forma dosis-dependiente(12). Reznik y Gambaryan demostraron que la triamcinolona es capaz de prevenir parcialmente los daños inducidos por el CPT (7.5 mg/kg, 72 horas) en el riñón de la rata(13).
Paralelamente, en la práctica clínica es común la asociación en forma aguda, de un esteroide antiinflamatorio para evitar alguno de los efectos adversos más intensos del tratamiento antineoplásico. Es por ese motivo que en la presente investigación nos propusimos estudiar el posible papel de los esteroides antiinflamatorios, solos o combinados con antagonistas NK1, fármacos que han demostrado reducir el daño inflamatorio causado por diversos antineoplásicos, en la modulación de la citotoxicidad en vejiga urinaria y en tracto gastrointestinal, inducidas por la CFM y la RAD, respectivamente.
Materiales y Métodos
Animales de experimentación
Como animales de experimentación se utilizaron ratas albinas macho, de la cepa Sprague-Dawley, con un peso comprendido entre 300-450 g, y se mantuvieron en grupos de 4-6 animales por jaula.
Los animales tuvieron libre acceso a agua y a comida granulada comprimida, estándar y fueron mantenidos con la dieta habitual para la especie hasta el día del experimento.
Métodos
El día del experimento, cada animal fue pesado y, según el grupo al cual pertenecía recibió uno de los siguientes pre-tratamientos:
Vehículo, 0.1 ml/kg (grupo control)
GR203040, un antagonista de los receptores NK1 (0.3 mg/kg, i.p.).
GR205171, un antagonista de los receptores NK1 (0.3 mg/kg, i.p.).
dexametasona (2 horas antes de la aplicación del citotóxico).
la combinación de GR203040 + dexametasona.
la combinación de GR205171 + dexametasona.
Quince minutos después de recibir el pretratamientos, cada animal, recibió uno de los siguientes citotóxicos:
1. Ciclofosfamida (CFM), por vía intraperitoneal, 150 mg/kg.
2. Radiación corporal total (RAD). Dosis: 2 Gy en 5 min: Para la aplicación de este citotóxico, cada animal fue colocado en un recipiente circular de fibra de vidrio transparente (35 cm de diámetro; 7 cm de altura), y el mismo se ubicó 100 cm por debajo de una fuente de radiación X (Seiifert Isovolt 420 X-ray Set) preajustada para producir una dosis de radiación total de 200 rads (2 Gy), en un período aproximado de 5 minutos (420 kv, 10 nA, 2 mmCu, FFF).
Posteriormente a la aplicación de la CFM o la RAD, los animales fueron regresados a su jaula, donde permanecieron hasta el momento de realizar los procedimientos necesarios para cuantificar citotoxicidad.
Cuantificación de la citotoxicidad
La citotoxicidad fue evaluada mediante: 1) cuantificación de la extravasación de proteínas plasmáticas (EPP), un método cuantitativo indirecto y 2) estudios histológicos, un método cualitativo directo.
Cuantificación de la extravasación de proteínas plasmáticas: El colorante Azul de Evans es capaz de unirse cuantitativamente a la albúmina, tanto in vivo como in vitro. Esta propiedad ha sido ampliamente usada para cuantificar la extravasación proteica como un índice del incremento de la permeabilidad vascular e, indirectamente, del daño tisular(14). El Azul de Evans, una vez extravasado hacia los tejidos, es entonces removido de los mismos, y cuantificado por espectrofotometría a visible.
Los animales fueron anestesiados con pentobarbital, la vena yugular fue canulada y el Azul de Evans fue administrado a una concentración de 50 mg/kg peso (20 mg/ml + heparina 100 Ul/ml); 15 minutos después, el colorante fue removido del sistema cardiovascular por perfusión intracardíaca de solución salina (NaCl 0.9%) a 37°C, a una velocidad de 25 ml/min. Después de esto, se extrajo la vejiga urinaria, segmentos de duodeno y de yeyuno (de 1 cm de longitud, aproximadamente) y un riñón. Todo el tejido adiposo y conectivo extravisceral fue removido cuidadosamente, y cada espécimen fue lavado en solución salina y secado sobre papel, antes de ser pesado y colocado en un volumen exactamente medido de formamida. El contenido de Azul de Evans de cada tejido fue determinado después de su extracción con formamida (por 24 horas, a 60°C) utilizando espectrofotometría a 620 nm. La cantidad de Azul de Evans fue reportada como mg AE/g tejido.
Estudios histopatológicos: Los estudios histopatológicos fueron realizados para tener otra evaluación del daño celular inducido por los diferentes agentes, y el posible papel del antagonista NK1 y de la dexametasona. A tal fin los animales recibieron un tratamiento igual al descrito para la cuantificación de la EPP, pero sin la administración del Azul de Evans. Una vez extraídas las muestras (vejiga, porciones de duodeno y yeyuno y un riñón), se procedió eliminar todo adiposo o conectivo extravisceral, y cada espécimen fue lavado en solución salina y secado sobre papel y luego fijado por 12-16 horas en solución tamponada neutra de formalina; posteriormente las muestras fueron embebidos en parafina, y seccionados en cortes de 3-4 micras y teñidos. Las tinciones incluyeron hematoxilina-eosina, azul de alcian/ácido periódico de Shifft, amilasa/ácido periódico de Shifft, inmunohistoquímica para Factor VIII e inmunohistoquímica para el fibrinógeno. Todos los cortes fueron examinados buscando evidencias de cualquier cambio con respecto a los controles, y particularmente los asociados con extravasación de proteínas plasmáticas e inflamación.
RESULTADOS
Los resultados obtenidos, demuestran que ambos citotóxicos producen una toxicidad preferencial sobre diferentes tejidos de la rata. La CFM produjo un incremento significativo de la EPP solamente en la vejiga urinaria, mientras que la RAD lo hizo en el tejido intestinal. No se observaron cambios en la EPP a nivel renal.
Los aumentos de la EPP inducidos por CFM y RAD fueron parcialmente prevenidos al pretratar con cualquiera de los antagonistas de los receptores NK1, (GR203040 y GR205171), con dexametasona sola, o con la combinación de ambos tipos de fármacos. En efecto, la EPP en vejiga urinaria provocada por CFM se vio atenuada en un 43%, 36% (p=0.005) y 40% (p<0.001), al pretratar con el GR205171, o el GR203040, o la dexametasona, respectivamente (Tabla 1 y Figura 1). Aquellos animales que recibieron RAD + el pretratamiento con el GR205171, o el GR203040, o la dexametasona tuvieron a una reducción de la EPP en duodeno del 60%, 50% y 57% (p<0.005), respectivamente (Tabla 1 y Figura 2).
Efecto del pretratamiento con un antagonista de los receptores NK1, con la dexametasona o con la combinación, sobre la EPP inducida en 6 horas por la CFM (150 mg/kg, i.p.) o en 2 horas por RAD (2Gy), en diferentes tejidos de la rata.
|
| Tejido | |||
|
| Tratamiento | Vejiga | Duodeno | Yeyuno |
| CFM + | Vehículo solo (Basal) Vehículo GR205171 (0.3mg/kg) GR203040 (0.3mg/kg) Dexametasona (1 mg/kg) GR205171 + Dexa GR203040 + Dexa | 17.46 ± 2.85 140.9±4.78 $ 80.2±13.03** 70.7±15.1** 84.1±18.09* 45.7±11.74*** 47.8±9.15*** | 64.81 ± 10.24 68.9±4.26 76.7±11.5 62.4±7.2 77.3±18.50 63.7±6.95 59.9±7.29 | 50.34±7.16 55.4±5.10 58.6±13.67 51.3±3.1 74.0±16.28 60.8±4.45 61.8±5.32 |
| RAD + | Vehículo GR205171 (0.3mg/kg) GR203040 (0.3mg/kg) Dexametasona (1 mg/kg) GR205171 + Dexa GR203040 + Dexa | 14.13±1.14 14.97±2.21 16.7±9.95 10.84±1.48 15.6±3.8 18.40±6.5 | 132.71±15.3 $$ 89.24±37.85** 92.15±11.9** 85.3±4.2** 63.9±6.7*** 61.30±8.7*** | 88.81±7.3 $ 74.81±29.05 84.69±13.57 72.12±5.36 60.6±7.5* 64.40±7.8* |
Los animales que recibieron CFM o RAD fueron sacrificados 6 y 2 horas después, respectivamente.
El basal representa la cantidad del Azul de Evans que difunde a los tejidos de los animales controles.
Todos los valores están expresado en µg AE/g tejido y son la media ± EEM de 9 animales.
$:p<0.05; $$:p< 0.005 comparados con animales controles (basal), t de Student no pareada.
*:p<0.05; **:p< 0.005; ***: p< 0.001, comparados con animales que recibieron el agente citotóxico solo, t de Student no pareada.
Efecto del pretratamiento con antagonistas NK1 o con dexametasona, sobre la EPP inducida por la CFM sobre la vejiga urinaria de la rata.
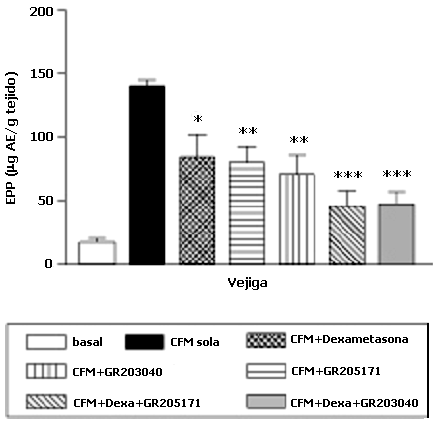
Todos los valores son la media ± EEM de 9 animales.
*p<0.05; **p < 0.005; *** p < 0.001, comparados con animales que recibieron la CFM sola, t de Student no pareada.
Efecto del pretratamiento con antagonistas NK1 o con dexametasona, sobre la EPP inducida por la RAD sobre duodeno y yeyuno de la rata
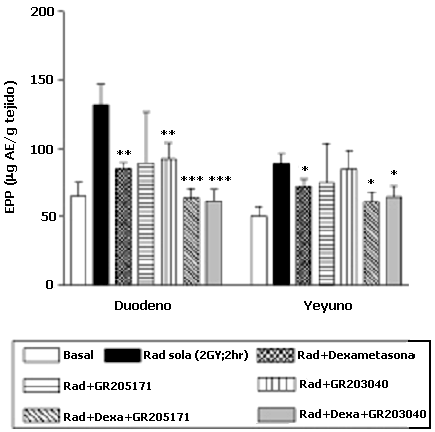
Todos los valores son la media ± EEM de 9 animales.
*p<0.05; **p < 0.005; *** p < 0.001, comparados con animales que recibieron la CFM sola, t de Student no pareada.
Cuando animal recibió la combinación del esteroide + el antagonista de los receptores NK1, la prevención de la EPP inducida por los citotóxicos fue mayor, tanto en la vejiga urinaria (65%, p=0.001), como en duodeno (100%, p<0.001); la combinación también fue capaz de proteger parcialmente al yeyuno (80%, p<0.001).
Evaluación histológica
Los efectos de la CFM sobre la EPP y daño celular producidos en la vejiga urinaria de la rata, y la capacidad del antagonismo en los receptores NK1 para prevenirlos parcialmente, fueron corroborados por estudios histológicos. En vejiga urinaria, la CFM produjo un edema masivo de la lámina propia, particularmente la zona más profunda, y de la capa muscular adyacente, (Figura 3). Cuando los animales fueron pretratados con el antagonista NK1, el GR205171 + la dexametasona, se observó edema en la lámina propia, pero con una significativa reducción en su severidad. Similarmente, los animales que recibieron RAD corporal total desarrollaron un efecto tóxico particularmente marcado en duodeno, con edema y destrucción epitelial, efectos que fueron parcialmente prevenidos por el tratamiento combinado con el GR205171 + dexametasona, (Figura 4).
Histologías de muestras de vejigas de ratas tratadas con CFM
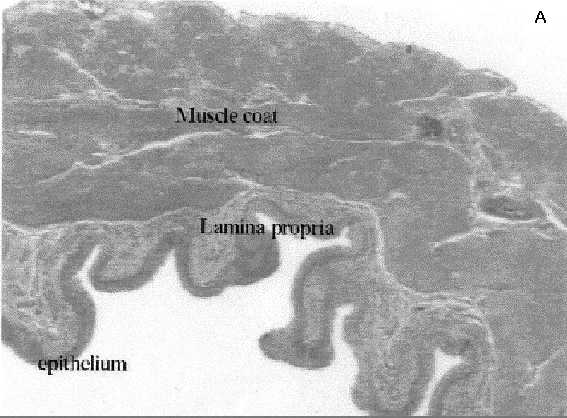
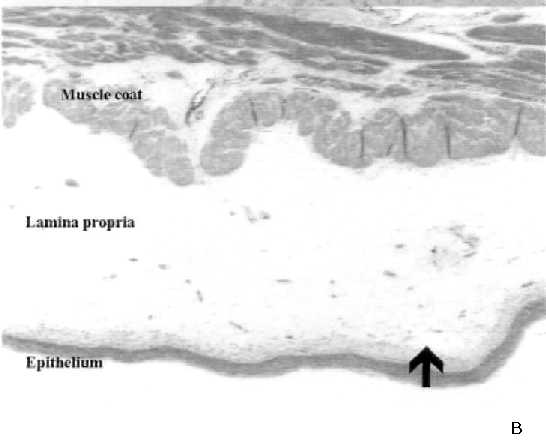
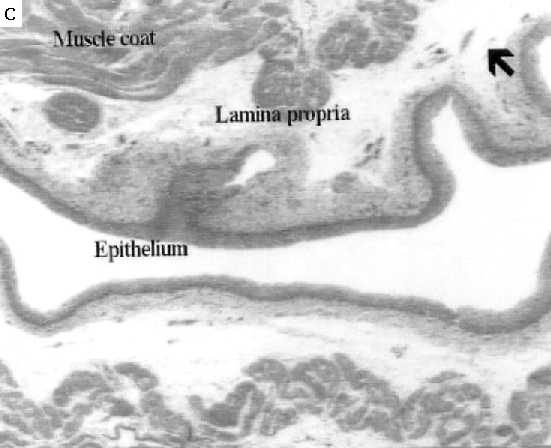
A: Vejiga control; B: Vejiga de rata tratada con CFM 150 mg/kg, y sacrificada 6 horas después. Notar el edema masivo, indicado con la flecha; C: vejiga de rata tratada con CFM, y pretratada con la combinación de GR205171 + Dexametasona. Hay una protección parcial, con reducción significativa del edema.
Histologías de muestras duodeno de ratas tratadas con RAD
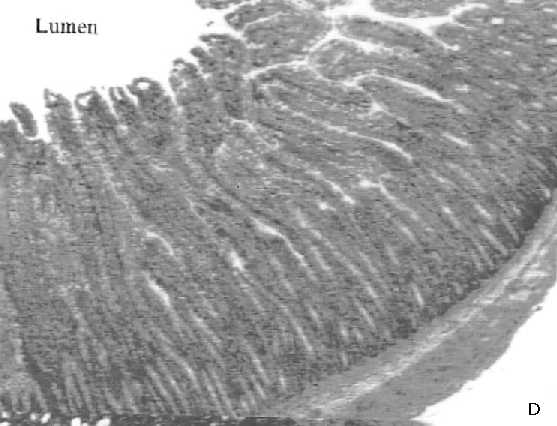
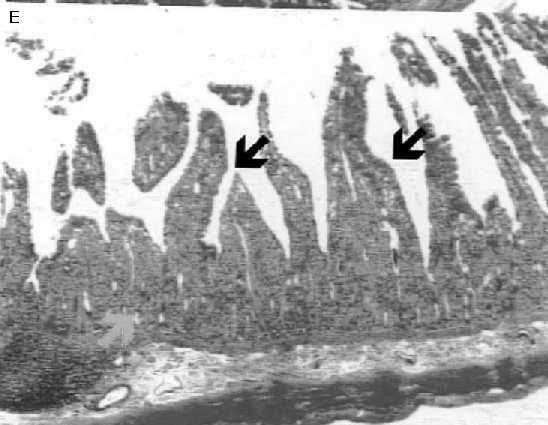
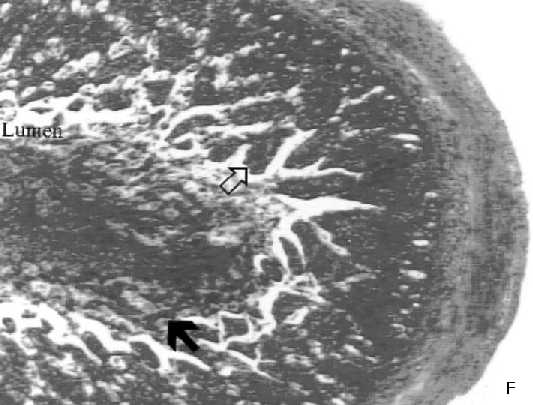
D: Duodeno control; E: Duodeno de rata tratada con RAD corporal total (2GY en 5 min) y sacrificada 2 horas después. Se observa gran destrucción de tejido, con perdida de la estructura y lesiones crípticas (flechas); F: Duodeno de rata tratada con RAD, y pretratada con la combinación de GR205171 y Dexametasona. Hay una protección parcial de los daños observados en E.
DISCUSIÓN Y CONCLUSIONES
Nuestros experimentos demuestran que la administración individual del GR205171, del GR203040 o de la dexametasona fue capaz de producir una inhibición de aproximadamente un 40% (p<0.05) de la EPP inducida tanto por la CFM como por la RAD. La combinación de los dos tipos de drogas (antagonista NK1 + dexametasona) proporcionó, en ambos casos, una mejor protección contra el efecto de los citotóxicos. El hecho de que la dexametasona y los antagonistas de los receptores NK1 tengan efectos aditivos en inhibir la EPP inducida por la CFM y por la RAD, sugiere que el esteroide y el antagonista de los receptores NK1 tienen sitios de acción diferentes, y apoya la idea de que más de un mediador está involucrado en la producción de la cistitis por CFM y de la enteritis por RAD. En este estudio se ha demostrado que la combinación de la dexametasona y un antagonista NK1 puede disminuir significativamente los efectos adversos inflamatorios inducidos por la CFM y la RAD, en la rata.
El mecanismo por el cual el esteroide dexametasona es capaz de prevenir el daño en vejiga urinaria puede deberse a múltiples efectos. Es bien conocido que los corticoesteroides tienen la capacidad de prevenir o suprimir el desarrollo de manifestaciones inflamatorias, independientemente de la naturaleza del agente desencadenante(15). Un gran número de mecanismos se han descrito para esta acción antiinflamatoria; los corticoesteroides inducen la síntesis de proteínas o de una familia de proteínas, la de la lipocortina, que inhiben la actividad de la fosfolipasa A(16) y la liberación del factor activador de plaquetas (PAF, en inglés)(17). Entre las muchas substancias cuya síntesis es inhibida por glucocorticoides también se incluyen citokinas, como la interleukina 1 (IL-1) y el factor de necrosis tumoral a, las cuales producen inflamación inespecífica, producción de PGE, colagenasa y citodestrucción(13). Adicionalmente, varias citokinas inducen la sintetasa del NO (NOS), lo cual resulta en una producción incrementada de NO(10,11,18). El NO ha sido identificado como un mediador multifactoral, y es capaz de inducir incremento del flujo sanguíneo y de la exudación plasmática en sitios de inflamación, acumulándose evidencias que lo señalan como partícipe de la destrucción celular(19). El NO juega un papel fisiopatológico importante en la producción de la cistitis neurogénica por CFM; la inhibición de la producción del NO, mediante la administración de un inhibidor de su síntesis, previene dicha cistitis(10,11). Es pues factible, que el efecto beneficioso de la dexametasona o pueda ser una consecuencia de la reducción en la producción de NO, por la inhibición tanto de citokinas y como de la producción de la sintasa del NO.
En este estudio también se demostró que cada agente citotóxico utilizado tiene toxicidad selectiva por diferentes tejidos, produciendo daños con características y magnitudes distintas; es así que la CFM, tiene como órgano blanco fundamental a la vejiga urinaria, sin ocasionar, aún a las altas dosis, cambios relevantes ni en intestino ni en riñón; análogamente, la RAD corporal total produjo sus efectos tóxicos tisulares principalmente en intestino, con preferencia en duodeno.
En resumen, los resultados obtenidos en el presente estudio permiten concluir que:
1. Tanto el bloqueo del receptor NK1, como la administración aguda de un esteroide como la dexametasona son capaces de prevenir parcialmente la inflamación neurogénica inducida por la CFM y por la RAD en diferentes tejidos de la rata.
2. El tratamiento combinado con un antagonista NK1 más el compuesto glucocorticoide dexametasona, fue capaz de mejorar la protección ofrecida por los tratamientos individuales. Esto, adicionalmente a sugerir que dichos compuestos tienen mecanismos de acción diferentes, aporta evidencias prometedoras sobre la posibilidad de utilizar la combinación de un esteroide administrado agudamente y de un antagonista de los receptores NK1 en la práctica clínica, con la finalidad de mejorar tanto la actividad antiemética, como la citoprotectora, contra los efectos producidos por agentes antineoplásicos, como la CFM y la RAD.
3. Los receptores NK1 desempeñan un papel importante, pero no único, en el desarrollo de la EPP, el daño celular o ambos, producidos por los agentes antineoplásicos CFM y RAD, en vejiga urinaria y tracto gastrointestinal, respectivamente.
AGRADECIMIENTO
Esta investigación ha sido parcialmente financiada por el Proyecto CDCH 06.10.4492.99, responsabilidad de A. Alfieri.
Referencias bibliográficas
1. Fraiser LU, Sarathchandra K y Kehrer JP. Cyclophosphamide Toxicity. Caracterising and avoiding the problem. Drug 1991; 2: 781-95. [ Links ]
2. Grimberg-Funes D, Sheldon C y Weiss M. The use of prostaglandin F2 alpha for the prophylaxisof cyclophosphamide induced cystitis in rat. J Urol. 1990; 144:1500-1504. [ Links ]
3.Phillips FS, Sternberg SS, Cronin AP y Vidal PM. Cyclophosphamide and urinary bladder toxicity. Cáncer Res. 1961; 21:1577-1589. [ Links ]
4. Mac Lean A. Early adverse effects of radiation. Br Med Bull 1973; 29: 69-73. [ Links ]
5. Berthong M & Fajardo LF. Radiation injury in surgical pathology: Part II. Alimentary tract. Am J Surg Pathol. 1981; 5: 153-178. [ Links ]
6. Buell MG & Harding RK. Pro-inflammatory effects of local irradiation on the rat gastrointestinal tract. Dig Dis Sci. 1989; 34: 390-99. [ Links ]
7. Harding RK, Leach KE, Prudhomme-Lalonde L & Ferrarotto CL. Acute effects of 5 Gy ionizing irradiation on mast cell populations, in the ferret jejunum. Gastroenterology. 1992; 102: A635. [ Links ]
8. Alfieri AB y Gardner CJ. The NK1 antagonist, GR203040, inhibibits cyclophosphamide-induced damage in the rat and ferret bladder. Gen. Pharmacol. 1997; 29(2): 245-250. [ Links ]
9. Alfieri AB y Gardner CJ. Effects of GR203040 a novel NK1 receptor antagonist, on plasma protein extravasation and damage induced by radiation and cisplatin, in the ferret. Gen Pharmacol. 1998; 31(5): 741-746. [ Links ]
10. Alfieri AB y Cubeddu LX. Nitric Oxide and NK1-Tachynin receptors in Cyclophosphamide-induced cystitis, in rats. J. Pharmacol. Exp. Therapeutics 2000; 295(2): 824-829. [ Links ]
11. Alfieri AB, Malavé A y Cubeddu LX. Nitric Oxide synthase and Cyclophosphamide-induced cystitis in rats. Naunyn-Schiedembergs Arch. Pharmacol. 2001; 363(3): 353-357. [ Links ]
12. Bacci E, Bertrand C, Gepetti P, Baker J, Nadel J, Laitinen LA y Peterson G. Budesonide inhibits plasma extravasation induced by capsaicin and by substance P in the rat nasal mucosa.Reg. Peptide 1993; 49: 159-166. [ Links ]
13. Reznik LV y Gambaryan SP. Protective effect of anti-inflamatory corticosteroid Triamcinolone in cisplatin nephrotoxicity. Renal Physiol. Biochem. 1994; 17: 50-56. [ Links ]
14. Saria A, Lundberg JM, Skofitsch G y Lembeck F. Vascular protein leakage in various tissue induced by substance P, capsaicin, bradykinin, serotonin histamine and by antigen challenge. Naunyn-Schmiedebergs Arch. Pharmacol. 1983; 324: 212-218. [ Links ]
15. Adcock IM, Peters M, Gelder C, Shirasaki H, Brown CR, Barnes. Increased tachykinin receptor gene expression in asthmatic lung and its modulation by steroids. J Mol Endocrinol. 1993; 11(1): 1-7. [ Links ]
16. Di Rosa M, Calignano A, Carnuccio R, Ialenti A, Sautebin L Multiple control of inflammation by glucocorticoids. Agents Action 1985; 36: 1225-1231. [ Links ]
17. Parente L, Flawer RJ Hydrocortisone and «macrocortin» inhibit the zymosan-induced release of lyso-PAF from rat peritoneal leucocytes. Life Sci. 1985; 36: 1225-123. [ Links ]
18. Pfeilschnifter J, Rob P, Mulch A, Fandrey J, Vosbeck K, Busse R. Interleukin 1 and tumor necrosis factor induce a macrophae-type of nitric oxide synthase in rat mesangial cells. Eur J Biochem. 1992; 203: 251-255. [ Links ]
19. Kolb H y Kolb-Bachofen V. Nitric oxide: a pathogenic factor in autoinmunity. Inmunol Today 1992; 13: 157-159. [ Links ]













