Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT v.23 n.2 Caracas jul. 2004
Papel de la aldosterona y las glándulas suprarrenales en la acción renal de la adrenomedulina administrada centralmente
E Diaz1 y A Israel1.
1Escuela de Farmacia, Laboratorio de Neuropéptidos, Universidad Central de Venezuela, Caracas, Venezuela.
e-mail: astern88@hotmail.com
RESUMEN
La adrenomedulina (AM) es un péptido hipotensor altamente expresado en el sistema nervioso central. La administración central de AM produce: inhibición de la ingesta de sal, agua y de la secreción de arginina-vasopresina, incremento de los niveles plasmáticos de oxitocina, diuresis y natriuresis En las glándulas suprarrenales la AM inhibe la secreción de aldosterona (ALD) inducida por la angiotensina II, KCL o ACTH. Nosotros evaluamos la hipótesis de la disminución de la actividad mineralocorticoide sobre el riñón como el posible mecanismo responsable del fenómeno natriurético. La AM-IVT incrementó el volumen urinario y la excreción de sodio durante las 6 horas del período de recolección de la orina. En las ratas controles y las depletadas de sodio, los niveles de ALD plasmática permanecieron sin cambios hasta 15 minutos después de la AM-IVT. La natriuresis inducida por la AM-IVT no fue afectada significativamente en la ausencia (ratas ADX) o el exceso de ALD plasmática (SHAM+ALD), o en ratas ADX, con o sin reemplazo hormonal. Nuestros resultados sugieren que la AM juega un papel en la regulación central del balance de fluidos y electrolitos, y que el efecto natriurético de la AM cerebral no está relacionado con los niveles plasmáticos de mineralocorticoides, ni con la presencia de las glándulas suprarrenales.
Palabras Clave: Adrenomedulina, Aldosterona, Adrenalectomía, Natriuresis, Diuresis.
ABSTRACT
Adrenomedullin (AM) is a hypotensive peptide that is highly expressed in the central nervous system. Central AM increases water and salt intake, arginine-vasopressin secretion and produces diuresis and natriuresis. In adrenal glands AM inhibits aldosterone (ALD) secretion induced by angiotensin II, KCL or ACTH. We assessed the hypothesis that a diminished mineralocorticoid effect on the kidney may explain the natriuretic phenomenon. In control or sodium depleted rats, plasma ALD remained unchanged for up to 15 minutes after AM-IVT. Natriuresis induced by AM-IVT was not significantly affected in the absence (ADX rats) or excess of plasma ALD (SHAM+ALD), or in ADX rats, with or without hormonal treatment. Our results suggest that AM plays a role in the central regulation of water and electrolyte balance, and that AM natriuretic effect is unrelated to mineralocorticoids plasma levels or to the adrenal glands.
Key Words: Adrenomedullin, Aldosterone, Adrenalectomy, Natriuresis, Diuresis.
INTRODUCCIÓN
La adrenomedulina (AM) es un péptido de 52 aminoácidos en el humano y de 50 en la rata, el cual ejerce una potente acción vasodilatadora e hipotensora cuando es administrado sistémicamente. La AM esta presente en plasma, en el líquido cefaloraquídeo y en diversos órganos, incluyendo en el sistema nervioso central(1-4). En el SNC las concentraciones más elevadas de AM se encuentran en la glándula pituitaria, tálamo, hipotálamo, tallo cerebral y otras regiones(4-6). Los estudios de inmunohistoquímica demostraron la localización discreta de la AM inmunomarcada (AMir) en diversas regiones del cerebro y en el hipotálamo la AMir esta localizada en neuronas del núcleo supraóptico y el paraventricular(4-6). Los sitios de unión específicos de la AM, los cuales difieren de los del CGRP, se han encontrado en diversos tejidos de la rata, incluyendo el cerebro y la médula espinal(7,8). Así mismo, se han encontrado receptores específicos de AM en el cerebro humano (corteza cerebral, cerebelo, tálamo, hipotálamo, protuberancia y bulbo raquídeo)(9). El gen de la AM se expresa y transcribe en el cerebro(2,5). Estos hallazgos sugieren un papel potencial para este péptido en el SNC que pudiera ser complementario a sus efectos periféricos.
La administración central de la AM tiene efectos marcados sobre la hidratación corporal. La AM cerebral inhibe la ingesta de agua y el apetito por la sal(10-12) y atenúa los niveles plasmáticos de arginina-vasopresina inducidos por la hiperosmolaridad o la hipovolemia(13). Adicionalmente, la administración intracerebroventriular de AM incrementa la liberación del péptido natriurético auricular(14), induce una reducción evidente de la actividad de los nervios simpáticos renales(15) y un incremento en el volumen y la excreción de sodio urinarios(16).
Estos resultados sugieren que la AM en el SNC juega un papel importante en la regulación del balance de fluidos y electrolitos, para defender al organismo contra estados de hipervolemia e hipernatremia.
Se desconoce el mecanismo exacto mediante el cual la AM cerebral participa en la excreción de sodio y agua. Existe evidencia que la AM juega un papel en la modulación de las funciones adrenocorticales y especialmente en la secreción de mineralocorticoides, tanto en condiciones fisiológicas como patológicas. Se ha encontrado inmunoreactividad a la AM a lo largo de todo el eje hipotálamo-pituitaria-médula suprarrenal en humanos, ratas y porcinos(17). La glándula suprarrenal posee sitios de unión para la AM principalmente del subtipo CGRP1. La AM ejerce una acción inhibitoria directa sobre la secreción de aldosterona estimulada por angiotensina II o potasio en las células de zona glomerulosa, siendo revertida y sobrepasada por una acción estimulatoria indirecta cuando la integridad del tejido suprarrenal es preservado(18-20). Esta evidencia nos permite proponer que el retiro de la actividad mineralocorticoide del riñón podría constituir uno de los mecanismos mediante el cual la AM ejerce sus efectos natriuréticos cuando es administrada centralmente. Por lo que nos planteamos evaluar si la acción de la AM-IVT sobre la función renal es una consecuencia de la disminución de los niveles de aldosterona plasmática y cual es el papel de las glándulas suprarrenales en las acciones centrales ejercidas por la AM.
MATERIALES Y MÉTODOS
Se usaron ratas albinas, macho, Sprague-Dawley (220-280g), con agua y alimento ad libitum, en condiciones controladas de temperatura y fotoperíodo (luz desde las 06:00 am a las 18:00 pm).
Se implantó una cánula en el ventrículo lateral izquierdo bajo anestesia con pentobarbital sódico (40 mg/kg,i.p.), 1 mm caudal a la sutura coronal y a 1.5 mm lateral de la sutura sagital del cráneo, mediante la ayuda de un aparato estereotáxico (David Kopf Instruments). Se permitió un período no menor de 72 horas como postoperatorio, en el cual los animales tuvieron libre acceso al agua y al alimento (Ratarina®), hasta la realización del experimento. La canulación ICV fue confirmada post-mortem, con la inyección de una solución de colorante (fast green, 5 μl). Sólo se utilizaron los datos experimentales de aquellos animales en los que el colorante se había distribuido en los ventrículos laterales, tercero y cuarto. La cantidad de sodio y potasio en las muestras de orina recolectadas se determinó por fotometría de llama. Los resultados son expresados en μEq/ml de orina y corregidos por peso corporal (μEq/100 g.p.c.).
Efecto de la administración de exceso de aldosterona
Un grupo de animales se distribuyeron al azar en lo siguiente: Vehículo (V): recibieron vehículo (solución de cloruro de sodio al 0.85% en etanol al 10%), i.p. (N=33); ALD: recibieron d-aldosterona (20 μg/kg, i.p.) (N=24); AM: 100 pmol/5μl, ICV (N=28) y ALD-AM: recibieron d-aldosterona (20 μg/kg, i.p.) 90 minutos antes de la AM-ICV (100 pmol/5μl) (N=24).
Protocolo experimental adrenalectomía bilateral
En el momento de la canulación intracebroventricular, bajo anestesia con pentobarbital (40 mg/kg, i.p.), se realizó una incisión en la piel en línea media desde la primera hasta la tercera vértebra lumbar. Se abordaron las glándulas suprarrenales, removiéndolas cuidadosamente (adrenalectomía bilateral = ADX) o se retiró un pequeño trozo de tejido adiposo perineal (operación simulada = SHAM). Un primer grupo de animales adrenalectomizados con cánula ICV fueron divididos en los siguientes grupos: SHAM (operación simulada) con vehículo (solución fisiológica, 5μl) (N=12); SHAM+AM (100 pmol/5μl, ICV)(N=14); ADX (adrenalectomizadas) (N=14) y ADX+ AM (100 pmol/5μl, ICV)(N=17).
Un segundo grupo de ratas ADX con cánula ICV recibió como terapia hormonal sustitutiva exclusivamente dexametaxona (4 mg/kg s.c.) (Merck Sharp & Dohme) el día de la cirugía y dos días después. Las ratas con operación simulada recibieron vehículo. Después de la cirugía todas las ratas fueron pesadas y colocadas en jaulas individuales y luego fueron divididos en los siguientes grupos: SHAM con vehículo (solución fisiológica, 5μl, ICV) (N=16); SHAM+AM (100 pmol/5μl, ICV) (N=15 ); ADX-DEX (N=7); ADX-DEX+ AM (100 pmol/5μl, ICV) (N=7).
Un tercer grupo de ratas adrenalectomizadas con cánula ICV recibieron reemplazo hormonal completo, el día de la cirugía y dos días después. Las ratas ADX fueron inyectadas con fosfato de dexametaxona (4 mg/kg s.c.) y con d-aldosterona (20 μg/kg, i.p.). Los animales fueron divididos en los siguientes grupos: SHAM con vehículo (10% de etanol en 0.85% de solución salina i.p.) (solución fisiológica, 5μl, ICV) (N=11); SHAM+AM (100 pmol/5μl, ICV) (N=10 ); ADX-DEX-ALD (N=12); ADX-DEX-ALD+ AM (100 pmol/5μl, ICV) (N=17). Cuatro días después de la cirugía, el día del experimento el grupo ADX-DEX-ALD recibió una sola dosis de aldosterona (20 μg/kg i.p.) y el grupo ADX-DEX-ALD+AM recibió aldosterona (20 μg/kg i.p.) 90 minutos antes de la administración de AM-ICV.
En todos los grupos, las ratas ADX se les proporcionó solución salina como bebida y a las ratas con operación simulada agua. En todos los casos, inmediatamente después de la administración de los tratamientos los animales recibieron una carga oral de agua (20ml/kg) y la orina fue recolectada a la 1,3 y 6 hr. Se midió el volumen urinario y posteriormente se cuantificó mediante fotometría de llama el sodio urinario.
Determinación del curso temporal de los niveles de aldosterona plasmáticos en ratas tratadas con AM-ICV
Se utilizaron animales sometidos a una dieta normosódica y animales sometidos a una dieta hiposódica, los cuales fueron canulados tres días antes del experimento y fueron divididos en los siguientes grupos: Normosódicas (tiempo 0): antes del tratamiento (N= 8); Hiposódicas (tiempo 0): antes del tratamiento (N=8).
Las ratas fueron anestesiadas con pentobarbital sódico (80 mg/kg i.p) y se colocaron en decúbito dorsal e inmediatamente se les practicó una incisión media longitudinal desde el pubis al apéndice xifoides, se retiraron a un lado los intestinos y se ubicó la vena cava inferior por delante de la columna vertebral, junto con la aorta abdominal. Seguidamente, se tomaron 4 ml de sangre en una inyectadora que estaba enrasada con heparina. Posteriormente a otro grupo de ratas hiposódicas, con cánula ICV, se les administró AM-ICV (100pmol/5μl) y se tomaron muestras de sangre de 4 ml de la vena cava inferior, a los 5, 10, 15 y 30 minutos (N=8, cada uno), bajo anestesia con pentobarbital sódico (80 mg/kg).
Las muestras fueron transvasadas a un tubo de ensayo heparinizado y se centrifugaron a 12000 r.p.m por 4 minutos a 4°C. El plasma sobrenadante se almacenó a -80°C hasta el día del ensayo. La concentración plasmática de aldosterona se cuantificó mediante radioinmunoensayo utilizando un paquete comercial para tal fin (Coat-A-Count®, Diagnostic Products Co, Los Angeles, CA)(21). La concentración de aldosterona fue calculada a partir de una curva estándar (rango de 0 a 1200 pg/ml), y los resultados se expresaron como pg de aldosterona/mg de proteínas plasmáticas. Las proteínas plasmáticas fueron determinadas según el método de Lowry(22).
Análisis estadístico
Los resultados son expresados como la media más o menos el error estándar de la media (X ± EEM ). Las diferencias significativas entre los distintos tratamientos serán evaluadas utilizando el análisis de varianza (ANOVA) de dos vías y el rango estadístico de Student-Newman-Keuls. Se considerarán como estadísticamente significativos los valores de p<0.05.
RESULTADOS
Efecto del exceso de aldosterona sobre la respuesta renal inducida por la AM-ICV
Los efectos del exceso de aldosterona sobre la respuesta renal inducida por la administración central de AM se muestran en la figura 1. La AM-ICV aumentó el volumen urinario y la excreción de sodio, a las 3 y 6 hr (p<0.05; p<0.01; p<0.001). El pretratamiento con la aldosterona (20 μg/kg i.p., 90 minutos antes de la administración del péptido ICV), no alteró la diuresis y la natriuresis inducida por la AM (*p>0.05, ANOVA dos vías).
Efecto del pretratamiento con la aldosterona sobre la respuesta urinaria producida por la AM-ICV
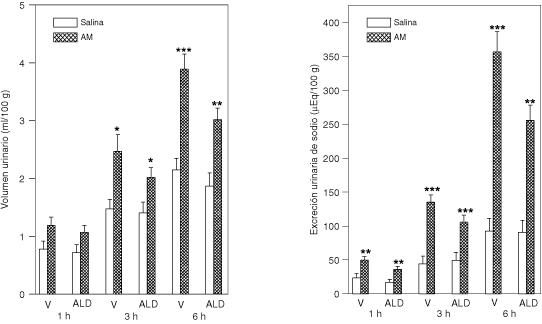
Los grupos de ratas fueron pretratados con aldosterona (ALD) (20 μg/ml/kg, i.p.) o vehículo (V)(10% de etanol en 0.85% de solución fisiológica) 90 minutos antes de la administración de la AM (100pmol/5µl, ICV) o solución fisiológica (5 µl, ICV). La orina fue recolectada a las 1, 3 y 6 hr (n=24-54 por grupo). Se muestran las medias ± EEM. *p<0.05, **p<0.01 y ***p<0.001, comparado con el grupo control (solución fisiológica).
Determinación del curso temporal de los niveles de aldosterona plasmáticos en ratas tratadas con AM-ICV
La dieta hiposódica incrementó 4.26 veces los niveles plasmáticos de aldosterona (tiempo 0). La administración de AM-ICV (100 pmol/5μl) no alteró los niveles incrementados de aldosterona plasmática (pg aldosterona /mg de proteína) en ratas sometidas a dieta hiposódica a los 5, 10, 15 y 30 minutos después de la administración del péptido con respecto al basal (Figura 2). No se observaron diferencias significativas en las proteínas plasmáticas basales (tiempo 0) de los animales sometidos a una dieta normosódica (68.68 ± 2.6 mg proteína/ml de plasma) o a la dieta hiposódica (67.29 ± 1.29). Igualmente, no se observaron cambios en las proteínas plasmáticas del grupo sometido a la dieta hiposódica en ninguno de los tiempos de recolección de la muestra posteriores a la AM-ICV (69.06 ± 1.56; 62.71 ± 4.08; 70.32 ± 4.31; 59.88 ± 2.03 mg de proteína/ml de plasma, respectivamente).
Efecto de la administración central de AM sobre los niveles plasmáticos de aldosterona (pg/mg proteína) en ratas sometidas a una dieta hiposódica
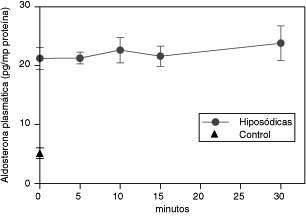
Las muestras fueron tomadas antes de la AM-ICV (tiempo cero) y a los 5,10, 15 y 30 minutos después de la administración del péptido. Los resultados se muestran como la media medias ± EEM.
Papel de las glándulas suprarrenales en la respuesta renal inducida por la AM-ICV
El efecto de la adrenalectomía bilateral en ratas con o sin terapia sustitutiva sobre la diuresis y natriuresis inducida por la administración central de AM se muestran en las figuras 3, 4 y 5. La AM-ICV incremento el volumen urinario y la excreción de sodio a las 3 y 6 horas.
Respuesta urinaria a la administración intracerebroventricular de la adrenomedulina en ratas con operación simulada (SHAM) o adrenalectomizadas sin reemplazo hormonal
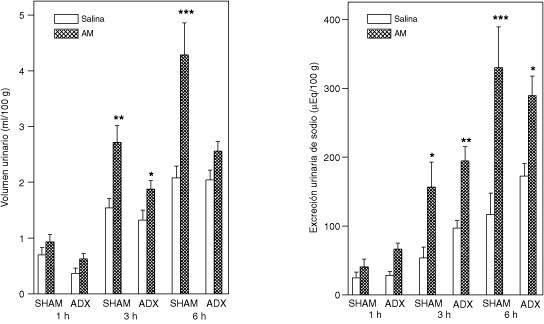
Las ratas fueron divididas en cuatro grupos: SHAM que recibieron solución fisiológica (5 µl, ICV) (N=12) o AM (100pmol/5µl, ICV) (N=12) y ratas ADX que recibieron solución fisiológica (N=14) o AM (100pmol/5µl, ICV) (N=17). Se muestran las medias ± EEM. *p<0.05, **p<0.01 y ***p<0.001, comparado con el grupo control (solución fisiológica).
Respuesta urinaria a la administración intracerebroventricular de la adrenomedulina en ratas con operación simulada (SHAM) o adrenalectomizadas pretratadas con dexametasona (ADX-DEX) (4mg/kg s.c., el día de la cirugía y dos días después) como terapia hormonal sustitutiva
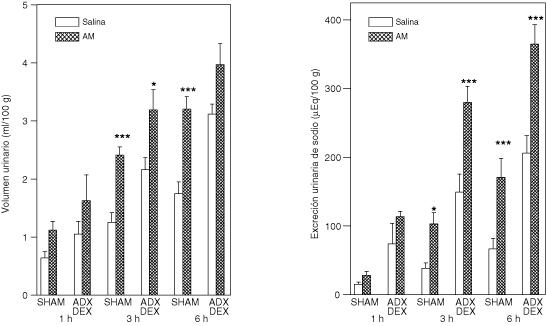
Las ratas fueron divididas en cuatro grupos: SHAM que recibieron solución fisiológica (5 µl, ICV) (N=16) o AM (100pmol/5µl, ICV) (N=15) y ratas ADX-DEX que recibieron solución fisiológica (N=7) o AM (100pmol/5µl, ICV) (N=7). Se muestran las medias ± EEM. *p<0.05, **p<0.01 y ***p<0.001, comparado con el grupo control (solución fisiológica).
La diuresis y la natriuresis inducida por la administración central de AM no fue alterada por la remoción de las glándulas suprarrenales, tampoco fue afectada en el grupo sin reemplazo hormonal (Figura 3) ni en los grupos con reemplazo hormonal: exclusivo del corticosteroide (dexametasona) (Figura 4) o mineralocorticoide (aldosterona) y corticosteroide (Figura 5).
Respuesta urinaria a la administración intracerebroventricular de adrenomedulina en ratas con operación simulada (SHAM) o adrenalectomizadas con terapia hormonal sustitutiva: dexametasona (DEX) 4 mg/kg, s.c. y aldosterona (ALD) 20 μg/ml/kg i.p., el día de la cirugía y dos días después
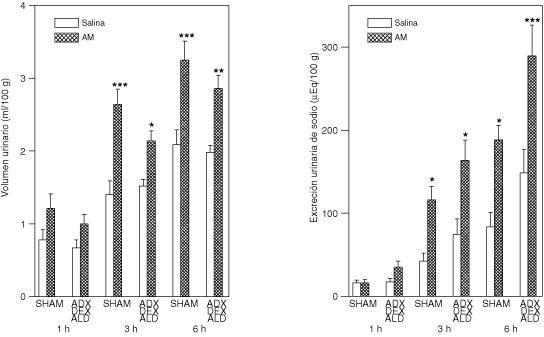
Los grupos de ratas fueron los siguientes: SHAM pretratados con vehículo (10% etanol, 0.85% NaCl, i.p) 90 minutos antes de que recibieran solución fisiológica (5 µl, ICV) (N=12) o AM (100pmol/5µl) (N=10); ratas ADX-DEX-ALD, pretratadas el día del experimento con ALD (20μg/ml/kg, i.p) 90 antes de la administración de solución fisiológica (N=12) o AM (100pmol/5 µl, ICV) (N=17). Se muestran las medias ± EEM. *p<0.05, **p<0.01 y ***p<0.001, comparado con el grupo control (solución fisiológica).
DISCUSIÓN
Existe evidencia de la presencia de un sistema adrenomedulinérgico en el SNC. Así, se ha descrito la producción de AM y la presencia de sitios de unión para la AM en el cerebro del humano y de la rata(4,23,24,25). Se ha propuesto que estructuras tales como el área postrema y el núcleo paraventricular pudieran estar envueltas en la acción central de la AM, donde la AM actuaría como un neurotransmisor, un neuromodulador o una neurohormona(26), participando así en la regulación del balance hidromineral(10,11,12). En efecto, la administración central de AM inhibe la ingesta de agua y sal (Samson) y aumenta la excreción urinaria de agua y sal(16).
El mecanismo que media la diuresis y natriuresis inducida por la AM(16), podría ser multifactorial, implicando la reducción de la liberación de AVP, la reducción en el eflujo simpático o la liberación reducida de la secreción de aldosterona (ALD) desde la corteza de la glándula suprarrenal.
De manera similar a otros péptidos reguladores presentes en la glándula suprarrenal(27), la AM afecta la actividad secretoria de la corteza suprarrenal de la rata y el humano. Sin embargo, la naturaleza de este efecto es controversial ya que la evidencia indica acciones estimuladoras o inhibidoras sobre la secreción de aldosterona(28). En efecto, la AM in vitro inhibe significativamente la secreción de aldosterona estimulada por angiotensina II, potasio y el ionóforo de calcio, A23187, en células dispersadas de la zona glomerulosa de la glándula suprarrenal de la rata sin afectar la producción de aldosterona basal o estimulada por la ACTH(18,20). Igualmente, en la rata in vivo en la que la secreción de aldosterona fue estimulada por una dieta deficiente de sodio o por nefrectomía bilateral, la administración de AM periférica inhibe significativamente la secreción de aldosterona en respuesta a cualquier manipulación(18). Contrariamente, se ha reportando un efecto estimulador de la AM sobre la secreción de aldosterona en la preparación de glándula suprarrenal intacta superfundida de rata(20). Recientemente se han demostrado in vivo acciones opuestas de la AM sobre la glándula suprarrenal: un efecto estimulador observado cuando la secreción de aldosterona es inhibida y un efecto inhibitorio cuando la aldosterona es estimulada. En condiciones basales estas dos acciones parecen anularse mutuamente(29). En la corteza suprarrenal humana, las acciones de la AM dependen del tipo de preparación de tejido usada, así la AM es capaz de estimular la secreción de aldosterona en preparaciones de tejido intacto tales como rebanadas de suprarrenal, pero inhibir cuando se utilizan células dispersadas(19). Aunque controversial, sin embargo el peso de la literatura publicada sugiere que la AM ejerce una acción predominantemente inhibitoria sobre la aldosterona a nivel celular(28).
La mayoría de los péptidos reguladores afectan la función de la corteza suprarrenal a través de dos vías: (i) pueden actuar de una manera paracrina, uniéndose a receptores específicos localizados en las células adrenocorticales o produciendo la liberación de otras moléculas reguladoras de las células cromafines, las cuales actuarían sobre las células adrenocorticales; (ii) pueden modular uno o más mecanismos extra-suprarrenales (por ejemplo, liberación de ACTH desde la pituitaria o liberación de renina desde el riñón) envueltos en el control multifactorial integrado de la actividad secretoria de la corteza suprarrenal(27).
La adrenomedulina ejerce un papel en el control neuroendocrino de la corteza suprarrenal. La AM inhibe la liberación de ACTH basal y estimulada por CRH en cultivo de células de la pituitaria anterior de la rata(30). De igual forma la infusión intravenosa del péptido en ovejas conscientes reduce significativamente los niveles plasmáticos de ACTH(31). Además, se ha demostrado que la administración de AM-ICV inhibe la liberación de AVP inducida por la hiperosmolaridad en ratas(13). Se desconoce si este efecto de la AM ocurre al mismo tiempo que la acción antimineralocorticoide reportada in vivo para la AVP(18), una hormona conocida como estimuladora de la zona glomerulosa y de la secreción de aldosterona(27).
Nuestros resultados muestran que cuando los riñones están bajo la influencia máxima de la aldosterona exógena, la AM administrada centralmente es aún capaz de incrementar la excreción de sodio, es decir el pretratamiento con exceso de aldosterona no previene el efecto natriurético de la AM-ICV, lo cual sugiere que esta acción es independiente de los niveles circulantes de aldosterona.
Se ha sugerido que la AM juega un papel en la regulación de la secreción de aldosterona en situaciones en las que la síntesis de angiotensina II está aumentada. Así, la AM administrada periféricamente no afecta las concentraciones de aldosterona plasmática ni suprarrenal en ratas normales, pero los reduce significativamente en animales privados de sodio(18,32). Al estudiar el efecto de la AM-ICV sobre los niveles de aldosterona plasmáticos en un modelo animal en el cual el sistema renina-angiotensina-aldosterona se encuentra activado, como lo son las ratas sometidas a una dieta baja en sodio durante tres semanas, observamos que la administración central de éste péptido no produjo cambios en los elevados niveles plasmáticos de aldosterona.
Estos hallazgos, claramente demuestran que la natriuresis inducida por la AM-ICV no esta relacionada con los niveles plasmáticos de aldosterona y excluye la posibilidad del retiro de la actividad mineralocorticoide en los riñones como un mecanismo eferente. Esto coincide con los resultados obtenidos en ovejas conscientes con autotransplante cervical de suprarrenales, sometidas a una dieta deficiente en sodio, en las que la infusión de AM no redujo los niveles plasmáticos de aldosterona. Sin embargo, en este estudio, la AM inhibió la estimulación aguda de aldosterona por la Ang II, KCL o ACTH(33).
Si la acción renal de la AM administrada centralmente es independiente de los niveles circulantes de aldosterona, la ausencia de esta hormona no debería afectar las acciones de la AM. Evaluamos esta posibilidad mediante el estudio de los efectos renales de la AM-ICV en ratas a las que se les suprimió las glándulas suprarrenales, en ausencia y en presencia terapia hormonal de reemplazo. Este modelo experimental se aproxima a niveles muy bajos o nulos de aldosterona. Esta preparación ha sido usada para examinar las acciones renales de diversos péptidos(34) y además permite evaluar la importancia de las glándulas suprarrenales en la acción central de la AM sobre la función renal.
La adrenalectomía bilateral produce diversos cambios en el volumen sanguíneo, la función cardíaca y el estado de hidratación. Todos y cada uno de estos factores pudieran interferir en la respuesta diurética y natriurética de la AM administrada centralmente. Sin embargo, es bien conocido que estos cambios pueden ser corregidos por la administración de glucocorticoides y por el mantenimiento de los animales con alta ingesta de sodio(35). Así, podemos asumir que las ratas ADX-tratadas tienen un volumen circulatorio normal y una hemodinamia cardíaca y renal normal. Las limitaciones en la interpretación de los datos de las ratas ADX, con una función renal teóricamente comprometida, fueron parcialmente resueltas por los experimentos en paralelo con ratas ADX con reemplazo hormonal.
Nuestros resultados en los que se demuestra que la ADX, con o sin sustitución hormonal, no afecta la repuesta renal a la administración intracerebroventricular de AM, indica que la AM es capaz de ejercer sus acciones diuréticas y natriuréticas en ausencia de las glándulas suprarrenales y de forma independiente de los niveles de mineralocorticoides (ausencia o exceso).
Agradecimientos
Los autores agradecen al Sr. Francis Brito por su asistencia técnica y al Fondo Nacional de Ciencias Innovación y Tecnología (FONACIT) por el financiamiento como proyecto S1 200000503.
REFERENCIAS BIBLIOGRÁFICAS
1. Ichiki Y, Kitamura K, Kangawa K, Kawamoto M, Matsuo H, Eto T. Distribution and characterization of immunoreactive adrenomedullin in human tissue and plasma. FEBS Letters 1994; 338: 6-10. [ Links ]
2. Kitamura K, Sakata J, Kangawa K, Kojima H, Matsuo H, Eto, T. Cloning and characterization of cDNA encoding a precursor for human adrenomedullin. Biochemical Biophysics Research Communications 1993; 194: 720-725. [ Links ]
3. Satoh F, Takahashi K, Murakami O, Totsune K, Sone M, Ohneda M, Abe K, Miura Y, Hayashi Y, Sasano H, Mouri T. Adrenomedullin in human brain, adrenal glands and tumor tissues of pheochromocytoma, ganglioneuroblastoma and neuroblastoma. J Clinical Endocrinology Metabolism 1995; 80: 1750-1752. [ Links ]
4. Satoh F, Takahashi K, Murakami O, Totsune K, Sone M, Ohneda M, Susano H, Mouri T. Immunocytochemical localization of adrenomedullin-like immunoreactivity in the human hypothalamus and the adrenal gland. Neuroscience Letters 1996; 203: 207-210. [ Links ]
5. Hwang IS, Tang F. The distribution and gene expression of adrenomedullin in the rat brain: peptide/mRNA and precursor/active peptide relationships. Neuroscience Letters 1999; 267:85-88. [ Links ]
6. Ueta Y, Kitamura K, Isse T, Shibuya I, Kabashima N, Yamamoto S, Kangawa K, Matsuo H, Eto T, Yamashita H. Adrenomedullin-immunoreactive neurons in the paraventricular and supraoptic nuclei of the rat. Neuroscience Letters 1995; 202: 37-40. [ Links ]
7. Owji AA, Smith DM, Coppock HA, Morgan GA, Bhogal R, Ghatei MA, Bloom SR. An abundant and specific binding site for the novel vasodilator adrenomedullin in the rat. Endocrinology 1995; 136: 2127-2134. [ Links ]
8. Oliver KV, Wainwright A, Heavens RP, Hill RG, Sirinathsinghji DJS. Distribution of novel CGRP1 receptor and adrenomedullin receptor mRNAs in the rat central nervous system. Molecular Brain Research 1998; 57:149-154. [ Links ]
9. Takahashi K, Satoh F, Sone M, Murakami O, Sasano H, Mouri T, Shibahara S. Expression of adrenomedullin mRNA in the human brain and pituitary. Peptide 1997; 18: 1051-1053. [ Links ]
10. Samson WK, Murphy TC. Adrenomedullin inhibits salt appetite. Endocrinology 1997; 138: 613-616. [ Links ]
11. Samson WK. Adrenomedullin and the control of fluid and electrolyte homeostasis. Annual Rev Physiology 1999; 61: 363-389. [ Links ]
12. Murphy TC, Samson WK. The novel vasoactive hormone, adrenomedullin, inhibits water drinking in the rat. Endocrinology 1995; 136: 2459-2463. [ Links ]
13. Yokoi H, Arima T, Kondo K, Iwasaki Y, Oiso Y. Intracerebroventricular injection of adrenomedullin inhibits vasopressin release in conscious rats. Neuroscience Letters 1996; 216: 65-67. [ Links ]
14. Charles CJ, Rademaker MT, Richards AM, Cooper GJ, Coy DH, Nicholls MG. Hemodynamic, hormonal, and renal effects of intracerebroventricular adrenomedullin in conscious sheep. Endocrinology 1998; 139: 1746-1751. [ Links ]
15. Saita M, Shimokawa A, Kunitake T, Kato K, Hanamori T, Kitamura K, Eto T, Kannan H. Central actions of adrenomedullin on cardiovascular parameters and sympathetic outflow in conscious rats. American J Physiology (Regulatory Integrative Comparative Physiology 43) 1998; 274: R979-R984. [ Links ]
16. Israel A, Díaz E. Diuretic and natriuretic action of adrenomedullin administered intracerebroventricularly in conscious rats. Regulatory Peptides 2000; 89: 13-18. [ Links ]
17. Nusdorferr G, Rossi G, Mazzochi G. Role of adrenomedullin and related peptides in the regulation of the hypothalamo–pituitary-adrenal axis. Peptides 1997; 18: 1079-1089. [ Links ]
18. Yamaguchi T, Baba K, Doi Y, Yano K, Kitamura K, Eto T. Inhibition of aldosterone production by adrenomedullin, a hypotensive peptide, in the rat. Hypertension 1996; 28: 308-314. [ Links ]
19. Andreis P, Neri G, Prayer T, Rossi G, Gottardo G, Malendowics L, Nussdorfer G. Effects of adrenomedullin on the human adrenal glands: an in vitro study. J Clin Endocrinol Metab 1997; 82: 1167-1170. [ Links ]
20. Mazzocchi G, Musajo F, Neri G, Gottardo G, Nussdorfer G. Adrenomedullin stimulates steroid secretion by isolated perfused rat adrenal glan in situ: comparison with calcitonin gene-related peptide effects. Peptides 1996; 17: 853-857. [ Links ]
21. Kubasic N. Evaluation a new commercial radioassay kit for aldosterone using and iodinated tracer. Clin Biochem 1979; 12: 59-61. [ Links ]
22. Lowry O, Rosenbrough N, Farr A, Randl R. Protein measurement with the folin phenol reagent. J Biological Chemistry 1951; 193: 265-275. [ Links ]
23. Sone M, Takahashi K, Satoh F, Murakami O, Totsune K, Ohneda M, Sasano H, Ito H, Mouri T. Specific adrenomedullin binding sites in the human brain. Peptides 1997; 18: 1125-1129. [ Links ]
24. Juaneda C, Dumont Y, Chabot J, Quirion R. Autoradiographic distribution of adrenomedullin receptors in the rat brain. Eur J Pharmacol 2001; 421: R1-R2. [ Links ]
25. Minamino N, Kikumoto K, Isumi Y. Regulation of adrenomedullin expression and release. Microsc Res Tech 2002; 57: 28-39. [ Links ]
26. Serrano J, Alonso D, Fernández J, Encinas J, López J, Castro-Blanco S, Fernández-Vizarra P, Richard M, Santacana M, Uttenthal O, Ventura M, Mez-Murillo R, Martínez A, Cuttita F, Rodrigo J. Adrenomedullin in central nervous system. Microsc Res Tech 2002; 57: 76-90. [ Links ]
27. Nussdofer G. Paracrine control of adrenal cortical function by medullary chromaffin cells. Pharmacol Rev 1996; 48: 496-530. [ Links ]
28. Kapas S, Hinson J. Adrenomedullin in the adrenal. Microsc Res Tech 2002; 57: 91-97. [ Links ]
29. Albertin G, Malendowicz L, Tortorella C, Mazzochi G, Nussdofer G. Evidence for a paracrine role of adrenomedullin in the physiological resetting of aldosterone secretion by rat adrenal zona glomerulosa. Peptides 2000; 21: 413-417. [ Links ]
30. Samson W, Murphy T, Schell D. A novel vasoactive peptide, adrenomedullin, inhibits pituitary adrenocorticotropin release. Endocrimology, 1995; 136: 2349-2352. [ Links ]
31. Parkers D, May C. Direct cardiac and vascular actions of adrenomedullin in conscious sheep. Br J Pharmacol 1997; 120: 1179-1185. [ Links ]
32. Charles Ch, Rademaker M, Richards M, Cooper G, Coy D, Jing N, Nicholls H. Hemodynamic, hormonal, and renal effects of adrenomedullin in conscious sheep. Am J Physiol 1997; 272: R2040-R2047. [ Links ]
33. Salemi R, McDougall J, Ardí K, Wintour E. Effect of adrenomedullin infusion on basal and stimulated aldosterone secretion in conscious sheep with cervical adrenal autotransplants. J Endocrinol 2000; 166: 389-399. [ Links ]
34. Musabayane C, Ndhlovu C, Forsling M, Balment R. Interaction of aldosterone and oxytocin to influence renal sodium excretion in rats. Experimental Physiology 1994; 79: 763-774. [ Links ]
35. Israel A, Torres M, Barbella Y. Natriuretic and diuretic action of centrally administered rat atrial natriuretic peptide (99-126): possible involvement of aldosterone and the sympathoadrenal system. Can J Pharmacol 1988; 66: 295-300. [ Links ]













