Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT v.23 n.2 Caracas jul. 2004
Perfil Dopaminérgico del compuesto 2-aminoindano N-aralquíl sustituido
JE Angel-Guío1, JE Charris2, A Israel3, B Migliore de Angel4, H Suárez-Roca4, MR Garrido3, SE López5, E Díaz3,
R Ferrer1, E Michelena de Báez1, LJ Rodríguez1, J Silva4, A Moronta4, G Espinoza4 y L Quintero4.
1 Laboratorio de Síntesis Orgánica y Diseño de Fármacos. Departamento de Química, Facultad Experimental de Ciencias.
2 Laboratorio de Síntesis Orgánica.
3 Laboratorio de Neuropéptidos, Facultad de Farmacia, Universidad Central de Venezuela.
4 Sección de Farmacología. Instituto de Investigaciones Clínicas. Dr. Américo Negrette., Facultad de Medicina. Universidad del Zulia, Maracaibo. Venezuela.
5 Laboratorio de Química Orgánica 210. Dpto. de Química. Universidad Simón Bolívar.
E-mail: jangel@luz.ve, jangel63@yahoo.com, jangel63@hotmail.com.
Resumen
El sistema dopaminérgico central está implicado en las diversas etiologías que involucran a patologías neuropsiquiátricas, tales como la enfermedad de Parkinson, la depresión y la esquizofrenia. Son numerosas las drogas dopaminérgicas utilizadas en el tratamiento de esas dolencias, sin embargo estas terapias causan serios efectos adversos. En este contexto, la génesis de nuevos y más eficientes agentes dopaminérgicos, representa un vasto campo de investigación. En el presente trabajo se sintetizó el compuesto 3, concebido como un ligando dopaminérgico, y se evaluó el perfil de su acción dopaminérgica mediante administración central del compuesto y la determinación de parámetros conductuales como el comportamiento estereotipado (roer) y la medición de la respuesta renal en ratas. Los resultados de la evaluación farmacológica muestran que el compuesto 3 bloquea significativamente la estereotipia inducida por apomorfina, e inhibe la diuresis y natriuresis inducida por la administración central de dopamina. Estos hallazgos sugieren que el compuesto 3 se comporta como un antagonista dopaminérgico, frente a la respuestas tanto conductuales como renales.
Palabras Clave: Dopamina, Derivados N-araquil-2-aminoindanos sustituido, Estereotipia, Apomorfina, Diuresis y natriuresis.
Abstract
Brain dopaminergic system has a crucial role in the etiology of several neuropsychiatric disorders, including Parkinsons disease, depression and schizophrenia. Several dopaminergic drugs are used to treat these pathologies, but many problems are attributed to these therapies. Within this context, the search for new more efficient dopaminergic agents with less adverse effects represents a vast research field. The aim of the present study was to synthesize compound 3, planned to be dopamine ligand, and to evaluate its dopaminergic action profile. This compound was assayed in two experimental models: stereotyped behavior (gnaw) and renal urinary response, after central administration. The pharmacological results showed that compound 3 significantly blocked the apomorphine-induced stereotypy and dopamine-induced diuresis and natriuresis in rats. On the basis of this results compound 3 demonstrated an inhibitory effect on dopaminergic behaviors and renal actions.
Key Words: Dopamine, N-aralkil substitution of 2-aminoindan, Stereotyped, Apomorphine, Diuresis and natriuresis.
Introducción
La dopamina es una amina biógena que pertenece a los neurotransmisores catecolaminérgicos y constituye alrededor del 80% del contenido de dichas sustancias en el cerebro. La dopamina controla diversas funciones, que incluyen la actividad motora, los estados afectivos y la liberación de hormonas. Además está implicada en las etiologías que involucran a los desórdenes neurodegenerativos, que incluyen a la enfermedad de Parkinson, la depresión y la esquizofrenia(1,2). Adicionalmente, la dopamina cerebral es reconocida actualmente como un importante modulador de la presión arterial sistémica mediante su participación en los procesos de regulación del balance de los fluidos y electrolitos, así como en la liberación de vasopresina(3,4). La esquizofrenia es una enfermedad psiquiátrica crónica que afecta aproximadamente al 1% de la población mundial. Generalmente, los pacientes esquizofrénicos presentan dos tipos principales de síntomas conocidos como los positivos, que incluye entre otros, los delirios y las alucinaciones, mientras que entre los negativos encontramos los estados de aislamiento, las apatías y la dificultades de concentración. La mayoría de las drogas antipsicóticas utilizadas en el tratamiento de la esquizofrenia bloquean al receptor D2 para contrarrestar esta enfermedad. Estos fármacos son efectivos únicamente en el manejo de los síntomas positivos, pero generan efectos adversos, tales como, los trastornos extrapiramidales y la disquinesia tardía(1,2). Es por ello que la búsqueda de nuevos y más eficaces agentes dopaminérgicos con menos efectos adversos, constituye actualmente un campo de investigación extremadamente activo.
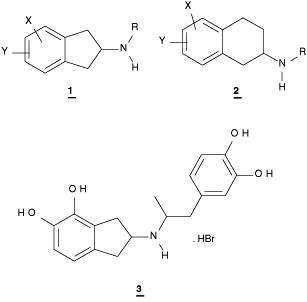
Durante las últimas décadas, han sido reportados una gran cantidad de análogos de los compuestos 2-aminoindanos 1 y las 2-aminotetralinas 2 N-substituidos, con acción tanto a nivel del sistema nervioso central como periférico(5-8). De acuerdo a las bien establecidas relaciones estructura-actividad biológica para los compuestos dopaminérgicos, diversos autores(9-11), y nuestro propio estudio teórico conformacional(12), ha permitido predecir que el compuesto 3 es un ligando con potencial actividad dopaminérgica, debido especialmente a que en su estructura está presente el fragmento del farmacóforo necesario para la interacción con el receptor dopaminérgico (fragmento m-hidroxifenil etilamino). El compuesto 3 representa un análogo rígido del α rotámero de la dopamina con dos sustituyentes hidroxílicos sobre el anillo aromático del grupo aralquíl (Figura 1). En el presente trabajo se incluye la síntesis del compuesto 3 y la evaluación de su perfil farmacológico.
Estructuras de los compuestos 1- 3
Material y Métodos
Química
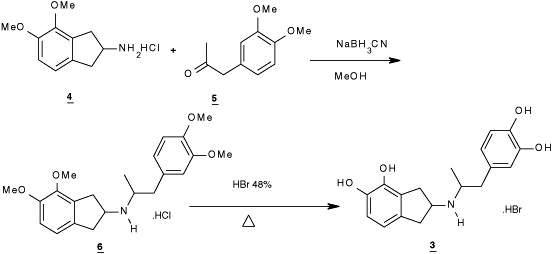
A través de una reacción de aminación reductiva, al mezclar el derivado 4 con la cetona 5 como se muestra en la figura 2, se obtuvo el compuesto 6. Subsecuentemente, el derivado 6 fue hidrolizado para dar el compuesto 3(14). El compuesto 4,5-dimetoxi-2-aminoindano HCL(4) fue obtenido de acuerdo al procedimiento descrito en la literatura(6-7,13).
Los puntos de fusión no fueron corregidos y se determinaron mediante el uso de un aparato "Thomas Hoover Capillary Melting Point". Los espectros de resonancia magnética nuclear (RMN) fueron registrados a través de un espectrómetro marca Jeol JNNEX 270 FT a 67.80 MHz (13C) y a 270.05 MHz (1H) siendo reportado en ppm (δ) la señal del TMS como estándar interno a campo bajo. Los espectros de infrarrojo se realizaron como pastillas de KBr en un espectrofotómetro modelo Shimadzu 470. Los espectros de masas se registraron en un espectrómetro de masa marca Hewlett Packard 5995. La pureza de todos los compuestos fue determinada por cromatografía de capa fina usando solventes con distinta polaridad. Los análisis elementales fueron realizados por Atlantic Microlab, Inc., Norcross, GA. USA, y los resultados obtenidos estuvieron entre ± 0.4% de los valores calculados. Todos los solventes fueron destilados y secados del modo usual.
Obtención del cloruro de N-[2-(4,5-dimetoxifenil)-metil-etil]-4,5-dimetoxi-2-amino indano(7): En un balón de tres bocas se añadió en 80 ml de metanol, 2.0 g (10 mmol) de cloruro de 4,5-dimetoxi-2-aminoindano 5, 1.94 g, (10 mmol) de la 4,5-dimetoxi-fenilacetona 6 y 0,94 g (15 mmol) del cianoborhidruro de sodio con agitación constante bajo atmósfera de nitrógeno por 48 h. La mezcla resultante fue tratada con un exceso de HCl 2N. El solvente fue removido bajo presión reducida, el sólido remanente fue disuelto en H2O y la solución acuosa fue extraída con éter. Se llevó la capa acuosa a pH alcalino con una solución al 20% de NaOH y la misma fue extraída con CHCl3. La capa orgánica fue secada sobre sulfato de magnesio anhidro y se indujo la precipitación al pasarle una corriente de HCl seco a través de la solución. Los cristales resultantes fueron recolectados por filtración. La recristalización fue llevada a cabo con isopropanol-eter (70%); m.p. 167-168 °C. IR (KBr) cm-1: 2950 (CH3); 2900 (CH2); 2.800-2750, 1625, 1612, 1525 (R2NH2+Cl-); 1488, 1463 (C=C); 1275, 1263, 1075, 1028 (C-O-C); 800 (ArH). 1H RMN (CDCl3): δ 1.06 (d,3H,J= 10.8 Hz, CH3); 1.72 (bb, R2NH); 2.36-2.48 (m,2H,CH2Ar); 2.55 (dd, 1H, J= 5.4 Hz, Hax (C1-Indano)); 2.65 (dd,1H, J= 5.4 Hz, Hax (C3-Indano)); 3.06 (dd,1H, J= 5.4 Hz, Heq (C1-Indano)); 3.16 (dd,1H, J= 5.4 Hz, Heq (C3-Indano)); 2.93-3.26 (m,1H,-CH(CH3)CH2Ar); 3.86 (m,13 H, (-OCH3)4, CH(C2-Indano)); 6.64 (dd, 1H, J= 8.1 Hz y 2.97 Hz, ArH (C6-Aralquil)); 6.67 (d, 1H, J= 8.1 Hz, ArH (C5-Aralquil)); 6.70 (d, 1H, J= 8.1 Hz, ArH, (C6-Indano); 6.75 (d, 1H, J= 2.97 Hz, ArH (C2-Aralquil)); 6.81 (d, 1H, J= 8.1 Hz, ArH (C7-Indano)). 13C NMR: 15 (CH3); 35 (CH2Ar); 37 (C1-C3 Indano); 41 (CH(CH3)CH2Ar); 51 (C2-Indano); 56, 57, 60 (OCH3)4; 112, 113, 114, 121, 122, 130, 133, 134, 145, 148, 149, 152 (C, ArH). DEPT: 15(CH3); 35 (CH2Ar) (Señales invertidas); 37 (C1-C3 Indano) (Señales invertidas); 41 (CH(CH3)CH2Ar); 51 (C2-Indano); 56,57,60 (OCH3)4; 112 (C6-Aralquil); 113 (C5-Aralquil); 114 (C6-Indano); 121 (C2-Aralquil); 122 (C7-Indano). EM m/e: No muestra el ion molecular, 220 (100%); 177 (50%); 146 (10%); 91 (6%), 77 (4%).
C22H30O4NCl: 407.94. Anal. Calc. C: 64.77, H: 7.41, N: 3.43. Encontrado: C: 65.03, H: 7.17, N: 3.26
Obtención del Bromhidrato de N-[2-(4,5-dihidroxifenil)-metil-etil]-4,5-dihidroxi-2-aminoindano(4): Una solución de 5 ml de HBr al 48% se añadió sobre 0,40 g (1.0 mmol) de la amina clorhidrato 7 en un balón de tres bocas, bajo reflujo y con atmósfera de nitrógeno por 5 h. Posteriormente el solvente fue removido bajo presión reducida y el residuo sólido fue recristalizado con isopropanol-eter (70%), m.p. 149-150 °C.
IR (KBr) cm-1: 3625-3050 (OH); 2975 (CH3); 1625, 1512 (R2NH2+); 1506 (C=C); 1300-1225 (C-O-H). 1H RMN (DMSO-d6): δ 1.07 (d,3H, J= 6.43 Hz, CH3); 2.5-3.47 (m,7H,CH2Ar,CH2(C1-Indano), CH2(C3-Indano); CH(CH3)CH2Ar); 3.95 (m,1H,CH(C2-Indano)); 6.51 (d,1H,J= 7.91 Hz, ArH (C6-Aralquil)); 6.53 (d,1H, J= 7.91 Hz, ArH (C5-Aralquil)); 6.61 (d,1H, J= 7.91 Hz, ArH (C6-Indano)); 6.64 (s,1H,ArH, (C2-Aralquil)); 6.69 (d,1H, J= 7.91 Hz, (C7-Indano)); 8.04-8.60 (bb, (OH)4); 8.90 (bb, NH2+Br-). 13C RMN: δ 15.70 (CH3); 18.66 (CH2Ar); 34.83 (C1,C3-Indano); 37.29 (CH(CH3)CH2Ar); 51.12 (C2-Indano); 115.30 (C6-Aralquil); 116.28 (C5-Aralquil); 117.21 (C6-Indano); 121 (C2-Aralquil)); 126.8 (C7-Indano); 127, 128, 131, 142, 143, 145, 146 (C, ArH). C18H22O4NBr : 396.28. Anal. Calc. C: 54.56, H: 5.59, N: 3.54, Anal. Encontrado: C: 54.93, H: 5.27, N: 3.59
Ruta sintética del Bromhidrato de N-[2-(3,4-dihidroxifenil)-metil-etil]-4,5-dihidroxi-2-aminoindano (4)
Evaluación de la actividad biológica
Estudios conductuales: Se utilizaron ratas macho Sprague-Dawley, de 200-250 g de peso corporal (Centro Tecnológico IVIC, Caracas), mantenidas bajo períodos alternativos de luz y oscuridad, con libre acceso al agua y alimento estándar (Ratarina®, Protinal). Se les implantó una cánula en el ventrículo lateral derecho de acuerdo con las siguientes coordenadas: 0.40 mm bregma, 1.1 mm lateral, 2.2 mm ventral, y mediante la ayuda de un aparato estereotáxico, bajo anestesia con pentobarbital sódico (40 mg/kg, i.p.). Después de tres días de recuperación, se procedió a infundir lentamente en el ventrículo cerebral: vehículo (NaCl 0.9%) (grupo control) o el compuesto 3 (0.6 y 6 μg/ml), disuelto en solución isotónica de cloruro de sodio (0.9%), a una tasa de 0.5 μl/min. A dos grupos de ratas pretratadas con el compuesto 3 o vehículo, se les administró apomorfina HCl (APO) (Sandoz S.A., Basel, Switzerland) (1 mg/kg, i.p.) diez minutos antes del inicio de la observación conductual. Se monitoreó el comportamiento de los animales por un período de 45 minutos, a intervalos de 4.5 minutos, en cámaras de Plexiglas transparentes (32x28x28 cm) mediante el registro asistido por computadora de la conducta estereotipada de roer (repetitiva y sin propósito).
Evaluación de la acción renal: Se utilizaron ratas macho, Sprague-Dawley, (220-280g) mantenidas bajo condiciones controladas de temperatura y fotoperíodos (luz entre 0600 a 1800 hr) a las cuales le fue permitido libre acceso a agua y comida. Se implantó una cánula en el ventrículo lateral izquierdo, 1 mm caudal a la sutura coronal y 1.5 mm lateral a la sutura sagital con ayuda de un aparato estereotáxico (David Kopf Instruments), bajo anestesia con pentobarbital sódico (40 mg/kg, ip). La cánula fue fijada al cráneo mediante cemento acrílico. Se le permitió a los animales una recuperación de, al menos, tres días. Las inyecciones intracerebroventriculares (ICV) fueron realizadas con una jeringa Hamilton acondicionada con un tope para asegurar sólo la penetración necesaria de la aguja.
Los animales fueron distribuidos al azar en los siguientes grupos experimentales: V: control vehículo (NaCl 0.9%, 5 o 10 ml), DA: dopamina (100 μg/5μl, ICV); C3: compuesto 3 (50μg/5μl, ICV); y DA+C3 (15 min. antes de la DA). Los animales fueron pesados, se les administró una carga oral de agua (20 ml/kg) y fueron colocados en jaulas metabólicas individuales, agua y comida fueron retirados durante el experimento. La orina fue recolectada a las 3 y 6 hr; la vejiga fue vaciada suavemente mediante masaje suprapúbico. La canulación fue confirmada post-mortem examinando la distribución de la inyección ICV de 5 μl de una solución de colorante (fast green) previa a la decapitación del animal. Sólo se utilizaron los datos experimentales de aquellos animales en los que el colorante se había distribuido en los ventrículos laterales, tercero y cuarto. El sodio y potasio en las muestras de orina recolectadas fue determinado mediante fotometría de llama. Todos los resultados se expresan como la media ± error estandar de la media (E.E.M.).
Las diferencias estadísticas entre los diferentes grupos fueron evaluadas mediante el análisis de variancia de una o dos vías (ANOVA) y el rango estadístico de Student-Newman Keuls o Duncan, según el caso. Se consideró como estadísticamente significativos los valores de p menores de 0.05 (p<0.05).
Resultados y discusión
La estereotipia es un componente importante de numerosos desórdenes psiquiátricos, incluyendo el autismo infantil(15) o la esquizofrenia(16). Está bien establecido que el comportamiento estereotipado en ratas incluye la conducta de oler y roer y que dependen de la acción de la dopamina(17). Se ha demostrado que el sustrato neural del comportamiento estereotipado inducido por la apomorfina en animales incluye las proyecciones dopaminérgicas centrales hacia la región del caudado-putamen(18). Está bien reconocido que la apomorfina es un agonista mixto de los receptores D1/D2 dopaminérgicos(17,19). La activación de los receptores D1/D2 a nivel del cuerpo estriado se expresa como la respuesta de un comportamiento excesivo y repetitivo (estereotipia). Aun más, se ha demostrado que en ratas adultas y neonatas, lesionadas con 6-hidroxidopamina (6OH-DA), el comportamiento estereotipado es el producto de la activación de ambos subtipos de receptores. Recientemente se ha postulado al receptor D1 como responsable de la iniciación del comportamiento estereotipado, mientras que la participación del receptor D2 involucra el mantenimiento de dicha acción, pero no así el proceso de iniciación. Es por ello que la acción combinada de los antagonistas D1/D2 bloquean la estereotipia de manera más efectiva que el bloqueo selectivo mediante un antagonista selectivo del receptor D1(20). Los resultados de los experimentos reportados en el presente estudio demuestran que el compuesto 3 (0,6 μg/ml y 6 μg/μl), por si sólo, no induce el comportamiento estereotipado (roer). Ahora bien, la administración central del compuesto 3 a la dosis de 6 μg/μl redujo y a la dosis de 0,6 mg/ml inhibió significativamente la estereotipia inducida por la apomorfina (Figura 3), lo que indica que en el sistema nervioso central el compuesto 3 actúa como un antagonista dopaminérgico. Si embargo, la selectividad como antagonista de los receptores dopaminérgicos involucrados en la estereotipia se logra con el uso de bajas dosis.
Efecto de la administración ICV del compuesto 3 (0.6 µg/µ y 6 µg/µl) sobre la conducta estereotipada
(roer) de la rata
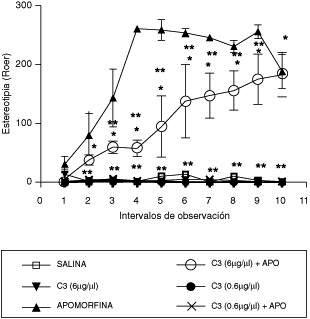
En el eje de las ordenadas se muestra el número de roídas por cada intervalo. En el eje de las abscisas el número de intervalos de medición. La conducta fue observada por 45 minutos, en intervalos de 4,5 min. cada uno. Los controles fueron inyectados con solución salina (0,9%) y apomorfina (1mg/kg de s.c.). Los resultados fueron expresados como el promedio ± E.E.M. de cuatro mediciones. *p< 0.0001 comparado con el vehículo y **p<0.0001 comparado con apomorfina. Se utilizó el análisis de varianza (ANOVA) de una y dos vías, seguido de la prueba de Duncan. Los resultados del compuesto 3 y del compuesto 3 + apomorfina se superponen con la del control salino.
Evaluamos asimismo, la respuesta renal a la administración central del compuesto 3(21-24). Como se muestra en la figura 4, la administración intracerebroventricular del compuesto 3 no altera el volumen urinario ni la excreción urinaria de sodio en el período de 6 horas de recolección. Sin embargo, el pretratamiento central con el compuesto 3 bloqueó completamente la diuresis y natriuresis inducida por la DA (Figura 4). Varios neurotransmisores aplicados centralmente son capaces de modular la excreción de agua y electrolitos(21,24). Se ha sugerido que las neuronas dopaminérgicas participan en la regulación de la presión sanguínea y de la sed, y posiblemente, en la regulación de la liberación de vasopresina(4). El sistema dopaminérgico hipotalámico, ha sido involucrado en el control central del balance de los fluidos y electrolitos(21,22). Más aún, la DA cuando es administrada por vía ICV, incrementa la excreción renal de sodio(21,22) resultados presentes, por lo que se le ha implicado en la regulación central de la excreción de electrolitos.
Respuesta urinaria a la administración ICV de DA en ratas pretratadas con el compuesto 3
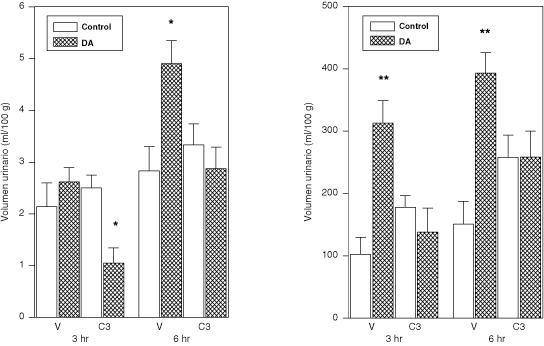
Grupos de ratas recibieron una inyección ICV del compuesto 3 (C3) (50 µg/5µl) (N= 6-7), o vehículo (V) (5µl) (N= 6-7) 15 minutos antes de la administración ICV de DA (100 µg/5µl) o salina (5 µl) seguida por la administración de agua p.o. (20 ml/kg). *p<0.05 y **p<0.01, comparado con el control.
Nuestros resultados en los que se muestra la acción inhibitoria del compuesto 3 sobre la conducta estereotipada (roer) inducida por la apomorfina y la diuresis y natriuresis inducida por la dopamina, están de acuerdo con las predicciones de nuestro estudio teórico conformacional, y sugieren fuertemente que este compuesto puede representar un potencial antagonista dopaminérgico. Esto estaría en concordancia con los resultados reportados sobre la obtención de respuestas antagonistas cuando se incorpora un grupo hidroxilo en el anillo aromático del fragmento aralquíl(12). Así, se postula que el fragmento del compuesto 3 constituido por el 4,5-dihidroxi-2-aminoindano, interactuaría con el receptor desplazando al ligando (apomorfina o dopamina); sin embargo, los grupos hidroxilo presentes en el fragmento aralquílico hace que adopte una conformación particular que imposibilita su interacción con el sitio activo del receptor y por ende la completa activación del complejo droga-receptor(12). Es necesaria la realización de experimentos adicionales para cada diasteroisómero del compuesto 3 con los ligandos dopaminérgicos específicos a fin de confirmar esta hipótesis.
En conclusión, el compuesto 3, parece tener un perfil de acción coherente con la función dopaminérgica. En base a los resultados obtenidos sobre la estereotipia inducida por apomorfina y las acciones renales mediadas centralmente, podemos concluir que el compuesto 3 demostró ser un potencial antagonista de las acciones mediadas centralmente por la dopamina.
Agradecimientos
Este trabajo fue financiado por el FONACIT- Venezuela, proyecto S1 97000394 y LAB 97000665. Agradecemos también a la División de Investigación de la Universidad del Zulia, FEC-Venezuela y a la Facultad de Farmacia de la Universidad Central de Venezuela.
Referencias bibliográficas
1. Baldessarini RJ. Drugs and the treatment of psychiatric disorders: Psychosis and anxiety. In: Hardman JG, Limbird LE (Eds.), The Pharmacological Basis of Therapeutics. Goodman & Gilman. McGraw-Hill, New York, NY, USA. 1996. [ Links ]
2. Stahl P. Essential Psychopharmacology. Neuroscientific Basis and Practical Applications. 2nd edn. Cambridge University Press, New York, NY, USA. 2000. [ Links ]
3. Welsch-Kunze S, Kuschinsky K. On the possible involvement of glutamate receptors in conditioning of behavioural effects of apomorphine Psychopharmacol. 1990; 101: 421-428. [ Links ]
4. Forsling ML, Williams H. Central effects of dopamine on vasopressin release in the normally hydrated and water-loaded rat. J Physiol. 1984; 346: 49-59. [ Links ]
5. Cannon JG, Kim JC, Aleem MA. Centrally acting emetics. 6. Derivatives of -naphthylamine and 2-indanamine. J Med Chem. 1972; 15: 348-350. [ Links ]
6. Cannon JG, Pérez JA, Pease JP. Comparison of biological effects of N-alkylated congeners of beta-phenethylamine derived from 2-aminotetralin, 2-aminoindan, and 6-aminobenzocycloheptene. J Med Chem. 1980; 23: 745-749. [ Links ]
7. Cannon JG, Pérez JA, Bhatnager RK, Long JP, Sharabi FM. Conformationally restricted congeners of dopamine derived from 2-aminoindan. J Med Chem. 1982; 25: 1442-1446. [ Links ]
8. McDermed JD, McKenzie GM, Phillips AP. Synthesis and pharmacology of some 2-aminotetralins. Dopamine receptor agonists. J Med Chem. 1975; 18: 362-367. [ Links ]
9. Cannon JG, Long JP, Bhatnagar R. Future directions in dopaminergic nervous system and dopaminergic agonists. Review. J Med Chem. 1981; 24: 1113-1118. [ Links ]
10. Wikstrom H, Andersson B, Sanchez D, Lindberg P, Arvidsson LE, Johansson A M, Nilsson JLG, Svensson K, Hjorth S, Carlsson A. Resolved monophenolic 2-aminotetralins and 1,2,3,4,4a,5,6,10b-octahydrobenzo[f] quinolines: structural and stereochemical considerations for centrally acting pre- and postsynaptic dopamine-receptor agonists. J Med Chem. 1985; 28: 215-225. [ Links ]
11. Wikstrom H. Centrally acting dopamine D2 receptor ligands: agonists. Prog Med Chem. Review. Progress Med Chem. 1992; 29: 185-216. [ Links ]
12. Rodríguez LJ, Medina Y, Suárez-Roca H, Migliore de Angel B, Israel A, Charris J E, López SE, Caldera JA, Angel-Guio JE. Conformational theoretical study of substituted and non-substituted N-aralkyl-2-aminoindans and its relation with dopaminergic activity. THEOCHEM. J Mol Struct. 2003; 636: 1-8. [ Links ]
13. Heinzelmann RV, Kolloff HG, Hunter JH. Physiologically Active Indanamines. II. Compounds Substituted in the Aromatic Ring. J Am Chem Soc. 1948; 70: 1386-1390. [ Links ]
14. Charris JE, Pérez JA, Domínguez JN, Angel JE, Pérez Z, Salazar-Bookaman M, Acosta H. N-aralkyl substitution of 2-aminoindans, synthesis and their inotropic and chronotropic activity in isolated guinea pig atria. Arzneimittel – Forschung. Drug Research. 1997; 47: 1208-1210. [ Links ]
15. Hutt C, Hutt SJ. Stereotypies and their relation to arousal. A study of autistic children. In: Hutt SJ, Hutt C. (Eds.), Behaviour Studies in Psychiatry. Pergamon, Oxford, 1970; p 175-200. [ Links ]
16. Jones IH. Observations on schizophrenia stereotypies. Comp Psychiat. 1965; 6: 323-335. [ Links ]
17. Costall B, Naylor RJ, Cannon JG, Lee T. Differentiation of dopamine mechanisms mediating stereotyped behaviours and hyperactivity in the nucleus accumbens and caudate-putamen. J Pharma Pharmacol. 1977; 29: 337-342. [ Links ]
18. Creese L, Iversen SD. The pharmacological and anatomical substrate of amphetamine response in the brain. Brain Res. 1975; 83: 419-436. [ Links ]
19. Roitman MF, Schafe GE, Thiele TE, Berstein IL. Dopamine and sodium appetite: antagonists suppress sham drinking of NaCl solutions in the rat. Behav. Neurosci. 1997; 111: 606-611. [ Links ]
20. Chartoff EH, Marck BT, Matsumoto AM, Dorsa DM, Palmiter RD. Induction of stereotypy in dopamine-deficient mice requires striatal D1 receptor activation. Proc Natl Acad Sci USA. 2001; 98(18): 10451–10456. [ Links ]
21. Israel A, Torres M, Cierco M, Barbella Y. Further evidence for a dopaminergic involvement in the renal action of centrally administered natriuretic peptide in rats. Brain Res. Bull. 1991; 27: 739-742. [ Links ]
22. Orfila L, Angel J, Torres M, Barbella Y, Israel A. Evidence for a dopaminergic involvement in the renal action of centrally administered JA116a, a novel compound with possible dopaminergic activity, in rats. J Pharm Pharmacol. 1994; 46: 397-399. [ Links ]
23. Charris J, Pérez J, Duerto de Pérez Z, Ayala C, Stern A, Migliore de Ángel B, Michelena de báez E, Caldera J, Compagnone R, Avila D, Rodríguez L, Angel J. Synthesis of (±) 1 amino-6,7,8,8ª-tetrahydroacenaphthene and its effect on the inhibition of the MAO-enzyme at the brain cortex and liver level. Die Pharmazie 2000; 55: 62-64. [ Links ]
24. Angel-Guío JE, Charris JE, Pérez J, Duerto de Pérez Z, Compagnone R, Israel A, Orfila L, Migliore de Angel B, López S E, Rodríguez L, Caldera J, Michelena de Báez E, Arrieta F. Synthesis and Theoretical study of (±) 6 amino-1,2,3,10-tetrahydroacenaphthene and its biological evaluation on the central dopaminergic system. II Farmaco 2000; 55: 575-582. [ Links ]













