Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT v.23 n.2 Caracas jul. 2004
Papel de las pde ic en la contracción del músculo liso de las vías aéreas: Futuras drogas broncorelajadoras
L Guerra de González1, R González de Alfonzo1, I Lippo de Bécemberg1 y M Alfonzo2.
1 Doctora. Instituto de Medicina Experimental, Sección de Biomembranas Fac. Medicina UCV.
2 Doctor. Instituto de Medicina Experimental, Sección de Biomembranas y Cátedra de Fisiopatología, Escuela Luis Razetti, Facultad de Medicina UCV.
E-mail: hmag5@hotmail.com
RESUMEN
En el músculo liso traqueal, los antagonistas muscarínicos (atropina) incrementan simultáneamente los niveles basales de los nucleótidos cíclicos (AMPc, GMPc), dependiendo del tiempo y dosis con máximo a 15 min y pEC50 7.4 ± 0.2. El IBMX (10 μM), inhibidor no selectivo de PDEs, induce una respuesta similar. Sin embargo, la atropina potencia los incrementos del AMPc inducidos por 10 μM Rolipram (inhibidor PDE-IV) y los del GMPc producidos por 10 μM Zaprinast (inhibidor PDE-V), sugiriendo la inhibición de una PDE que hidrolice ambos nucleótidos. La Vinpocetina (20 μM), inhibidor de PDE-Ic no dependiente de Calmodulina, produjo una respuesta semejante al antagonista muscarínico. Además, la atropina inhibió la PDE-Ic de las membranas celulares y no afectó la PDE-I citosólica. Los antagonistas muscarínicos actúan como "agonistas inversos" sobre los m2/m3 AChR del sarcolema, iniciando una novedosa cascada que inhibe la PDE-Ic, provocando el incremento simultáneo del AMPc y GMPc en este tejido.
Palabras Clave: PDE, GMPc, AMPc, mAChR, Músculo liso de las vías aéreas, Antagonistas muscarínicos.
ABSTRACT
Muscarinic antagonists increase simultaneously and in a similar fashion the intracellular levels of cyclic nucleotides, in bovine tracheal smooth muscle. These original pharmacological responses were time-and dose-dependent, being maximal at 15 min, with pEC50 (7.4 ± 0.2) for atropine Isobutylmethylxantine (IBMX 10 μM), a non-selective cyclic nucleotide phosphodiesterase (PDE) inhibitor, induced a similar effects suggesting the involvement of PDEs. Atropine enhanced the increments of cAMP levels induced by Rolipram and cGMP levels by Zaprinast. However, Vinpocetine (20 μM), a non-calmodulin dependent PDE Ic inhibitor was able to "mimic" these muscarinic antagonist responses. In cell free systems, muscarinic antagonists inhibit the membrane-bound PDE-Ic whereas the soluble (cytosol) PDE Ic was not affected. Thus muscarinic antagonists acting as "inverse agonists" on m2/m3 AChRs on sarcolema initiate a new signal cascade leading to PDE-Ic inhibition simultaneous rise in both cAMP and cGMP intracellular levels in tracheal smooth muscle.
Key Words: PDE, cGMP, cAMP, mAChR, Airways smooth muscle, Muscarinic antagonists.
INTRODUCCIÓN
Los procesos de contracción/relajación del músculo liso de las vías aéreas, regulan el calibre de dichas vías, el cual está reducido durante la crisis de asma bronquial. Ambos procesos exhiben diferentes cascadas de señalización celular que son iniciadas en el sarcolema del músculo liso, generando los nucleótidos cíclicos AMPc y GMPc como segundos mensajeros(1). El AMPc participa en la relajación del músculo liso, el cual se incrementa a través de dos vías, mediante la estimulación de los receptores β2 adrenérgicos-proteína Gs-adenilil ciclasa(2) y mediante la inhibición de las fosfodiesterasas de los nucleótidos cíclicos (PDEs), localizadas en el músculo liso traqueal (MLT)(3), especialmente la PDE IV, la cual es inhibida de manera selectiva por el rolipram(4). El papel del GMPc en la fisiología del músculo liso de las vías aéreas, es controversial. Se ha demostrado que la relajación dependiente del GMPc, se realiza por dos diferentes vías de señalización: 1) La cascada de señalización que activa a la guanilil ciclasa soluble (GCs) acoplada a canales de potasio activados por calcio (K+Ca2+)(5). 2) La segunda cascada se inicia con la activación de la guanilil ciclasa asociada al sarcolema sensible a péptidos natriuréticos (NP)(6) e involucrada en la fisiología del MLT, sugerido por Ishii y Murad(7). En este sentido, una guanililciclasa (GC-B) sensible a CNP ha sido identificada por Borges y col(8) quienes demostraron que esta enzima participa en señalización muscarínica. La activación de un receptor muscarínico (mAChR) provoca la contracción del músculo liso traqueal con un incremento de los niveles basales de GMPc, reportado por Katsuki y Murad(9). Recientemente, Guerra de González y col(10,11) han establecido que agonistas muscarínicos induce, la contracción en el MLTB, induciendo dos señales de GMPc. La primera señal (20 s) es el resultado de la activación de la guanilil ciclasa soluble (GCs) y la segunda señal (60s) parece ser producto de la guanilil ciclasa de membrana (GCm), descrita por Bécemberg y col(12) y Alfonzo y col(13). Al incubar preparaciones de MLTB durante 15 min con un antagonista muscarínico no selectivo (atropina) para bloquear la acción del agonista muscarínico, encontramos que la atropina (0.1-10 μM) incrementa los niveles basales de AMPc y GMPc(14). En este trabajo, nos hemos propuesto estudiar este aumento simultáneo de los niveles intracelulares de AMPc y GMPc inducidos por los antagonistas muscarínicos en el MLTB.
MATERIALES Y MÉTODOS
Materiales
Atropina, 4-DAMP, metoctramina, IBMX, rolipram, zaprinast, vinpocetina, carbamil colina fueron adquiridos en Sigma, la 5nucleotidasa purificada del veneno de serpiente (Crotalus terrificus), fue suministrada gentilmente por el Dr. Scannone de la Facultad de Farmacia de la UCV. Los kits para la determinación de GMPc (TRK-500) de Amersham y los kits para la determinación de AMPc (KAPH2-172), de DPC. La albúmina sérica de bovino (Fracción V) de Armour. Dowex-1-X-8 de Bio-Rad. Los otros reactivos químicos grado pro-analisis fueron obtenidos de Merck y Fisher.
Preparación e incubación del músculo liso traqueal de bovino (MLTB): Las traqueas de bovino obtenidas del matadero local, son transportadas en solución Krebs Ringer Bicarbonato (KRB) a 4°C y procesadas de acuerdo ha lo descrito por Guerra de González y col(11).
Evaluación de los nucleótidos cíclicos: Para cuantificar el contenido de los nucleótidos cíclicos, las franjas musculares se introducen en una cámara multiórganos, con sistema de aireamiento con mezcla de 95% oxígeno, 5% CO2 y de 400 ml, se dejan equilibrar por 30 min. Los fragmentos de músculo liso son removidos del baño a tiempos específicos y congelados en nitrógeno líquido hasta la extracción de los nucleótidos ácidos solubles. Las muestras congeladas son cortadas y homogeneizadas en TCA (6%) frío, el material es centrifugado a 1500 x g por 10 minutos a 4°C. El sedimento es procesado para determinar las proteínas totales. El sobrenadante ácido soluble fue procesado como ha sido descrito(11). Estas muestras son utilizadas para evaluar el contenido de los nucleótidos cíclicos AMPc y GMPc, utilizando Kits Comerciales, como fue descrito previamente por Alfonzo y col(15).
Preparación de las fracciones soluble y de membranas celulares del MLTB: Las franjas musculares fueron aisladas como se describió previamente(11). Se prepara un extracto celular con estos fragmentos (20 gr) con un amortiguador conteniendo: 0.3 M sacarosa, 20 mM K-EGTA, 2 mM benzamidina, 0.25 mM PMSF, 0.5 mM DTT, HEPES-KOH (pH 7.0), según Sahid y col(16). Este material es homogeneizado con un Polytron a máxima velocidad y luego la dispersión es filtrada a través 8 capas de gasa. El material filtrado es centrifugado a 10.000 x g por 15 min. El sobrenadante se centrifuga a 150.000 x g por 1 hora para obtener el sedimento (la fracción de membranas celulares) y el sobrenadante (la fracción soluble o citosol). La fracción de membranas celulares es dispersada con un pequeño volumen del amortiguador, tanto al citosol como a la fracción de membranas celulares, se les adiciona 30% (v/v) de glicerol, se congelan en nitrógeno líquido y se guardan a –86°C para los ensayos de actividad de la PDE.
Determinación de la actividad de la fosfodiesterasas de los nucleótidos cíclicos: La actividad de PDE se determina, usando [3H]GMPc de acuerdo a lo descrito(17). Así, proteínas (50 a 100 μg) se incuban durante 30 min a 30°C con [3H]GMPc (0.1 μC) por ensayo en un amortiguador que contiene: 0.3 mM GMPc, 40 mM de Tris-HCl pH 7.5, 10 mM de MgCl2 y 1 unidad de 5nucleotidasa. La reacción se detiene agregando 10 mM de EDTA y transfiriendo las muestras a 4°C, luego todo el medio de incubación se coloca en una columna de intercambio iónico AG-1-X8 formato, para la elución de los productos hidrolizados ([3H] guanosina) con etanol-agua (1:1). El contenido de [3H] es determinado usando un contador de líquido de centelleo con una eficiencia de un 30%.
Otros métodos
La cantidad de proteínas totales en las muestras del sedimento del material insoluble del TCA es tratado con 1N NaOH. Posteriormente se cuantifica el contenido de proteínas de acuerdo al procedimiento utilizado por Bensaudoun y Weinstein(18), usando albúmina de suero de bovino como estándad. Los valores de los nucleótidos cíclicos están expresados en picomoles por miligramos de proteínas. Los análisis estadísticos fueron realizados utilizando el test de Student. Los valores de –log EC50 (pE50) fueron calculados utilizando el programa computarizado Prism.3. (Graph Pad®).
RESULTADOS
El efecto de la Atropina y del IBMX sobre los niveles de los nucleótidos cíclicos del MLVA
En el MLTB, los niveles basales de los dos nucleótidos cíclicos (AMPc y GMPc), se incrementan de una forma dependiente del tiempo de incubación en presencia de 10 μM de Atropina (antagonista muscarínico no selectivo). Así, el contenido de AMPc se incrementa en 10 min. de 5.0 ± 0.8 pmoles/mg de proteínas, hasta 25.0 ± 1.3 (p<0.01). Simultáneamente; los niveles basales del GMPc se incrementan desde 1.0 ± 0.3 pmoles/mg de proteínas hasta 18 ± 1.2 (p<0.001), ambas respuestas biológicas exhiben un patrón cinético similar. Este efecto provocado por la atropina, es similar al efecto inducido por los inhibidores no selectivos de las PDEs. Así la Figura 1 nos muestra el efecto del IBMX (10 μM), sobre los niveles de los dos nucleótidos cíclicos, siendo la respuesta es marcadamente superior en la presencia de atropina. Estos datos sugieren que las PDEs pueden estar involucradas en el efecto provocado por la atropina.
El efecto de la Atropina y del IBMX sobre los niveles basales de los nucleótidos cíclicos (AMPc y GMPc) en el MLTB
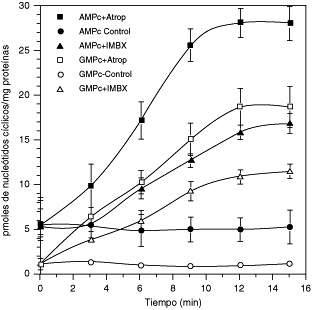
Las franjas musculares son incubadas a diferentes tiempos con atropina (10 μM) e IBMX (10 μM). Los nucleótidos cíclicos son cuantificados como se describe en Materiales y Métodos. Los símbolos llenos corresponden al AMPc, en condición basal (●), en presencia de atropina (■) y en presencia de IBMX (▲). Los símbolos vacíos corresponden al GMPc en condición basal (○) en presencia de atropina (□) y de IBMX (∆). Cada valor es el promedio ± el error estándar de 4 preparaciones diferentes de MLTB y las determinaciones de los nucleótidos cíclicos fueron hechas por triplicado.
El efecto de inhibidores selectivos de las PDEs sobre los niveles de los nucleótidos cíclicos
El efecto de los inhibidores selectivos de las PDEs rolipram (PDE IV) y zaprinast (PDE V) fueron evaluados en ausencia y en presencia de atropina (10 μM). La atropina potencia el efecto de estos inhibidores selectivos (datos no mostrados), sugiriendo que este antagonista muscarínico debe afectar otra PDE que regule simultáneamente los niveles de AMPc y GMPc. En este sentido, la PDE 1c es capaz de hidrolizar ambos nucleótidos cíclicos (AMPc y GMPc) con igual afinidad, por ello evaluamos el efecto de la vinpocetina, un inhibidor selectivo no dependiente de CaM de la PDE 1c. En la Figura 2, nos muestra que la vinpocetina (20 μM) y la atropina (10 μM) provocan una respuesta muy parecida sobre los niveles de los dos nucleótidos cíclicos, siendo la respuesta más potente en presencia del inhibidor vinpocetina. Ambos efectos son dependientes del tiempo de incubación, con un máximo a los 15 minutos para ambos nucleótidos cíclicos.
El efecto de la vinpocetina y la atropina sobre los niveles de los nucleótidos cíclicos (AMPc y GMPc) con respecto a tiempo de incubación
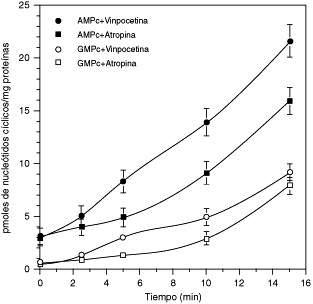
Las franjas de MLTB son incubadas a diferentes tiempos en presencia de vinpocetina 20 mM (● ○) y atropina 10 mM (■□ ) de acuerdo a lo descrito en Materiales y Métodos. Los símbolos llenos corresponden al AMPc y los símbolos vacíos corresponden al GMPc. Cada valor corresponde al promedio ± el error estándar de 3 diferentes preparaciones de MLTB y la cantidad de los nucleótidos cíclicos fueron ensayadas por triplicado.
La actividad de la PDE en fracciones (soluble y de membranas celulares) del MLTB
La actividad de la PDE1c, se determinó midiendo la actividad de PDE-GMPc en presencia de Zaprinast 10 μM, lo cual elimina a la PDE V. En la Figura 3, se muestra el efecto de inhibidores selectivos y no selectivos de PDE, sobre la PDE-GMPc, insensible a zaprinast. Así, la vinpocetina (20 μM) provoca una inhibición de 20% de la PDE-GMPc citosólica, pero inhibe en un 50% la PDE-I asociada a la fracción de membranas celulares, posiblemente en el sarcolema. La Atropina (10 μM) no afecta la actividad de la PDE citosólica, pero inhibe aproximadamente 50% la actividad de la PDE-I presente en la fracción de membranas celulares. Es importante destacar que el IBMX (10 μM), es capaz de inhibir el 50% de la actividad citosólica y aproximadamente 80% de la PDE-GMPc de las membranas celulares.
El porcentaje de inhibición de la PDE-GMPc en la fracción soluble (citosol) y en membranas celulares del MLTB en presencia de antagonistas muscarínicos y de inhibidores de la PDE
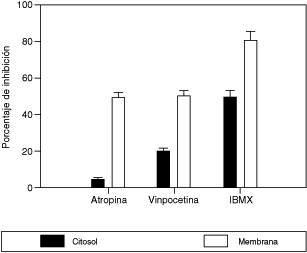
La actividad de la PDE se expresa como pmoles de GMPc hidrolizados/min/mg de proteínas determinado usando como sustrato 3[H]- GMPc en presencia de 10 μM de Zaprinast. El 100% de la actividad del citosol (fracción soluble) corresponde a 1.094 ± 50 y la fracción de membranas es de 971 ± 40. Cada valor corresponde a 3 diferentes preparaciones hechas por duplicado, el error estándar es del 5%.
DISCUSIÓN
Los antagonistas muscarínicos (atropina, 4-DAMP, AFDX-116 y metoctramina) son grandes moléculas cargadas que no pueden pasar a través de las membranas biológicas, y actúan sobre los mAChR localizados en el sarcolema del MLTB y provocando el incremento de los niveles basales de AMPc y GMPc. La identificación definitiva del subtipo de receptor mAChR involucrado en este efecto biológico no está claro. En este sentido, el MLTB exhibe dos subtipos farmacológicos de receptor muscarínico (M2 y M3)(19,20). De acuerdo al perfil farmacológico (pEC50) evaluado por nosotros es:Atropina ≥ 4-DAMP ≥ AFDX ≥ Metoctramina, sugiriendo que el subtipo involucrado en esta respuesta sería el M2AChR(21), lo cual está de acuerdo con el perfil farmacológico descrito por Mc Intosh and Blazynski(22) para acciones mediadas por M2AChR. Los mAChR pueden estar acoplados a cascadas de señalización que pueden incrementar los niveles de estos nucleótidos cíclicos debido a la inhibición de las isoenzima PDEs. En el MLTB, se ha identificado 5 familias de PDE, las cuales difieren en estructura primaria, mecanismos regulatorios y sensibilidad a diferentes inhibidores farmacológicos(16). Estas familias son PDE-I (dependiente de calmodulina (CAM), PDE-II (estimulada por GMPc), PDE-III (inhibida por GMPc), PDE-IV (AMPc-específica) y PDE-V (GMPc-específica). En nuestro caso, la función de la PDE-II y PDE-III, ha sido descartada, de acuerdo con las propiedades bioquímicas descritas por Shahid y col(16) y Juilfs y col(23). El rolipram incrementó el contenido de AMPc, sin modificar los niveles de GMPc, lo cual confirma la presencia de PDE-IV en el MLTB(16). Así la PDE-IV sensible a rolipram es un "blanco molecular" para diversos agentes antiasmáticos(24) asociado con la relajación del músculo liso de las vías aéreas. Además, el zaprinast (un inhibidor selectivo de la PDE-V) incrementa los niveles de GMPc en el tejido sin afectar el contenido de AMPc, confirmando la existencia de la PDE-V en MLTB, de acuerdo a lo descrito en MLT de acure(25) y MLTB(16). La atropina, potencia significativamente el efecto provocado por los inhibidores selectivos de las PDE-IV/V, sugiriendo que la inhibición de otra PDE puede ser la responsable del incremento simultáneo de los niveles de los dos nucleótidos cíclicos. El MLT exhibe un grupo de la subfamilia de PDE-I, dependiente de CaM(26), que hidrolizan AMPc y GMPc con igual afinidad (bajo Km = 1-3 μM), específicamente la PDE-Ic(16). Así la vinpocetina, un inhibidor selectivo no relacionado con CaM de la PDEIC, lo cual ha sido reportado para el músculo liso vascular(27), provoca una respuesta similar a la atropina, incrementando los niveles basales de los dos nucleótidos cíclicos. La atropina no afecta la actividad de la PDE-[3H]GMPc presente en la fracción soluble en contraste con la significativa inhibición de la actividad de la enzima presente en las membranas celulares, lo cual sugiere la posibilidad que la atropina afecta la enzima asociada a la membrana. Así la inhibición directa por el antagonista muscarínico, no parece ser el caso, sino que los antagonistas muscarínicos pueden afectar indirectamente estas PDE de membranas, a través de una cascada de señalización celular aun desconocida, localizada en la membrana del MLVA como se puede observar en el modelo propuesto en la Figura 4. La inflamación de las vías aéreas, la cual afecta al músculo liso de las vías aéreas, es una disfunción que caracteriza al asma bronquial. En la terapia de esta enfermedad, los glucocorticoides son las únicas drogas efectivas, pero sus efectos secundarios no deseados en especial en los niños, hacen que se necesiten nuevas drogas. En este sentido, los inhibidores de las PDEs, de la cual la teofilina es el prototipo de inhibidor no selectivo, ha sido utilizada extensamente(28). Se ha encontrado que los inhibidores de la PDE IV pueden regular algunas funciones biológicas de las células del sistema inmune actuando como anti-inflamatorios. Estos reportes, junto con el hallazgo que la expresión de la PDE IV está íntimamente asociada a la activación muscarínica del músculo liso de las vías aéreas(29), lo que sugiere que la PDE IV sería un excelente "blanco" terapéutico(4,24). Desafortunadamente, los inhibidores de la PDE IV han sido asociados a efectos no deseados que afectan al SNC (cefaleas) y al sistema gastrointestinal (vómitos)(28). En este sentido, la aparición de nuevas drogas como es el caso, que inhiban a la PDE Ic de manera selectiva y que eleven de manera simultánea los niveles de AMPc y GMPc, e inducir una relajación sostenida del músculo liso de las vías aéreas, según el modelo de la Figura 5, puede significar un avance terapéutico.
Modelo de la cascada de señalización asociados a los receptores muscarínicos y la PDEIc.
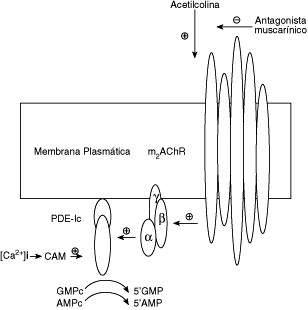
Modelo del mecanismo de acción de los antagonistas muscarínicos sobre los niveles de los nucleótidos cíclicos ampc y gmpc en el músculo liso de las vías aéreas
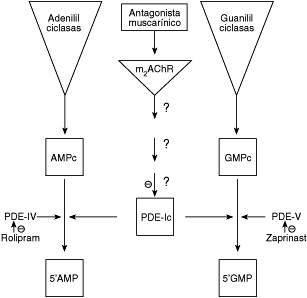
En un futuro, inhibidores selectivos de la PDE Ic pueden ser drogas de efectos rápidos para producir la broncorelajación y así revertir una crisis aguda de asma bronquial. Es importante enfatizar que este trabajo define a la PDEIC como un nueva entidad crucial en la fisiología y farmacología del MLVA.
AGRADECIMIENTO
Financiado por Proyectos CDCH-UCV No. 09-33-4846-2004 (LGG), 09.33 4764-2004 (ILB) y PG 09.33 4858-2001 (RGA).
REFERENCIAS BIBLIOGRÁFICAS
1. Coburn RF, Baron CB. Coupling mechanisms in airway smooth muscle. Am J Physiol 1990; 119-33. [ Links ]
2. Barnes PJ. Beta adrenergic receptors and their regulation. Am J Resp Crit Care Med 1955; 152: 838-61. [ Links ]
3. Torphy TJ. Phosphodiesterase isozymes. Molecular targets for novel anti-asthma agents. Am J Respir Crit Care Med 1998; 157: 351-70. [ Links ]
4. Bemareggi MM, Belvisi MG, Patel H, Barnes PY, Giembyez MA. Antipasmogenic activity of isoenzyme-selective phosphodiesterase inhibitors in guinea pig trachealis. Br J Pharmacol 1999; 128: 327-36. [ Links ]
5. Kannan MS. Johnson DE. Modulation of nitric oxide dependent relaxation of pig tracheal smooth muscle by inhibitors of guanylyl cyclase and calcium activated potassium channels. Life Sci 1995; 56: 2229-38. [ Links ]
6. Chinkers M, Garbers DL, Chang MS, Lowe DG, Chin H, Gieddel DV, et al. A membrane form of guanylate cyclase is an atrial natriuretic peptide receptor. Nature 1989; 338: 78-83. [ Links ]
7. Ishii K, Murad F. ANP relaxes bovine tracheal smooth muscle and increases cGMP. Am Physiol 1989; 256: C495-500. [ Links ]
8. Borges A, Villarroel SS, Winand NJ, Bécemberg IL, Alfonzo M, Alfonzo RG. Molecular and biochemical characterization of a CNP-sensitive guanylyl cyclase in bovine tracheal smooth muscle. Am. J Resp Cell Mol Biol 2001; 25: 98-103. [ Links ]
9. Katsuki S. Murad F. Regulation of cAMPc levels and contractility in bovine tracheal smooth muscle. Mol Pharmacol 1977; 13: 330-41. [ Links ]
10. Guerra de González L, Bécemberg IL, Alfonzo RG, Alfonzo M. La activación muscarínica del músculo liso de las vías aéreas. Arch Vzlnos Farmacol Terap 1995; 14: 18-24. [ Links ]
11. Guerra de González L, Misle A, Pacheco G, Napoleón V, Alfonzo RG, Bécemberg IL, Alfonzo M. Effects of 1-H [1,2,4]oxadiazolo [4,3a]quinoxalin-1-one (ODQ) and NAME on cyclic GMP levels during muscarinic activation of tracheal smooth muscle. Biochem Pharmacol 1999; 58: 563-69. [ Links ]
12. Bécemberg IL, Peña AR, Camarillo I, Alfonzo RG, Alfonzo M. Muscarinic agents modify kinetics properties of membrane bound guanylyl cyclase activity. FEBS Lett 1989; 253: 16-22. [ Links ]
13. Alfonzo MJ, Gonzalez LG, Villarroel SS, Toba GF, Misle AJ, Herrera VN, et al. Signal transduction pathways through mammalian guanylylcyclases.New Adv Cardiovasc Physiol Pharmacol 1998; 147-75. [ Links ]
14. Guerra de González L, Villarroel RS, Alfonzo RG, Bécember IL, Alfonzo M. La atropina actúa como un inhibidor de las PDE de los nucleótidos Cíclicos en el músculo liso traqueal de bovino. Rev Facultad Med 2002; 25: 72-4. [ Links ]
15. Alfonzo RG, Bécemberg IL, Alfonzo M. A Ca2+/CaM dependent protein kinase associated with Ca2+ transport in sarco (endo) plasmic vesicles from tracheal smooth muscle. Life Sci 1996; 58: 18-24. [ Links ]
16. Shahid M, Van Amsterdam R, De Boer J, Berge RE, Nicholson CD, Zaagsma J. The presence of five cyclic nucleotide phosphodiesterase isoenzyme activities in bovine tracheal smooth muscle and the functional effects of selective inhibitors. Br J Pharmacol 1991; 104: 471-7. [ Links ]
17. Han P, Werber J, Surana M, Fleischer N, Michaeli T, The calcium CaM-dependent PDEIC down-regulates glucose-induced insulin secretion. J.Biol Chem 1999; 274: 22337-44. [ Links ]
18. Bensadoun A, Weinstein D. Assay of proteins in the presence of interfering materials. Anal Biochem 1976; 70: 241-50. [ Links ]
19. Luchesi PA, Scheid CR, Romano FD, Kargacin D, Mullikin-Kilpatrick D, Yamaguchi H, et al. Ligand binding ad G-proteins coupling of muscarinic receptors in airway smooth muscle. Am J Physiol 1990; 258: C 730-6. [ Links ]
20. Misle A, Bécemberg IL, Alfonzo RG, Alfonzo M. Metoctramine binding sites sensitive to alkylation on muscarinic receptors from tracheal smooth muscle. Biochem Pharmacol 1994; 48: 191-5. [ Links ]
21. Guerra de González L, Alfonzo RG, Bécemberg IL, Alfonzo M. Cyclic nucleotide-dependent phosphodiesterases (PDEI) inhibition by muscarinic antagonists in bovine tracheal smooth muscle. Biochem Pharmacol 2004; 68: 651-8. [ Links ]
22. Mc Intosh H, Blazynski C. Muscarinic receptor stimulated GTPase activity in synaptic membranes from bovine retina. J Neurochem 1992; 59: 210-15. [ Links ]
23. Juilfs DM, Soderling S, Burns I, Beavo JA. Cyclic GMP as substrate and regulator of cyclic nucleotide phosphodesterases (PDEs). Rev Physiol Biochem Pharmacol 1999; 135: 67-104. [ Links ]
24. Barnett MS. Phosphodiesterase 4 (PDE 4) inhibitors in asthma and chronic obstructive pulmonary disease (COPD) Prog Drug Res 1999; 53: 129-93. [ Links ]
25. Langlands JM, Rodger IW. Diamond J. The effect of M4B22948 on methacoline and histamine-induced contraction and inositol 1,4,5 triphosphate in guinea pig tracheal tissue. Br J Pharmacol 1989; 98: 336-8. [ Links ]
26. Kakkar R, Raju RV, Sharma RR. Calmodulin-dependent cyclic nucleotide phosphodiesterase (PDEI). Cell Mol Life Sci 1999; 55: 1164-86. [ Links ]
27. Hagiwara M, Endo T, Hidaka H. Effects of vinpocetine on cyclic nucleotide metabolism in vascular smooth muscle. Biochem Pharmacol 1984; 33: 453-7. [ Links ]
28. Spina D. The potential of PDE4 inhibitors in asthma or COPD. Curr. Opin. Ingestig. Drugs. 2000; 1(2): 204-213. [ Links ]
29. Hanson G, Jin S, Umetsu DT, Conti M. Absense of muscarinic cholinergic airway responses in mice deficient in the cyclic nucleotide phosphodiesterase PDE 4D. Proc Natl Acad Sci (USA). 2000; A97(12): 6751-6756. [ Links ]













