Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT v.24 n.1 Caracas 2005
La Homocisteína como factor de riesgo en la enfermedad cardiovascular
M del C Padrón N1, VL Colina B2 y ZR Quero G3.
1 M.Sc. en Farmacología. Profesora Asistente de la Cátedra de Farmacología y Toxicología de la Escuela Luis Razetti, Facultad de Medicina, UCV. E-mail: mpadron@epidauro.med.ucv.ve
2 M.Sc. en Fisiología. Asistente de Investigación de la Sección de Investigaciones Cardio-Renales. Instituto de Medicina Experimental. UCV.
3 M.Sc. en Fisiología. Asistente de Investigación de la Cátedra de Farmacología de la Escuela José María Vargas, Facultad de Medicina, UCV.
RESUMEN
La homocisteína (Hcy) es un aminoácido sulfurado no esencial que es producido como intermediario en el ciclo de la metionina. Una vez en plasma la Hcy es rápidamente oxidada. Sin embargo, se ha encontrado que una elevación de la Hcy (más de 15 mmoles/L), puede estar relacionada con causas genéticas, deficiencias nutricionales, la edad, el género, algunas patologías y el uso de ciertos fármacos. Mc Cully en 1969, planteó la posible relación de la hiperhomocisteinemia (HHcy) como un factor de riesgo de la enfermedad vascular a nivel cardiaco, cerebral y periférico. Desde entonces, se han realizado estudios a nivel básico y epidemiológico para comprobar esta hipótesis. Se proponen diversos mecanismos: estrés oxidativo, disfunción endotelial, disminución de óxido nítrico, aumentos de factores de la coagulación e inflamatorios, entre otros. El efecto de la HHcy parece ser multifactorial y afectaría tanto la estructura de la pared vascular como el sistema de coagulación. En conclusión, ahora que se ha visto incrementado el nivel de conocimiento de cómo la hiperhomocisteinemia está unida a un aumento en el riesgo de las enfermedades vasculares, especialmente de ICC y a pesar de las fuertes evidencias que enlazan los niveles elevados de homocisteína con los eventos coronarios y la mortalidad.
Palabras Clave: Homocisteína, Factor de riesgo cardiovascular.
ABSTRACT
Homocysteine (Hcy) it is an sulfurated amino acid that is produced as middleman in the cycle of the methionine. Once in plasm, the Hcy is quickly oxidized. However, Hcy has been found that an elevation of the Hcy (more than 15 nmoles/L), it can be related with genetic causes, nutritional deficiencies, the age, the gender, some pathologies and the use of certain drugs. Mc Cully in 1969, outlined the possible relationship of the hiperhomocysteinemia (HHcy) as a factor of risk of the vascular illness at heart, cerebral and outlying level. From then on, they have been carried out studies at basic and epidemic level to check this hypothesis. They intend diverse mechanisms: oxidative stress, endothelial dysfunction, decrease of nitric oxide, increases of factors of the clotting and inflammatory, among others. The effect of the HHcy seems to be multifactorial and it would affect the structure of the vascular wall like the system of clotting so much. In conclusion, now that the level of knowledge has been increased the hyperhomocysteinemia is together to an increase in the risk of the vascular illnesses of how, especially of ICC and in spite of the strong evidences that connect the high levels of homocysteine with the coronary events and the mortality.
Key Words: Homocysteine, Cardiovascular risk factor.
INTRODUCCIÓN
En los últimos veinte años, se ha dado una explosión en el número de publicaciones que describen la asociación entre homocisteína y la enfermedad cardiovascular. Se ha relacionado la hiperhomocisteinemia con un incremento en el riesgo de los eventos cardíacos tales como muerte súbita, accidente cerebro vascular, enfermedad arterial periférica, coronaria, cerebral y carótida; así como en tromboembolismo venoso y pulmonar. Estando también implicada dicha hiperhomocisteinemia en el transplante de arterias coronarias e hipertensión arterial.
Desde 1961 cuando se utilizó por primera vez el término "Factor de Riesgo", han sido propuestos un gran número de nuevos o emergentes factores para la aterosclerosis y la idea es poder utilizarlos en la prevención de las enfermedades cardiovasculares(1).
La homocisteína (Hcy) es un aminoácido sulfurado que participa en dos vías metabólicas, la remetilación de la metionina (requiere ácido fólico y vitamina B12) y la transulfuración de la cisteína a cistationa (requiere vitamina B6)(2). Ambas vías requieren de cofactores derivados de vitaminas (cianocobalamina, riboflavina, piridoxina, ácido fólico entre otros). Una vez en el plasma, la Hcy es rápidamente oxidada y genera varias especies moleculares como los dímeros sulfurados, la tiolactona y la Hcy unida a proteínas(3), los cuales son determinados como Hcy total por varios métodos que inicialmente fueron muy complejos y costosos pero que hoy en día ya han sido automatizados(4).No hay consenso en cuanto a los valores de referencia, pero los más aceptados como hiperhomocisteinemia (HHcy) son valores mayores de 15 mmoles/L. Existen causas genéticas para la elevación de la Hcy en plasma, pero también se ha encontrado que deficiencias nutricionales, la edad, el sexo así como algunas patologías y el uso de ciertos fármacos también pueden aumentarla(5,6).
Desde el año de 1969, Mc Cully(7) planteó la posible relación entre la hiperhomocisteinemia (HHcy) como un factor de riesgo de la enfermedad vascular a nivel cardiaco, cerebral y periférico, se han realizado estudios a nivel básico y epidemiológico(8) que en su gran mayoría soportan esta hipótesis. Desde el punto de vista fisiopatológico se está desarrollando una gran cantidad de investigaciones que proponen diversos mecanismos tales como son: el estrés oxidativo(9), la disfunción endotelial(10), la disminución de los niveles de óxido nítrico(11), los aumentos de factores de la coagulación e inflamatorios(12),entre otros. El efecto de la HHcy parece ser multifactorial y afectaría tanto la estructura de la pared vascular como el sistema de coagulación.
En esta revisión se pretenden analizar desde los aspectos generales y básicos sobre la homocisteína, hasta las implicaciones de las alteraciones de sus niveles plasmáticos, considerándolo como un factor de riesgo en las enfermedades cardiovasculares.
Factores de Riesgo
Los factores de riesgo constituyen elementos que predisponen a las enfermedades cardiovasculares y los mismos se presentan, condicionados por factores genéticos y ambientales. Si bien, no tienen manifestaciones clínicas, muchas veces pueden en diferentes grados determinan daño cardiovascular, aún en personas asintomáticas.
El término de factor de riesgo se utilizó por primera vez en 1961, como una consecuencia del estudio cardíaco de Framinghan (iniciado en 1948) donde se pudo concluir que no hay un factor esencial, que se puede utilizar como un o unos parámetros para identificar individuos con un riesgo aumentado de enfermedad cardiovascular y de asociaciones estadísticas entre factores que modulan los procesos aterogénicos en pared arterial(1,13).
Aún hoy, continúa la investigación sobre factores de riesgo, ya que entre 25-40% de los pacientes con enfermedad cardiovascular incipiente no presentan alteraciones de los factores ya establecidos o clásicos, y es por esto que en los últimos años, se han propuesto nuevos factores que siguen siendo objeto de estudio. En la Tabla 1, se presentan además de los factores de riesgo clásicos, algunos de los que se consideran como factores de riesgo nuevos o emergentes. Sin embargo, para establecer la validez de estos últimos se requieren realizar estudios tanto de investigación básica como epidemiológica.
En 1932, Du Vigreand descubrió la presencia de la homocisteína y demostró a partir de la investigación básica que se forma a partir del metabolismo de la metionina y que es un aminoácido necesario para el crecimiento y desarrollo normal de los mamíferos.
Por otra parte, a partir de los estudios de investigación clínica se obtuvieron los siguientes antecedentes: Carey y colaboradores en 1968, describieron complicaciones aterotrombóticas de aparición temprana en 9 pacientes homocigotos con homocisteinuria y en 1969, Mc Cully relacionó incrementos de los niveles plasmáticos de homocisteína con enfermedad cardiovascular y propuso que existía una relación ellas(7). Más recientemente, en el 2001, Hofman y colaboradores(14) reportaron resultados similares en un modelo murino, donde demostraron que la hiperhomocisteinemia aumentaba la inflamación vascular y aceleraba la ateroesclerosis.
También, se ha encontrado una relación entre los factores de riesgo clásicos (consumo de cigarrillos, edad, sexo, niveles plasmáticos de colesterol) y los niveles de Hcy(15,16,17,18,19). Nygard y colaboradores(20,21) encontraron una asociación positiva en una artículo llamado "Estudio de homocisteína de Hordaland" en 7591 hombres y 8585 mujeres.
Es por todos los argumentos anteriormente planteados que algunos autores, entre ellos Blum y colaboradores(22) proponen incorporar la medición de rutina de los niveles de Hcy en pacientes con otros factores de riesgo y con historia de enfermedad arterial coronaria, tromboembolismo o con trombosis venosa.
En cuanto a los estudios epidemiológicos de caso-control o de cohorte se ha encontrado divergencia en los resultados, ya que algunos autores descartan el posible papel de la homocisteina como factor de riesgo(23,24,25,26) mientras que otros postulan que la Hcy es un factor predictivo tan potente, como los niveles de colesterol. En este sentido un meta análisis de 27 estudios calculó que por cada aumento de 5 mmol/l de Hcy, aumenta el riesgo de enfermedad coronaria en el 60% de los hombres y en el 80% de las mujeres, lo que equivale a un aumento de 20 mg/dl de colesterol total(2,24).
Por su parte, Bushey y colaboradores(8) evaluaron 22 estudios epidemiológicos y encontraron que en 20 de ellos se presentó una asociación significativa entre la hiperhomocisteinemia y el riesgo de enfermedad cardíaca coronaria.
Sin embargo, aún no se tiene la respuesta a la siguiente pregunta: ¿Al disminuir los valores plasmáticos de Hcy disminuye también el riesgo de enfermedad cardiovascular?. Los autores sugieren que sólo con estudios aleatorios se podría dar una respuesta definitiva.
Homocisteína
La homocisteína (Hcy) es un aminoácido sulfurado no esencial derivado de la conversión metabólica de la metionina, dependiente de vitaminas (B6,B12 y ácido fólico)(12), (Figura 1). Se ha planteado que la Hcy es un marcador bioquímico o indicador metabólico de consideración.
Estructura química de la homocisteína
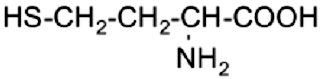
Metabolismo
Son tres los mecanismos que tienen las células para mantener las concentraciones de Hcy y dichas vías metabólicas se esquematizan en la Figura 2.
Metabolismo de la homocisteína
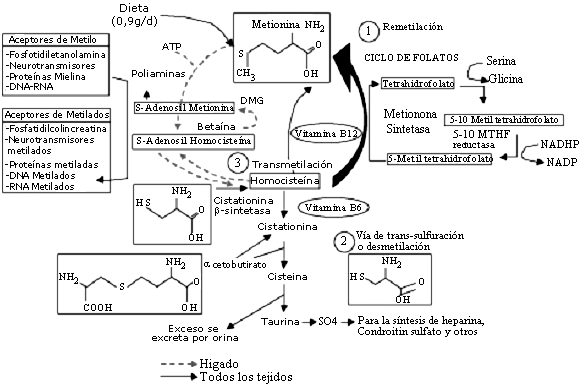
La primera vía es la Remetilación, donde se hace el reciclaje de folatos intracelulares y participa la enzima metionina sintetasa, siendo fundamental la presencia de cianocobalamina (vitamina B12) y ácido fólico. Esta vía mantiene los valores básales de Hcy.
La segunda vía es la Transulfuración o Desmetilación, en donde participa la enzima cistationina b sintetasa y requiere como cofactor la vitamina B6. Por esta vía, se revierte transitoriamente los incrementos de Hcy postprandiales y su actividad se puede medir con el método de postcarga de metionina(2).
Esta dos vías están coordinadas por la S-adenosilmetionina la cual actúa como un inhibidor alostérico de la metilenotetrahidrofolato reductasa (MTHFR) y como un activador de la cistationa b-sintetasa (CBS)(26).
Por último, en la Transmetilación, ocurre el catabolismo de la colina y la betaína(2).
Existe otra vía menor, sólo presente en el hígado (algunos autores indican que también existe en los riñones) que es la de la betaína, donde la Hcy se remetila a metionina(6), (Figura 2).
El grupo tiol le confiere a la Hcy que llega al plasma, la posibilidad de múltiples interacciones como son: la oxidación rápida de dos moléculas de Hcy y producir homocistina, la formación de puentes disulfuro con cisteína para originar cistina o con proteínas y la pérdida de una molécula de agua de la homocisteína originando una tiolactona. La Hcy unida a proteínas representa del 70-90%(3,27), es por esto que lo que se determina en plasma es Hcy total.
La fracción no unida es filtrada por los glomérulos y reabsorbida en los túbulos renales, por consiguiente su excreción renal es relativamente baja.
Causas de la hiperhomocisteinemia
En 1962, Carson y Neil reportaron en Irlanda del Norte, que en niños con retardo mental se encontraba homocisteinuria. Posteriormente en 1964, Mudd y Filkelsten en USA, mostraron que en biopsias hepáticas de niños con homocisteinuria no se detectaba cistationa b-sintetasa, representando esto la primera observación de la relación que existe entre Hcy con vitamina B6(6). Estudios como los realizados sugirieron que en las alteraciones reportadas de Hcy podría existir una causa genética, no obstante debemos recordar que las causas de la hiperhomocisteinemia son multifactoriales, tal como se muestra la Tabla 2.
En cuanto a las causas hereditarias, se han descrito 7 formas distintas de homocisteinuria (una enfermedad genética rara autosómica recesiva), siendo la más frecuente la que se relaciona con la enzima cistationina b sintetasa en donde se aumenta los niveles de Hcy y metionina y disminuye la cisteína y la cistina, afectándose así la vía de la transulfuración. En Irlanda, esta mutación ocurre 1:40.000, mientras que en el resto del mundo es bastante rara (1:200.000).
En la forma homocigota se encuentran niveles de Hcy de hasta 400 mmol/l y las manifestaciones clínicas son: retardo mental (en 50% de los casos), el cual se ha asociado como secundario a los accidentes cerebrovasculares; complicaciones oculares como el glaucoma, ya que la Hcy interfiere en el entrecruzamiento del colágeno retinal, apareciendo a los 3 ó 4 años de edad. Otra manifestación clínica puede ser la osteoporosis que se manifiesta en dos de tres pacientes de 15 años pero sin producir síntomas. Existen además, complicaciones vasculares (probablemente por daño del endotelio), las cuales son las mayores causas de morbilidad y mortalidad. La oclusión de arterias coronarias, renales y cerebrales acompañado de tejido infartado, ocurre en la primera década de vida y la cuarta parte de los pacientes muere antes de los treinta años por una enfermedad vascular. En pacientes heterocigotos la prevalencia de la enfermedad vascular es menos marcada, uno de cada 70 pacientes heterocigotos presentan niveles plasmáticos de Hcy entre 20-40 mmol/l(33).
Otra de las mutaciones más estudiadas se relaciona con defectos en los mecanismos de transporte, en donde se ha descrito la mutación puntual de la 5-10 metilenetetrahidrofolato reductasa (5-10 MTHFR) que afecta la vía de la remetilación. La forma homocigota tiene mal pronóstico por falta de terapia. Por último el polimorfismo C677T que produce una enzima termolábil, no es muy común, pero se considera de riesgo para la enfermedad vascular aterotrombótica(34).
El resto de las causas que se detallan en la Tabla 2, afectan a los cofactores de las vías metabólicas de la Hcy.
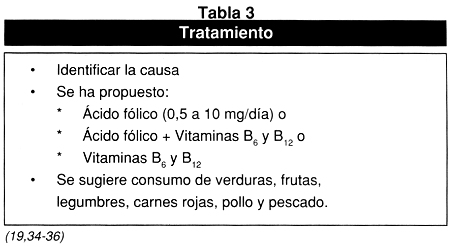
Cabe resaltar que en dos tercios de todos los casos de hiperhomocisteinemia que no involucran factores genéticos, se pueden relacionar con deficiencias nutricionales, por lo que se ha investigado si los suplementos vitamínicos podrían mejorar la morbilidad y la mortalidad; se ha sugerido que los individuos con niveles plasmáticos de Hcy >12 mmol/l, deben ingerir productos ricos en ácido fólico por vía oral, sólo o combinado con vitaminas B6 y B12.
En la Tabla 3 se presenta un resumen de los tratamientos que se pueden seguir según varios autores habiendo previamente identificado la causa de la hiperhomocisteinemia.
Sin embargo, Malinow y colaboradores(37) estudiaron una cohorte de 304 pacientes, de ambos sexos y encontraron una variación interindividual al tratamiento con suplementos de ácido fólico, ya que en algunos pacientes paradójicamente aumentaron sus niveles de Hcy en plasma pero no encontraron reproducibilidad de los valores medidos a los tres años. De manera, que al igual que otros autores(38) sugieren que se requieren más investigaciones para determinar la respuesta de los niveles de Hcy y ácido fólico.
Determinación de Hcy en plasma
Los métodos para determinar a la Hcy plasmática se desarrollaron en los años 80 con técnicas complejas y costosas hasta llegar hoy en día a técnicas automatizadas más asequibles, (Tabla 4).
Hanson y colaboradores(41) probaron en una misma muestra de plasma algunos de estos métodos y encontraron diferencias analíticas entre ellas. Recomendando entonces, la estandarización del método.
Actualmente, la determinación de Hcy en la mayoría de los laboratorios se lleva a cabo dentro del marco de protocolos de estudio de diferentes situaciones patológicas, como por ejemplo la trombofilia y en pacientes con historia de enfermedad coronaria(31).
El procedimiento más aceptado es el de tomar la muestra en ayuno, si bien algunos autores no lo indican(42), colocarla en hielo y separar el plasma en las 2-3 horas siguientes de obtenida la muestra, ya que los glóbulos rojos liberan Hcy y pueden dar falsos positivos. Si las muestras se congelan a –20°C la determinación de este aminoácido puede realizarse posteriormente(6,27,43).
Duarte y colaboradores en el 2002 evaluaron otro aspecto importante en la recolección de la sangre y es que si la muestra se recolecta en tubos el anticoagulante etilentrietilamida (EDTA), los valores de Hcy se encontraran elevados en comparación a si se emplean tubos de recolección con fluoruro de sodio (NaF), lo cual puede atribuirse a que estos productos (EDTA y NaF) afectan de forma diferente la tasa de liberación de la Hcy total desde los glóbulos rojos o quizás por inhibición de la glicólisis o por alguna otra interacción durante el ensayo. Por lo tanto, se recomiendan que los valores de referencia de Hcy total deben ser diferenciados en relación al método de recolección de la muestra, al tiempo de separación y al sistema de ensayo clínico utilizado(41,43).
Kang y colaboradores(44) propusieron unos valores de referencia de Hcy plasmática total que se muestran en la Tabla 5. Si bien estos son los más aceptados, no hay un consenso definitivo entre los investigadores que determinan niveles plasmáticos de Hcy.
Los niveles plasmáticos de Hcy varían con la edad, con el sexo y con los hábitos de fumar. Siendo los valores mayores en hombres y en fumadores. Pero, no parece haber cambios relacionados con la raza(45,46).
Refsum y colaboradores(47) basados en estudios retrospectivos señalan que un aumento de 1 mmol/l de Hcy plasmática está asociado con un incremento del 10% de riesgo de enfermedad vascular.
Se sugiere entonces, que los niveles de Hcy se deben medir en pacientes con una historia de enfermedad de arterias coronarias (aunque no tengan factores de riesgo clásicos) en individuo con historia de tromboembolismo y de patologías con trombosis venosa(24).
Otro aspecto relacionado con la determinación de Hcy y cuando se sospecha de algún trastorno relacionado con éste aminoácido, y su nivel plasmático en ayunas se encuentra dentro del rango "normal" se refiere a utilizar la "prueba de sobrecarga de metionina". En este caso, se sugiere un ayuno y al día siguiente se mide la Hcy basal, luego se administra una solución de metionina (100 mg/kg de peso) y se puede medir a las 2, 4, 6 u 8 horas después. Si el valor encontrado sobrepasa dos desviaciones estándar se considera que hay hiperhomocisteinemia(36).
En este sentido, Bostom y colaboradores(48) sugieren que la determinación de Hcy basal en pacientes en ayuno, no detecta el espectro total de individuos que pueden tener hiperhomocisteinemia, ya que ellos evaluaron a 274 participantes en el estudio de Familia Cardíaca NHLBI y encontraron que el 43% de las personas que tenían hiperhomocisteinemia era identificado sólo después de la prueba de la sobrecarga de metionina. Estos autores argumentan que las concentraciones de Hcy libre son muy bajas y por ello no son detectables.
Por último, debido a la relación estrecha entre la Hcy y el ácido fólico y los vitaminas B6 y B12, también se han determinado las concentraciones plasmáticas de estos cofactores y se ha encontrado que en los casos donde los niveles de las vitaminas y el folato están bajo, la concentración de Hcy total es alta(45).
Homocisteína como Factor de Riesgo
El reconocimiento de la homocisteína plasmática como factor de riesgo independiente de enfermedad vascular, sea coronaria, cerebral o periférica, ha provocado un aumento significativo del número de publicaciones que hacen referencia a la importancia de su control, como en años anteriores ocurrió con los niveles de colesterol y la hipertensión arterial.
Con relación al infarto al miocardio, se han realizado estudios prospectivos haciendo seguimiento de los niveles plasmáticos de Hcy(49,50,51) encontrando una asociación entre los niveles moderados a altos de Hcy con el subsiguiente riesgo de infarto al miocardio, independiente de otros factores de riesgo. En dos de estos trabajos(49,50), los autores sugieren el tratamiento con suplementos vitamínicos, por lo que la Hcy sería un factor de riesgo modificable.
Sin embargo, Senaratne y colaboradores(52) quienes encontraron una elevación de Hcy durante infarto agudo al miocardio (n = 62) cuando se miden los niveles de la misma dentro de las primeras 48, 72 horas y seis semanas después del evento cardiaco, proponen que dicho incremento podría estar relacionado a un aumento en las proteínas reactivas durante la fase aguda y es por esto que ellos sugieren que la determinación de Hcy debería hacerse seis semanas después, con el objeto de así determinar la verdadera línea basal de éste aminoácido.
También, se ha asociado el nivel plasmático de Hcy con el riesgo de insuficiencia cardiaca congestiva (ICC). Vasan y colaboradores(53) estudiaron esta relación en 2491 adultos con una edad promedio de 72 años que participaron en el estudio de Framingham, encontrando una asociación positiva mayor entre la ICC y los niveles de Hcy en mujeres que en hombres. Así mismo, la hiperhomocisteinemia es un factor de riesgo importante, independiente y frecuente para aterosclerosis clínica (en particular en la enfermedad vascular aorto-ilíaca, coronaria y cerebrovascular) así como la trombosis venosa y arterial. Para la enfermedad arterial coronaria, la hiperhomocisteinemia imparte un riesgo similar al fumar cigarrillos o a la hiperlipidemia(31).
Con la evaluación tanto de la Hcy plasmática como de la sobrecarga de metionina se ha demostrado hiperhomocisteinemia moderada en 21 a 26% de pacientes jóvenes con enfermedad arterial coronaria, 24% de pacientes con enfermedad cerebrovascular y 32% de los pacientes con enfermedad vascular periférica(54,55,56).
En pacientes con enfermedad arterial coronaria confirmada por angiografía, los niveles de Hcy plasmáticos son un fuerte predictor de mortalidad, independiente de factores de riesgo clásicos como la proteína-C reactiva, el genotipo homocigoto para la metilenetetrahidrofolato reductasa(57) o los niveles de lipoproteína (a)(58).
Desde los años 70 se han acumulado datos clínicos biológicos y epidemiológicos que han demostrado que los niveles de Hcy moderadamente elevados favorecen el desarrollo de aterogénesis y trombogénesis(59,60-62). El riesgo de eventos coronarios o cerebrales es de 1,5 a 3 veces mayor en sujetos en ayuno con niveles de Hcy mayores de 15 mmol/l(59,63).
Mandel y colaboradores(64) demostraron que en pacientes homocigotos para homocisteinuria y la mutación R506Q (consiste en la sustitución de glutamina por arginina en la posición 506) en el gen que codifica para el factor V de coagulación (descrita como Factor V Leiden) tienen un riesgo aumentado de trombosis indicando una potenciación de los efectos de estas mutaciones.
En general, se ha demostrado que la Hcy plasmática está alterada en patologías que cursan con cambios ateroscleróticos tales como: hipertensión arterial y diabetes tipo 1(61,65), hipotiroidismo(61,66), lupus eritematoso sistémico(67), artritis reumatoide(68) e incluso los eventos cardiovasculares en mujeres menopáusicas(69,70) y en otro tipo de patologías tales como anemia perniciosa, gastritis atrófica, psoriasis, síndrome de mala absorción e insuficiencia renal(71).
Hackam y Anand(72) señalan que la enfermedad vascular aterosclerótica debe ser considerada como un problema de salud pública en incluyen a la Hcy junto a la proteína-C reactiva, la lipoproteína (a) y el fibrinógeno como candidatos emergentes de factores de riesgo. Por su parte, Pasterkamp y colaboradores(73) acotan que si bien se puede considerar a la Hcy como un predictor de eventos cardiovasculares adversos, este factor no es afectado por el estado de la enfermedad aterosclerótica.
Mecanismos Fisiopatológicos
La relación entre la Hcy plasmática y las alteraciones ateroscleróticas ha sido confirmada en más de 80 estudios epidemiológicos, sin embargo, aún no existe consenso en cuanto a los mecanismos subcelulares involucrados(27,74).
Para abordar este aspecto, se han realizado tanto estudios in vivo como in vitro. Estos últimos, sin embargo, deben ser interpretados con cautela y en forma crítica, ya que en algunos casos se han utilizado condiciones que no son comparables con las fisiológicas y fisiopatológicas.
Al revisar la literatura, encontramos que se han propuesto diferentes mecanismos fisiopatológicos que podemos enumerar: Estrés oxidativo, disfunción endotelial, aumento de la concentración de tiolaclona, proliferación de células de músculo liso, aumento de la oxidación de la LDL, de la agregación plaquetaria, de factores de coagulación y activación de factores proinflamatorios(27,75,76).
Loscalzo(9) señala que la autooxidación de la Hcy genera potentes especies reactivas de oxígeno (homocistina, homocisteína tiolactona y disulfuros mezclados con homocisteína) además de la oxidación del grupo sulfhidrilo, el anión radical superóxido, el peróxido de hidrógeno y el radical hidroxilo; todos ellos pueden provocar daño de la pared vascular afectando la regulación vasomotora, el fenotipo antitrombótico, la agregación plaquetaria, elastasas y la deposición de calcio en la íntima arterial, además de la peroxidación de los lípidos de las lipoproteínas plasmáticas.
Como parte de los efectos directos de la Hcy o sus metabolitos, encontramos que Tang y colaboradores(77) demostraron que la Hcy tiene un efecto bifásico estimulante de la síntesis de ADN en células musculares lisas obtenidas de aortas de humanos dependiente de la concentración, seguido de inhibición a concentraciones fisiopatológicas. También se ha encontrado un efecto bifásico de Hcy sobre la actividad de colagenasa en la matriz de colágeno.
Otro efecto directo de la Hcy fue estudiado por Hajjar y colaboradores(12) quienes demostraron que una inhibición de la interacción del activador de plasminógeno tisular (t-PA) con la Anexina humana (proteína unida fosfolípidos de membrana, dependiente de calcio), puede provocar cambios del patrón antitrombótico de las células endoteliales de la pared vascular.
Por otro lado, también se ha revisado el efecto de la forma oxidada de la Hcy, la homocistina, en cultivos de células musculares lisa aisladas de arterias coronarias de corazones humanos con cardiopatía idiopática, reportándose que puede causar alteraciones ateroscleróticas prematuras en el corazón, ya que se encontró una proliferación de células e inducción de síntesis de colágeno(3).
Otro campo de investigación se refiere al efecto de la Hcy sobre el metabolismo del óxido nítrico (NO) por diversas vías: afectando su síntesis por efecto de las especies reactivas de oxígeno (aumento de los niveles de dismutasa superóxido) que se producen y/o por productos de la peroxidación lipídica(9,78) o por agotamiento del NO existente o por la formación de S-nitrosohomocisteina(80), lo cual agrava el daño oxidativo y elimina el efecto vasodilatador del NO. Sin embargo, este aspecto requiere mayor investigación ya que otro grupo de investigadores han obtenido resultados opuestos(81).
Por último, Jakubowski(11) demostró en cultivos celulares de fibroblastos humanos, que al aumentar la concentración de Hcy se incrementa la concentración de otro metabolito, la tiolactona. Este autor señala que ésta podría combinarse con partículas de LDL, promoviendo agregación, captación por los macrófagos de la íntima arterial y las células espumosas de las placas de ateromas en formación o podría conjugarse con proteínas intracelulares y de secreción, lo que conduciría a alteraciones del metabolismo oxidativo; con esto se reforzaría el daño oxidativo y los cambios fibróticos y proliferativos de las células musculares lisas de la pared vascular, tal como lo evidenció Mc Cully en 1971.
En cuanto a experimentos in vivo, Lentz y colaboradores(82) indujeron en primates con 4 semanas de dieta enriquecida con metionina y libre de colina y baja concentración de ácido fólico, la aparición de hiperhomocisteinemia y demostraron que desarrollaron disfunción vascular similar a la encontrada en primates sometidos a dieta aterogénica por 18 meses.
En resumen, hoy en día se propone que la Hcy actúa sobre el sistema cardiovascular vía dos procesos: uno de ellas, el tromboembolismo, en el que estarían involucrados la activación de factores procoagulantes y la unión de la lipoproteína (a) a la fibrina y la otra vía, la aterosclerosis que estaría ocasionada por una citotoxicidad endotelial reflejada por el aumento de marcadores del daño endotelial y por disminución en la generación de óxido nítrico además de la propia capacidad oxidativa de la Hcy(31,75,76).
En conclusión, ahora que se ha visto incrementado el nivel de conocimiento de cómo la hiperhomocisteinemia está unida a un aumento en el riesgo de las enfermedades vasculares, especialmente de ICC y a pesar de las fuertes evidencias que enlazan los niveles elevados de homocisteína con los eventos coronarios y la mortalidad, los resultados obtenidos no muestran claramente que el reducir los niveles de homocisteína impacten favorablemente sobre el índice de mortalidad; estas preguntas sin respuestas aún esperan más ensayos y análisis que se dirijan a responder estos hechos. Mientras tanto, el análisis de los niveles de homocisteína por su alto costo no es recomendado en todo tipo de pacientes. Este debe llevarse a cabo en pacientes que presenten altos factores de riesgo tradicionales (por ejemplo: mayores de 40 años, fumadores, diabéticos, con niveles elevados de colesterol o con una fuerte historia familiar de eventos de ateroesclerosis prematura). Se recomienda en pacientes con ICC y que tengan un riego aumentado de la misma y con niveles de homocisteína mayores de 12 mM y sin un adecuado suplemento de vitaminas B6 y B12 y ácido fólico.
La Asociación Americana del Corazón ha recomendado que el objetivo terapéutico sea disminuir los niveles de homocisteína por debajo de 10 mM y que los pacientes deban ingerir al menos cinco raciones de frutas y vegetales diariamente.
REFERENCIAS BIBLIOGRÁFICAS
1. Hoeg, JM. Evaluating coronary heart disease risk. Tiles in the mosaic. JAMA 1997; 277(17): 1387-1390. [ Links ]
2. Welch GN and Loscalzo J. Homocysteine and atherotrombosis. N. Eng J Med 1998; 338(15): 1042-1050. [ Links ]
3. Tyagi SC. Homocyteine redox receptor and regulation of extracellular matrix componentes in vascular cells. Am J Physiol 1998; 274(43): C396-C405. [ Links ]
4. Escalona M. Homocisteína. Puede ser encontrado en www.Lab.nutricion.cl/homocis.htm 2003 [ Links ]
5. Mayer EL, Jacobsen DM. and Robinson K. Homocysteine and coronary atherosclerosis. J AMER Coll Cardiol 1996; 27(3): 517-527. [ Links ]
6. Marin-Velásquez, A. Marín Polanco JA. y Marín Polanco E. Homocisteína y aterotrombosis. En: Aterosclerosis al día IV. (I. Soltero, editor). Publicación de la Asoc. Venezolana de Aterosclerosis 2000; pp 219-245. [ Links ]
7. Mc Cully KS. Vascular pathology of homocysteinemia: implications for the pathogenesis of arteriosclerosis. Am.J.Pathology 1969; 56:111-128. [ Links ]
8. Bouskey CJ, Beresford SAA, Omesas GS and Motulsy AG. Cuantitative assesment of plasma homocysteine as a risk factor for vascular disease.Probable benefits of increasing folic acid intake. JAMA 1995; 274: 1049-1057. [ Links ]
9. Loscalzo J. The oxidant stress of hyperhomocysteinemia. J Clin Invest. 1996; 98(1): 5-7. [ Links ]
10. Bellamy MF, McDowell IFW, Ramsey MW et al. Hyperhomocysteinemia after an oral methionine load acutely impairs endothelial function in healthy adults. Circulation 1998; 98: 1848-1852. [ Links ]
11. Jakubowski H. Metabolism of homocysteine thiolactone in human cell cultures. J Biol Chem 1997; 272(3): 1935-1942. [ Links ]
12. Hajjar KA, Mauri L, Jacovina AT, et al. Tissue plasminogen activator binding to the Annexin II tail domain. J Biol Chem 1998; 273(16): 9987-9998. [ Links ]
13. Bastías Guzmán E. Factores de Riesgo Cardiovascular. Puede ser encontrado en: www.knop.cl/cursonutrición/Factores 2003. [ Links ]
14. Hofman MA, Lalla E, Lu Y, et al, Hyperhomocysteinemia enhances vascular inflammation and accelerates atherosclerosis in a murine model. J. Clin Invest 2001; 107(6): 675–683. [ Links ]
15. Bjorke Monsen AL and Ueland PM Homocystein and metihylmalonic acid in diagnosis and risk assessment from infancy to adolescence. Am J Clin Nutri 2003; 78(1): 7-21. [ Links ]
16. Bazzano LA, He J, Muntner P, Vupputuris S and Whelton PK. Relationship between cigarette smoking and novel risk factors for cardiovascular disease in the United States. Am Intern Med 2003; 138 (11): 891-897. [ Links ]
17. Handy DE and Loscalzo L Homocysteine and atherothrombosis: diagnosis and treatment. Curr. Atheroscle Rep 2003; 5(4): 276-283. [ Links ]
18. Mager A, Battler A, Birnbaum Y, Magal N and Shohat M. Plasma homocysteine, methylenetehahydrofolate reductase genotypes, and age at onset of symptoms of myocardial ischemia. Am J Cardiol. 2002; 89(8): 919-923. [ Links ]
19. Osganian SK, Stampler MJ, Spiegelman D, et al. Distribution of and factors associated with serum homocysteine levels in children. JAMA 1999; 281(13): 1189-1196 [ Links ]
20. Nygard O, Vollset SE, Refsum H, et al. Total plasma homocysteine and cardiovascular risk profile JAMA 1995; 274: 1526-1533. [ Links ]
21. Ueland PM, Nygard O, Vollset SE and Refsum H. The Hordaland Homocysteine studies. Lipids 2001; 36(Supp) S33-S38. [ Links ]
22. Blum A, Lupovitch S, Khazim K, et al. Homocysteine levels in patients with risk factors for atherosclerosis. Clin Cardiol 2001; 24(6): 463-466. [ Links ]
23. Wierzbicki AS, Lambert-Hammill M, Junadi E, Lunib PJ and Crook MA. Differing relationships of methylene tetrahydrofolate reductase genotypes with cardiovascular risk in familial and polygenic hypercholesterolaemia. J Cardiovascular Risk 2000; 7(6): 341-344 [ Links ]
24. Tsai WCh, Li YH, Tsai LM; Chao TH et al. Correlation of homocysteine levels with the extent of Coronary Atherosclerosis in patients with low cardiovascular risk profiles. Am J Cardiol 2000; 85: 49-52. [ Links ]
25. Selhub J and Miller JW. The pathogenesis of homocysteinemia: Interruption of the Coordinate Regulation by S/- Adenosylmethionine of the Remethylation and Transsulfuration of Homocysteine. AM J Clin Nutri 1991; 55: 131-134 [ Links ]
26. Guilland JC, Favler A, Potier de Courcy G, Galan P and Hercberg S. Hyperhomocysteinemia: an independent risk factor or a simple marker of vascular disease? 1 Basic data. Pathol Biol. 2003; 51(2):101-110. [ Links ]
27. Menéndez Cabezas A y Fernández-Brito JE. Metabolismo de la homocisteína y su relación con la aterosclerosis. Rev. Cubana Invest Biomed. 1999; 18(3): 155-168. [ Links ]
28. Abdu TA, Elhadd TA, Akber M, Hartland A et al. Plasma homocysteine is not a major risk factor for vascular disease in growth hormone deficient adults. Clin Endocrinol. 2001; 55(5): 635-638. [ Links ]
29. Pinto X, Vilaseca MA, García-Giralt N et al. Homocysteine and the MTHFR 677C. T Allele in premature coronary artery disease. Case control and family studies.. Eur.J.Clin Invest. 2001; 31(1): 6-8 [ Links ]
30. Blom HJ. Mutated 5,10-methylenetetrahydrofolate reductase, hyperhomocysteinemia and risk for cardiovascular disease. Nature, nurture or nonsense?. Eur J Clin Invest. 2001; 31: 6–8 [ Links ]
31. Calvo H. Homocisteína y Enfermedad arterial oclusiva. Puede ser encontrada en www.galenonet.com/Cardio/Hcy & AOD.htm 2003. [ Links ]
32. Desouza C, Keebler M, McNamara DB and Fonseca V. Drugs affecting homocysteine metabolism: impact on cardiovascular risk. Drugs 2002; 62(4): 605–616. [ Links ]
33. Rosenberg LE. Inherited disorders of amino acid metabolism and storage. E: Principle of Internal Medicine. Harrison´s (K. Iseselbacher, E. Braunwald; J.D. Wilson and col, editor) 13a Edition. Mc Graw Hill New York. 1994; 2(352): 2117–2123. [ Links ]
34. Virgos C, Joven J, Simó JM, Villela E, et al. Homocyst(e)ine and the C677T mutation of methylenetetrahydrofolate reductase in survivors of premature myocardial infarction. Clin. Biochem. 2000; 33(6): 509–512. [ Links ]
35. Bellamy MF, McDowell IFW, Ramsey MW, Brownlee M, et al. Oral folate enhances endothelial function in hyperhomocysteinaemic subjects. Eur J Clin Invest. 1999; 29: 659–662. [ Links ]
36. Malinow RM, Bostom AG and Krauss RM. Homocyst(e)ine, diet and cardiovascular disease. Circulation 1999; 99: 178–182. [ Links ]
37. Malinow RM, Barton Duell P, Williams MA, Kruger WD et al. Short-term folic acid supplementation induces variable and paradoxical changes in plasma homocyst(e)ine concentrations. Lipids 2001; 36: 527 –532. [ Links ]
38. Guilland JC, Favier A, Potier de Courcy G, Galan P and Hercberg S. Hyperhomocysteinemia: an independent risk factor or a simple maker of vascular disease? 2. Epidemiological data. Pathol Biol 2003; 51(2): 111–121. [ Links ]
39. Araki A and Sako J. Determination of free and total homocysteine in plasma of high performance liquid chromatography with flourescent detection. J Chromat. 1987; 422: 43–52. [ Links ]
40. Refsum H, Helland S and Ueland OM. Radioenzymic determination of homocysteine in plasma and urine. Clin Chem 1985; 31: 624–628. [ Links ]
41. Hanson NQ, Eckfeldt JH, Schwichtenberg K, et al. Interlaboratory variation of plasma total homocysteine measurements: results of three seccessive homocysteine proficiency testing surveys. Clin Chem 2002; 48(9): 1539–1545 [ Links ]
42. Bostom AG, Silbershatz H, Rosenberg IH, Selhub J, et al. Nonfasting plasma total homocysteine levels and all-cause and cardiovascular disease mortality in elderly Framingham men and women. Arch Intern Med 1999; 159: 1077–1080. [ Links ]
43. Duarte NL, Wang XL and Leon Wilcken DE. Effects of anticoagulant and time of plasma separation on measurement of homocysteine. Clin Chem 2002; 48(4): 665–668. [ Links ]
44. Kang SS, Wong PW, Malinow MR. Hyperhomocystinemia as risk factor for occlusive vascular disease. Ann Rev Nutr 1992; 12: 279–298. [ Links ]
45. Selhub J, Jacques PF, Rosenberg IW, Rogers G. et al. Serum total homocysteine concentrations in the third national health and nutrition examination survey (1991-1994): Population reference ranges and contribution of vitamin status to high serum concentrations. Ann Intern Med 199; 131(5): 331–339. [ Links ]
46. Domínguez Rodríguez A, Abreu González P y Jiménez Sosa A. Homocisteína y enfermedad arterial coronaria. Rev Esp Cardiol 2002; 55: 554–555. [ Links ]
47. Refsum H, Helland S and Ueland OM. Homocysteine and cardiovascular disease. Ann Rev Med 1998; 49: 31–62. [ Links ]
48. Bostom AG, Jacques PF, Nadeau MR, Willimas RR, et al. Post-methionine load hyperhomocysteinemia in persons with normal fasting total plasma homocysteine: initial results from The NHLBI Family Heart Study. Atherosclerosis 1995; 116: 147–151. [ Links ]
49. Stampfer MJ, Malinow MR, Willet WC, Newcorner LM, et al. A prospective study of plasma homocyst(e)ine and risk of myocardial infarction in US physicians. JAMA 1992; 268(7): 877–881. [ Links ]
50. Malinow MR, Ducimetiere P, Luc G, Evans AE, et al. Plasma homocyst(e)ine levels and graded risk for myocardial infarction: finding in two populations at contrasting risk for coronary heart disease. Atherosclerosis 1996; 126: 27–34. [ Links ]
51. Reis RP, Azinheira J, Reis HP, Bordalo e Sa A, Tavares J, et al. Prognosis significance of blood homocysteine after myocardial infarction. Rev Port Cardiol 2000; 19(5): 581–585. [ Links ]
52. Senaratne MP, Griffiths J and Nagendran J. Elevation of plasma homocysteine levels associated with acute myocardial infarction. Clin Invest Med 2000; 23(4): 220–226. [ Links ]
53. Vasan RS, Beiser A, D´Agostino RB, Levy D, Selhub J, Jacques PF, Rosenberg I and Wilson P. Plasma homocystein and risk for congestive heart failure in adults without prior myocardial infarction. JAMA 2003; 289: 1251–1257. [ Links ]
54. van den Berg M and Boers GH. Homocystinuria: what about mild homocysteinaemia? Postgrad Med J 1996; 72(851): 513–518. [ Links ]
55. Fernández Miranda C, Aranda JL, Gómez González P, et al. Hiperhomocisteinemia is frequent in coronary disease patients. Study of 202 patients. Med Clin 1999; 113(11): 407–410. [ Links ]
56. Chai AU and Abrams J. Homocysteine: a new cardiac risk factor? Clin Cardiol 2001; 24 (1): 80–84. [ Links ]
57. Anderson JL, Muhlestein JB, Horne BD, Carlquist JF, et al. Plasma homocysteine predicts mortality independently of traditional risk factors and C-reactive protein in patients with angiographically defined coronary artery disease. Circulation 2000; 102: 1227–1232. [ Links ]
58. Laraqui A, Bennouar N, Meggouh F, Allami A, et al. Homocysteine, lipoprotein (a): risk factors for coronary heart disease. Ann Bio Clin 2002; 60(5): 549–557. [ Links ]
59. Conri C, Constans J, Parrot F, Skopinski S and Cipriano C. Inverted question mark Homocysteinemia: role in vascular disease. Presse Med 2000; 29(13): 737–741. [ Links ]
60. Cattaneo M. Hyperhomocysteinaemia and atherothrombosis. Ann Med 2000; 32(Suppl 1): 46–52. [ Links ]
61. Cattaneo M. Hyperhomocysteinaemia and thrombosis. Lipids 2001; 36: S13–S26. [ Links ]
62. Falk E, Zhou J and Möller J. Homocysteine and atherothrombosis. Lipids 2001; 36: S3–S11. [ Links ]
63. Abbate R, Sofi F, Brogi D and Marcucci R. Emerging risk factors for ischemic stroke. Neurol Sci 2003; 24(Suppl 1): S11–S12. [ Links ]
64. Mandel H, Brenner B, Berant M, Rosenberg N, et al. Coexistence of hereditary homocystinuria and factor V Leiden – Effect on thrombosis. New Engl J Med 1996; 334(12): 763–768. [ Links ]
65. Glowinska B, Urban M, Peczynska J, Florys B and Szydlowska E. Elevated concentrations of homocysteine in children and adolescents with arterial hypertension accompnying Type 1 diabetes. Med Sci Monit 2001; 7(6): 1242–1249. [ Links ]
66. Giménez Barriga ME, Jimeno Carrúez AJ, Ramírez Martínez IR, et al. Estudio de homocisteína – Hipotiroidismo. Puede ser encontrado en www.socalmi.org/comunicaciones_1.htm [ Links ]
67. Martínez-Berriotxoa A, Ruiz-Irastorza G, Egurbide Arberas MV, et al. Plasma homocysteine levels in systemic lupus erythematosus. Med Clin 2003; 120(18): 681–685. [ Links ]
68. Roubenoff R, Dellaripa P, Nadeau MR, Abad LW, Muldonn B, Selhub J and Rosenberg IH. Abnormal homocysteine metabolism in rhemautoid arthritis. Arthritis Reum 1997; 40: 718–722. [ Links ]
69. Davison S and Davis SR. New markers for cardiovascular disease risk in women: impact of endogenous estrogen status and exogenous postmenopausal hormone therapy. J Clin Endocrinol Metab 2003; 88(6): 2470–2478. [ Links ]
70. Smolders RG, van der Mooren MJ, Sipkema P and Kenemans P. Estrogens, homocysteine, vasodilatation and menopause: basic mechanisms, interactions and clinical implications. Gynecol Endocrinol 2003; 17(4): 339–354. [ Links ]
71. Kalra DK. Homocysteine and cardiovascular disease. Current Ather Reports 2004; 6: 101-106 [ Links ]
72. Hackam DG and Anand SS. Emerging risk factors for atherosclerotic vascular disease: a critical review of the evidence. JAMA 2003; 290(7): 947–949. [ Links ]
73. Pasterkamp G, Algra A, Grobee DE, de Jaegere PP, et al. Homocysteine and the stage of atherosclerotic disease: a study in patients suffering from clinically silent and clinically manifest atherosclerotic disease. Eur J Clin Invest 2002; 32(5): 309–315. [ Links ]
74. Dalmau Serra J. Nuevos factores de riesgo cardiovascular detectables en la edad pediátrica. An Esp Pediatr 2001; 54: 4–8. [ Links ]
75. Lawrence de Koning AB, Werstuck GH, Zhou J and Austin RC. Hyperhomocysteinemia and its role in the development of atherosclerosis. Clin Biochem 2003; 36(6): 431–441. [ Links ]
76. Scott CH and Suttons MS. Homocysteine: evidence for a causal relationship with cardiovascular disease. Cardiol Rev 1999; 7(2): 101–107. [ Links ]
77. Tang L, Mamotte CDS, Van Bockxmeer FM and Taylor RR. The effect of homocusteine on DNA synthesis in cultures human vascular smooth muscle. Atherosclerosis 1998; 136: 169–173. [ Links ]
78. Hajjar KA. Homocysteine: a sulphrous fire. J Clin Invest 2001; 107(6): 663-664. [ Links ]
79. Upchurch GR, Welch GN, Fabian AJ, Brecher P, Loscalzo J and Pigazzi A. Homocyst(e)ine decreases bioavailable nitric oxide by a mechanism involving glutathione peroxidase. J Biol Chem 1997; 272(27): 17012–17017. [ Links ]
80. Stamler JS, Osborne JA, Jaraki O, Rabbani LE, Mullins M, Singel D and Loscalzo J. Adverse vascular effects of homocysteine are modulated by endothelium-derived relaxing factor and related oxides of nitrogen. J Clin Invest 1993; 91: 308–318. [ Links ]
81. Welch GN, Upchurch GR, Farivar RS, Pigazzi A, Vu K and Brecher P. Homocysteine-induced nitric oxide production in vacular smooth muscle cells by NF-Kappa B-dependent transcriptional activation of Nos.2. Proc Am Assoc Physicians 1998; 110: 22-31. [ Links ]
82. Lentz SR, Sobey CG, Piegors DJ, Bhopatkar MY, Faraci FM, Malinow R and Heistad DD. Vascular dysfunction in monkeys with diet-induced hyperhomocyst(e)inemia. J Clin Invest 1996; 98(1): 24–29. [ Links ]