Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT v.24 n.2 Caracas 2005
La Oxitocina media la natriuresis inducida por la Angiotensina ii administrada centralmente
J Arzola1, L Zavala1, E Díaz1, M Pastorello1, M del R Garrido1 y A Israel1.
1 Laboratorio de Neuropéptidos, Facultad de Farmacia, Universidad Central de Venezuela.
E-mail: astern88@hotmail.com
RESUMEN
El sistema renina-angiotensina cerebral es uno de los sistemas más importantes que participan en la regulación del balance hidromineral. La administración central de renina o angiotensina II (Ang II) induce dipsogenia, apetito por la sal, aumento de presión arterial, natriuresis, liberación de oxitocina y vasopresina desde el núcleo paraventricular hipotalámico. La evidencia indica que la oxitocina es una hormona natriurética. Por ello, estudiamos el papel de la oxitocina como posible efector humoral de la natriuresis inducida por la administración intracerebroventricular (ICV) de Ang II en ratas euvolémicas, mediante el uso del atosiban (AT), un antagonista selectivo de los receptores de oxitocina. La administración central de renina o Ang II produjo un efecto antidiurético a la primera hora y un aumento en la excreción urinaria de sodio, de potasio y de GMPc a las 1, 3 y 6 horas. El AT potenció el efecto antidiurético e inhibió completamente la natriuresis, kaliuresis y aumento de la excreción de GMPc, inducidos por la Ang II. Los efectos renales de renina fueron independientes del óxido nítrico ya que el pretratamiento con L-NAME, un inhibidor de la sintasa del óxido nítrico, no alteró la respuesta renal inducida por la administración de renina-ICV. Nuestros resultados apoyan el papel de la oxitocina como efector de la acción natriurética mediada por el sistema renina angiotensina cerebral.
Palabras Clave: Angiotensina II, Atosiban, Natriuresis, Oxitocina, Óxido nítrico.
ABSTRACT
The renin angiotensin system (RAS) is considered to play an important physiological role in the regulation of body fluid. Intracerebroventricular administration of renin or angiotensin II (Ang II) increases blood pressure, sympathetic outflow, water intake, sodium excretion and oxytocin and vasopressin release and decreases urine volume. Evidence indicates tha oxytocin is a natriuretic hormone. Thus, with the use of a specific oxytocin receptor antagonist, atosiban (AT), we evaluated the role of oxytocin as a possible effector in the natriuretic action induced by intracerebroventricular (ICV) administration of Ang II or renin. Our results demonstrate that Ang II-ICV administration reduced urinary volume at 1 hour of collection and increased urinary excretion of sodium, potassium and cGMP at 1-, 3- and 6 hrs period of urine collection. Atosiban potentiated the Ang II antidiuretic effect and blunted natriuresis, kaliuresis and increased cGMP excretion induced by ICV-Ang II. The increase in urinary cGMP was independent of the stimulation of nitric oxide synthase activity, since L-NAME pretreatment did not modify the renal actions induced by ICV-renin. Our results support the concept that oxytocin mediated the natriuretic action of the brain renin angiotensin system.
Key Words: Angiotensin II, Atosiban, Natriuresis, Oxitocin, Nitric oxide.
INTRODUCCIÓN
La estabilidad del medio interno requiere de mecanismos fisiológicos complejos capaces de mantener las concentraciones de electrolitos dentro de límites adecuados para la supervivencia del organismo. Todos esos procesos son debidamente regulados e integrados de manera que conforman una unidad global en el ser vivo. En los animales superiores, uno de esos mecanismos que han evolucionado en el tiempo como regulador del medio interno es el sistema renina-angiotensina (SRA). A nivel periférico, el SRA constituye uno de los más importantes sistemas que participan en el control de los niveles de agua y sodio en el organismo, así como en la regulación de la presión arterial.
La evidencia demuestra que existe en el cerebro un sistema renina-angiotensina activo, el cual participa en el control homeostático y cardiovascular. En efecto, todos los componentes del SRA, así como sus ARNm, han sido detectados en diferentes áreas del sistema nervioso central (Zini y col., 1996).
La administración central de Ang II o renina produce aumento de la presión arterial, dipsogenia, aumento del apetito por la sal, antidiuresis y -contrariamente a lo que produce periféricamente- produce aumento de la excreción urinaria de sodio (Itoh y col., 1988; Wright y Harding, 1997; Unger y col., 1996; Barbella y col., 1993). Sin embargo, el mecanismo por el cual la ANG II produce natriuresis y los posibles efectores involucrados, no están aun bien establecidos.
Se conoce que la administración central de Ang II o de renina estimula la liberación de vasopresina (AVP) y de oxitocina (OX) desde la neurohipófisis, y ambas hormonas tienen acciones natriuréticas (Verbalis y col., 1991; Balment y col., 1984). La acción natriurética de la Ang II cerebral podría estar mediada por la liberación a la circulación de una de éstas dos hormonas neurohipofisiarias.
La oxitocina (OX), es un nonapéptido sintetizado en los núcleos supraóptico y paraventricular del hipotálamo y es liberada a la circulación desde terminales nerviosos de la hipófisis posterior. Se han identificado receptores para OX en muchos tejidos, entre los que se encuentran el riñón, el corazón, el timo, el páncreas, los adipositos y el miometrio (Gimpl y col., 2001). La oxitocina ejerce acciones fisiológicas durante el parto estimulando las contracciones uterinas y posteriormente en la eyección de la leche. Sin embargo, su localización a concentraciones similares en la hipófisis y en el plasma circulante de animales machos, indica que la OX ejerce otras acciones además de las ya descritas. De hecho, resultados de estudios recientes vinculan a esta hormona en procesos tales como el aprendizaje, la memoria, y la conducta sexual y materna, además de la regulación de la homeostasis hidromineral (Gutkoswska y col., 2000).
Existe evidencia experimental que ha permitido establecer una relación entre la Ang II, la liberación hipotalámica de oxitocina y la consecuente secreción del péptido natriurético auricular (PNA). Este último es una hormona producida y liberada desde el corazón, con demostrados efectos diuréticos y natriuréticos. En este sentido, en experimentos en los que se induce expansión de volumen mediante la administración de solución salina isosmótica o hiperosmótica, los cuales desencadenan la estimulación de los baroreceptores ubicados en las arterias, se ha demostrado que el aumento de la concentración plasmática del péptido natriurético auricular se asocia a la liberación de oxitocina (Haanwinckel y col., 1995; McCann y col., 2003). Igualmente, la inyección intravenosa de OX induce incrementos de los niveles plasmáticos de PNA dependientes de la dosis, y la administración intraperitoneal de OX a ratas con sobrecarga de agua induce natriuresis, kaliuresis, e incremento de la osmolaridad urinaria acompañada de incrementos plamáticos de PNA. Estos efectos parecen estar mediados exclusivamente por el receptor de la OX, ya que la natriuresis inducida por la administración de AVP u OX a dosis fisiológicas, en ratas conscientes, no involucra a ninguno de los subtipos de receptores de vasopresina, V1/V2, sin embargo la respuesta a la OX puede ser bloqueada por antagonistas de sus receptores (Balment y col., 1993, Verbalis y col., 1991). De manera similar, Zavala y col. (2004) han demostrado que la natriuresis inducida por la administración central de renina se asocia a un aumento de la concentración plasmática del PNA. El mecanismo primario que desencadena el incremento en los niveles circulantes del PNA no está esclarecido hasta el presente, posiblemente sea de naturaleza multifactorial, de forma que podría involucrar la acción sobre el corazón de hormonas como la vasopresina y/o de la oxitocina. En apoyo a este planteamiento se ha demostrado que en las ratas hipofisectomizadas se produce la eliminación total de la respuesta natriurética y diurética frente a la expansión de volumen, asociada a retención de sodio y a la caída en la presión sanguínea (Dietz y Nazian, 1990).
Todo lo anterior parece indicar que, tanto la oxitocina como el PNA se encuentran involucrados en la respuesta fisiológica renal a la administración central de Ang II (Gutkoswska y col., 2000). Por ello, en el presente estudio nos planteamos como hipótesis que la oxitocina constituye uno de los efectores de la respuesta natriurética que ocurre tras la administración central de Ang II o renina.
MATERIALES Y MÉTODOS
Animales de experimentación
Se utilizaron ratas machos de la cepa Sprague-Dawley, entre 200 y 250 g. de peso corporal procedentes del bioterio de la Facultad de Farmacia de la UCV, las cuales se mantuvieron con agua y alimento estándar para animales de laboratorio (Ratarina®) ad libitum.
Canulación intracerebroventricular (ICV)
Los animales fueron canulados, bajo anestesia con pentobarbital sódico (40 mg/kg, i.p.), mediante el uso de un aparato estereotáxico (David Kopf Instruments®) (Severs y col., 1970). Como cánula se utilizó una aguja hipodérmica de 20 GA, 4 mm de longitud y que se colocó en el ventrículo lateral izquierdo, a 1 mm caudal a la sutura coronal y a 1,5 mm lateral a la sutura sagital. La administración ICV de los diferentes tratamientos se realizó con una inyectadora Hamilton, acondicionada para permitir su adecuada penetración a través de la cánula. En todos los casos, se confirmó la canulación post mortem mediante administración de 5 ml de solución colorante Fast Green (Sigma Chemicals Co., MO, USA) incluyendo aquéllos animales en los que se observó una distribución uniforme en los ventrículos cerebrales.
Los animales de experimentación fueron divididos al azar en cuatro grupos experimentales para la administración de los tratamientos a seguir:
1. Bloqueo de los receptores de oxitocina con atosiban: 1) Solución Fisiológica (NaCl 0.9%), 5 ml ICV; 2) Angiotensina II (5 nmol/5 ml); 3) Antagonista de oxitocina: atosiban. Compuesto sintético, de formula: [Mpa1, D-Tyr (Et)2, Thr4, Orn8] oxitocina nonapéptido (500 mg/kg, s.c., 30 minutos antes del inicio del experimento. 1 minuto antes de Ang II y 3 hr después); 4) Atosiban+Ang II.
2. Bloqueo de la actividad de la sintasa del óxido nítrico (SON) con L-NAME: 1) Solución fisiológica (NaCl 0.9%) (5 ml, ICV); 2) L-NAME (20 mg/kg p.c., ip); 3) L-NAME (20 mg/kg p.c., ip. 10 minutos antes renina); 4) renina (7.14 mGU/5 ml, ICV).
Inmediatamente después de los tratamientos los animales recibieron una carga oral de agua (20 ml/kg, p.c.) y fueron colocados en jaulas metabólicas individuales sin acceso a agua ni alimento. Se recolectaron muestras de orina a las 1, 3 y 6 horas. Se determinó la excreción urinaria de sodio y potasio y GMPc.
Determinación del contenido de Na+ y K+ urinario
La cantidad de sodio y potasio en las muestras de orina recolectadas se determinó por fotometría de llama (Corning® 405 de Corning Medical Instruments, UK). Los resultados se expresan en mEq/ml de orina y corregidos por peso corporal (mEq/ml/100 g, p.c.).
Determinación de GMPc urinario
Se recolectaron las muestras de orina a diferentes períodos según el protocolo, para la determinación de la excreción urinaria de GMPc. El contenido de GMPc se cuantificó por radioinmunoensayo (RIA) utilizando para ello un paquete comercial (Amersham® International plc, UK). El método se fundamenta en la competencia que se establece entre el GMPc no marcado de la muestra y una cantidad fijada de GMPc marcado con 3H, por su unión a un anticuerpo altamente específico para éste nucleótido. La cantidad de GMPc unido al anticuerpo es inversamente proporcional a la cantidad de GMPc presente en la muestra. Los resultados se expresan en picomoles por 100 gramos de peso corporal.
ANÁLISIS ESTADÍSTICO
Todos los resultados se expresan como la media más o menos el error estándar de la media (x ± EEM). La significancia de las diferencias de las medias entre los distintos tratamientos, fueron probadas utilizando el análisis de varianza (ANOVA) de una vía y el rango estadístico de Student-Newman-Keuls. Se consideró como estadísticamente significativos los valores de p menores de 0.05 (p<0.05).
RESULTADOS
En la figura 1 se muestra el volumen urinario expresado en ml/100g de p.c. de rata, de la orina recolectada a la 1, 3 y 6 hr después de la administración intracerebroventricular de solución salina o Ang II, en ratas tratadas o no con Atosiban. La administración central de Ang II redujo el volumen urinario y el pretratamiento con atosiban potenció el efecto antidiurético de la Ang II, de manera significativa (p<0.001). A las tres horas, la angiotensina II per se, no causó antidiuresis, pero si lo hizo en presencia del antagonista del receptor de oxitocina. La administración central de Ang II produjo un aumento significativo de la excreción urinaria de sodio y de potasio a las 1, 3 y 6 horas. El atosiban inhibió completamente el efecto natriurético y kaliurético, en todos los períodos de recolección. La relación de sodio/potasio no sufrió cambios significativos por tratamiento (Vehículo, N=21; Ang II, N=23; Atosiban (AT), N=10; AT+Ang II, N= 10).
Efecto del Atosiban sobre la respuesta urinaria a la administración central de Ang II
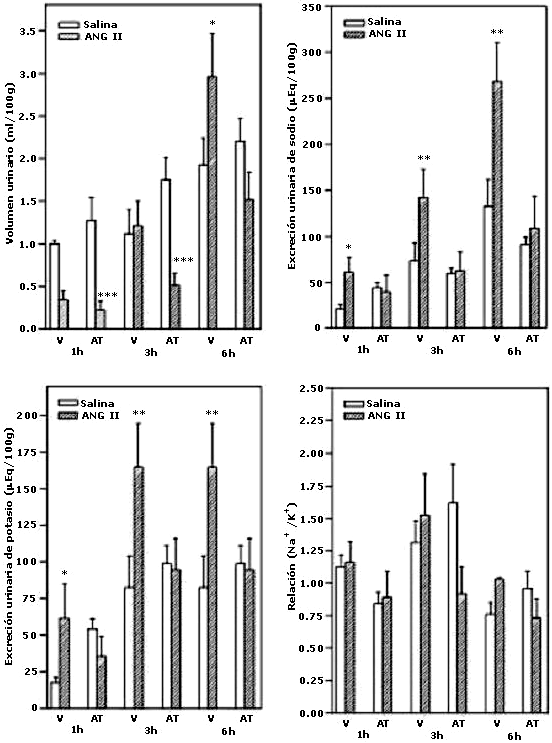
Los resultados se expresan como la medias + EEM de N= 10-21 animales por grupo.
*p<0.05, **p<0.0, ***p<0.001, comparado con su basal.
V: vehículo
AT: Atosiban.
Efecto del bloqueo del receptor de oxitocina sobre la excreción urinaria de GMPc inducida por la administración central de Ang II
En la figura 2 se muestra que la administración ICV de Ang II incrementó significativamente la excreción urinaria de GMPc a las 1, 3 y 6 hr (p<0.05). El tratamiento con el atosiban, inhibió completamente el incremento de la excreción urinaria de GMPc inducido por la administración central de Ang II, sin alterar la excreción basal del mismo.
Efecto del Atosiban sobre la excreción urinaria de GMPc inducida por la administración central de Ang II
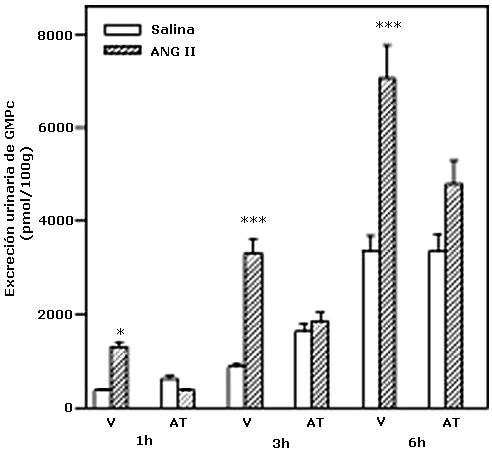
Los resultados se expresan como la medias + EEM de N= 10-21 animales por grupo.
*p<0.05, **p<0.0, ***p<0.001, comparado con su basal.
V: vehículo
AT: Atosiban.
Efecto del bloqueo de la actividad de la sintasa del óxido nítrico (NOS) con L-NAME sobre la antidiuresis, la natriuresis, la kaliuresis y la relación sodio/potasio inducida por la administración central de renina
Como se muestra en la figura 3, la administración ICV de renina (7.14 mGU/5 ml) disminuyó significativamente la diuresis de los animales tratados con respecto a los controles a la 1, 3 y 6 h (p<0.001). Además, la renina incrementó la excreción urinaria de sodio y potasio (p<0.05; p<0.01; p<0.001) a todos los períodos de recolección. Se observó un incremento paralelo en la relación sodio/potasio. El tratamiento con el inhibidor de la sintasa del óxido nítrico, NG nitro-L-arginina metil-éster (L-NAME) (20 mg/kg p.c., i.p.), no modificó significativamente la respuesta renal inducida por la administración ICV de renina en ninguno de los períodos de recolección (Vehículo, N=15; NAME, N=16; NAME+REN, N=18 y REN, N=14).
Efecto del la inhibición de la síntesis de óxido nítrico con L-NAME sobre la respuesta urinaria a la administración central de renina
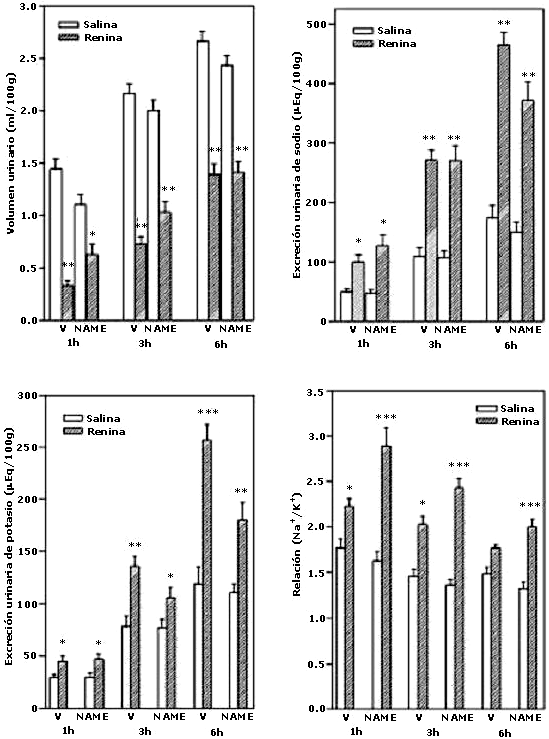
Los resultados se expresan como la medias + EEM de N=14-18 animales por grupo.
*p<0.05, ***p<0.001, comparado con su basal.
Efecto del bloqueo de la actividad de la sintasa del óxido nítrico (SON) con L-NAME sobre la excreción urinaria de GMPc inducida por la administración central de renina
En la figura 4 se muestra que la administración ICV de renina (7.14 mGU/5 ml) incrementó significativamente la excreción urinaria de GMPc (p<0.05) en comparación a los controles a los cuales se les administró solución fisiológica (NaCl 0.9%, 5 ml, ICV). El tratamiento con el inhibidor de la sintasa del óxido nítrico, L-NAME (20 mg/kg p.c., i.p.), no alteró el incremento en la excreción urinaria de GMPc inducido por la administración central de renina en los animales tratados. Además el L-NAME per se, incrementó los niveles urinarios de GMPc inducidas por la administración ICV de renina (p<0.05) (Vehículo, N=15; NAME, N=16; NAME+REN, N=18 y REN, N=14).
Efecto del L-NAME sobre la excreción urinaria de GMPc inducida por la administración central de renina
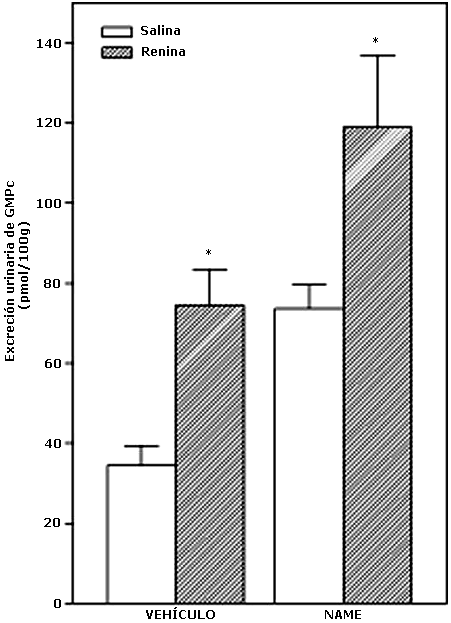
Los resultados se expresan como la medias + EEM de N= 14-18 animales por grupo.
*p<0.05, comparado con su basal.
DISCUSIÓN
El balance hidromineral en el organismo es una función esencial para la vida, por lo que es lógico suponer que converjan múltiples mecanismos que actúan tanto a corto como a mediano plazo, para mantener el fino ajuste de este equilibrio, de forma que el organismo, mediante la activación de mediadores neuronales, neurohumorales, endocrinos y locales, garantiza a todas sus células un medio ambiente adecuado con el único fin de que se mantengan todas las funciones celulares en óptima actividad. Uno de los sistemas neurohumorales que participa en dicha función es el sistema renina angiotensina cerebral, cuyo efector principal es la angiotensina II.
La administración central de Ang II produce natriuresis y la liberación desde la neurohipófisis de dos hormonas, la oxitocina y la vasopresina, ambas con acciones claras sobre la excreción urinaria de agua y sal, lo que plantea que dichas hormonas podrían estar vinculadas con el papel funcional del sistema renina-angiotensina cerebral en el control del balance hidromineral del organismo (Itoh y col., 1988; Wright y Harding, 1997; Unger y col., 1996; Barbella y col., 1993).
La oxitocina es una hormona que participa en el control del balance hidromineral, y su administración a dosis fisiológicas en ratas conscientes produce un incremento significativo de la excreción urinaria de sodio (Verbalis y col., 1991). De igual manera, se ha demostrado que el corazón de la rata es un sitio de almacenaje y liberación de oxitocina, donde también se expresan los receptores de dicha hormona (Jankowski y col., 1998). La acción natriurética de la oxitocina podría estar mediada a través de su acción directa sobre el riñón, o indirecta a través de la estimulación de los receptores de oxitocina cardíacos y la consecuente liberación del PNA a la circulación (Gutkowska y col., 1997).
El PNA es una hormona natriurética almacenada y liberada desde la región auricular del corazón. Numerosos estudios han indicado que el principal mecanismo mediante el cual el PNA induce sus efectos renales implica a un receptor acoplado a la guanilil ciclasa particulada (receptor PNA-A/GC-A) localizado en las células tubulares del riñón y la acumulación intracelular de GMPc (Anand-Srivastava y Trachte, 1993; Wedel y Garbers, 1997). El riñón es una rica fuente de guanilil ciclasa particulada sensible a PNA (Sagnella y col., 1992) y la determinación de los niveles de GMPc urinario se ha utilizado ampliamente como marcador biológico de la actividad renal de este péptido. El incremento de los niveles de GMPc activaría proteínas kinasas dependientes de GMPc (PKG), que producirían el cierre de los canales de sodio, lo que a su vez induciría natriuresis (Tremblay y col., 2002; Misono, 2002). Por lo tanto la excreción urinaria de GMPc, constituye un índice indirecto de la acción renal del PNA. Aun más, se ha demostrado que el ratón transgénico carente de GC-A (ratón GC-A nulo) es incapaz de responder a la infusión de PNA o a la expansión de volumen, estímulos que inducen diuresis y natriuresis en el ratón salvaje (Kishimoto y col., 1996), lo que indica que la vía de señalización que implica a PNA-A/GC-A/GMPc contribuye con el papel del PNA en la regulación hidromineral.
Nuestros resultados apoyan una acción indirecta de la oxitocina en la natriuresis inducida por la Ang II-ICV. En efecto, la demostración de que la administración central de renina, produce un incremento significativo de la concentración plasmática del péptido natriurético auricular, la cual alcanza su valor pico a los dos minutos y este incremento se asocia con un aumento del GMPc urinario (Zavala y col., 2004), junto con los hallazgos presentes en los que se muestra que la natriuresis y el incremento en la excreción urinaria de GMPc inducidos por la AngII-ICV, es inhibida completamente con el pretratamiento con atosiban, un antagonista selectivo del receptor de la oxitocina, apoyan esta posibilidad. Así, la oxitocina, una vez liberada a la circulación por la Ang II cerebral, actuaría sobre sus receptores cardíacos e induciría la liberación del PNA desde el corazón (Antunes-Rodrígues y col., 1996; Jankoswski y col., 1998).
Existen además, otros mediadores que son capaces de generar aumento en los niveles de este segundo mensajero en varios sistemas biológicos. El óxido nítrico (ON), el cual es un importante mediador de numerosas funciones fisiológicas en diferentes órganos y tipos celulares, a través de su unión a su receptor guanilil cilasa soluble (GC-S), desencadena la producción de GMPc en estos tejidos (Gross y Wolin, 1995). El riñon también contiene guanilil cilasa soluble (GC-S) y se ha determinado que esta se expresa en el glomérulo, en el túbulo proximal y en los túbulos colectores de la corteza renal (Theilig y col., 2001).
El ON juega un papel fisiológico importante en el riñón, en especial, en la preservación del flujo sanguíneo renal durante los estados donde se produce vasoconstricción periférica como ocurre en situaciones donde hay exceso de ANG II o en casos de deshidratación (Braam, 1999). El ON es capaz de afectar tanto las células endoteliales como las del aparato yuxtaglomerular a fin de preservar el flujo sanguíneo regional y reducir la reabsorción de sodio y agua en el túbulo contorneado proximal (Nakamura y col., 1993).
Con el fin de establecer si la estimulación de la GC soluble contribuye al incremento del contenido urinario de GMPc inducido por la administración central de Ang II o de renina, se evaluó el efecto de un inhibidor de la sintasa del ON, mediante el uso de un análogo de la L-arginina, el L-NAME. Nuestros resultados demuestran que el pretratamiento con L-NAME no afecta de forma significativa el incremento en los niveles urinarios de GMPc estimulado por la administración central de renina. Más aún, el tratamiento con L-NAME no bloqueó la respuesta natriurética a la administración central de renina, lo que ratifica que el efecto natriurético y el incremento de la producción de GMPc es independiente de la vía de la guanilil ciclasa soluble y de la producción de ON, y está mediado por la estimulación de la liberación del PNA inducida por Ang II o renina. Por tanto, nuestros resultados orientan la posibilidad que la estimulación del SRA cerebral desencadena una vía de liberación hormonal y de señalización celular que implica al OX/PNA/GC-A/GMPc en la producción de la natriuresis.
Este planteamiento está apoyado aun más en los hallazgos de Soares y col., (1999), quienes encontraron que el bloqueo específico de la óxido nítrico sintasa en los riñones inhibe por completo la natriuresis producida por la administración intravenosa de la oxitocina, pero no así la inducida por el PNA. Esto parece indicar que existen, al menos, dos vías para modular la excreción renal de sodio desde el sistema nervioso central. En el primer caso, la oxitocina liberada desde la neurohipófisis estimularía la liberación de PNA desde el corazón (Antunes-Rodrigues y col., 1996) e iniciaría la cascada de la guanilil ciclasa particulada a nivel renal. En el segundo caso, acciones directas de la oxitocina sobre el riñón, activarían la enzima óxido nítrico sintasa para producir ON, que actuaría a nivel renal sobre la guanilil ciclasa soluble para producir GMPc. Nuestros resultados en los que se observa que el bloqueo de la SON, el L-NAME, no afecta la excreción urinaria de sodio y GMPc inducidos por renina, demuestran que la natriuresis inducida por el SRA cerebral es independiente de la producción renal de óxido nítrico e indican que la acción de la oxitocina como intermediaria del sistema SRA se efectuaría a través de la liberación del PNA desde el corazón.
Lo anterior, nos permite aseverar que en la compleja red de los mecanismos que regulan la homeostasis de los fluidos y electrolitos corporales, el SNC juega un papel preponderante, y la capacidad de este órgano para producir una respuesta compensadora de la natriuresis implica que el cerebro se comunica con el riñón a través de la guanilil ciclasa A.
En conclusión, el presente estudio permite sugerir que la estimulación del SRA cerebral a través de la acción de los péptidos efectores de este sistema, la ANG II o la renina, estimula la liberación de oxitocina, la cual al interactuar con sus receptores cardíacos induce la secreción del PNA a la circulación. Este péptido, al interactuar de forma selectiva con su receptor PNA-A/GC-A a nivel renal, produce un aumento de los niveles urinarios de GMPc que en última instancia modula proteínas dependientes de este segundo mensajero que actuando a nivel de la arteriola aferente y eferente aumenta la presión hidrostática del glomérulo y la fracción de filtración de sodio,para finalmente inducir natriuresis (McCann, 2003)
AGRADECIMIENTOS
Este trabajo esta subvencionado por el Proyecto IIF-2005 del Instituto de Investigaciones Farmacéuticas de la Universidad Central de Venezuela.
REFERENCIAS BIBLIOGRÁFICAS
1. Antunes-Rodrigues J, Favaretto AL, Ballejo G, Gutkowska J y McCann SM.: ANP as a neuroendocrine modulator of body fluid homeostasis. Rev Bras Biol. 1996; 56:221-31. [ Links ]
2. Anand-Srivastava M y Trachte G: Atrial natriuretic factor receptors and signal transduction mechanisms. Pharmacol Rev. 1993; 45(4): 455-497. [ Links ]
3. Balment RJ, Brimble MJ, Musabayane CT y Forsling ML: Natriuretic response of the rat to plasma concentration of arginine-vasopressin whiting the physiological range. J Physiol. 1984; 352: 517-526. [ Links ]
4. Barbella Y, Cierco M e Israel A: Effect of losartan a non peptide angiotensin II receptor antagonist on drinking behavior and renal actions of centrally administered renin. P.S.E.B.M. 1993; 202: 401-406. [ Links ]
5. Braam B. Renal endothelial and macula densa NOS: integrated response to changes in extracellular fluid volume. Am J Physiol. 1999; 276: R1551-61. [ Links ]
6. Dietz JR y Nazian SJ. Studies on the role of the pituitary in the control of atrial natriuretic factor secretion and sodium excretion. Proc Soc Exp Biol Med. 1990; 194: 232-239. [ Links ]
7. Gimpl G y Faheronholz F: The oxytocin receptor system: Structure, function and regulation. Physiol Rev 2001; 8(2): 629-683. [ Links ]
8. Gross SS y Wolin MS: Nitric oxide: pathophysiological mechanisms. Annu Rev Physiol. 1995; 57: 737-69. [ Links ]
9. Gutkowska J, Jankowski M, Mukaddam-Daher S, McCann SM, Chantal L, Zingg HH y McCann SM: Oxytocin release atrial natriuretic peptide by combining with oxytocin receptors in the heart. Proc Natl Acad Sci. USA, 1997; 94: 11704-11709. [ Links ]
10. Gutkowska J, Jankowski M, Mukaddam-Daher S y McCann SM: Oxytocin is a cardiovascular hormone. Brazilian J of Medical and Biological Research 2000; 33: 625-633. [ Links ]
11. Haanwinckel M, Elias LK, Favaretto A LV, Gutkowska J y McCann SM, Antunes-Rodrigues J: Oxytocin mediates atrial natriuretic peptide release and natriuresis after volume expansion in the rat. Proc Natl Acad Sci. USA, 1995; 92: 7902-7906. [ Links ]
12. Itoh H, Nakao K, Yamada T, Morji N, Shiono S, Sugawara A, Saito Y, Mukoyama M, Arai H y Imura H: Central interaction of brain atrial natriuretic polypeptide (ANP) system and the brain renin-angiotensin system in ANP secretion from the heart: evidence for possible brain-heart axis. Can J Physiol Pharmacol. 1988; 66 : 255-261. [ Links ]
13. Jankowski M, Haljar F, Al Kawas S, Mukaddam-Daher S, Hoffman G, McCann S y Gutkowska J: Rat heart: A site of oxytocin production and action. Proc Natl Acad Sci. USA, 1998; 95: 14558-14563. [ Links ]
14. Kishimoto I, Dubois S y Garbers D: The heart communicates with the kidney exclusively through the guanylyl cyclase-A receptor: acute handling of sodium and water in response to volume expansion. Proc Natl Acad Sci 1996; 93: 6215-6219. [ Links ]
15. McCann SM, Gutkowska J y Antunes-Rodrigues J: Neuroendocrine control of body fluid homeostasis. Brazilian J. of Medical and Biological Research 2003; 36: 165-181. [ Links ]
16. Misono K: Natriuretic peptide receptor: structure and signalling. Mol Cell Biochem 2002; 230: 49-60. [ Links ]
17. Nakamura T, Alberola AM y Granger JP. Role of renal interstitial pressure as a mediator of sodium retention during systemic blockade of nitric oxide. Hypertension 1993; 21: 956-60. [ Links ]
18. Sagnella G, Singer D, Markandu N, Buckley M y McGregor G: Is atrial natriuretic peptide guanosine 3-5- cyclic monophosphate coupling a determinant of urinary sodium excretion in essential hypertension? J Hypertens 1992; 10: 349-354. [ Links ]
19. Severs WB, Summy-Long J, Taylor J y Connor J: A central effect of angiotensin: release of pituitary pressor material. J Pharmacol Exp Ther 1970; 74: 27-34. [ Links ]
20. Soares TJ, Coimbra TM, Martins AR, Pereira AGF, Carnio EC, Branco LGS, Alburquerque-Araujo WIC, Nucci G, Gutkowska J y McCann SM, Antunes-Rodrigues J: Atrial natriuretic peptide and oxytocin induce natriuresis by release of GMPc. Proc Natl Acad Sci. USA, 1999; 96: 278-283. [ Links ]
21. Theiling F, Bostanjoglo M, Pavenstadt H, Grupp C, Holland G, Slosarek I, Gressner AM, Russwurm M, Koesling D y Bachmann S: Cellular distribution and function of soluble guanylyl cyclase in rat kidney and liver. J Am Soc Nephrol 2001; 12: 2209-2220. [ Links ]
22. Tremblay J, Desjardins R, Hum D, Gutkowska J y Hamet P: Biochemistry and physiology of the natriuretic peptide receptor guanylyl cyclases. Mol Cell Biochem 2002; 230: 31-47. [ Links ]
23. Unger T, Chung O, Csikos T, Culman J, Gallinat S, Gohlke P, Hôle S, Meffert S, Stoll M, Stroth U y Zhu YZ: Angiotensin receptors. J Hypertens 1996; 14 (Suppl.5): S95-S103. [ Links ]
24. Verbalis JG, Mangione MP y Stricker M: Oxytocin produces natriuresis in rats at physiological plasma concentration. Endocrinology 1991; 128: 1317-1322. [ Links ]
25. Wedel B y Garbers D: New insights on the functions of the guanylyl cyclase receptor. FEBS Lett. 1997; 410: 29-33. [ Links ]
26. Wright JW y Harding JW: Brain angiotensin receptor subtypes in the control of physiological and behavioral responses. Neurosci Behav Rev 1997; 18(1): 21-53. [ Links ]
27. Zavala L, Barbella Y e Israel A: Neurohumoral mechanism in the natriuretic action of intracerebroventricular administration of renin. J. Renin-Angiotensin-Aldosterone System. 2004; 5: 39-44. [ Links ]
28. Zini S, Fournie-Zaluski MC, Chauvel E, Roques B, Corvol P y LLorens-Cortes C: Identification of metabolic pathways of brain angiotensin II and III using specific aminopeptidase inhibitors: Predominant role of angiotensin III in the control of vasopressin release. Proc Natl Acad Sci. USA, 1996; 232: 11968-11973. [ Links ]













