Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT v.25 n.2 Caracas dic. 2006
Señalización de la Adrenomedulina en la eminencia media de la rata
#
Mathison Yaira e *Israel Anita*Laboratorio de Neuropéptidos de la Facultad de Farmacia y #Cátedra de Farmacología de la Escuela de Medicina J.M. Vargas, Universidad Central de Venezuela, Caracas, Venezuela. FAX: (582) 605.2707. E-mail: astern88@hotmail.com
*Dirigir la correspondencia a: Apartado Postal 50176, Sabana Grande 1050A, Caracas Venezuela.
Resumen
La adrenomedulina (AM) es un péptido de 52 aminoácidos, ampliamente distribuido en el SNC, que ejerce diferentes acciones farmacológicas a través de la estimulación de tres subtipos de receptores, el AM1, el AM2 y el tipo 1 del receptor relacionado con el gen de la calcitonina (CGRP1). La presencia de la AM y de vasopresina en las neuronas de los núcleos supraópticos y paraventriculares hipotalámicos, que se proyectan a la eminencia media, en conjunción con la presencia y co-localización de la actividad de la sintasa de óxido nítrico (SON) y fibras inmunorreactivas para GMPc en esta estructura sugiere la participación de la vía de señalización NO/cGMP en las acciones de la AM en el SNC. Por ello, investigamos la presencia de la actividad NOS y la consecuente estimulación de la producción de GMPc inducida por la AM en la EM, así como el subtipo de receptor involucrado. Nuestros resultados demuestran que en la EM de la rata, la AM estimula en forma dependiente de la dosis, la producción de GMPc y la actividad SON. Aun más, la estimulación de la producción de GMPc inducida por la AM, fue bloqueada por el L-NAME, un inhibidor de la SON. Estos efectos de la AM son mediados por el receptor AM1, ya que el antagonista selectivo, el AM22-52, inhibe la activación de la SON y la producción de GMPc inducida por la AM, mientras que el antagonista selectivo del receptor de CGRP1, el CGRP8-37, fue inefectivo. Nuestros hallazgos demuestran la presencia de receptores específicos y funcionales para la AM1 en la EM de la rata, los cuales están acoplados a la vía de señalización NO/GMPc. Esto apoya el concepto que la AM podría jugar un papel regulador en la función neuroendocrina y reproductiva.
Palabras clave: adrenomedulina, óxido nítrico, eminencia media.
Summary
Adrenomedullin (AM) is a 52 amino acid peptide widely distributed in the central nervous system which exerts several pharmacological actions through its interaction with three receptor subtypes, AM1, AM2 and the type 1 receptor of the calcitonin gene related peptide (CGRP1). The co-localization of AM and vasopressin in hypothalamic paraventricular and supraoptic nucleai, which Project to the median eminence, together with the presence of nitric oxide synthase activity and IR-cGMP neurons, suggest a role for NO/GMPc signaling in the AM actions in the CNS. Thus, we studied the effect of AM on receptor-mediated NO/cGMP signaling in rat median eminence (ME), a hypothalamic structure known to contain a rich plexus of nitric oxide synthase (NOS)-containing neurons and fibers. AM significantly increased cGMP formation NOS activity. Preincubation of AN-ME fragment with L-arginine analog, N-nitro-L-arginine (L-NAME) inhibited AM-stimulated cGMP formation. The addition of the selective AM receptor antagonist, AM(22-52), blocked AM-induced increase in NOS activity and cGMP generation, while CGRP(8-37), a selective CGRP1 receptor antagonist, was ineffective. Our results demonstrate that in median eminence fragments, adrenomedullin stimulate NO/cGMP signaling pathway through the interaction with the AM1 receptor, supporting the concept that adrenomedullin may represent an important regulator of reproductive and neuroendocrine and reproductive function.
Key words: adrenomedulin, nitric oxide, median eminence
Recibido: 01/10/2006 Aceptado: 15/11/2006
Introducción
La adrenomedulina (AM) es un péptido de 52 aminoácidos en el humano y 50 aminoácidos en la rata, el cual ejerce potentes acciones vasodilatadoras e hipotensoras cuando se administra sistémicamente. Además de sus efectos periféricos, ciertas acciones de la AM están mediadas centralmente. La AM se encuentra distribuida ampliamente en todo el sistema nervioso central (SNC), encontrando las concentraciones más elevadas del péptido en la glándula pituitaria, tálamo, hipotálamo, tallo cerebral y otras regiones (Hwang and Tang, 1999; Satoh y col., 1996; Ueta y col., 1995).
El gen de la AM se expresa y se transcribe en el cerebro (Hwang y Tang, 1999, Kitamura y col., 1993), y muestra una amplia distribución que coincide con la localización de la AM en el SNC de la rata (Serrano y col., 2000). El ARNm de la preproAM se encuentra ampliamente distribuido, con los niveles más elevados en centros autonómicos que incluyen el núcleo paraventricular (NPV), el núcleo supraóptico (NSO), el locus coeruleus, el tallo ventrolateral del bulbo raquídeo y la columna intermediolateral de la médula espinal (Shan y Krukoff, 2001). Así mismo, el ARNm de la AM es altamente expresado en la pituitaria, el hipotálamo, la eminencia media y es detectable en la corteza cerebral, el cerebelo, el tallo cerebral y el hipocampo (Hwang y Tang, 1999).
Se ha demostrado la presencia de AM-IR en diferentes áreas del hipotálamo de la rata, incluyendo el NSO y NPV. Se ha sugerido que los axones de las neuronas inmunoreactivas a la AM en el hipotálamo pueden terminar en la pituitaria posterior, vía el tracto hipotálamo-neurohipofisis y en la eminencia media (Ueta y col., 1999). Aun más, se ha demostrado la coexistencia de la AM con la oxitocina y la vasopresina en las mismas neuronas del hipotálamo, indicando la posibilidad de una acción central importante de este péptido en la regulación neuroendocrina (Ueta y col., 1995).
La AM también es producida en regiones extrahipotalámicas, ya que se ha observado la presencia de ARNm de AM en cada región del cerebro humano examinada (corteza frontal, corteza temporal, corteza occipital, protuberancia, tálamo, hipotálamo, cerebelo) y en la pituitaria anterior. Los hallazgos son compatibles con los reportes anteriores de AM-IR en el cerebro humano y soporta la idea que la AM actúa como un neurotransmisor, un neuromodulador o una neurohormona en el cerebro (Takahashi y col., 1994).
Los receptores específicos de la AM (AM-R), los cuales difieren del CGRP1, se encuentran en varios tejidos de la rata incluyendo el cerebro y la médula espinal (Nuki y col., 1993), y en el cerebro humano (corteza cerebral, cerebelo, tálamo, hipotálamo, pedúnculos cerebrales y bulbo raquídeo) (Sone y col., 1997). Sin embargo, a diferencia de la médula espinal, en el SNC los sitios AM-R son más escasos que los del CGRP, los cuales se encuentran de manera más abundante y extensa en el cerebro (Wimalawansay col., 1996). Se sabe que la AM muestra homología en su estructura química con el péptido relacionado con el gen de la calcitonina (CGRP) (Kitamura y col., 1993). Sin embargo ha sido complicado definir los sitios de unión de la AM, y numerosos estudios han sugerido que sus acciones pueden estar mediadas a través del receptor CGRP1. En efecto, el antagonista del receptor CGRP1, el CGRP8,37 bloquea el incremento del AMPc inducido por la AM en células de músculo liso vascular (Samson y col., 1995). Aun mas, un gran número de sitios de unión del CGRP se encuentran presentes en el cerebro (Oliver y col., 1998) y algunas acciones centrales de la AM sobre la presión arterial (Takahashi y col., 1994) y la ingesta de alimento (Taylor y col., 1996) son abolidas por un antagonista del CGRP1, CGRP8,37, sugiriendo que estos efectos de la AM están mediados por el receptor CGRP1. Contrariamente, se han descrito sitios de unión específicos para la AM que difieren de los del CGRP en el cerebro humano30; y se ha demostrado que el efecto vasopresor de la AM administrada centralmente no es abolido por el antagonista del receptor tipo 1 del CGRP (Samson y col., 1998).
Mediante técnicas autoradiográficas se encontró una distribución muy discreta de los receptores de la AM en el cerebro de la rata, con la región más rica en el plexo coroideo, en la superficie del tercer, cuarto ventrículo y en los ventrículos laterales, el núcleo amigdaloide basolateral, lóbulo neural de la glándula pituitaria, el nervio trigémino y la capa de células granulares del cerebelo (Juaneda y col., 2001). De igual forma, se han reportado sitios de unión específicos para la AM en varias regiones del cerebro humano (corteza, cerebelo, tálamo, hipotálamo, puente y bulbo raquídeo) (Sone y col., 1997).
Se ha estudiado la modulación de la expresión del gen de la AM en respuesta a estresores fisiológicos en regiones del cerebro de la rata. Así, la administración intravenosa de lipopolisacáridos (LPS) inhibe la expresión del gen de la AM en el núcleo paraventricular (región parvo y magnocelular), NSO, núcleo dorsal motor del vago y área postrema. De igual forma, el estrés por restricción y la privación de agua por 24 horas (deshidratación) reduce los niveles del ARNm de la AM en el NPV (ambas regiones), núcleo supraóptico, núcleo del tracto solitario (NTS), núcleo dorsal motor del vago, área postrema y órgano subfornical. Estos resultados sugieren un papel de la AM en la regulación del sistema hipotálamo-neurohipófisis, eje hipotálamo-hipófisis-suprarrenal y en funciones autonómicas centrales (Shan y Krukoff, 2001).
En relación al efecto de la AM sobre la pituitaria anterior, se ha demostrado que la AM inhibe la secreción basal de ACTH, así como la estimulada por la hormona liberadora de corticotropina (CRH) en las células de la pituitaria anterior, sugiriendo un papel fisiológico del péptido en el control cardiovascular y en la homeostasis renal (Samson y col., 1995). Adicionalmente, la administración intracerebroventricular (ICV) de AM en ratas, causa un incremento significativo de los niveles plasmáticos de oxitocina (OX) y una marcada inducción de la inmunoreactividad a c-fos en el NPV y NSO. Esta inducción fue reducida por el pretratamiento con un antagonista de los receptores específicos de AM (AM22-52. Lo que sugieren que la AM es responsable de la activación de neuronas secretorias en el NPV y NSO vía receptores específicos de AM y que la AM estimula la secreción de OX por activación de las células hipotalámicas productoras de OX (Serino y col., 1999).
Es conocido que el cerebro puede dirigir la actividad de la hipófisis. Así, las señales externas pueden ser percibidas por el sistema nervioso central, converger en el hipotálamo, donde son procesadas, amplificadas y transducidas a señales humorales (Karsch, 1984). Debido a su arreglo anatómico y a su proximidad con la hipófisis, el hipotálamo asume una importancia especial como interfase entre el SNC y el sistema endocrino (Karsch, 1984). La EM es una región que merece una mención especial, porque es el área de confluencia de mensajeros neuronales y hormonas circulantes que regulan la función del lóbulo anterior de la hipófisis (Karsch 1984; Seybold y Wicox, 1987). La EM abarca la base del hipotálamo y se continúa con el tallo de la pituitaria. Contiene pocos cuerpos celulares, pero posee abundantes axones y terminales de neuronas hipotalámicas y extrahipotalámicas, células gliales y células ependimales especializadas llamadas tanacitos (Karsch, 1984). La EM constituye la vía final común de las señales que van desde el cerebro hasta la hipófisis (Palkovits y col., 1986). Tiene importancia fisiológica ya que es el sitio donde se liberan los factores hipofisiotrópicos dentro del sistema capilar portal, que lleva estos factores a su sitio de acción en el lóbulo anterior de la hipófisis (Seybold y Wilcox, 1987). Además de las hormonas liberadoras (GnRH, CRH, TRH) e inhibidoras (dopamina y somatostatina), la capa externa de la EM contiene fibras nerviosas y terminales para mas de 30 neuropéptidos (Palkovits, 1986). La AM es uno de los neuropéptidos que se encuentra en relativamente en altas concentraciones en la EM (Samson, 1999); su presencia en esta estructura, así como la presencia de receptores específicos, sostiene la hipótesis de que la AM pueden modular la regulación hipotalámica sobre la hipófisis a nivel de la EM.
El óxido nítrico (ON) es un importante neurotrasmisor y mediador biológico de las respuestas del eje neuroendocrino (Nelson y col., 1997). Recientemente se ha demostrado que esta molécula participa en la regulación de la liberación de hormonas hacia el sistema portal hipofisiario, actuando directamente sobre los terminales neuroendocrinos localizados en la eminencia media (Prevot y col., 2000). El ON es sintetizado endógenamente mediante la acción de una familia de enzimas, las sintasas del ON (SON). La activación de la SON es un proceso dependiente de calcio intracelular que cataliza la conversión de la L-arginina a L-citrulina, liberando cantidades equimolares de ON (Förstermann y Kleiner, 1995; Moncada y col., 1997). Recientemente han sido clonadas tres isoenzimas diferentes: la enzima soluble del cerebro (tipo I = SONb = SONn) (Bredt y col. 1991), la enzima particulada de las células endoteliales (tipo III = SONe), la cual presenta un 60% de homología con la nNOS, conservando los sitios de unión para los cofactores incluyendo calmodulina y presenta un sitio de miristoilación, que permitiría su unión al miristato y su anclaje a la membrana (Lamas y col., 1992) y la enzima soluble inducible de macrófagos (tipo II = SONi) que presenta un 50% de homología con la nNOS (Lowestein y col., 1992). Dos de las isoformas son constitutivas, la SONn que se encuentra localizada en las células del tejido nervioso, tanto centrales como periféricos, y la SONe o SON III está localizada preferencialmente en la célula endotelial vascular, ambas al ser activadas producen cantidades de ON en el rango pmolar y están implicadas en la señalización celular. La sintasa del óxido nítrico inducible (SON I o SON II), es independiente de calcio y se expresa en los macrófagos y otras células en respuesta a la inducción por mediadores de la inflamación o productos bacterianos; su activación produce grandes cantidades de ON (Bredt y Snyder, 1994; Moncada y col., 1997; Förstermann y col., 1994).
Estudios inmunohistoquímicos han revelado la presencia de SONn en áreas localizadas del cerebro y en estructuras nerviosas periféricas. Específicamente se ha detectado la presencia de cuerpos neuronales con inmunorreactividad para la SON (irSON) en las capas molecular y granulosa del cerebelo, y en la capa granulosa del bulbo olfatorio. Se ha descrito la presencia de una alta concentración de SONn en el núcleo pedúnculo-pontino tegmental, en el colículo superior e inferior, el caudado-putamen, el giro dentado del hipocampo y el núcleo de la estría terminal. En menor proporción se observa marcaje en las capas superficiales de la corteza cerebral (Bredt y col., 1990). Adicionalmente, se ha reportado la presencia de ARNm para la SONn en el cerebelo, el bulbo olfatorio, el colículo, el hipocampo y en la corteza cerebral, localizado en neuronas que presentan actividad de NADPH diaforasa (Bredt y col., 1991).
En el eje hipotálamo-hipofisiario de la rata, se ha detectado neuronas con inmunorreactividad para la SON en cuerpos celulares en los núcleos supraóptico y paraventricular cuyas fibras inmunorreactivas se proyectan hacia la eminencia media y la neurohipófisis (Bredt y col., 1990). En la neurohipófisis la irSON está localizada en gránulos de diversos tamaños y también se han descrito células inmunopositivas en los lóbulos anterior y medios de la hipófisis. Adicionalmente, Kawakami y col. (1998), mediante microscopia electrónica han descrito la localización ultraestructural de la irSON en la EM, demostrando la presencia de irSON tanto en glías como en neuronas.
Existe evidencia que indica que el ON juega un papel importante en la regulación de la función neuroendocrina (Nelson y col., 1997). Así, se ha reportado que el ON modula la liberación de oxitocina, incrementa la liberación de somatostatina inducida el factor liberador de la hormona del crecimiento (Aguilla, 1994), modula la liberación de la hormona liberadora de corticotropina (CRH) desde el hipotálamo de la rata in vitro (Costa y col., 1993), y parece ser el mediador de diversas hormonas liberadoras que modulan la liberación de CRH y ACTH (Nelson y col., 1997).
Así, el pretratamiento con L-NAME, un inhibidor de la SON, inhibe el incremento en la liberación de CRH inducido por la administración iv de IL-1B, oxictocina o vasopresina (Rivier y Shen, 1993). Adicionalmente, se ha reportado que la inhibición central de la SON incrementa la liberación de oxitocina durante la deshidratación (Summy-Long y col., 1993). Por otra parte, la liberación hipotalámica de GnRH in vitro, es estimulada por el nitroprusiato de sodio, un donador de ON, mientras que la administración intracerebroventricular (ICV) de un inhibidor de la SON reduce la liberación de la hormona luteinizante (Rettori y col., 1993; 1994; Moretto y col., 1993).
Los datos disponibles apuntan hacia una posible interrelación entre la AM y el sistema ON/GMPc en la eminencia media. La presencia de inmunorreactividad para las AM en las neuronas magnocelulares del hipotálamo que proyectan hacia la EM y la neurohipófisis, y específicamente la presencia de sitios de unión para AM asociada a una fuerte irSON en las fibras nerviosas que se extienden a los largo de la zona interna de la EM hasta el núcleo arcuato (Serrano y col., 2000), colocalizada con fibras y cuerpos celulares que presentan inmunorreactividad para el GMPc (De Vente y col., 1998), sugiere que el ON/GMPc podría mediar los efectos de la AM en esta estructura hipotalámica.
En el presente trabajo nos proponemos evaluar si la AM es capaz de activar una vía de señalización que involucre el ON/GMPc en la EM, y caracterizar el subtipo de receptor involucrado.
Materiales y métodos
Animales
Como animales de experimentación se utilizaron ratas albinas, machos, de la cepa Sprague-Dawley, de 200-250 g de peso, provenientes del Bioterio del Instituto Nacional de Higiene, Caracas; las cuales son mantenidas en condiciones adecuadas, permitiéndoles libre acceso al agua y a la comida. Los animales fueron sacrificados mediante decapitación, entre las 9:00 y las 11:00 horas. Los cerebros fueron inmediatamente removidos y se procedió a la microdisección del tejido fresco en un tiempo no superior a los tres minutos.
Determinacion de la actividad guanilil cilasa
La eminencia media (EM) fue extraída mediante microdisección bajo control estereomicroscópico y mantenida en buffer Krebs-Ringer (KBR; conteniendo en mM: NaCl 125; KCl 3,5; KH2PO4 1,25; MgSO4 1,20; CaCl2 0,75; NaHCO3 25; glucosa 10 y teofilina 1,6) gaseado con 95% O2 : 5% CO2.
Para el ensayo de la activación de la guanilil ciclasa cada EM fue transferida individualmente a tubos Eppendorf de 1,5 ml conteniendo 180 µl de buffer KBR, sometiéndose a preincubación durante 10 minutos a 37ºC, en presencia o ausencia de los correspondientes antagonistas. La reacción se inició con el agregado de los agonistas (20 µl), o buffer para los controles, al medio de incubación seguidos de 10 minutos adicionales de incubación. La reacción fue detenida agregando 20 µl EDTA (166 mM, pH 7,5) y calentando a 90 ºC durante 3 min. Las muestras fueron mantenidas en hielo y posteriormente homogeneizadas mediante sonicación. Las muestras fueron congeladas a –20ºC para la posterior determinación del GMPc.
Determinacion del GMPc mediante radioinmunoensayo
Se tomó una alícuota de 100 µl para la determinación del GMPc. El contenido de GMPc se cuantificó por radioinmunoensayo (RIA) por el método descrito por Steiner y col., 1972, utilizando un kit comercial (Amersham® International plc, UK). El ensayo se basa en la competencia entre el GMPc no radioactivo (muestra) y una cantidad fija del compuesto marcado, por la unión a un anticuerpo que posee alta especificidad y afinidad por el GMPc. La cantidad de GMPc radioactivo unido al anticuerpo está relacionada inversamente con la concentración de GMPc presente en la muestra.
Brevemente, las muestras a una dilución 1 :25 en solución buffer Tris/EDTA (50 mM Tris/HCl, 4 mM EDTA, pH 7.5), se incuban en hielo con 50 µl de 3H-GMPc y 50 µl de anticuerpo específico para GMPc por 90 minutos (volumen final: 200 µl). Se separa el GMPc unido al anticuerpo por precipitación con (NH4)2SO4 y posterior centrifugación (12000 r.p.m/5 min a 4°C). Se descarta el sobrenadante y los precipitados son reconstituidos con agua destilada. La radioactiviad se cuantifica mediante espectrometría de centelleo líquido (Packard® Tricarb 2700TR).
La cantidad de GMPc se calcula utilizando una curva estándar (rango de 0 a 4 pmol/tubo). La actividad guanilil ciclasa se reporta como pmoles de GMPc formados/10 min/mg de proteínas.
Ensayo de la actividad de la sintasa del oxido nitrico
Inmediatamente después de la extracción, el cerebro fue colocado sobre hielo y la eminencia media extraída mediante control estereomicroscópico. Una vez obtenida la estructura se mantiene en frío, en Buffer Hepes 50 mM, pH 7,1 y EDTA 1mM hasta el momento del ensayo.
La actividad de la SON se determinó mediante la cuantificación de la conversión de arginina radiomarcada a citrulina, utilizando una modificación del método descrito por Bredt y Snyder (1990).
Los tejidos fueron mantenidos en buffer Hepes 50 mM, pH 7,1 + EDTA 1mM. Posteriormente cada muestra es preincubada por 30 minutos a 37ºC en buffer Hepes 50mM, pH 7,1 conteniendo ditiotreitol 1mM, ß-NADPH 0,5 mM; CaCl2 1,25 mM y 10 µg/ml de calmodulina, [3H]-arginina 0,12µM y arginina 0,3 µM, seguido de un período de incubación de 10 minutos. Para determinar la estimulación de la actividad de la SON los agonistas fueron agregados al iniciar los 10 minutos de incubación, y los antagonistas cuando fuera el caso en el período de preincubación. La reacción fue detenida agregando buffer Hepes 20 mM, pH 5,5; EDTA 4mM, frío y calentando durante 5 min a 90ºC. Los tejidos fueron sonicados, centrifugados a 12.000 rpm durante cuatro minutos y el sobrenadante pasado a través de una columna de Dowex 50, forma Na+ (RBI), desde donde fue eluído con 2 ml de agua. La [3H]-citrulina formada es cuantificada mediante espectroscopia de centelleo líquido.
La identificación de la [3H]-citrulina se confirmó mediante cromatografía en papel. El porcentaje de recuperación es determinado utilizando [3H]-citrulina. La actividad de la sintasa del óxido nítrico se expresó como pmol de citrulina formada/hora/mg de proteínas.
Ensayo de la actividad de la sintasa del oxido nitrico
Inmediatamente después de la extracción, el cerebro fue colocado sobre hielo y la eminencia media extraída mediante control estereomicroscópico. Una vez obtenida la estructura se mantiene en frío, en Buffer Hepes 50 mM, pH 7,1 y EDTA 1mM hasta el momento del ensayo.
La actividad de la SON se determinó mediante la cuantificación de la conversión de arginina radiomarcada a citrulina, utilizando una modificación del método descrito por Bredt y Snyder (1990).
Los tejidos fueron mantenidos en buffer Hepes 50 mM, pH 7,1 + EDTA 1mM. Posteriormente cada muestra es preincubada por 30 minutos a 37ºC en buffer Hepes 50mM, pH 7,1 conteniendo ditiotreitol 1mM, ß-NADPH 0,5 mM; CaCl2 1,25 mM y 10 µg/ml de calmodulina, [3H]-arginina 0,12 µM y arginina 0,3 µM, seguido de un período de incubación de 10 minutos. Para determinar la estimulación de la actividad de la SON los agonistas fueron agregados al iniciar los 10 minutos de incubación, y los antagonistas cuando fuera el caso en el período de preincubación. La reacción fue detenida agregando buffer Hepes 20 mM, pH 5,5; EDTA 4mM, frío y calentando durante 5 min a 90ºC. Los tejidos fueron sonicados, centrifugados a 12.000 rpm durante cuatro minutos y el sobrenadante pasado a través de una columna de Dowex 50, forma Na+ (RBI), desde donde fue eluído con 2 ml de agua. La [3H]-citrulina formada es cuantificada mediante espectroscopia de centelleo líquido.
La identificación de la [3H]-citrulina se confirmó mediante cromatografía en papel. El porcentaje de recuperación es determinado utilizando [3H]-citrulina. La actividad de la sintasa del óxido nítrico se expresó como pmol de citrulina formada/hora/mg de proteínas.
Determinacion de proteinas
Las proteínas tisulares se determinaron por el método de Lowry y col. (1951), utilizando albúmina sérica de bovino como patrón.
Expresion de los resultados y analisis estadistico
Los resultados se expresan como la media ± E.S.M., y fueron analizados mediante la prueba de t-Student y el análisis de varianza de una vía (ANOVA). Se consideró como significativo un valor de p<0.05.
Resultados
Efecto de la adrenomedulina sobre la producción de GMPc y la actividad de la sintasa de oxido nítrico (SON) en la EM de la rata
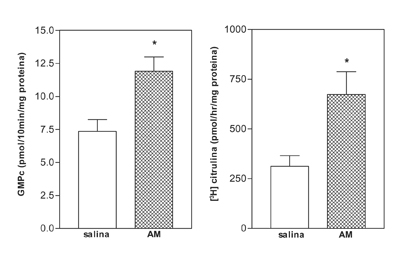
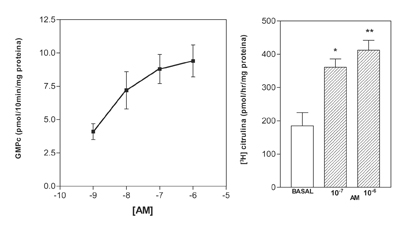
Como se muestra en las figuras 1 y 2, en la EM de la rata la AM estimula la actividad SON expresada como producción de [3H]citrulina así como la formación de GMPc, en una forma dependiente de la dosis.
Figura 1. Efecto de la adrenomedulina (10-7 M) sobre la producción de GMPc (panel izquierdo) y la actividad de la sintasa de oxido nítrico (SON) (panel derecho) en la EM de la rata. *p<0.01 comparado con salina.
Figura 2. Dependencia de la dosis del efecto de la adrenomedulina sobre la producción de GMPc (panel izquierdo) y la actividad de la sintasa de oxido nítrico (SON) (panel derecho) en la EM de la rata. *p<0.01, *p<0.001 comparado con salina.
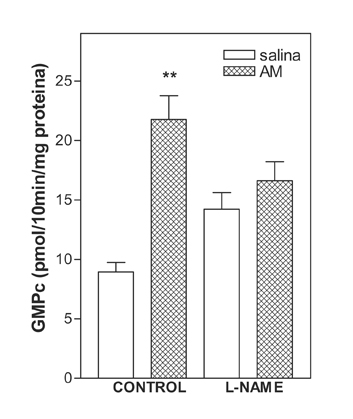
Efecto del análogo de la L-arginina,, L-NAME, sobre la producción de GMPc inducida por AM en la eminencia media de la rata
Se empleó el análogo de la L-arginina, L-NAME, para determinar si la vía de señalización de la L-arginina y la síntesis de NO esta implicada en la producción de GMPc inducida por la AM. Los fragmentos enteros de la EM fueron incubados con el inhibidor específico de la SON, 10 minutos antes de la adición de AM (10-7 M) (N= 5-12 por grupo). En la EM, el L-NAME (10-5 M) inhibió significativamente la producción de GMPc inducida por la AM (figura 3).
Figura 3. Efecto del análogo de la L-arginina,, L-NAME, sobre la producción de GMPc inducida por AM en la eminencia media de la rata. Los fragmentos enteros de la EM fueron incubados con el inhibidor específico de la SON, L-NAME (10-5 M) 10 minutos antes de la adición de AM (10-7 M) (N= 5-12 por grupo). *p<0.001 comparado con salina.
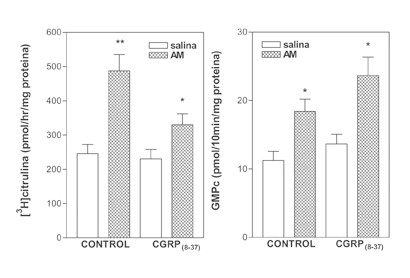
Efecto del antagonista del receptor de CGRP1, el CGRP(8-37), sobre la actividad SON y la producción de GMPc inducida por la AM en la EM de la rata
Se utilizó un antagonista selectivo del receptor CGRP1, con el fin de establecer el subtipo de receptor implicado en el incremento de la SON y de la producción de GMPc inducido por la AM en la EM de la rata. La adición de CGRP(8-37) (10-5 M) a la mezcla de incubación no alteró la respuesta en la formación de GMPc o de la actividad SON estimulada por la AM (N= 5-15, por grupo) (figura 4).
Figura 4. Efecto del antagonista del receptor de CGRP1, el CGRP(8-37), sobre la actividad SON y la producción de GMPc inducida por la AM en la EM de la rata. Se adicionó CGRP(8-37) (10-5 M) a la mezcla de incubación 10 minutos antes que la AM (10-7 M) (N= 5-15, por grupo). *p<0.01, *p<0.001 comparado con salina.
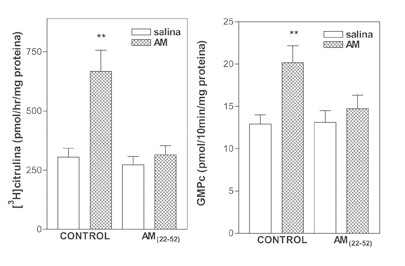
Efecto del antagonista selectivo del receptor de AM, el AM(22-52), sobre la actividad SON y la producción de GMPc estimulada por la AM en la EM de la rata
La figura 5 muestra que la adición a la mezcla de incubación del AM(22-52) (10-5M), un antagonista selectivo del receptor de la AM, inhibió significativamente la actividad SON y la formación de GMPc estimulada por la AM (N= 5-15, por grupo).
Figura 5. Efecto del antagonista selectivo del receptor de AM, el AM(22-52), sobre la actividad SON (panel izquierdo) y la producción de GMPc (panel derecho) estimulada por la AM en la EM de la rata. Se añadió a la mezcla de incubación del AM(22-52) (10-5M), un antagonista selectivo del receptor de la AM 10 minutos antes que la AM (10-7 M) (N= 5-15, por grupo). *p<0.01 comparado con salina.
Discusión
Existe evidencia de la presencia de un sistema adrenomedulinérgico funcional en el sistema nervioso central. Así, se ha descrito la producción de AM y la presencia de sitios de unión para la AM en el cerebro del humano y de la rata (Sone y col., 1997; Takahashi y col., 1997; Juaneda y col., 2001). Mediante técnicas inmunohistoquímicas se ha descrito la presencia de AM, la cual se encuentra ampliamente distribuida en el sistema nervioso central de la rata, encontrando inmunoreactividad (AM-IR) para este péptido en neuronas a través de todo el cerebro y la médula espinal, así como en algunas células endoteliales vasculares y glías perivasculares (Serrano y col., 2002). Específicamente, la AM-IR se encuentra en los núcleos paraventricular, supraóptico e infundibular del hipotálamo humano y de la rata, donde el péptido se colocaliza con fibras inmunorreactivas a la oxitocina y la vasopresina (Ueta y col., 1995; Satoh y col., 1996; Serrano y col., 2000; Serrano y col., 2002). De igual modo, se ha demostrado la expresión de ARNm de la AM en el cerebro y la glándula pituitaria del humano (Takahashi y col., 1997). Se ha implicado al área postrema (Allen y col., 1996) y al hipotálamo con las acciones cardiovasculares de la AM. Además, se ha demostrado que la actividad eléctrica de las neuronas dentro del área postrema del bulbo raquídeo es directamente afectada por la AM en las rebanadas de cerebro (Allen y col., 1996). Toda esta evidencia permite proponer que estructuras tales como el área postrema, los núcleos supraóptico y paraventricular, y la eminencia media pudieran estar envueltas en la acción central de la AM, donde este péptido actuaría como un neurotransmisor, un neuromodulador o una neurohormona (Serrano y col., 2002).
Aunque la distribución de los sitios de unión de la AM en el SNC ha sido bien documentada, los mecanismos de señales de transducción de los receptores de este péptido en el cerebro no han sido clarificados y se conoce mucho menos de los segundos mensajeros intracelulares relacionados con sus acciones biológicas.
La AM fue inicialmente aislada desde una fracción extraída de un tejido capaz de inducir la síntesis de AMPc en las plaquetas (Kitamura, y col., 1993). Si bien originalmente se pensó como única vía de activación la adenilil ciclasa, los receptores de AM también parecen estar unidos a canales iónicos y a una variedad de sistemas de segundos mensajeros a través de efectos directos sobre las enzimas acopladas a proteínas G. Al igual que otras hormonas vasoactivas, el fenotipo de la célula receptora determina la vía de segundos mensajeros activada por la unión del péptido (Samson, 1999).
En la mayoría de los casos el mecanismo de acción de la AM es vía unión a un receptor unido a una proteína G, activación de una Gs, adenilil ciclasa y una proteina kinasa A (PKA) (Hinson y col., 2000). En células endoteliales de aorta de bovino, la AM activa la adenilil ciclasa y la fosfolipasa C mediante un mecanismo que involucra una proteína G sensible a la toxina del cólera. La concentración de calcio se eleva inicialmente como resultado de la generación de IP3 y los canales de calcio se mantienen abiertos en la membrana celular. Estos incrementos en los niveles de calcio citosólico pudieran entonces activar la sintasa de óxido nítrico (SON); lo que sugiere también una vía de activación de la SON mediada por una proteína G directamente (Shimekake y col., 1995).
En efecto, el ON se ha propuesto como uno de los mecanismos que media la vasodilatación inducida por la AM. Así, los efectos de la AM sobre el óxido nítrico han sido evaluados en algunas líneas celulares. En células de músculo liso vascular de aorta de bovino y en miocitos cardíacos la AM aumenta el ARNm de la óxido nítrico sintasa estimulada por la interleukina 1(IL-1), efecto que al menos en la rata es inhibido NG-monometil-L-arginina. Desafortunadamente ninguno de los estudios citados abarca una evaluación completa de la AM o sobre el AMPc y/o el [Ca2+]i. Un estudio sistemático de los sistemas de señalización en células endoteliales de aorta de bovino establece que la AM eleva el AMPc y el [Ca2+]i, vía una fosfolipasa C. Ambos efectos parecen ser dependientes de la toxina colérica pero no son sensibles a la toxina pertussis o son mediados por PKA. Además la AM incrementa los niveles de GMPc en estas células (Shimekake y col., 1995).
Existe evidencia de que el ON actúa como un neurotransmisor en el sistema nervioso central y periférico (Moncada y col., 1991; Moncada y Higgs, 1993). Ya que el ON es una molécula extremadamente lábil, la presencia de la enzima que sintetiza el ON, la oxido nítrico sintasa, ha sido usada para el mapeo de la distribución de neuronas que lo contienen. Entonces, la información sobre la localización celular de la SON ha sido estudiada por inmunohistoquímica y por hibridización in situ. Estos estudios revelaron que la SON está localizada en neuronas del sistema nervioso central y periférico (Edvinsson y col., 1998). Adicionalmente, se ha demostrado la presencia de los componentes de la vía de señalización ON/GMPc en todas las áreas del cerebro de la rata. La guanilil ciclasa soluble activada por ON y la SON están localizados en las estructuras cerebrales en estrecha superposición, excepto en las células grano del cerebelo, las cuales se encontraron positivas a GMPc ocasionalmente. Por otra parte, el inmunomarcaje de la SON en el área hipotalámica fue muy denso en las fibras varicosas delgadas (de Vente y col., 1998).
La presencia de actividad de la SON, conjuntamente con fibras y cuerpos celulares con inmunorreactividad para GMPc en el SNC, junto con la cercana asociación de los plexos de fibras varicosas que contienen inmunorreactividad para la sintasa de óxido nítrico con elementos celulares que presentan receptores para la AM, indica un posible papel de la AM en la regulación de la función celular mediante la posible generación de óxido nítrico/GMPc, como mediadores de los efectos de dicho péptido.
Nuestros resultados apuntan a esa posibilidad ya que la AM fue capaz de incrementar la actividad SON y la producción de GMPc en un área selecta del hipotálamo, como lo es la eminencia media de la rata. El aumento del GMPc inducido por la AM esta relacionada con la producción de ON ya que este efecto fue bloqueado por el antagonista de la SON, el L-NAME. En apoyo a estos hallazgos, Shan y Krukoff (2001) demostraron que la administración intracerebroventricular de AM en ratas, incrementa en forma significativa la concentración de nitratos y nitritos en el hipotálamo, así como la expresión inmunohistoquímica de la NADPH-diaforasa en las neuronas productoras de ON en el núcleo paraventricular.
Varias líneas de evidencias sugieren que la AM, en el SNC, podría tener mecanismos de acción plurales a través de la interacción con receptores específicos. Los sitios específicos de unión de la AM se han demostrado en varios tejidos de la rata incluyendo el cerebro (Owji y col., 1995; Juaneda y col., 2001), los vasos sanguíneos (Nandha y col., 1996) y en las células del músculo liso vascular (Ishizaka y col., 1994). Se ha demostrado que la presencia de receptores específicos para la AM difiere de la de los receptores del CGRP en el cerebro del humano (Sone y col., 1997). Igualmente, se han identificado sitios de unión para la AM en cultivo primario de astrocitos y de células híbridas de neuroblastoma x glioma de ratón/ rata (Zimmerman y col., 1996). Aunque es controversial, parece que los efectos cardiovasculares centrales de la AM son mediados a través de los receptores CGRP1 ya que, la respuesta vasopresora de la AM central es anulada con el pretratamiento con hCGRP8-37 en ratas conscientes y anestesiadas (Saita y col., 1998; Takahashi y col., 1994). Por el contrario, Samson y colaboradores (1998) reportaron que la administración de la AM en el ventrículo lateral o en el cuarto ventrículo cerebral eleva la presión sanguínea en ratas conscientes y este efecto no es bloqueado por el antagonista del receptor CGRP1.
La AM en el cerebro puede ejercer sus acciones a través de la interacción con sitios de unión específicos y la estimulación de la vía de señalización de segundos mensajeros como el ON/GMPc. La expresión de tres receptores huérfanos acoplados a proteína G indica que la AM puede interactuar con múltiples receptores de afinidad y selectividad variable (Aiyar y col., 1996; Han y col., 1997; Kapas y col., 1995a, Kapas y col., 1995b), sugiriendo que la comunicación cruzada entre la AM y CGRP ocurriría vía uno o más de estos receptores. Al determinar el efecto de los antagonistas putativos de los diferentes subtipos de receptores, CGRP8-37 y AM22,52 en la activación de la SON y la consecuente producción de GMPc inducida por la AM, mostramos que las acciones celulares de la AM fueron significativamente bloqueadas por el antagonista del receptor de AM, la AM22,52, mientras que no fueron alteradas por el antagonista del receptor CGRP1, indicando que la AM ejercería las acciones neuroendocrinas a través del receptor específico para la AM en el SNC.
Los estudios más recientes establecen firmemente que el receptor semejante al receptor de la calcitonina (CRLR) puede funcionar como un receptor selectivo para la AM o como un receptor de CGRP, dependiendo de su co-expresión con proteínas accesorias que han sido llamadas proteínas modificadoras de la actividad del receptor (RAMP) (McLatchie y col., 1998). Quizás la respuesta a toda la problemática planteada con los receptores de la AM se encuentre en la nueva teoría de McLactchie y col. (1998), en la que proponen que el receptor semejante al receptor de la calcitonina (CRLR) (un receptor con siete dominios transmembrana) puede funcionar como un receptor de CGRP o un receptor de adrenomedulina, dependiendo de cual de los miembros de una nueva familia de proteínas de un único dominio transmembrana, (RAMPs: proteínas modificadoras de la actividad del receptor), sean expresadas. Las CRLR tienen tres alternativas farmacológicas que son conferidas por las proteínas accesorias. Así, la RAMP1 produce un receptor de CGRP1 sensible a CGRP8,37, la RAMP2 permite expresar un receptor AM específico sensible a AM22-52 clasificado actualmente como un receptor de AM1 mientras que RAMP3 permite expresar un receptor sensible a ambos antagonistas y designado como AM2 ( Kuwasako y col., 2004). Las RAMPs y CRLR están estrechamente asociadas y son expresadas juntas en la superficie celular.
Aunque, se ha demostrado que la AM afecta las funciones cerebrales, los factores que regulan la expresión del gen de las RAMPs en el SNC actualmente se desconocen. Sin embargo, basados en nuestros resultados podríamos especular que la expresión de RAMP2 en el cerebro puede participar en los efectos de la AM sobre la producción de ON/GMPc a través de la estimulación de un receptor AM1.
En conclusión, la estimulación del receptor AM1 en la eminencia media de la rata desencadena una vía de señalización acoplada a la producción de ON/GMPc, lo que sugiere un papel funcional de la AM en la regulación neuroendocrina.
Agradecimientos
Este trabajo fue subvencionado por el Consejo de Desarrollo Científico y Humanístico de la Universidad Central de Venezuela, a través del Proyecto Individual PI-06-30-5030-2002.
Referencias
1. Aiyar, H.; Rand, K.; Elshourbary, N.A.; Zeng, A.; Adamau, J.E.; Bergsma, D.J.; Li, Y. A cDNA encoding the calcitonin gene-related peptide type 1 receptor. J. Biol. Chem. 1996; 271: 11325-11329. [ Links ]
2. Allen, M.A.; Ferguson, A.V.. In vitro recording from area postrema neurons demonstrate responsiveness to adrenemedullin. Am. J. Physiol. (Regulatory Integrative Comp. Physiol 39); 1996; 270: R920-R925. [ Links ]
3. Aguilla M. Growth hormone-releasing factor increases somatostatin release and mRNA levels in the rat paraventricular nucleus via nitric oxide by activation of guanylate cyclase. Proc Natl Aca Sci USA; 1994; 91:782-786. [ Links ]
4. Bredt D, Snyder S. Isolation of nitric oxide synthetase, a calmodulinrequiring enzyme. Proc. Natl. Acad. Sci. USA; 1990; 87 ( 2): 682-685. [ Links ]
5. Bredt D, Hwang P, Snyder S. Localization of nitric oxide indicating a neural role for nitric oxide. Nature; 1990; 347:768 - 770. [ Links ]
6. Bredt, D.; Hwang, P.; Glatt, Ch.; Lowestein, Ch.; Reed, R.; Snyder, S. Cloned and expressed nitric oxide synthase structurally resembles cytochrome P-450 reductase. Nature; 1991; 351: 714- 718. [ Links ]
7. Bredt, D.; Snyder, S. Nitric oxide: A physiologic messenger molecule. Annu Rev Biochem; 1994, 63: 175-195. [ Links ]
8. Costa, A; Rainer, P; Besser, M; Grossman, A. Nitric oxide modulates the release of corticotropin-releasing hormone from rat hypothalamus in vitro. Brain Res; 1993; 605: 187-192. [ Links ]
9. DeVente, J; Hopkins, D; Markerink-Van, Ittersum M; Emson, P; Schmidt H. y Steinbusch, H. Distribution of nitric oxide synthase and nitric oxide-receptive, cyclic GMP-producing structures in the rat brain. Neuroscience. 1998; 87(1): 207-241. [ Links ]
10. Edvinsson, L; Mulder, H; Goadsby, P. y Uddman, R. Calcitonin generelated peptide and nitric oxide in the trigeminal ganglion: Cerebral vasodilatation from trigeminal nerve stimulation involves mainly calcitonin gene related peptide. J Auton Nerv Syst. 1998; 70:15-22. [ Links ]
11. Förstermann, U. y Kleinert, H. Nitric oxide synthase: expression and expressional control of the three isoforms. Naunyn-Schmiedeberg´s Arch Pharmacol. 1995; 352: 351-364. [ Links ]
12. Han, Z Q.; Coppock, H A.; Smith, D M.; VanNoorden, S.; Makgoba, M W.; Nicholl, C.G.; Legon, S. The interaction of CGRP and adrenomedullin with a receptor expressed in the rat pulmonary vascular endothelium. J Mol Endocrinol. 1997; 18: 267-272. [ Links ]
13. Hinson, J; Kapas, S. y Smith, D. Adrenomedullin, a multifunctional regulatory peptide. Endocrine Rev. 2000; 21: 138-167. [ Links ]
14. Hwang, I S; Tang, F. The distribution and gene expression of adrenomedullin in the rat brain: peptide/mRNA and precursor/active peptide relationships. Neurosci Lett. 1999; 267: 85-88. [ Links ]
15. Ishizaka, Y; Ishizaka, Y; Tanaka, M; Kitamura, K; Kangawa, K; Minamino, N; Matsuo, H; Eto, T. Adrenomedullin stimulates cyclic AMP formation in rat vascular smooth muscle cells. Biochem Biophys Res Commun. 1994; 200: 642-646. [ Links ]
16. Juaneda, C; Dumont, Y; Chabot, JG; Quirion, R. Autoradiographic distribution of adrenomedullin receptors in the rat brain. Eur J Pharmacol. 2001; 421:R1-R2. [ Links ]
17. Karsch F: The hypothalamus and anterior pituitary gland. En Reproduction in mammalians; Hormonal control of reproduction. Libro 3. Austic C y Short R editors. Univ Press Cambridge. " 2da. Edición, 1984. [ Links ]
18. Kapas, S; Catt, KJ; Clark, AJ. Cloning and expression of cDNA encoding a rat adrenomedullin receptor. J Biol Chem. 1995a; 270: 25344-25347. [ Links ]
19. Kapas, S.; Clark, A.J.L. Identification of an orphan receptor gene as a type 1 calcitonin gene-related peptide receptor. Biochem. Biophys. Res. Commun. 1995b; 217: 832-838. [ Links ]
20. Kitamura, K.; Sakata, J.; Kangawa, K.; Kojima, H.; Matsuo, H.; Eto, T. Cloning and characterization of cDNA encoding a precursor for human adrenomedullin. Biochem. Biophys. Res. Commun. 1993; 194: 720-725. [ Links ]
21. Kawakami, S; Ichikawa, M; Yokosuda, M; Tsukamura, H. y Maeda, K. Glial and neuronal localization of neuronal nitric oxide synthase immunorreactivity in the median eminence of female rats. Brain Research 1998; 789: 322-326. [ Links ]
22. Kuwasako, K; Cao, YN; Nagoshi, Y; Kitamura, K; Eto, T. Adrenomedullin receptors: pharmacological features and possible pathophysiological roles. Peptides. 2004; 25(11):2003-2012. [ Links ]
23. Lamas, S; Marsden, O; Li, G; Tempst, P. y Michel, T. Endothelial nitric oxide synthase: molecular cloning and characterization of a distinct constitutive isoform. Proc Natl Acad Sci USA; 1992; 89: 6348-6352. [ Links ]
24. Lowenstein, CJ; Glatt, CS; Bredt, DS. y Snyder, SH. Cloned and expressed macrophage nitric oxide synthase contrast with the brain enzyme. Proc Natl Acad Sci USA; 1992; 89: 6711-6715. [ Links ]
25. Lowry, O; Rosebrough, N; Farr, A. y Randall R. Protein measurement with the Folin phenol reagent. J. Biol. Chem. 1951; 193: 265-275. [ Links ]
26. McLatchie, LM.; Fraser, NJ.; Main, MJ.; Wise, A.; Brown, J.; Thompson, N.; Solari, R.; Lee, M.G.; Foord, SM. RAMPs regulate the transport and ligand specificity of the calcitonin-receptor-like receptor. Nature (London) 1998; 393: 333-339. [ Links ]
27. Moretto, M; López, F. y Negro-Vilar, A. Nitric oxide regulates luteinizing hormone-releasing hormone secretion. Endocrinology 1993; 133: 2399 - 2402. [ Links ]
28. Moncada, S; Palmer, R. y Higgs, E. Nitric oxide: physiology, pathophysiology and pharmacology. Pharmacol. Rev. 1991; 43: 109-137. [ Links ]
29. Moncada, S; Higgs, E. The L-arginine oxide pathway. New Engl J Med. 1993; 2002-2012. [ Links ]
30. Moncada, S; Higgs, A;. y Furchgott, R. XIV International Union of Pharmacology; Nomenclature in nitric oxide research. Pharmacol Rev; 1997; 49(2):137-142. [ Links ]
31. Nandha, KA.; Taylor, GM.; Smith, DM.; Owji, AA.; Byfield, PG.; Ghatei, MA.; Bloom, SR. Specific adrenomedullin binding sites and hypotension in the rat systemic vascular bed. Regulatory Peptides; 1996; 62:145-151. [ Links ]
32. Nelson, R; Kriegssfeld, L; Dawson, V;. y Dawson, T. Effects of nitric oxide on neuroendocrine function and behavior. Frontiers in Neuroendocrinology; 1997; 18: 463- 491. [ Links ]
33. Nuki, C.; Kawasaki, H; Kitamura, K; Takrnaga, M; Kangawa, K; Eto, T; Wada, A. Vasodilator effect of adrenomedullin and calcitonin gene-related receptors in rat mesenteric vascular bed. Biochem. Biophys. Res. Commun. 1993; 196:245-251. [ Links ]
34. Oliver, KV.; Wainwright, A.; Heavens, RP.; Hill, RG.; Sirinathsinghji, DJS. Distribution of novel CGRP1 receptor and adrenomedullin receptor mRNAs in the rat central nervous system. Molecular Brain Res. 1998; 57:149-154. [ Links ]
35. Owji, A.A.; Smith, D.M.; Coppock, H.A.; Morgan, G.A.; Bhogal, R.; Ghatei, M.A.; Bloom, S.R. An abundant and specific binding site for the novel vasodilator adrenomedullin in the rat. Endocrinology. 1995; 136: 2127-2134. [ Links ]
36. Palkovits, M. Neuropeptides in the median eminence. Neurochem Int. 1986; 9: 131-139. [ Links ]
37. Prevot, V; Bouret, S; Stefano, GB;. y Beauvillain, JC. Median eminence nitric oxide signaling. Brain Research Reviews. 2000; 34: 27-41. [ Links ]
38. Rivier, C; Shen, G. In the rat, endogenous nitric oxide modulates the response of the hypothalamic-pituitary-adrenal axis to interleukin-1B, vasopressin and oxytocin. J Neurosci. 1994; 14: 1985-1993. [ Links ]
39. Rettori, V; Belova, N; Dess, W; Nyberg, C; Gimeno, M;. y McCann, S. Role of nitric oxide in the control of luteinizing hormone-releasing hormone release in vivo and in vitro. Proc Natl Acad Sci. USA; 1993; 90:10130-10134. [ Links ]
40. Saita, M.; Shimokawa, A.; Kunitake, T.; Kato, K.; Hanamori, T.; Kita-mura, K.; Eto, T.; Kannan, H. Central actions of adrenomedullin on cardiovascular parameters and sympathetic outflow in conscious rats. Am. J. Physiol. (Regulatory Integrative Comp. Physiol. 43). 1998; 274: R979-R984. [ Links ]
41. Samson, W.K.; Murphy, T.C.; Schell, D.A. A novel vasoactive peptide, adrenomedullin, inhibits pituitary adrenocorticotropin release. Endocrinology. 1995; 136: 2349-2352. [ Links ]
42. Samson, W.K.; Murphy, T.C.; Schell, D.A. Central mechanisms for the hypertensive effects of preproadrenomedullin derived peptides in conscious rats. Am. J. Physiol. 1998; 274: R1505-R1509. [ Links ]
43. Samson, W.K. Adrenomedullin and the control of fluid and electrolyte homeostasis. Annu. Rev. Physiol. 1999; 61: 363-389. [ Links ]
44. Satoh, F.; Takahashi, K.; Murakami, O.; Totsune, K.; Sone, M.; Ohneda, M.; Susano, H.; Mouri, T. Immunocytochemical localization of adrenomedullin-like immunoreactivity in the human hypothalamus and the adrenal gland. Neurosci. Lett. 1996; 203: 207-210. [ Links ]
45. Seybold, V. y Wilcox, B. Distribution of neurotransmitter binding sites in the cat median eminence. Neuroendocrinology 1987; 46: 32-38. [ Links ]
46. Shan, J; Krukoff, TL. Intracerebroventricular adrenomedullin stimulates the hypothalamic-pituitary-adrenal axis, the sympathetic nervous system and production of hypothalamic nitric oxide. J Neuroendocrinol. 2001; 13:975-84. [ Links ]
47. Shimekake, Y.; Nagata, K.; Ohta, S.; Kambayashi, Y.; Teraoka, H.; Kitamura, K.; Eto, T.; Kangawa, K. y Matsuo, H. Adrenomedullin stimulates two signal transduction pathways, cAMP accumulation and Ca2+ mobilization, in bovine aortic endothelial cells. J. Biol. Chem. 1995; 270: 4412-4417. [ Links ]
48. Serrano, J; Uttenthal, LO; Martinez, A; Fernandez, AP; Martinez de Velasco, J; Alonso, D; Bentura, ML; Santacana, M; Gallardo, JR; Martinez-Murillo, R; Cuttitta, F; Rodrigo, J. Distribution of adrenomedullin-like immunoreactivity in the rat central nervous system by light and electron microscopy. Brain Res. 2000; 853:245-68. [ Links ]
49. Serrano, J; Alonso, D; Fernandez, AP; Encinas, JM; Lopez, JC; Castro-Blanco, S; Fernandez-Vizarra, P; Richart, A; Santacana, M; Uttenthal, LO; Bentura, ML; Martinez-Murillo, R; Martinez, A; Cuttitta, F; Rodrigo, J. Adrenomedullin in the central nervous system. Microsc Res Tech. 2002; 57:76-90. [ Links ]
50. Serino, R; Ueta, Y; Hara, Y; Nomura, M; Yamamoto, Y; Shibuya, I; Hattori, Y; Kitamura, K; Kangawa, K; Russell, JA; Yamashita, H. Centrally administered adrenomedullin increases plasma oxytocin level with induction of c-fos messenger ribonucleic acid in the paraventricular and supraoptic nuclei of the rat. Endocrinology 1999; 140:2334-42. [ Links ]
51. Sone, M.; Takahashi, K.; Satoh, F.; Murakami, O.; Totsune, K.; Ohneda, M.; Sasano, H.; Ito, H.; Mouri, T. Specific adrenomedullin binding sites in human brain. Peptides. 1997; 18: 1125-1129. [ Links ]
51. Sone, M.; Takahashi, K.; Satoh, F.; Murakami, O.; Totsune, K.; Ohneda, M.; Sasano, H.; Ito, H.; Mouri, T. Specific adrenomedullin binding sites in human brain. Peptides. 1997; 18: 1125-1129.
52. Summy-Long, J; Bui, V; Mantz, S; Koehler, E; Weisz, J;. y Kadekaro, M. Central inhibition of nitric oxide synthase preferentially augments release of oxitocin during deshidratation. Neurosci Lett. 1993; 152: 190-193. [ Links ]
53. Steiner, A.; Parker, C;. y Kipnis, D. Radioimmunoassay for cyclic nucleotides. J. Biol. Chem. 1972; 247: 1106-1113. [ Links ]
54. Takahashi, H.; Watanabe, T.; Nishimura, M.; Nakanishi, T.; Sakamoto, M.; Yoshimura, M.; Komiyama, Y.; Masuda, M.; Murakami, T. Centrally induced vasopressor and sympathetic responses to a novel endogenous peptide, adrenomedullin, in anesthetized rats. Am. J. Hypertension. 1994; 7: 478-482. [ Links ]
55. Takahashi, K.; Satoh, F.; Sone, M.; Murakami, O.; Sasano, H.; Mouri, T.; Shibahara, S. Expression of adrenomedullin mRNA in the human brain and pituitary. Peptide 1997; 18: 1051-1053. [ Links ]
56. Taylor, G.M.; Meeran, K.; OShea, D.; Smith, D.M.; Ghatei, M.A.; Bloom, S.R. Adrenomedullin inhibits feeding in the rat by a mechanism involving calcitonin gene-related peptide receptors. Endocrinology 1996; 137:3260-3264. [ Links ]
57. Ueta, Y.; Kitamura, K.; Isse, T.; Shibuya, I.; Kabashima, N.; Yamamoto, S.; Kangawa, K.; Matsuo, H.; Eto, T.; Yamashita, H. Adrenomedullin-immunoreactive neurons in the paraventricular and supraoptic nuclei of the rat. Neurosci Lett. 1995; 202: 37-40. [ Links ]
58. Wimalawansa, SJ. Calcitonin gene-related peptide and its receptors: molecular, genetics, physiology, pathophysiology, and therapeutic potentials. Endocrin. Rev. 1996; 17: 533-585. [ Links ]
59. Zimmerman, U.; Fischer, J.A.; Frei, K.; Fischer, A.H.; Reinscheid, R.K.; Muff, R. Identification of adrenomedullin receptors in cultured rat astrocytes and in neuroblastoma x glioma hybrid cells (NG108-15). Brain Res. 1996; 724: 238-245. [ Links ]