Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT v.26 n.1 Caracas jun. 2007
Tratamiento farmacológico de la obesidad: presente, pasado y futuro
Lisney Valdelamar, Moisés Rodríguez, Valmore Bermúdez, Elliuz Leal , Fernando Bermúdez, Mayela Cabrera, Edgardo Mengual, Carlos Silva, Anilsa Amell, Abdón Toledo
Universidad del Zulia. Facultad de Medicina centro de investigaciones endocrino-metabólicas Dr. Félix Gómez
Resumen
La obesidad es una enfermedad endocrino-metabólica caracterizada por excesiva acumulación de grasa en el tejido adiposo. La importancia en el estudio y tratamiento de la obesidad, radica no sólo en la alta incidencia de ésta patología en los últimos años, sino el alto riesgo en salud que ésta implica. El objetivo del tratamiento es revertir el balance energético positivo, y mejoramiento de las co-morbilidades asociadas, mediante la reducción de la ingesta de alimentos y el aumento del gasto energético. Los pilares de la terapéutica son modificar la conducta, dieta y ejercicios. Sin embargo estas no son herramientas que garantizan el mantenimiento de la pérdida de peso a largo plazo sin efecto rebote. Los fármacos constituyen una herramienta empleada en asociación con los anteriores y no como única medida. Los fármacos para el tratamiento de la obesidad, se clasifican en aquellos que reducen la ingesta de alimentos (agentes noradrenérgicos, serotoninérgicos y duales), disminuyen la absorción (orlistat) y los que incrementan la termogénesis (efedrina y cafeína). En la actualidad sólo sibutramina y orlistat se vislumbran como las únicas drogas cuya seguridad y eficacia demostrada permiten su aplicación clínica a largo plazo (2 años). Los avances en el estudio del balance energético y su regulación han postulado nuevos blancos para la fabricación de futuros fármacos más específicos y eficaces como los antagonistas de receptores endocanabinoides.
Palabras Clave: Obesidad, Índice de Masa Corporal, balance energético, agentes noradrenérgicos, agentes serotoninérgicos, sibutramina, orlistat.
Abstract
Obesity is a chronic, stigmatized and costly disease that is rarely curable and is increasing in prevalence in most of the world. At this time, available treatments, including drugs, are palliative and are effective only while the treatment is being actively used; when effective drugs or other treatments are discontinued, weight gain is an inevitable consequence. Any effective drug will be widely used for its cosmetic as well as medical benefits, as obesity is a socially stigmatized problem. Thus, any drug that is approved should meet high standards for safety.
Obesity prevention and management should be given as much priority and skill by all professionals as it would be given to any other common chronic disease with such serious consequences. Several pharmacological approaches have been proposed to promote weight loss and/or minimize weight regain and the need for and logic of anti-obesity drug treatment has been recognized. While the pharmacological market of anti-obesity drugs remained almost unchanged for several decades, the last years has been characterized by three major events: first, the withdrawal, because of reported serious side effects, of two drugs widely used in Europe and in the US (fenfluramine and dexfenfluramine); second, the widely clinical use of two drugs sibutramine and orlistat and finally the development of new drugs like enndocanabinoid system antagonist.
Key Words: Obesity, Body Mass Index, energetic balance, noradrenegic agents, serotoninergic agents, sibutramin, orlistat.
Recibido: 28/01/2006 Aceptado: 03/04/2007
Introducción
La obesidad es una enfermedad endocrino-metabólica multifactorial que obedece a la compleja interacción de la predisposición genética, elementos ambientales, sociales e individuales, cuya principal característica es una excesiva acumulación energía a manera de grasa en el tejido adiposo1,2; pero más allá de constituirse como una alteración energética (balance positivo) es una patología crónica, asociada a un alto riesgo de morbi-mortalidad por la diversidad de complicaciones que produce (Figura Nº 1). Aunado al desmejoramiento en la calidad de vida, y de ser una causa temprana de muerte, se suma el vertiginoso incremento que ha experimentado los últimos 30 años, afectando no sólo los países industrializados sino también a naciones en vías de desarrollo, considerándose un grave problema de salud pública a nivel mundial3,4.
Figura 1. Espectro de Complicaciones Médicas y Psicobiológicas vinculadas con el desarrollo de Obesidad
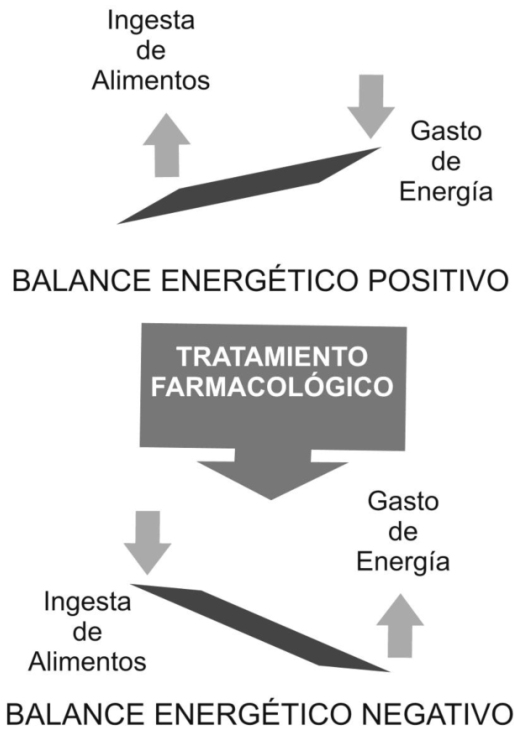
Ante estas circunstancias, el objetivo de las estrategias terapéuticas, es producir déficit energético a expensas de la utilización de las reservas energéticas corporales (principalmente tejido adiposo) y disminución de la ingesta calórica, conduciendo a la pérdida de peso, y con ello mejoramiento del perfil metabólico, y por tanto de la calidad de vida (principio que sólo es posible con el mantenimiento a largo plazo de ésta reducción de peso). Sin embargo aunque el paciente obeso o con sobrepeso puede estabilizar su peso, lo usual es que el balance energético positivo se perpetúe, por el continuo aumento de peso o la recuperación del peso (efecto rebote).
Los pilares que fundamentan el tratamiento de la obesidad y sobrepeso, son los cambios en el estilo de vida (dieta, ejercicio y terapia cognitiva/conductual)5,6 que aunque promueven la pérdida de peso corporal no son eficaces en el mantenimiento de la misma.
La ausencia de medidas de prevención y tratamiento no farmacológico efectivas, nos lleva a considerar herramientas médicas tales como terapia farmacológica e intervenciones quirúrgicas que nos permitan alcanzar el objetivo propuesto.
Criterios para el diagnóstico de Obesidad y Sobrepeso
La obesidad es una entidad patológica definida por la medición indirecta de la cantidad de grasa corporal, para lo cual, una de las medidas más utilizadas es el Índice de Masa Corporal (IMC) que se calcula dividiendo el peso (en Kg) entre la talla elevada al cuadrado (m2). La Organización Mundial de la Salud (OMS) define como normopeso, un IMC entre 20 y 24,9 Kg/m2, sobrepeso, cuando el IMC se encuentra entre 25 y 29,9 Kg/m2 y obesidad, todo IMC mayor de 30 Kg./m2 3,7 (Tabla Nº 1).
Sin embargo el IMC, no representa adecuadamente la distribución de grasa corporal, lo cual es un elemento que requiere ser considerado, pues la acumulación de grasa intra-abdominal es un factor de riesgo para enfermedad coronaria y diabetes mellitus8; para lo cual se recomienda la medición del Índice Cintura-Cadera (ICC) o mejor aún, la circunferencia abdominal, parámetros que se correlacionan con el volumen de grasa visceral e indirectamente con la adiposidad central8,9. Se considera una circunferencia abdominal de alto riesgo para la salud cuando sobrepasa los 94 cm para hombres y 80 cm para mujeres.
Tratamiento Farmacológico
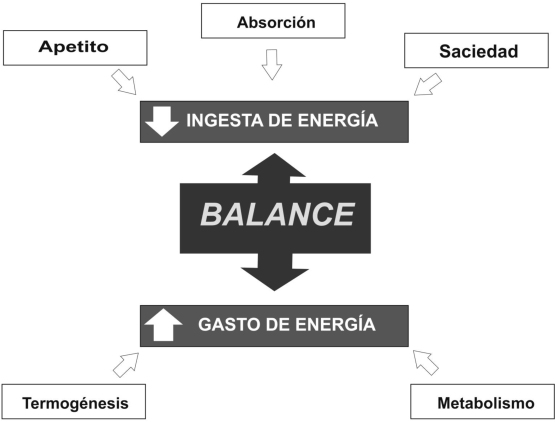
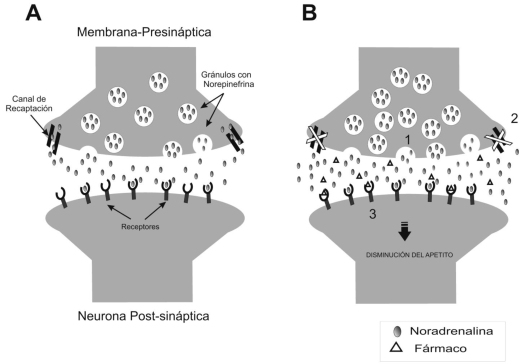
El principio fundamental de la terapia farmacológica de la obesidad es revertir el balance energético positivo (Figura Nº 2) responsable de la excesiva acumulación de triacilglicéridos en el tejido adiposo, actuando sobre los puntos de regulación de la ingesta de alimentos (Absorción intestinal, metabolismo intermediario, núcleos hipotalámicos) y sobre el gasto energético (termogénesis, metabolismo basal) lo cual se traduce en disminución de masa corporal. Aunque parece sencillo, la meta no sólo es la reducción de peso, sino su mantenimiento a largo plazo (evitando el efecto rebote) con efectos adversos mínimos. (Figura Nº 3)
Figura 3. Puntos sobre los que actúan los fármacos en el tratamiento de la Obesidad. Para la disminución de la ingesta, se puede actuar a nivel del hipotálamo para disminuir el apetito y la saciedad; otra forma sería limitar la absorción de los nutrientes a nivel del intestino. Para el incremento del gasto de energía el objeto seria aumentar la termogénesis y estimular el metabolismo basal
La United States Foods and Drugs Administration (FDA) conjuntamente con el National Heart, Lung and Blood Institute (NHLBI) sugieren que la instauración de drogas debe limitarse a individuos con IMC mayor o igual a 30 Kg/m2 en ausencia de entidades patológicas asociadas. Por otra parte, si el sobrepeso se acompaña de co-morbilidades, las drogas pueden emplearse en pacientes con IMC de 27 Kg/m2 o más. (Tabla N° 2)
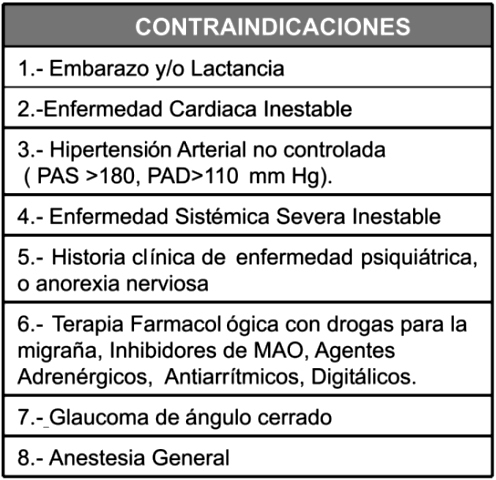
De igual forma deben tomarse en cuenta los criterios de exclusión o contraindicaciones para el uso de drogas en el tratamiento de la obesidad (Tabla Nº 3): historia médica de anorexia nerviosa, embarazo, lactancia, enfermedades psiquiátricas como la ansiedad, el transtorno bipolar, enfermedad coronaria, hipertensión arterial no controlada. Los agentes serotoninérgicos (ver más adelante) como sibutramina están contraindicados en individuos que reciben fármacos inhibidores de monoamino oxidasa (MAO). En presencia de patologías digestivas como el síndrome de colon irritable, enfermedad de Crohn, y colitis ulcerosa está restringido el uso de agentes como el Orlistat que afectan la absorción intestinal24.
Reseña Histórica: Aprendiendo de los errores
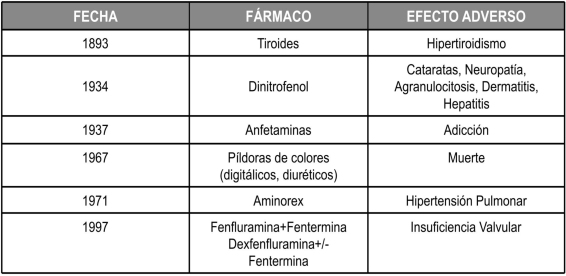
En la tabla Nº 4 se enuncian los fármacos utilizados en el pasado para el tratamiento de la obesidad con sus correspondientes efectos adversos los cuales fueron concluyentes para su eliminación del mercado farmacéutico, y que dieron pie a una secuencia de catástrofes que marcaron la búsqueda de drogas eficaces en la terapéutica de la obesidad36,38.
Tabla 4. Evolución histórica de los fármacos para el tratamiento de la Obesidad y los efectos adversos por los cuales fueron retirados del mercado. Véase con más detalle en la Reseña Histórica en el artículo.
En 1893, se utilizaba el extracto de tiroides en el tratamiento de la obesidad, ya que al desconocer la bases fisiopatológicas de la misma se pensó que su trasfondo era el hipotiroidismo, y de ésta forma la administración exógena de T3 y T4, producía rápida pérdida de peso, a expensas del catabolismo en músculo y a la inducción de la lipasa sensible a hormonas.
Sin embargo, eran frecuentes problemas cardiovasculares como las arritmias, angina de pecho, hipertensión arterial y la Insuficiencia cardíaca39. Posterior a estos sucesos, en 1933 fue introducido el Dinitrofenol, un químico desacomplante y que por lo tanto producía la dislocación de la fosforilación oxidativa y con ello se incrementaba la tasa metabólica y la perdida energética en forma de calor40,42. Sin embargo, el desarrollo de cataratas, neuropatía42,46, agranulocitosis, dermatitis, hepatitis y muerte condujeron a su retiro del mercado42. Las Anfetaminas (αlfa-metil-β-fenetilamina) y sus derivados, se introdujeron en 1937 al demostrarse que tenían propiedades estimulantes del SNC, que resultaban en la reducción de masa corporal, dependiente de la dosis. Lamentablemente, su uso continuo y en dosis elevadas reveló el desarrollo de tolerancia y dependencia47,48, lo que sembró la desconfianza en ellas y en todos sus derivados (fueran o no adictivos), motivando su salida del mercado. En 1967 la combinación de digitálicos, anfetaminas y diuréticos (Rainbow pills), empezó a utilizarse para la reducción de peso de forma manera rápida pero con un riesgo muy elevado, de muerte súbita por arritmias44,46. Un hecho similar se suscitó con la introducción en el mercado del Aminorex en 1965, la cual era una droga anorexigénica con propiedades simpaticomiméticas como las anfetaminas, pero sin su potencial de adicción cuya descontinuación se produjo tras informes que reportaban el desarrollo de hipertensión pulmonar47.
Finalmente, el desarrollo de enfermedad valvular cardíaca desencadenó en los 90´s la salida de los estantes farmacéuticos, de la combinación de Fenfluramina (droga que promueve la liberación e inhibe la recaptación de serotonina en las terminales nerviosas) y Fentermina así como de la Dexfenfluramina, lo que generó un gran impulso en el desarrollo de fármacos eficaces y seguros en el manejo a largo plazo de la obesidad (49).
Clasificación de los fármacos contra la obesidad
En general las drogas para el tratamiento de la obesidad se clasifican según sus potenciales mecanismos de acción y los puntos del balance energético sobre los que actúan. De esta manera, las tres grandes categorías son: a) los que deducen la ingesta de alimentos; b) los que modifican el metabolismo intermediario y c) los que aumentan el gasto de energía.
A) Fármacos que disminuyen la ingesta de alimentos
Agentes Noradrenérgicos
Múltiples núcleos en el Sistema Nervioso Central (principalmente en hipotálamo) están implicados en la regulación del balance energético50,54. Las neuronas que conforman éstos núcleos contienen noradrenalina, serotonina, y dopamina. Éstos neurotransmisores sintetizados y almacenados en las terminales neuronales proximales, son liberados a la hendidura sináptica para posteriormente acoplarse a receptores presentes en las terminaciones distales, permitiendo la propagación de los impulsos nerviosos desde estos núcleos hacia otros núcleos del SNC y/o la periferia, alterando la ingesta y el gasto de energía, así como la utilización de substratos o reservas adiposas55.
Norepinefrina (NE) puede incrementar o disminuir la ingesta de alimentos, dependiendo del tipo de receptor a que se acople y la localización de los mismos56. La acción de la NE sobre los receptores adrenérgicos tipo α1 localizados en neuronas del núcleo ventromedial del hipotálamo disminuye la ingesta de alimentos57. El papel de los receptores adrenérgicos α1 y α2 en la ingesta se pone de manifiesto cuando al administrar antagonistas de los receptores α1, como terazozin (utilizado en el tratamiento de la hipertensión) se produce ganancia de peso58, efecto que también se consigue al administrar agonistas de los receptores adrenérgicos α259. Por otra parte, la estimulación de los receptores β2-adrenérgicos en el área perifornical parece no sólo promover la disminución de la ingesta calórica sino también tener un pequeño efecto sobre la termogénesis60, de ésta manera al administrar fármacos agonistas de éstos receptores como terbutalina, clembuterol y salbutamol en el SNC se produce una disminución en la ingesta de alimentos61. Los agonistas de receptores adrenérgicos β3, parecen promover también la reducción de la ingesta energética, no sólo a nivel central sino periférico en las células del tejido adiposo al estimular la termogénesis62.
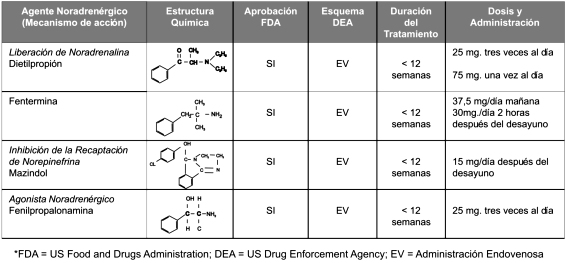
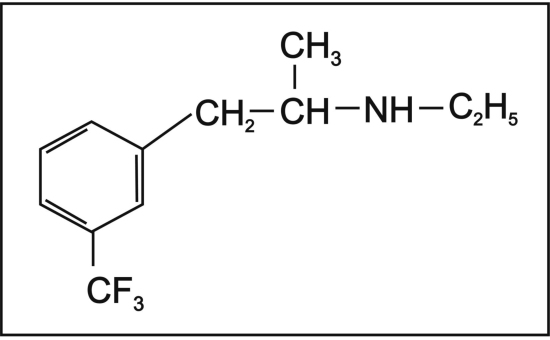
Los fármacos noradrenégicos, con excepción de mazindol, se derivan de β-feniletilamina (Tabla Nº 5), cuya estructura química es similar a la de los neurotransmisores dopamina, epinefrina y norepinefrina63. La anfetamina constituye el fármaco prototipo de éste grupo de compuestos (de allí que se les vincule de manera implícita a todos sus derivados con el desarrollo de adicción). La modificación química del esqueleto estructural de la β-feniletilamina permite la obtención de una amplia gama de compuestos con diversas respuestas farmacológicas64,68 como la estimulación de la liberación de NE de los gránulos presinápticos e incluso de dopamina con incremento de la avidez del neurotransmisor en la hendidura sináptica y con ello la interacción con receptores postganglionares (benzfetamina, fendimetrazina, fentermina, y dietilpropión)63 inhibición de la recaptación de NE (mazindol) o acción agonista sobre receptores adrenérgicos (fenilpropanolamina). (Figura N° 4)
Todas estas drogas, se administran por vía oral, alcanzando su concentración pico en sangre en poco tiempo (1 a 2 horas tras su absorción intestinal), su tiempo de vida media es corto, sufren un proceso de inactivación por metabolismo o conjugación hepático antes de su excreción por la orina69.
En general los agentes adrenérgicos promueven la reducción de peso corporal principalmente por la disminución de la ingesta de comida por retardar la necesidad de ingerir alimentos o por promover la saciedad. Algunos fármacos como el mazindol y dietilpropión, parecen aumentar la tasa de consumo de oxígeno y la actividad en el tejido adiposo pardo en roedores, sin embargo éstos efectos no se han registrado en humanos70,72. La eficacia de éstos agentes radica en la reducción de peso corporal de 3 a 8% comparado con placebo y más del 5 % del peso corporal inicial69, sin embargo la posibilidad del desarrollo de adicción, tolerancia y múltiples efectos adversos como xerostomía, constipación, insomnio, euforia, palpitaciones, arritmias, hipertensión arterial, isquemia miocárdica y valvulopatía los etiqueta como herramientas de utilización limitada y poco confiables para el tratamiento de una entidad de carácter crónico. (Tabla N° 5)
Agentes serotoninérgicos
La inyección de fármacos con actividad agonista de receptores serotoninérgicos (quizapina y d-norfenfluramina y clorofenilpiperazina) dentro del núcleo hipotalámico paraventromedial (PVM) produce disminución de la ingesta de alimentos. Existen una amplia variedad de receptores de serotonina (5-HT) agrupados en 7 familias, con diferentes subtipos dentro de cada una de ellas73. La mayoría de los receptores son proteínas de membrana plasmática, acoplados a proteína G, con activación o inhibición de adenilatociclasa, con excepción de los receptores tipo 5 HT3 que actúa como receptor acoplado a un canal iónico73.
Los receptores de las familias 5-HT1 y 5-HT2, son los principalmente involucrados en la regulación del balance energético. La estimulación de los receptores tipo 5-HT1A, del núcleo del rafe dorsal estimula la ingesta de alimentos74. Por otra parte al administrar agonistas de recetores 5-HT1B/2C, disminuyen los niveles de neuropéptido Y (NPY) y por tanto se reduce la ingestión de alimentos75.
De la misma forma que los agentes noradrenérgicos, los fármacos serotoninérgicos pueden actuar como agonistas de los receptores, promoviendo la liberación desde las terminaciones presinápticas y/o inhibiendo su recaptación pero carecen de efectos estimulantes y de propiedades adictivas. Entre éstos se encuentran dexfefluramina y fenfluramina, que aunque fueron aprobados por la FDA fueron retirados del mercado en 1997 por su vinculación al desarrollo de enfermedad cardíaca valvular.
La fenfluramina es una mezcla racémica y dexfenfluramina su dextroisómero (Figura Nº 5). Estas drogas producen disminución de 6 al 10 % del peso corporal después de 1 año77,79 con mejoramiento de las co-morbilidades asociadas a la obesidad, tales como la insulinorresistencia, intolerancia a la glucosa, que resultaron independientes de la pérdida de peso80,81. En el estudio de Weitraub y colaboradores, el tratamiento continuado de fenfluramina y fentemina (combinación fen-phe) durante 3 meses demostró que el efecto en la reducción de peso corporal resultaba más eficaz, que con la utilización de éstos fármacos por separado, empleando menos dosis y disminuyendo la aparición de efectos adversos. Sin embargo el efecto reductivo era eficaz durante los primeros 6 meses, después de los cuales se desarrollaba tolerancia y por tanto un estancamiento en la perdida de peso, fenómeno denominado efecto de meseta82, con el desarrollo de efectos adversos como exacerbación de la manía, pérdida de la memoria, y de manera relevante hipertensión pulmonar y valvulopatía.
Agentes duales (noradrenérgicos/serotoninérgicos): Sibutramina
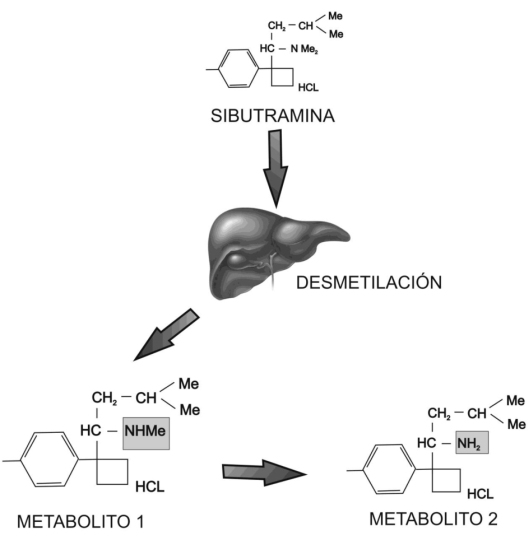
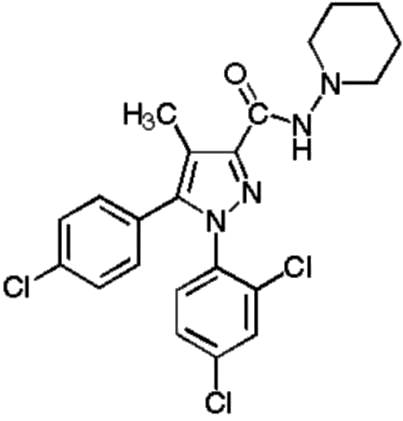
La Sibutramina, sintetizada por primera vez en 1980 con el objeto de ser utilizada como antidepresivo reduce la ingesta de alimento en animales de experimentación incrementando la termogénesis36. Sibutramina es una amina terciaria (N-[1-[-(4-clorofenil)ciclobutil]-3-metilbutil)-n.n-dimetilamina-monhidrato-clorhidrato)queorigina2metabolitos farmacológicamente activos (aminas secundarias), formados tras su desmetilación hepática. (Figura Nº 6) La dosis empleada oscila entre 10 y 15 mg diarios administrados una vez al día generalmente en la mañana.
Mecanismo de Acción
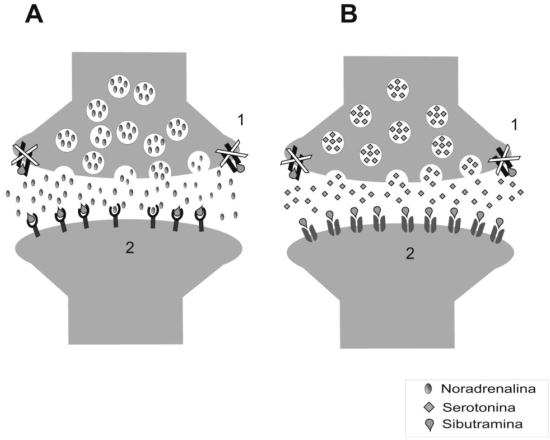
In vivo, sibutramina es un potente inhibidor selectivo de la recaptación de noradrenalina (NE), serotonina (5-HT) y Dopamina (DA) (Figura Nº 7). Sin embargo, éstos efectos son indirectos, porque In vitro, sibutramina se comporta como un débil inhibidor de la recaptación de monoaminas en tejido cerebral humano y de roedores, comparado con otros inhibidores de la recaptación de monoaminas como desipramina, imipramina, nimofensina y amitriptilina. Ésta acción es mediada In vivo, por los metabolitos 1 y 283,84. Sibutramina y sus metabolitos activos no estimulan la liberación de NE, 5-HT o DA, lo cual la diferencia de dexfefluramina y D-anfetamina; carece de actividad sobre la enzima Monoaminooxidasa (MAO) y presenta afinidad por una amplia variedad de receptores: α1, β2, β3 adrenérgicos, receptores de serotonina 5-HT1A, 5-HT1B, 5-HT2A, 5-HT2B, 5-HT2C, receptores de dopamina D1, D2, receptores muscarínicos, receptores histaminérgicos tipo H1 y receptores de benzodiazepinas (85,86).
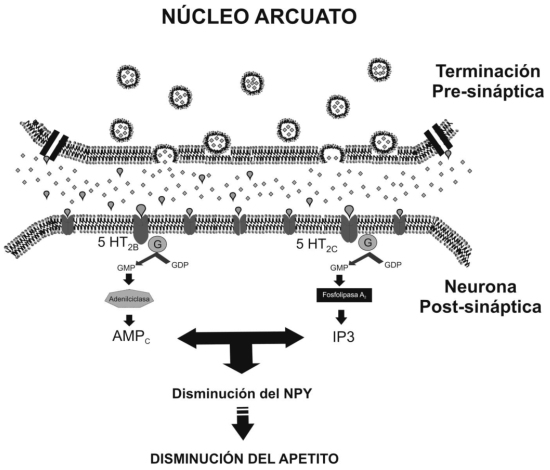
Los efectos farmacológicos de la sibutramina, son desencados principalmente por acciones agonistas sobre receptores serotoninérgicos tipo 5-HT2B y 5-HT2C, que se encuentran en abundancia a nivel del Núcleo Arcuato en el hipotálamo. Estos receptores son proteínas de membrana plasmática de las terminaciones neuronales postsinapticas, los cuales al ser activados por la serotonina desencadenan cascadas de señalización, caracterizadas por la activación de proteína G acopladas a la membrana, con el consiguiente aumento en las concentraciones de AMP cíclico (receptor tipo 5-HT2B ) o activación de enzimas como la Fosfolipasa A con aumento de segundos mensajeros como el Inositol 3 fosfato (IP3) o Diacilglicerol, en el caso del receptor 5-HT2C. Independientemente de cual sea la vía de señalización activada, el resultado neto es la represión de los genes codificadores e inhibición de la liberación del Neuropeptido Y (NPY) un importante agente orexigénico regulador del balance energético. Todo lo cual resulta en la disminución de la ingesta de alimentos, siendo este efecto dosis-dependiente97. (Figura Nº 8) Es de hacer notar que a nivel del Núcleo Arcuato también existen receptores serotonergicos tipo 5-HT1A, 5-HT1B, cuya activación implica el aumento en la síntesis y liberación del Neuropeptido Y; sin embargo los mecanismos de avidez de estos receptores y la disminución de la afinidad de la sibutramina con ellos aun se desconocen; por otra parte se infiere que las acciones de este fármaco, implican interacciones con otras sustancias reguladoras de balance energético, que en conjunto desencadenen la inhibición de las señales orexigenicas con activación de las anorexigénicas, que para el momento aun no se han dilucidado. En resumen Sibutramina reduce la ingesta de alimentos, debido a su capacidad para prolongar la saciedad, en contraste con los efectos de los derivados anfetamínicos, que se basaban en la supresión del apetito, aumentando la actividad locomotora87.
Por otra parte estudios experimentales en roedores han demostrado que Sibutramina, aumenta la termogénesis en el Tejido Adiposo Marrón (TAM), ya que la inhibición central de la recaptación de serotonina y norepinefrina, aumentan el tono simpático a nivel del adipocito y por tanto estimulación de los receptores betaadrenérgicos 3 (β 3) que modulan de manera positiva el gasto energético98.
Efectos terapeuticos
La eficacia y seguridad del tratamiento con sibutramina ha sido valorada en estudios a corto y a largo plazo90,95 así el porcentaje de reducción fue de 6-10% con respecto al peso corporal inicial, con recuperación de peso después de 18 meses pero en menor porcentaje con respecto al grupo placebo. Así mismo sibutramina, mejora las complicaciones de la obesidad (de manera proporcional a la reducción de peso) evidenciándose en mejoramiento del perfil metabólico (disminución de la glicemia basal insulina, péptido C, Hb. A1c, ácido úrico, triacilglicéridos, VLDLc, sin disminución de LDLc ni aumento de HDLc.
Efectos adversos:
Los efectos secundarios reportados, son de leve a moderada intensidad y se producen generalmente en las primeras 4 semanas de tratamiento, algunas veces autolimitados. Los más frecuentes son boca seca, nauseas, mareos, constipación, insomnio, y cefalea97. Dentro de los efectos adversos sobre el sistema cardiovascular se encuentran aumento de la presión arterial sistólica y diastólica (+/- 2 mmHg dosis de 10-15 mg)99 taquicardia y palpitaciones por el aumento del gasto cardíaco (6-13 latidos por minuto)99, sin asociarse a infarto miocárdico o accidente cerebrovascular, por lo cual la presión arterial y el pulso deben ser cuidadosamente monitoreados en los pacientes obesos con hipertensión, que inician la farmacoterapia con sibutramina pues en las primeras 8 semanas de tratamiento se reportan elevaciones de éstos parámetros. No se han descrito efectos adversos como desarrollo de hipertensión pulmonar, valvulopatía, adicción y/o síndrome de abstinencia Un efecto secundario poco reportado que debe ser objeto de estudio, lo constituye el desmejoramiento de la memoria y el desarrollo de amnesia, asociado al uso de la sibutramina99.
El tratamiento con sibutramina debe suspenderse en los casos en los que la disminución de peso sea menor del 5 Kg. en 3 meses o se recuperen más de 3 Kg. después de haber adelgazado o tras un año de tratamiento continuo94. No debe considerase la utilización de sibutramina en pacientes con historia de enfermedad cardiovascular, hipertensión, enfermedad cerebrovascular, trastorno bipolar, insuficiencia renal o hepática; ni en pacientes en tratamiento con fármacos como inhibidores de la MAO, o que tengan metabolismo hepático (enzimas citocromo p450) como ketoconazol, eritromicina y cimetidina, entre otras.
B) Farmacos que disminuyen la absorción intestinal orlistat
Orlistat es el único inhibidor de la absorción intestinal de grasa aprobado por la FDA, para el tratamiento de la obesidad100,105. Se trata de un derivado hidrogenado (liptastina) producido por Streptococcus toxutricini. Éste componente altamente lipofílico, actúa como un potente inhibidor de la mayoría, sino todas, las lipasas de mamíferos106,107. Se administra a una dosis de 120 mg tres veces con las comidas.
Mecanismo de acción:
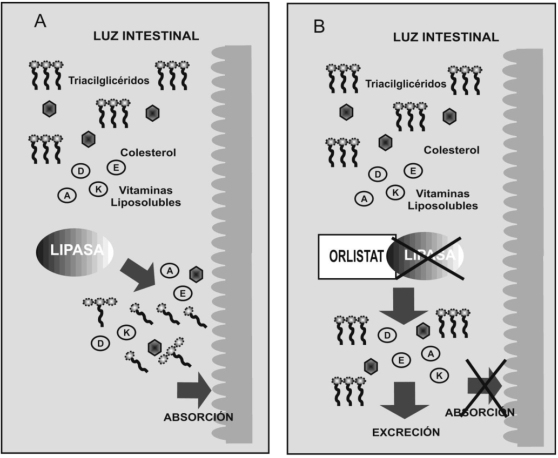
Orlistat o tetrahidrolipstatina actúa en la cavidad gástrica y en la luz del intestino delgado mediante la formación de un enlace covalente con el sitio activo de las lipasas gástrica y pancreática inhibiendo la escisión de los triacilglicéridos en ácidos grasos libres y monogliceroles absorbibles, de tal manera que 30 % de las grasas ingeridas se eliminan junto a las materias fecales, resultando en un déficit calórico, que promueve la pérdida de peso. (Figura Nº 9).
Efectos terapéuticos:
En un estudio controlado con placebo, aleatorio, doble ciego, desarrollado durante dos años, pacientes tratados con orlistat, mostraron una reducción de peso que oscilaba entre 8,5 y 10,2 % con respecto al peso corporal inicial, durante el primer año (grupo con placebo 5,5- 6,6%). En el segundo año, la pérdida de peso en los pacientes tratados con Orlistat, se mantuvo superior al 5% (7,6 y 7%), en contraste a los pacientes que recibían placebo (4,5-7,6%); demostrándose que la reducción fue gradual y mantenida, durante el primer año, y que la ganancia de peso con orlistat es lenta108,110.
Orlistat tiene efectos benéficos sobre el perfil metabólico. A diferencia de sibutramina disminuye los niveles de LDL c, en un 4-11%111 colesterol total, triacilglicéridos y cifras tensionales111, 116. Muestra además mejoras en los niveles de glicemia basal y pospandrial, hemogobina glucosilada e insulina, contribuyendo al control de los pacientes diabéticos obesos117.
Farmacocinética:
Debido a su alta liposolubilidad, la absorción de orlistat es mínima (1%), siendo su principal vía de eliminación la excreción fecal. La porción de absorción sufre metaolismo gastrointestinal, que origina 2 metabolitos (M1 y M3) farmacológicamnte inactivos, los cuales se excretan por vía biliar118.
Debido a su mecanismo de acción, disminuye la absorción de vitaminas liposolubles y análogos (A, D, E, y K), por lo cual deben administrarse suplementos de éstos, 2 horas antes o después del empleo del fármaco.
En virtud de su mínima absorción, orlistat no afecta las propiedades farmacocinéticas de digoxina, fenitoína119, warfarina, gliburide120, anticonceptivos orales alcohol121 ni tampoco de antihipertensivos como furosemida, captopril, atenolol y nifedipino122. Sin embargo especial cuidado debe tenerse al administrar orlistat conjuntamente con pravastatina y cliclosporina por que aumenta la disponibilidad de las mismas así como sus efectos farmacológicos.
Efectos adversos:
Sus principales efectos secundarios son gastrointestinales y se manifiestan durante las primeras 6 semanas de tratamiento, después de las cuales desaparecen o son bien tolerados. Éstos incluyen: borborismos, dolor abdominal, aumento de las defecaciones (11%), flatulencia con descarga fecal (24%) manchas oleosas (27%) urgencia fecal (22%) esteatorrea (20%) e incontinencia fecal (8%); todos los cuales aumentan con el mayor consumo de lípidos en las comidas.
Nuevas perspectivas: Antagonismo del sistema endocanabinoide en el tratamiento de la obesidad.
Desde hace siglos los canabinoides han sido utilizados con fines medicinales, y entre sus mas conocidos efectos se cuenta el incremento del apetito121. Esto incentivó por largo tiempo la búsqueda de las vías moleculares por las que se producían estos efectos, hasta que el esfuerzo dio sus frutos se hallaron en tejidos animales sustancias con propiedades similares a aquellas encontradas en la planta Cannabis sativa (marihuana) pero con una estructura química muy diferente ya que estos compuestos son derivados de ácidos grasos modificados, pertenecientes a las familias de las aciletanolaminas y los acilgliceroles, que son mediadores endógenos de naturaleza que incluyen a la araquidoniletanolamida (anandamida, AEA), la palmitoiletanolamida (PEA), la oleilamida y el mediador lipídico anorexígeno oleiletanolamida (OEA)122. La anandamida y la palmitoiletanolamida son cannabinomiméticos propiamente hablando, ya que actúan en los mismos receptores que los compuestos activos del cannabis, la anandamida es un ligando del receptor CB1123, 124 (localizado en sistema nervioso central, adipocito e intestino entre otros) y la palmitoiletanolamida es un ligando del receptor CB2 (localizado en sistema nervioso periférico)122. Los efectos centrales mediados por los endocannabinoides agonistas del CB1 son similares a los de la marihuana; Otras funciones son fundamentalmente periféricas e incluyen: 1. la regulación de la ingesta, actuando en centros hipotalámicos directamente o a través de neuropéptidos como CCK, CRH, NPY, oxitocina o de hormonas como la leptina 2. el control endocrino, activando la secreción de ACTH y glucorticoides, e inhibiendo la liberación de gonadotropinas, GH, prolactina y TSH; 3. regulandola microcirculación (la anandamida ha sido propuesta como el factor hiperpolarizante derivado del endotelio); 5. La hematopoyesis122,125,126.
Por otra parte la oleiletanolamida (OEA), actúa activando el receptor nuclear PPARα, factor de transcripción perteneciente a la superfamilia de receptores nucleares activados por ligandos127. La oleiletanolamida disminuye el apetito y la ingesta de alimentos y la incorporación de glucosa y ácidos grasos por los adipocitos, activando el metabolismo lipídico en hígado, reduciendo los triglicéridos y el colesterol plasmáticos127,128.
Rimonabant (SR141716, Acomplia®):
(Figura 10) En 1994 se produjo un cambio en la percepción del sistema endocabinoide como blanco en el tratamiento de la obesidad al revelar al antagonista selectivo del receptor CB1 Rimonabant; este evita o revierte rápidamente los efectos inducidos por la estimulación de los receptores CB1 tanto in vivo como in Vitro129,130. Dentro de sus características se cuenta que su afinidad para CB1 1000 veces mayor que para CB2. Inicialmente se pensó que dichos efectos eran debidos al antagonismo de los canabinoides endógenos, pero recientemente se descubrió que rimonabant posee actividad agonista inversa131.
La evidencia indica que administración de rimonabant durante 7 días demostró reducir la ingesta alimentaria, la sensación de hambre y el peso corporal en hombres con sobrepeso y obesos. Sin embargo en humanos, el efecto especifico de rimonabant en apetito (reduciendo el valor hedónico de los alimentos, reduciendo su palatabilidad o aumentando la sensación de saciedad) no ha sido aun completamente esclarecido132. El mecanismo responsable del rápido desarrollo de tolerancia a los efectos anoréxicos que ocurre durante la administración crónica de rimonabant no ha sido claramente establecido133. Aunado a esto, cuando los efectos de rimonabant fueron estudiados en pacientes obesos de alto riesgo o pacientes con sobrepeso con dislipidemias, se demostró que aumentó significantemente (dentro de otros marcadores biológicos) los niveles de adiponectina134,135. Un estudio reciente demostró que rimonabant es capaz de inhibir la proliferación y retrasar la maduración de pre-adipocitos de ratón en cultivo; este pudiese ser una propiedad adicional de rimonabant como compuesto antiobesidad, particularmente asociado al efecto reductor de masa corporal grasa136. Rimonabant parece ejercer un efecto directo en el consumo de energía lo cual indica que el efecto anti-obesidad de rimonabant pudiese ser en parte causado por un aumento en la producción de calor además de los otros mencionados efectos.
Recientes estudios clínicos en fase III, revelan que rimonabant puede reducir efectivamente el peso corporal y la adiposidad en individuos obesos, además de incrementar significativamente las HDL, la sensibilidad a la insulina y disminuir los niveles plasmáticos de triacilglicéridos137,138.
Referencias
1. Eckel RH, Yost TJ. Weight reduction increases adipose tissue lipoprotein lipase responsiveness in obese women. J Clin Invest 1987; 80:992-997. [ Links ]
2. Eckel RH, Yost TJ, Jensen DR. Sustained weight reduction in moderately obese women results in decreased activity of skeletal muscle lipoprotein lipase. Eur J Clin Invest. 1995; 6:396-402. [ Links ]
3. World Health Organization. Obesity: Preventing and Managing the Global Epidemic. World Health Organization: Geneva 1998. [ Links ]
4. Kopelman PG, finer N. Reply: Is obesity a disease?. International Journal of Obesity and Related Metabolic Disorders, 2001; 25:1405-1406. [ Links ]
5. Andersen T, Stokholm KH, Backer OG, Quaade F. Long term (5 year) results after either horizontal gastroplasty or very-low-calorie diet for morbid obesity. Int J Obesity 1988; 12:277-284. [ Links ]
6. Wing RR, Hill JO. Successful weight loss maintenance. Annu Rev Nutr. 2001;21:323-341. [ Links ]
7. Guidance for Treatment of Adult Obesity. Bethesda, MD: Shape Up America and American Obesity Association, 1996 [ Links ]
8. Executive summary of the clinical guidelines on the identification, evaluation, and treatment of overweight and obesity in adults. Arch Intern Med 1998; 158:185567. [ Links ]
9. Screening for obesity. Guide to clinical preventive services: report of the US Preventive Services Task Force, 2nd ed.Washington: US Preventive Services. Task Force, 1996: 21929. [ Links ]
10. Nawaz H, Katz DL. American College of Preventive Medicine Practice policy statement. Weight management counseling of overweight adults. Arch. J Prev Med 2001; 21:738. [ Links ]
11. Hitchcock P, Pugh J. Clinical Review: Management of overweight and obese adults. BMJ. 2002; 325: 757-761. [ Links ]
12. Prentice AM, Jebb SA. Obesity in Britain: gluttony or sloth?. BMJ 1995; 311(7002):437-9. [ Links ]
13. DiPietro L. Physical activity, body weight, and adiposity: an epidemiologic perspective. Exerc Sport Sci Rev. 1995;23:275-303. [ Links ]
14. Klem ML, Wing RR, McGuire MT, Seagle HM, Hill JO. A descriptive study of individuals successful at long-term maintenance of substantial weight loss. Am J Clin Nutr. 1997 Aug; 66 (2):239-46. [ Links ]
15. Schoeller DA, Shay K, Kushner RF. How much physical activity is needed to minimize weight gain in previously obese women?. Am J Clin Nutr 1997; 66(3):551-6. [ Links ]
16. Coakley EH, Rimm EB, Colditz G, Kawachi I, Willett W. Predictors of weight change in men: results from the Health Professionals Followup Study. Int J Obes Relat Metab Disord. 1998 Feb; 22(2):89-96. [ Links ]
17. Wing RR, Hill JO. Successful weight loss maintenance. Annu Rev Nutr. 2001; 21:323-41. [ Links ]
18. Saris WH. Exercise with or without dietary restriction and obesity treatment. Int J Obes Relat Metab Disord. 1995;19 (4):113-6. [ Links ]
19. Garrow JS, Summerbell CD. Meta-analysis: effect of exercise, with or without dieting, on the body composition of overweight subjects. European Journal of Clinical Nutrition, 1995; 49(1):1-10. [ Links ]
20. Wing RR. Physical activity in the treatment of the adulthood overweight and obesity: current evidence and research issues. Med Sci Sports Exerc. 1999Nov; 31(11): 547-52. [ Links ]
21. Pi-Sunyer X. Guidelines for the approval and use of obesity drugs. North American Association for the Study of Obesity. Obesity Task Force. AACE/ACE position statement on the prevention, diagnosis, and treatment of obesity. Endocr Pract. 1997;3:162-208. Revision, 1998: http://www.aace.com/clinguideindex.htm [ Links ]
22. Anorectic usage guidelines. American Society of Bariatric Physicians. Englewood, CO. 1998. [ Links ]
23. Clinical Guidelines on the Identification, Evaluation, and Treatment of Overweight and Obesity in Adults - The Evidence Report. Obesity Research 6(2):51S-209S, 1998. [ Links ]
24. Atkinson R. Clinical Guidelines on the Identification, Evaluaion, and Pharmacologic Tratament of Obesity in Adults. 2003: Chapter 15b [ Links ]
25. Stunkard AJ, McLauren-Hume M. The results of treatment for obesity. Arch Intern Med 103:79–85. [ Links ]
26. Trulson MF, Wasloh ED, Caso EK. A study of obese patients in a nutrition clinic. JAMA, 23:941–946. [ Links ]
27. Feinstein AR. The treatment of obesity: an analysis of methods,results and factors which influence success. J Chronic Disord 11:349–393. [ Links ]
28. Scoville BA Review of amphetamine-like drugs by the Food and Drug Administration: clinical data and value judgments. In: Obesity in Perspective. DHEW Publication No (NIH) 75–708. [ Links ]
29. Atkinson RL. Proposed standards for judging the success of the treatment of obesity. Ann Intern Med 1993; 119:677–680. [ Links ]
30. Bray GA. Evaluation of drugs for treating obesity. Obes Res 1995; 3:425–434. [ Links ]
31. Atkinson RL, Greenway FL, Bray GA, Dahms WT, Molitch M, Hamilton K, Rodin J. Treatment of obesity: comparison of physician and nonphysician therapists using placebo and anorectic drugs in a double blind trial. Int J Obes 1:113–120. [ Links ]
32. Dahms WT, Molitch ME, Bray GA, Greenway FL, Atkinson RL, Hamilton K. Treatment of obesity: cost-benefit assessment of behavioral therapy, placebo and two anorectic drugs. Am J Clin Nutr 31(5):774–778. [ Links ]
33. Food and Drug Administration Guidance for the Clinical Evaluation of Weight Control Drugs.Food and Drug Administration,Rockville,MD 1996. [ Links ]
34. European Agency for the Evaluation of Medicinal Products Committee for Proprietary Medicinal Products (CPMP) Clinical Investigation of drugs used in weight control. The European Agency for the Evaluation of Medicinal Products. London, UK. 1997. [ Links ]
35. Blackburn L, Miller D, Chan S. Pharmacutical treatment of Obesity. Nurs Clin North Am 1997; 32:831-848. [ Links ]
36. Bray GA The Obese Patient. W.B. Saunders, Philadelphia.1976 [ Links ]
37. Schwartz H Never satisfied. A cultural history of diets, fantasia and fat. Doubleday, New York. 1986 [ Links ]
38. Bray GA Historical framework for the development of ideas about obesity. In: Bray GA, Bouchard C, James WPT (eds) Handbook of Obesity. Marcel Dekker, Inc, New York, pp 1–29.1998. [ Links ]
39. Rivlin RS. Therapy with Hormones. Nengl J Med 1975; 292:26-29. [ Links ]
40. Tainter ML, Stockton AB, Cutting WC. Use of dinitrophenol in obesity and related conditions. JAMA, 1933; 101:1472-1475. [ Links ]
41. Simkins S. Dinitrophenol and desiccated thyroid in the treatment of obesity. JAMA, 1937; 108:2210-2119. [ Links ]
42. Council on Pharmacy and hemistry. Dinitrophenol not acceptable for N.N.R. JAMA, 1935; 105:31-33. [ Links ]
43. Lesses MF, Myerson A. Human autonomic pharmacology XVI: Benzedrine sulfate as an aid in the treatment of obesity. New Engl J Med 1938; 218:119–124. [ Links ]
44. Kaplan NM, Jose A. Thyroid as an adjuvant to amphetamine therapy of obesity: A controlled double-blind study. Am J Med Sci 1970; 260:105–110. [ Links ]
45. Kattus Jr AA, Biscoe BW, Dashe AM, Davis JH. Spurious heart disease induced by digitalis-containing reducing pills. Arch Intern Med 1968; 122:298–304. [ Links ]
46. Jelliffe RW, Hill D, Tatter D, Lewis Jr E. Death from weight-control pills. A case report with objective postmortem confirmation. JAMA, 1969; 208:1843–1847. [ Links ]
47. Gurtner HP. Aminorex and pulmonary hypertension. A review. Cor Vasa 1985; 27:160–171. [ Links ]
48. Smith HJ, Roche AHG, Jagusch MF, Herdson PB. Cardiomyopathy associated with amphetamine administration. Am Heart J 1976; 91:792–797. [ Links ]
49. Connolly HM, Crary JL, McGoon MD, Hensrud DD, Edwards BS, Edwards WD, Schaff HV. Valvular heart disease associated with fenfluramine-phentermine. N Engl J Med 1997;337:581–588. [ Links ]
50. Roncari DA. Relationships between the hypothalamus and adipose tissue mass. Adv Exp Med Biol. 1991; 291: 99-105. [ Links ]
51. Williams G, Harrold JA, Cutler DJ. The hypothalamus and the regulation of energy homeostasis: lifting the lid on a black box. Proc Nutr Soc. 2000Aug; 59(3):385-396. [ Links ]
52. Berthoud HR. Multiple neural systems controlling food intake and body weight. Neurosci Biobehav Rev. 2002Jun;26(4):393-428. [ Links ]
53. Bray GA. Peptides affect the intake of specific nutrients in the sympathetic nervous system. Am J Clin Nutr 1992; 55:265-271. [ Links ]
54. Leibowitz SF. Brain peptides and obesity: pharmacologic treatment. Obesity Res 3(Suppl 4):573S-589S, 1995. [ Links ]
55. Yanovski SZ, Yanovski JA. Obesity. N Engl J Med. 2002Feb21;346(8):591-602. [ Links ]
56. Leibowitz SF. Reciprocal hunger-regulating circuits involving a- and b-adrenergic receptors located, respectively, in the ventromedial and lateral hypothalamus. Proc Natl Acad Sci USA 1970; 67: 1063–1070. [ Links ]
57. Wellman PJ. A review of the physiological bases of the anorexic action of phenylpropanolamine (l-norephedrine). Neurosci B 1990;14:339–355. [ Links ]
58. Anonymous. Physicians Desk Reference. Medical Economics Co, Montvale, NJ, p 435 (Terazosin). 1997 [ Links ]
59. Sax L. Yohimbine does not affect fat distribution in men. Int J Obes 1991;15:561–565. [ Links ]
60. Yamashita J, Onai T, York DA, Bray GA. Relationship between food intake and metabolic rate in rats treated with b-adrenergic agonists. Int J Obes Relat Metab Disord 1994; 18:429–433. [ Links ]
61. Tsujii S, Bray GA. Food intake of lean and obese Zucker rats following ventricular infusions of adrenergic agonists. Brain Res 1992; 587:226–232. [ Links ]
62. Susulic VS, Frederic RC, Lawitts J, Tozzo E, Kahn BB, Harper ME, Himms-Hagen J, Flier JS, Lowell BB. Targeted disruption of the b(3) adrenergic receptor gene. J Biol Chem 1995; 270:9483–9492. [ Links ]
63. Samanin R, Garattini S. Neurochemical mechanism of action of anorectic drugs (review). Pharmacol Toxicol 1993; 73:63–68. [ Links ]
64. Bray GA Contemporary Diagnosis and the Management of Obesity. Handbooks in Health Care, Newton, PA. 1998 [ Links ]
65. Nichols DE. Studies of the relationship between molecular structure and hallucinogenic activity. Pharmacol Biochem Behav 1986; 24:335–340. [ Links ]
66. Lemaire d, Jacob P, Shulgin AT. Ring-substituted b-methoxyphenethylamines: a new class of psychotomimetic agents active in man. J Pharm Pharmaco 1985;37:575–577. [ Links ]
67. Dunn WJ, Wold S. Structure-activity study of b-adrenergic agents using the SIMCA method of pattern recognition. J Med Chem 1978; 21:922–930. [ Links ]
68. Beregi SL, Duhault J. Structure-anorectic activity relationships in substituted phenethylamines. Arzneimittelforschung 1977; 27:116–118. [ Links ]
69. Bray G. Drug Treatment of Obesity. Bailliéres Clinical Endocrinology and Metabolism, 1999;13:131-148. [ Links ]
70. Lang SS, Danforth Jr E, Lien EL. Anorectic drugs which stimulate thermogenesis. Life Sci 1983; 33:1269–1275. [ Links ]
71. Yoshida T, Umekawa T, Wakabayashi Y, Yoshimoto K, Sakane N, Kondo M. Anti-obesity and anti-diabetic effects of mazindol in yellow KK mice: its activating effect on brown adipose tissue thermogenesis. Clin Exp Pharmacol Physiol 1996; 23:476–482. [ Links ]
72. Lupien JR, Bray GA. Effect of mazindol, d-amphetamine and diethylpropion on purine nucleotide binding to brown adipose tissue. Pharmacol Biochem Behav 1986; 25:733–738. [ Links ]
73. Smith BK, York DA, Bray GA. Activation of hypothalamic serotonin receptors reduced intake of dietary fat and protein but not carbohydrate. Am J Physiol 1999; 277:R802–R811. [ Links ]
74. Dourish CT. Multiple serotonin receptors: opportunities for new treatments for obesity?. Obes Res. 1995; (4):449–462. [ Links ]
75. Dryden S, Wang Q, Frankish HM, Williams G. Differential effects of the 5-HT1B/2C receptor agonist mCPP and the 5-HT1A agonist flesinoxan on hypothalamic neuropeptide Y in the rat: evidence that NPY may mediate serotonins effects on food intake. Peptides, 1996; 17:943–949. [ Links ]
76. Guy-Grand B, Apfelbaum M, Crepaldi G, Gries A, Lefebvre P, Turner P. International trial of long-term dexfenfluramine in obesity. Lancet, 1989; 2:1142-1145. [ Links ]
77. Goldstein DJ, Potvin JH. Long-term weight loss: the effect of pharmacologic agents. Am J Clin Nutr 1994;60:647-657. [ Links ]
78. Willey KA, Molyneaux LM, Overland JE, Yue DK. The effects of dexfenfluramine on blood glucose control in patients with type 2 diabetes. Diabet Med 1992; 9:341-343. [ Links ]
79. Hudson KD. The anorectic and hypotensive effect of fenfluramine in obesity. J R Coll Gen Pract 1977;27:497-501. [ Links ]
80. Weintraub M, et al. Long term weight control study: I-VII and conclusión. Clin Pharmacol Ther 1992; 51: 581-646. [ Links ]
81. Cheetham SC, Viggers JA, Slater NA, Heal DJ. [3H] Paroxetine binding in rat frontal cortex strongly correlates with, [3H] 5-HT uptake: effects of administration of various antidepressant treatments. Neurophamarcol 1993; 32:737-743. [ Links ]
82. Cheetham SC, Viggers JA, Butler SA, Prow MR, Heal DJ . [3H] Nisoxetine– a radioligand for noradrenaline reuptake sites: correlation with inhibition of [3H] noradrenaline uptake and effcts of DSP-4 lesioning and antidepressant treatments. Neurophamarcol 1996; 35:63-70. [ Links ]
83. Stock Mj. Sibutramine: a review of the pharmacology of a novel antiobesity agent. Int J Obesity. 1997; 21(1): 25-29. [ Links ]
84. Buckett WR, Thomas PC, Luscombe GP. The pharmacology of sibutramine hydrochloride (BTS 54 524 ), a new antidepressant which induces rapid noradrenergix down-regulation. Prog Neuropsychopharmacol Biol Psych 1988; 12: 575-584. [ Links ]
85. Halford JCG, Wanninaye SC, Blundell JE. Behavioral saciety sequence (BSS) for the diagnosis of drug action on food intake. Pharmacol Biochem Behavior 1998; 61:159-168. [ Links ]
86. Bray GA, Blackbum GL, Fergusson JM, et al. Sibutramine produces dose-related weight loss. Obes Res 1999; 7: 189-198. [ Links ]
87. Fujioka K, Seaton TB, Rowe E, et al. Weight loss with sibutramine improves glicemic control and other metabolic parameters in obese patients with type 2 diabetes mellitus. Diabetes Obes Metab 2000; 2:175-187. [ Links ]
88. Mc Mahon FG, Fujioka K, Singh BN, et al. Efficacy and safety of sibutramine in obese white and African American patients with hypertension: a 1 year double blind, placebo controlled, multicenter trial. Arch Intern Med 2000; 160: 2185-2191. [ Links ]
89. Jones SP, Smith IG, Kelly F, Grey GA. Long term weight loss with sibutramine. Int J Obes 1995; 19 (2): 41. [ Links ]
90. Smith IG, Goulder MA. Randomized placebo control trial of long term treatment with sibutramine in mild to moderate obesity. J Fam Pract 2001; 50 (6):505-512. [ Links ]
91. James WP, Astrup A, Finer N, et al. Effect of sibutramine on weight maintenance after weight loss: a randomised trial. Lancet, 2000; 356: 2119-2125. [ Links ]
92. Bellido D, Rosendo JM, Jodar E y Garrido J. Comparación de dos pautas de tratamiento con sibutramina (continua e intermitente) en el mantenimiento a largo plazo de la pérdida de peso. 44 Congreso Nacional de la Sociedad Española de Endocrinología y Nutrición. Alicante, Mayo 2002. [ Links ]
93. Fanghanel G, Cortinas L, Sanchez Reyes, Barbera A. A clinical trial of the use of sibutramine for the treatment of patients suffering essential obesity. Int J Obes Relat Metab Disord 2000; 24: 144-150. [ Links ]
94. Nisoli E, Carruba MO. An assement of the safety and efficacy of sibutramine, an anti-obesity drug with a novel mechanism of action. Obesity Rew 2000; 1: 127-139. [ Links ]
95. Bray GA, Blackburn GL, Fergunson JM, Greenway FL, Jain AK, Mendel CM, Mendels J, Ryan DH, Schwartz Sl, Scheinbaum Ml, Seaton TB. Sibutramine produces doses-related weigth loss. Obesity Res 1999;7:189-198. [ Links ]
96. Van Gaal LF, De Wauters MA, Leew IH. Anti- Obesity drugs: what does sibutramine offer? An analisis of its potential contributionto obesity treatments. Exp Clin Endocrinol Diabetes 1998;106: (2): 35-40. [ Links ]
97. Lean MEJ. Sibutramine – a review of clinical efficacy. Int J Obesity 1997; 21: s30-s36. [ Links ]
98. Connoley Ian P, Yong-Ling Liu, Ian Frost, Ian P Reckless, David J Heal, Michael J Stock. Thermogenic efects of sibutramine and its metabolites. British Journal of Pharmacology, 1999; 126: 1487 -1495. [ Links ]
99. Clark D, Harrison M. Sibutramine may be associated with memory impairment. BMJ 2004; 329: 1316. [ Links ]
100. Tonstad S, Pometta D, Erkelens DW, Ose L, Moccetti T, et al. The effect of the gastrointestinal lipase inhibitor, orlistat, on serum lipids and lipoproteins in patients with primary hyperlipidaemia. Eur J Clin Pharmacol 1994;46(5):405-410. [ Links ]
101. Hollander PA, Elbein SC, Hirsch IB, Kelley D, McGill J, et al. Role of orlistat in the treatment of obese patients with type 2 diabetes. A 1-year randomized double-blind study. Diabetes Care, 1998 Aug;21(8):1288-1294. [ Links ]
102. Sjostrom L, Rissanen A, Andersen T, Boldrin M, Golay A, Koppeschaar HP, Krempf M. Randomised placebo-controlled trial of orlistat for weight loss and prevention of weight regain in obese patients. European Multicentre Orlistat Study Group. Lancet, 1998 Jul 18;352(9123):167-72. [ Links ]
103. Van Gaal LF, Broom JI, Enzi G, Toplak H. Efficacy and tolerability of orlistat in the treatment of obesity: a 6-month dose-ranging study. Orlistat Dose-Ranging Study Group. Eur J Clin Pharmacol 1998Apr;54(2):125-132. [ Links ]
104. Guerciolini R. Mode of action of orlistat. Int J Obes Relat Metab Disord 1997; 21: 12–23. [ Links ]
105. Hadvary P, Lengsfield H, Wolfer H. Inhibition of pancreatic lipase in vitro by the covalent inhibitor tetrahydrolipstatin. Biochem J 1998; 256:357–361. [ Links ]
106. Sjöstrom L, Rissanen A, Andersen T, et al. Radomised placebo-controlled trial of orlistat for weight loss and prevention of weight regain in obese patients. Lancet, 1998; 352: 167-172. [ Links ]
107. Davidson MH, Hauptman J, DiGIrolamo M, et al. Weight control and risk factor reduction in obese subjects treated for 2 years with orlistat: a randomized controlled trial. JAMA, 1999;281:235-242. [ Links ]
108. Karhunen L, Franssila-Kallunki A, Rissanen P, Valve R, Kolehmainen M, Rissanen A, Uusitupa M. Effect of orlistat treatment on body composition and resting energy expenditure during a two-year weightreduction programme in obese Finns. Int J Obesity 2000; 24: 1567-1572. [ Links ]
109. Tonstad S, Pornetta D, Erkelens DW. The effects of gastrointestinal lipase inhibitor, orlistat, on serum lipids and lipoproteins in patients with primaty hyperlipidaemia. European Journal of Clinical Pharmacology, 1994; 46: 405-410. [ Links ]
110. Heck AM, Yanovski JA, Calis KA. Orlistat, a new lipase inhibitor for the management of obesity. Pharmatherapy, 2000; 20:270-279. [ Links ]
111. Hill JO, Hauptman J, Anderson JW, et al. Orlistat, a lipase inhibitor, for weight maintenance after conventional dieting: a 1-year study. Am J Clin Nutr 1999; 69:1108-1116. [ Links ]
112. Sjöstrom L, Rissanen A, Andersen T, et al. Radomised placebo-controlled trial of orlistat for weight loss and prevention of weight regain in obese patients. Lancet, 1998; 352: 167-172. [ Links ]
113. Davidson MH, Hauptman J, DiGIrolamo M, et al. Weight control and risk factor reduction in obese subjects treated for 2 years with orlistat: a randomized controlled trial. JAMA, 1999;281:235-242. [ Links ]
114. Karhunen L, Franssila-Kallunki A, Rissanen P, Valve R, Kolehmainen M, Rissanen A, Uusitupa M. Effect of orlistat treatment on body composition andresting energy expenditure during a two-year weight reduction programme in obese Finns. Int J Obesity 2000; 24: 1567-1572. [ Links ]
115. Hollander PA, Elbein SC, Hirsch IB, et al. Role of orlistat in the treatment of obese patients with type 2 diabetes: a l-year randomized double-blind trial. Obes Res 1999; 7: 363-369. [ Links ]
116. Zhi J, Melia AT, Funk C, et al. Metabolic profiles of minimally absorbed orlistat in obese/overweigth volunteers. Journal of Clinics Pharmacology, 1996; 36:1006-1011. [ Links ]
117. Melia AT, Zhi J, Koss-Twardy SG. The influence of reduced dietary absorption induced by orlistat on the pharmacokinetics of digoxin in healthy volunteers. Journal of Clinics Pharmacology, 1995; 35: 840-843. [ Links ]
118. Zhi J, Melia AT, Koss-Twardy SG, et al. The influence of orlistat on the pharmacokinetics and pharmacodynamics of glyburide in healthy volunteers. Journal of Clinics Pharmacology, 1995; 35:521-525. [ Links ]
119. Guerciolini R. Mode of action of Orlistat. International Journal of Obesity, 1997; 21:s12-s23. [ Links ]
120. Webwe C, Tam YK, Schmidtke–Schrezenmeier G, et al. Effect of the lipase inhibitor Orlistat on the pharmacokinetics or four different antihypertensive drugs in healthy volunteers. European Journal Of Clinical Pharmacology, 1996;51:87-90. [ Links ]
121. Gaoni Y, Mechoulam R. Isolation, structure and partial synthesis of an active constituent of hashish. J Am Chem Soc 1964; 86: 1646. [ Links ]
122. Piomelli D. The molecular logic of endocannabinoid signalling. Nat Rev Neurosci 2003Nov;4(11):873-84. Review. [ Links ]
123. Devane WA, Hanus L, Breuer A, Pertwee RG, Stevenson LA, Griffin G, et al. Isolation and structure of a brain constituent that binds to the cannabinoid receptor. Science, 1992;258:1946-9. [ Links ]
124. Howlett AC. Pharmacology of cannabinoid receptors. Annu Rev Pharmacol Toxicol 1995;35:607-633. [ Links ]
125. Di Marzo V, Melck D, Bisogno T, De Petrocellis L. Endocannabinoids: endogenous cannabinoid receptor ligands with neuromodulatory action. Trends Neurosci 21:521-8. [ Links ]
126. Piomelli D, Giuffrida A, Calignano A, Rodríguez de Fonseca F. The endocannabinoid system as a target for therapeutic drugs. TIPS 2000;21:218-24. [ Links ]
127. Fu J, Gaetani S, Oveisi F, Lo Verme J, Serrano A, Rodriguez De Fonseca F, et al. Oleylethanolamide regulates feeding and body weight through activation of the nuclear receptor PPAR-alpha. Nature, 2003Sep;425(6953):90-3. [ Links ]
128. Calignano A, La Rana G, Piomelli D. Antinociceptive activity of the endogenous fatty acid amide, palmitylethanolamide. Eur J Pharmacol 2001;419:191-8. [ Links ]
129. Rinaldi-Carmona M, Barth F, Heaulme M, Shire D, Calandra B, Congy C, Martinez S, Maruani J, Neliat G, Caput D, et al. SR141716A, a potent and selective antagonist of the brain cannabinoid receptor. FEBS Lett 1994; 350: 240-244. [ Links ]
130. Rinaldi-Carmona M, Barth F, Heaulme M, Alonso R, Shire D, Congy C, Soubrie P, Breliere J, Le Fur G. Biochemical and pharmacological characterisation of SR141716A, the first potent and selective brain cannabinoid receptor antagonist. Life Sci 1995; 56: 1941-1947. [ Links ]
131. MacLennan S, Reynen P, Kwan J, Bonhaus D. Evidence for inverse agonism of SR141716A at human recombinant cannabinoid CB1 and CB2 receptors. Br J Pharmacol 1998; 124: 619-622. [ Links ]
132. Heshmati H, Caplain H, Heshmati H, Bellisle F, Mosse M, Fauveau C, Le Fur G. SR141716, a selective cannabinoid CB1 receptor antagonist, reduces hunger, caloric intake and body weight in overweight and obese men. Obes Res 2001; 9: O69. [ Links ]
133. Kirkham T. Endocannabinoids in the regulation of appetite and body weight. Behav Pharmacol 2005; 16: 297-313. [ Links ]
134. Bensaid M, Gary-Bobo M, Esclangon A, Maffrand J, Le Fur G, Oury-Donat F, Soubrie P. The cannabinoid CB1 receptor antagonist SR141716 increases Acrp30 mRNA expression in adipose tissue of obese fa/fa rats and in cultured adipocyte cells. Mol Pharmacol 2003; 63: 908-914. [ Links ]
135. Despres J, Golay A, Sjostrom L. Effects of rimonabant on metabolic risk factors in overweight patients with dyslipidemia: Rimonabant in Obesity-Lipids Study Group. N Engl J Med 2005; 353: 2121-2134. [ Links ]
136. Gary-Bobo M, Elachouri G, Scatton B, Le Fur G, Oury-Donat F, Bensaid M. The cannabinoid CB1 receptor antagonist rimonabant (SR141716) inhibits cell proliferation and increases markers of adipocyte maturation in cultured mouse 3T3 F442A preadipocytes. Mol Pharmacol 2006; 69: 471-478. [ Links ]
137. Van Gaal L, Rissanen A, Scheen A, Ziegler O, Rossner S. Effects of the cannabinoid-1 receptor blocker rimonabant on weight reduction and cardiovascular risk factors in overweight patients: 1-year experience from the RIO-Europe study. RIO-Europe Study Group. Lancet, 2005; 16: 1389-1397. [ Links ]
138. Vickers S, Kennett G. Cannabinoids and the regulation of ingestive behaviour. Curr Drug Targets 2005; 6: 215-223. [ Links ]