Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT v.26 n.2 Caracas 2007
Marcadores biológicos de estrés oxidativo.
Distribución por edad y sexo de las concentraciones basales de MDA, NO y ácido úrico en niños y adolescentes de Maracaibo-Venezuela
*Souki A, *Cano C, *Mengual E, ▪García D, *Torres D, *Almarza J, *Urdaneta Y, ♦León L, ♦Chávez Z, ♦Molero E, *Medina M, *Amell A.
*Centro de Investigaciones Endocrino-Metabólicas "Dr. Félix Gómez". Facultad de Medicina. Universidad del Zulia (LUZ). Maracaibo-Venezuela.
▪Escuela de Nutrición y Dietética. Facultad de Medicina. Universidad del Zulia (LUZ). Maracaibo-Zulia. Venezuela.
♦Ambulatorio Urbano Tipo III "La Victoria". Parroquia Carracciolo Parra Pérez. Maracaibo-Zulia. Venezuela
Recibido: 25/6/2007 Aceptado: 3/8/2007
Resumen
Aunque el malondialdehído (MDA), óxido nítrico (ON) y el ácido úrico están siendo utilizados con mayor frecuencia como marcadores biológicos confiables del estrés oxidativo, no han sido estudiados en niños y adolescentes sanos, por esta razón el objetivo del presente estudio fue describir el comportamiento de estos parámetros en una muestra de niños y adolescentes sanos de Maracaibo, Estado Zulia, Venezuela. Luego de la evaluación nutricional y clínica, fueron seleccionados 256 individuos sanos (120 femeninos y 136 masculinos) con edad promedio de 10,67± 0,29 años; divididos según el sexo en 4 grupos etarios, 2-5, 6-9, 10-13 y 14-18 años para determinarles las concentraciones séricas basales de MDA, NO y ácido úrico. Para el análisis estadístico se utilizaron las pruebas ANOVA de un factor (Tukey post hoc) y "t" de student para impares según el caso, considerándose significativo un valor de p< a 0,05. Con relación al MDA se observaron niveles significativamente mas altos en el total de los individuos masculinos comparados con el total de los femeninos (p<0,001); al comparar internamente los subgrupos se observó niveles significativamente mas bajos (p<0,01) en el femenino de 2-5 años comparado con el de 10-13 y 14-18 años y niveles significativamente mas altos (p<0,001) en los masculinos de 10-13 años y 14-18 años con relación a los de 2-5 años y 6-9 años. Para el NO solo se evidenció un aumento significativo (p<0,03) en el subgrupo masculino de 2-5 años comparado con el de 6-9 años. El ácido úrico sérico fue más alto (p<0,001) en el grupo masculino que en el femenino, siendo la concentración sérica más alta la de los subgrupo masculino y femenino de 14-18 años al compararlo con los otros grupos etarios del mismo sexo. Los resultados sugieren que en la muestra estudiada el sexo masculino presenta marcadores de stress oxidativo más elevados que el femenino estando dicho incremento influenciado por la edad en ambos grupos.
Palabras claves: estrés oxidativo, niños y adolescentes, oxidación/antioxidación.
Abstract
Despite recognition of the detrimental effects of malondialdehyde (MDA), nitric oxide (NO) and uric acid on oxidative stress, this hypothesis has not yet been tested in healthy children and adolescents. The objective of the present study was to describe the behavior of these parameters, in a sample of healthy children and adolescents from Maracaibo, Zulia State, Venezuela. After physical and nutritional examination, blood samples were collected from 256 healthy subjects (136 boys and 120 girls) age average of 10,67± 0,29 years; divided according to the sex in 4 groups of age 2-5, 6-9, 10-13 and 14-18 years, to determinate basal serum levels of MDA, NO and uric acid. For the statistical analysis there were used the one factor ANOVA tests (Tukey post hoc) and "t" test student for independent observations according to the case, a value being considered to be significant of p < to 0,05. Results showed that serum MDA levels were significantly higher in the male than female subjects (p<0.001); MDA levels were significantly lower (p<0.01) in the girls subgroup of 2-5 years when compared to subgroups of ages 10-13 and 14-18 years, while levels were significantly higher (p<0.01) in boys aged from 10-13 and 14-18 years when compared to boys aged from 2- 5 and 6- 9 years. The 2-5 year old boys had significantly higher NO levels (p<0.03) than the 6-9 year old group. The group of boys had significantly higher (p<0.001) uric acid levels than girls. The highest levels of uric acid were seen in both boys and girls aged 14-18 years. The present study suggests that there exists an increased oxidative stress in boys compared to girls being the increase influenced by the age in both groups.
Key works: oxidative stress, children and adolescents, oxidation/antioxidation.
Introducción
La ruptura del balance oxidación/antioxidación en el organismo, es una condición en la cual las defensas antioxidantes celulares son inadecuadas para degradar completamente las sustancias oxidantes generadas -especies reactivas del oxígeno (ERO) y del nitrógeno (ERN)-, debido a una excesiva producción de ERO y ERN, a la pérdida de defensas antioxidantes o ambas, lo que ocasiona daño a las proteínas, ácidos nucleicos y a los lípidos insaturados, pudiendo comprometer la salud y viabilidad celular. Además puede originar una gran variedad de respuestas celulares que implican la generación de otras especies reactivas secundarias que en último caso conducen a la muerte celular por necrosis o apoptósis.1,2
Las sustancias oxidantes en los organismos vivos pueden provenir de una gran variedad de fuentes tanto endógenas como exógenas. Las fuentes exógenas incluyen la contaminación ambiental, los gases naturales deletéreos como el oxígeno hiperbárico, los efectos de la radiación ionizante y no ionizante, químicos, toxinas, bacterias patógenas y virus. Las fuentes endógenas incluyen reacciones y enzimas que pueden producir de forma directa o indirecta ERO y ERN, tales como la reacción de Fentón, la xantina oxidasa, la sintetasa del óxido nítrico y los neutrófilos.3,4
El sistema de defensa antioxidante de las células vivas, constituye un mecanismo adaptativo de gran relevancia y puede ser clasificado en dos grupos principales: el de enzimas que incluyen la superóxido dismutasa, catalasa, peroxidasa y algunas enzimas de soporte, y el grupo de los antioxidantes de bajo peso molecular (ABPM), con un gran número de componentes capaces de disminuir la oxidación por medio de la interacción directa o indirecta con los ERO entre los cuales tenemos la Vitamina E (Vit E), la Vitamina C (Vit C), el glutatión (GSH) y el Acido úrico (AU).4
El estrés oxidativo de los organismos vivos puede ser evaluado mediante la utilización de marcadores biológicos; los cuales se definen como características que pueden ser medidas y valoradas de forma objetiva como indicadores de los procesos biológicos normales, de los procesos patogénicos o de las respuestas farmacológicas a un tratamiento terapéutico. El estrés oxidativo puede ser evaluado a través de la determinación de la peroxidación lipídica y de la capacidad antioxidante. La primera implica, la valoración plasmática de sustancias reactivas al ácido tiobarbitúrico como el Malondialdehido (MDA), la medición de alcanos exhalados (etano, propano y metano) y la oxidación del plasma (oxidación de la lipoproteína de baja densidad). La segunda esta relacionada con la determinación de las enzimas y moléculas antioxidantes entre las cuales podemos mencionar al ácido úrico.1-5
Hasta hace algunos años la investigación clínica en el área de peroxidación lipídica, había estado en desventaja debido a la falta de marcadores biológicos validos. En la actualidad uno de los marcadores utilizado con mayor frecuencia es el MDA plasmático, el cual se forma principalmente por la descomposición de los peróxidos de los ácidos grasos con tres o más dobles enlaces. Sin embargo su adecuada utilización requiere de intervalos de referencia que sean confiables provenientes de una población humana no seleccionada y que tome en consideración la influencia de la edad y el sexo, así como también otras variaciones especificas de la población.6 La mayor parte de los valores de referencia para MDA si bien se han diferenciado por edad y sexo provienen de grupos de donantes seleccionados.7
El acido úrico, si bien ha sido utilizado durante muchos años en la práctica clínica como un indicador de numerosas alteraciones metabólicas, sus propiedades como antioxidante solo han sido consideradas recientemente. Su concentración plasmática es 10 veces mayor que las de otros antioxidantes tales como la Vit C y Vit E lo cual le confiere mayor capacidad antioxidante.8 Su forma soluble en el plasma -el urato- capturara el ión radical superoxido (O.-), el radical hidroxilo (OH.), el oxígeno singlete y es capaz de quelar metales de transición. También es capaz de inhibir la reacción entre el oxido nítrico (NO) y el O.- para formar peroxinitrito, sustancia sumamente toxica que puede causar daño celular por nitración de los residuos de tirosina de las proteínas. De igual forma el AU es capaz contribuir a mantener los niveles de NO y la función endotelial al prevenir la degradación de la enzima superoxido dismutasa extracelular, enzima que juega un papel fundamental en el mantenimiento de la función vascular y endotelial, al remover el O.- evitando la reacción e inactivación del NO.3,4
Por otra parte el NO, considerado como un radical libre inestable; juega un importante papel en la regulación de la peroxidación lipídica inducida por los ERO (O2.-, OH., H2O2 y el radical peróxilo). El NO en algunos casos estimula la oxidación lipídica y en otros puede actúa como mediador de las reacciones que protegen las membranas de la oxidación, al inhibir la peroxidación lipídica inducida por el superoxido y peroxinitrito. El NO promueve la oxidación cuando su tasa de síntesis es menor o equivalente a la tasa de síntesis del ión radical superoxido; por el contrario cuando su tasa de síntesis es mayor a la del superoxido inhibe la peroxidación lipídica y por lo tanto la formación de MDA. Esta ultima reacción requiere una síntesis elevada de NO. El NO puede actuar de forma similar a la Vit E, como un posible inhibidor de las reacciones de propagación de radicales libres a través de una reacción radical-radical con especies citotóxicas como los radicales alcóxilo y peróxilo.9
Si bien el MDA, NO y el AU están siendo utilizados cada vez con mayor frecuencia como marcadores biológicos confiables del estrés oxidativo, estos no han sido suficientemente estudiados en niños y adolescentes sanos, existiendo información limitada en cuanto a los cambios que ocurren en estos parámetros relacionados a la edad y el sexo en este grupo poblacional; por esta razón el propósito del presente estudio preliminar, fue describir el comportamiento de algunos marcadores de oxidación biológica en un grupo de niños y adolescentes sanos de la ciudad de Maracaibo, Venezuela.
Sujetos y métodos
La presente investigación fue de tipo descriptiva, de diseño transeccional contemporáneo, de campo y multivariable10. Se evaluaron 505 niños y adolescentes (259 hembras y 246 varones), escolarizados, seleccionados al azar en 7 Unidades del Municipio Maracaibo, Estado Zulia, con edades comprendidas entre 2 y 18 años, con un promedio de edad de 11,2 ± 0,22 años, de raza mezclada y pertenecientes a diferentes estratos sociales de acuerdo al método Graffar modificado. Todos ellos participaron en forma voluntaria en el estudio sobre Factores Endocrino-Metabólicos Implicados en el Riesgo para la Aterosclerosis, en el período comprendido entre abril de 2004 y agosto de 2006 y la inclusión en el estudio requirió de la firma de un consentimiento informado por parte de los participantes así como de sus Padres y/o Representantes.
Cada uno de los individuos fue evaluado por un médico especialista en Pediatra y se les elaboró historia clínica completa, la cual proporcionó información sobre antecedentes de enfermedad crónica, medicación, antecedentes familiares de enfermedad cardiovascular y diabetes mellitus. La tensión arterial se midió en dos oportunidades con intervalo de 5 minutos, en el brazo derecho estando el sujeto en posición sentada y utilizando un brazalete adecuado según la circunferencia braquial del individuo. A fin de determinar el estado nutricional de los niños se les tomaron las siguientes medidas antropométricas: peso y talla con las que se determinó el IMC (kg/m2), siendo los puntos de corte los siguientes: bajo peso IMC percentil <10; peso normal IMC percentil ≥10 - <90; sobrepeso IMC percentil 90 – 3DS; obeso IMC ≥3DS,11 además se midieron los pliegues subcutáneos (subescapular, tricipital) y la circunferencia del brazo.12
Aplicando estos criterios se seleccionaron los niños y adolescentes con estado nutricional normal, sanos, sin resultado positivo para enfermedades vasculares, endocrinas, hepáticas, renales o para cualquier enfermedad aguda o crónica; sin utilización de medicamentos antioxidantes, antibióticos y/o esteroides (en el mes anterior al estudio), con la evaluación bioquímica completa y que firmaran el consentimiento informado. Quedando la muestra constituida por 256 individuos sanos, de ambos sexos (120 femenino y 136 masculino), con una edad promedio de 10,67± 0,29 años y se clasificó en 4 grupos etarios: 2-5; 6-9; 10-13; y 14-18 años.
Para la evaluación bioquímica y previo ayuno de 12 horas, se realizó a todos los individuos una extracción de sangre venosa para la determinación de malondialdehído (MDA), óxido nítrico (ON), y Acido Úrico. La determinación del malondialdehído se efectuó mediante la formación de derivados del ácido tiobarbitúrico13. El óxido nítrico se determinó mediante nitritos utilizando el ensayo de diazotización (reacción de Greiss), previa reducción de los nitratos14. El ácido úrico se determinó por el método de enzimático colorimétrico PAP (Human Gesellschaft für Biochemica und Diagnostica mbH). Adicionalmente a cada individuo se le determinó las concentraciones séricas de glucosa, triacilglicéridos, colesterol total y colesterol de HDL-c mediante métodos comerciales colorimétricos (Human Gesellschaft für Biochemica und Diagnostica mbH) a fin de verificar que no padecían ningún desorden metabólico. Todas las muestras fueron procesadas en el Laboratorio Clínico del Centro de Investigaciones Endocrino-Metabólicas "Dr. Félix Gómez" (CIEM). Este protocolo cumplió con las pautas señaladas en la Declaración de Helsinki y fue aprobado por el comité de bioética del CIEM de La Universidad del Zulia en Maracaibo (Venezuela).
La muestra quedó constituida por 256 individuos sanos, de ambos sexos (120 Femenino y 136 Masculino), con una edad promedio de 10,67± 0,29 años y se agruparon en 4 grupos etarios: 2-5; 6-9; 10-13; y 14-18 años. No todos los individuos evaluados al inicio del estudio fueron incluidos en la muestra, entre la razones para su exclusión se encuentran: los resultados de la evaluación del estado nutricional (desnutridos, con sobrepeso u obesos); los resultados de la evaluación clínica y/o bioquímica (sujetos que resultaron positivos para enfermedades vasculares, endocrinas, hepáticas, renales o para cualquier enfermedad aguda o crónica); el cumplimiento de tratamiento farmacológico (utilización de medicamentos antioxidantes, antibióticos y/o esteroides, en el mes anterior al estudio); incumplimiento en la toma de muestras (la no culminación de la evaluación bioquímica) y por ultimo la no disposición de firmar el consentimiento informado.
Análisis Estadístico
Todo el análisis estadístico se realizo utilizando el programa SPSS para Windows, versión 10 (SPSS Inc., Chicago, IL). Para el análisis descriptivo, se utilizaron las medidas de tendencia central y de dispersión: media, error estándar (EE), y percentiles (10, 50, 90). Previa corroboración de la distribución normal de las variables por medio de la prueba de Kolmogorov-Smirnov, se utilizaron para el análisis estadístico las pruebas ANOVA de un factor (Tukey post hoc) y "t" de student para impares según el caso, considerándose significativo un valor de "p" inferior a 0,05.
Resultados
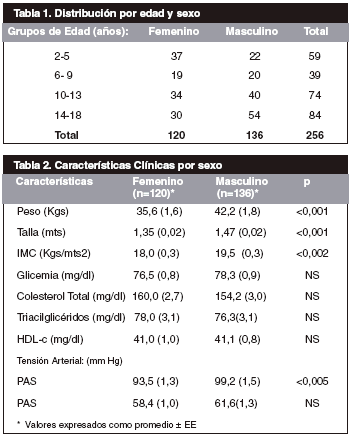
La Tabla 1 presenta la distribución de los 256 sujetos integrantes de la muestra por edad y sexo y en la Tabla 2 se exhiben sus características clínicas de clasificadas por sexo. No se observaron diferencias significativas entre las edades de individuos del sexo femenino y masculino del grupo estudiado. Sin embargo si se encontraron diferencias significativas entre los varones y las hembras en las variables peso, talla, Índice de Masa Corporal (IMC) y Presión Arterial Sistólica (PAS). En la Tablas 3, 4 y 5 se observan la distribución de las concentraciones séricas de MDA, ON y Ácido Úrico en individuos estudiados por edad y sexo.
Malondialdehído
Al comparar el promedio de la concentración sérica de MDA según el sexo se encontró una concentración más alta (p< 0,001) en los varones (1,4 ± 0,07 µM) con relación a las hembras (1,1 ± 0,06 µM). Por otra parte, cuando se analizaron los grupos por edad pero sin diferenciar el sexo, se observaron también diferencias significativas. El malondialdehído muestra una curva ascendente, correspondiendo niveles significativamente más altos a los individuos de 10-13 años y 14-18 años al ser comparados cada uno de estos grupos con los de 2-5 años y con los de 6-9 años (p<0,001). (Ver tabla 3)
Cuando se comparó los diferentes grupos etarios dentro del mismo sexo se pudo evidenciar que las hembras de 2-5 años presentaron niveles significativamente más bajos (p< 0,01) al compararlos con los grupos de 10-13 años y con el de 14-18 años. Con respecto al sexo masculino, el malondialdehído mostró una curva ascendente, correspondiendo niveles significativamente más altos a los individuos de 10-13 años y 14-18 años al compararlos con los de los grupos de 6-9 años y con los de 2-5 años. El grupo 10-13 años vs. 6-9 años con un valor de p<0,01 y vs. el de 2-5 años con un valor de p<0,001. El grupo de 14-18 años vs. el de 6-9 años con un valor de p<0,006 y vs. el de 2-5 años con un valor de p<0,001. (Ver Tabla 3)
Oxido Nítrico
Con respecto al ON solo se encontró una concentración significativamente mas alta (p< 0,03) en el grupo de varones de 2-5 años (27,3 ± 6,2 µM) comparado con el de 6-9 años del mismo sexo (25,8 ± 6,8 µM) (Ver Tabla 4).
Acido Úrico
Los niveles séricos de ácido úrico en el total de individuos estudiados fueron significativamente más elevados (p<0,001) en individuos del sexo masculino que en el femenino, pero al comparar por edad y sexo, solo se encontró cifras de ácido úrico significativamente mas elevadas (p<0,001) entre el sexo masculino y femenino en el grupo 14-18 años de edad.
Se observaron diferencias significativas por edad en los niveles de ácido úrico en los individuos estudiados al comparar grupos sin tomar en cuenta el sexo. El nivel significativamente más alto correspondió al grupo de 14-18 años (p<0,001) al compararlo con los grupos restantes. También se observó diferencias significativas al comparar el grupo de 10-13 años con el de 6-9 años (p<0,01) y con el de 2-5 años (p<0,001). (Ver Tabla 5)
Al comparar la concentración de ácido úrico entre los subgrupos del sexo femenino se encontró niveles significativamente mas elevados (p<0,04) en las del grupo de 14-18 con relación a las de 6-9 años y con las de 2-5 años (p<0,01). En el caso de sexo masculino, los de 14-18 años presentaron valores de acido úrico significativamente mas altos que el resto de los grupo del mismo sexo (p<0,001). También se observó que el grupo de 10-13 presentó valores significativamente superiores (p< 0,01) al compararlo con lo de 2-5 años (Ver Tabla 5)
Discusión
Si bien numerosos trabajos señalan cambios en los niveles de MDA, NO y AU como consecuencia de ciertos estados patológicos en sujetos de edad pediátrica; los estudios donde se evalúen esos mismo parámetros, en niños y adolescentes sanos, son muy escasos y los valores frecuentemente reportados, solo reflejan resultados de estudios realizados donde la población sana es utilizada como control, es decir con fines comparativos en estudios particulares relacionados con algún desequilibrio endocrino-metabólico o patología especifica. Es por ello evidente la importancia, por una parte de conocer los niveles de estos parámetros en grupos sanos de edad pediátrica pero también debe ser considerado relevante obtener información de si dichos parámetros se modifican durante el proceso de crecimiento y desarrollo. Esta información permitirá dar interpretaciones adecuadas, podrán ser utilizadas con fines predictivos de ciertas patologías y para la indicación de terapias antioxidantes adaptadas a las necesidades especificas de los diferentes grupos de edad pediátrica.
Con respecto al malondialdehído se pudo observar en este estudio que el grupo total de varones presento niveles mayores que el grupo total de las hembras. La posible explicación para este resultado podría ser los cambios hormonales que tienen que ver con la etapa de la pubertad, con incremento de los niveles de estradiol en las niñas. La estructura química de los estrógenos, fundamentalmente del 17β-estradiol permite atribuirle un papel antioxidante a esta molécula debido a que el anillo A del estradiol presenta un grupo hidroxilo y también dobles enlaces conjugados. Esta peculiaridad inmediatamente sugiere la posibilidad de una acción antioxidante15,16.
En un estudio llevado a cabo en Brasil con un grupo de 66 niños, con edades comprendidas entre 6 y 15 años de edad, donde los 21 de peso normal (el resto tenia sobrepeso o eran obesos), fueron utilizados como grupo control, se encontró que el grupo de sexo femenino (n=11), con un promedio de edad de 11,51 ± 3,12 años, presento un valor de 1,45 ± 0,31 nmol/dl y el masculino (n=10) con un promedio de edad de 11,24 ± 2,37 años, presento un valor de 1,34 ± 0,51 nmol/dl. Al igual que en nuestro estudio no se reporta diferencia significativa entre sexos para este grupo de edad17.
En relación al NO, un estudio realizado en Turquía con 296 niños sanos de ambos sexos (117 del sexo femenino y 179 del masculino) con edades comprendidas entre 0 y 16 años de edad encontraron que los niveles de NO fueron superiores en los niños de mas corta edad, presentando el valor mas elevado los recién nacidos y observaron una disminución de este parámetro con la edad. Este estudio encontró además que después de los 4 años de edad los niveles de NO fueron casi constantes con muy pequeñas fluctuaciones y que no existen diferencias entre varones y hembras en ningún grupo de edad. Estos resultados concuerdan con nuestros hallazgos en los cuales solo pudo encontrase diferencia significativa entre los varones de 2 a 5 años con los de 6 a 9, correspondiéndole a los de mas corta edad los valores mas altos18.
El NO es sintetizado endogenamente por la NO sintetasa, su vida media es corta en los sistemas biológicos por lo que es rápidamente metabolizado a nitritos y nitratos (NO3). Este ultimo es excretado de forma relativamente lenta y es utilizado como un indicador de la formación de NO. Los autores del estudio anterior plantean que la tendencia a disminuir con la edad tanto de los niveles plasmáticos de NO3 así como su excreción urinaria en niños sanos puede ser un reflejo en el incremento de la tasa de filtración glomerular, lo que parece ser relevante particularmente durante los primeros 4 años de vida. Por otra parte la reducción en los niveles plasmáticos de NO3 y su excreción urinaria coincide también con el incremento de la presión sanguínea relacionado con la edad y que es evidente en el primer año de vida por esta razón una reducción en la actividad en la NO sintetasa con la edad puede explicar en parte la reducción de NO3 y el incremento edad-dependiente en la presión sanguínea en la infancia18.
Con respecto al AU, Alper y col indicaron que comparar por sexo, niños de edad promedio de 13 años pertenecientes a diferentes etnias, se observo que los varones presentaron siempre valores de AU superiores a las hembras19. Los resultados obtenidos por trabajos como los de Costa y col indican que los niveles de acido úrico se incrementan con la edad durante la infancia y que hay una clara diferencia entre varones y hembras en la pubertad. En las niñas parece estabilizase alrededor de los 11 años pero en los varones se incrementa a través de toda la adolescencia. Incremento que ha sido asociado a una disminución en el aclaración renal de acido úrico en la edad púberal. Oyama y col establecen que en los niños japoneses los niveles de acido úrico comienzan a incrementarse entre los 11 a 12 años y aun después en los varones en los cuales los niveles son siempre superiores a los de las niñas de la misma edad. El inicio de la diferencia se corresponde con el inicio del desarrollo púberal de los niños Japoneses20,21.
Por otra parte Wilcox establece que los niveles séricos de AU se incrementan de forma muy lenta en la niñez y permanecen iguales en niños y niñas hasta la adolescencia. Durante la adolescencia la excreción de urato por el riñón declina hasta la encontrada en el adulto y hay un incremento sustancial en la masa corporal. Ambos cambios contribuyen a incrementar los niveles de AU. Durante la adolescencia temprana cuando las niñas tienen mayor peso que los varones de la misma edad, los niveles de AU son ligeramente superiores en las niñas. En la mitad de la adolescencia, ambos peso y niveles de AU en los niños excede al de las niñas, discrepancia que persiste hasta la menopausia y puede ser debida al efecto hipouricemico de los estrógenos22.
En nuestros resultados se pueden observar algunas similitudes y también discrepancias con los resultados de los autores arriba mencionados. Vemos así que las niñas de los grupos menores a 9 años presentaron valores similares a los de los varones de la misma edad. Aunque las del grupo de 10 a 13 años presentaron valores ligeramente inferiores a los de los varones del mismo grupo, la diferencia solo fue significativa entre los grupos (varones y hembras) de 14 a 18 años, donde las niñas presentaron los valores más bajos. En el caso de los varones los niveles de AU sufren incremento a través de toda la adolescencia iniciándose este incremento en el grupo de 10 a 13 años.
Como puede observarse los resultados de este estudio sugieren que en la muestra estudiada el sexo masculino presenta marcadores de stress oxidativo mas elevados que el femenino estando dicho incremento influenciado por la edad en ambos grupos. Por otra parte podemos indicar que si bien este trabajo constituye un estudio preliminar, para dar mayor valides a los resultados obtenidos es necesario incrementar el numero de sujetos evaluados a fin de que se constituya en una muestra representativa de la población infantil de nuestro estado, la cual además debe incorporar individuos de raza negra y representantes de nuestra población indígena.
Agradecimientos
El presente trabajo fue realizado gracias a los recursos financieros aportados por el Consejo de Desarrollo Científico y Humanístico (CONDES) de la Universidad del Zulia, bajo el programa VAC-CONDES 0059-2004.
Referencias
1. Dalle-Donne I, Rossi R, Colombo R, Giustarini D and Milzani A. Biomarkers of Oxidative Damage in Human Disease [Review]. Clinical Chemistry 2006; 52:169–76. [ Links ]
2. Stocker R, Keaney JF Jr. Role of oxidative modifications in atherosclerosis [Review]. Physiol Rev 2004; 84:1381–478. [ Links ]
3. Granota E and Kohenb R. Oxidative stress in childhood in health and disease states [Review]. Clinical Nutrition 2004; 23: 3–11 [ Links ]
4. Thérond P, Bonnefont-Rousselot D, Davit-Spraulc A, Conti M and Alain Legrand A. Biomarkers of oxidative stress: an analytical approach. Curr Opin Clin Nutr Meta Care 2000; 3:373-384. [ Links ]
5. Sies H. Oxidative stress: oxidant and antioxidant. Exp Physiol 1997; 82:291–5. [ Links ]
6. Nielsen F, Mikkelsen BB, Nielsen JB, Andersen HR and Grandjean P. Plasma malondialdehyde as biomarker for oxidative stress: reference interval and effects of life-style factors. Clinical Chemistry. 1997; 43:1209-1214. [ Links ]
7. Knight J, Smith SE, Kinder VE and Anstall HB. Reference intervals for plasma lipoperoxides: age, sex and specimen-related variations. Clinical Chemistry. 1987; 33:2289-2291. [ Links ]
8. Chamorro A, Obach VO, Cervera A, Revilla M, Deulofeu R and Aponte JH. Prognostic significance of uric acid serum concentration in patients with acute ischemic stroke. Stoke. 2002; 33:1048-1052. [ Links ]
9. Hummel SG, Fischer AJ, Martin SM, Schafer FQ and Buettner GR. Nitric oxide as a cellular antioxidant: A little goes a long way. Free Radical Biology & Medicine. 2006; 40: 501–506. [ Links ]
10. Hurtado J. El Proyecto de Investigación. Metodología de Investigación Holística. Sypal. Ediciones Quirón. Cuarta edición. Bogota, 2006 [ Links ]
11. Hernández-Valera Y, Henríquez PG, Arenas O, García Blanco M, Cárdena Y. Indice de masa corporal P/T2. Valores para diagnostico de desnutrición en niños de venezolanos de 2 a 10 años de edad. XXV Jornadas Nacionales de Puericultura y Pediatría 1986. En: Manual de crecimiento y desarrollo. Caracas, FUNDACREDESA, 1997; 186 p. [ Links ]
12. Frisancho AR. New norms of upper limb fat and muscle areas for assessment of nutricional status. Am J Clin Nutr 1981; 34: 2540-5. [ Links ]
13. Draper H, Squires E, Mahmoodi H, Wu J, Agarwal S, Hadley M. A comparative evaluation of thiobarbituric acid methods of the determinationof malondialdehyde in biological materials. Free Radic Biol Med .1993; 15:353-63. [ Links ]
14. Archer S. Measure of nitric oxide in biological model. FASEB J. 1993; 7:340-60. [ Links ]
15. Ruiz-Larrea MB, Leal AM, Martí C, Martinez R, Lacort M. Antioxidant action of estrogens in rat hepatocytes". J. Physiol. Biochem. Rev. Esp. Fisiol. 1997; 53:225-230. [ Links ]
16. Requintina PJ and Oxenkrug GF. The In Vitro Effect of Estradiol and Testosterone on Iron-Induced Lipid Peroxidation in Rat Brain and Kidney Tissues Ann. N.Y. Acad. Sci. 2005; 1053: 400–404 [ Links ]
17. Lima SCVC, Arrias RF, Almeida MG, Souza ZM, Pedrosa, LFC. Plasma lipid profile and lipid peroxidation in overweight or obese children and adolescents. J Pediatr (Rio J). 2004; 80(1):23-8 [ Links ]
18. Elli M, Soylemezoglu O, Erbas D, Bakkaloglu SA, Buyan N, Ozkaya O, Hasanoglu E. Plasma and urine nitric oxide levels in healthy Turkish children. Pediatr Nephrol. 2005; 20:1605–1609 [ Links ]
19. Alper AB, Chen W, Yau L, Srinivasan RS, Berenson GS, Hamm LL. Childhood Uric Acid Predicts Adult Blood Pressure. The Bogalusa Heart Study. Hypertension. 2005; 45:34-38. [ Links ]
20. Costa A., Iguala I, Bedini J, Quinto L. and Conget I. Uric acid concentration in subjtcs at risk of tipe 2 diabetes mellitus: relationship to components of the metabolic síndrome. Metabolism. 2002; 51:372-375. [ Links ]
21. Oyama C, Takahashi T, Oyamada M, Oyamada T, Ohno T, Miyashita M, Saito S, Komatsu K, Takashina K, Takada G. Serum uric acid as an obesity-related indicator in early adolescence. Tohoku J Exp Med. 2006; 209(3):257-62. [ Links ]
22. Wilcox W D. Abnormal serum uric acid levels in children. J Pediatr 1996; 128: 731-41. [ Links ]