Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT v.26 n.2 Caracas 2007
Evaluación del efecto protector de 2 inmunógenos de Trichinella. spiralis en ratas Long Evans con modificación nutricional e infectado con Trichinella spiralis
***M. en C. Claudia Maldonado Tapia, *M en BE Rosa Gabriela Reveles Hernández, *MVZ Sergio Saldivar Elías, *M. en C. José Jesús Muñoz Escobedo, **Dr en C. Mario Morales Vallarta, *Dra. en C. María Alejandra Moreno García.
*Docente Investigador Unidad Académica de Biología Experimental, Universidad Autónoma de Zacatecas. **Docente Investigador Facultad de Ciencias Biológicas, Universidad Autónoma de Nuevo León. ***Estudiante de Doctorado Facultad de Ciencias Biológicas, Doctorado en Microbiología. Universidad Autónoma de Nuevo León., México.
Correspondencia: claumt26@hotmail.com
Recibido: 22/04/2007 Aceptado: 26/07/2007
Summary
The Trichinellosis is an endemic zoonotics, cosmopolitan, which is hosted in rats, pigs, and other mammals including humans. The presence of Trichinellosis is due to ingestion of insufficiently cooked swine meat. Poor countries with low medical resources are mainly affected by the disease. A numbered of immunogen have been characterized 45kDa was found to be the immunodominant most effective against T. spiralis, unfortunately a vaccine has not yet been found. Malnutrition (DN) effects have been described/detected in lymphatic organs. The immune mechanisms of the host have been altered with DN caloric-proteic (DPC). Objetive: The protective effect of two 2 immunogen of T. spiralis was evaluated in Long Evans rats with nutritional modifications and infected with T. spiralis. Methods: Eighty Long Evans rats (30 days old) were divided into two groups a 40 nut with 24% protein and a 40 DN with 12% protein of which eight groups were divided again into the different treatments: a) 10 control rats, b) 10 T. spiralis infected rats, c)10 immunized rats with total soluble antigens (AST), d) 10 immunized with 45 kDa of T. spiralis immunogen (one application per week in four dosages), challenged after the first week of immunization, sacrificed after the sixth week of post-infection. Evaluation parameters: Parasite charge determination using artificial digestion, (D/A), morphological characteristics of the nurse cell were determined by the tissue compression tests. Detention to immune response was determined by WB. Results: Different treatments to treat the nut, DN, immunized and infected rats were obtained by D/A. A significant difference was shown in the Ll quantities present in 30 g of muscle. The nut and DN rats control, in Ll absence, and in the groups of nut rats, 200 ul of Ll were collected, in the DN infected group 400ul of Ll were collected, in the Nut immunized with AST and infected, 10 ul of Ll were collected. Meanwhile the rats treated with DN recovered 100 ul of Ll. In a similar manner, the treatment for the Nut rats with vaccinated 45 kDa and the T. spiralis infection; it did not present Ll. while the DN treated recovered 10 ul of Ll, with morphological modifications. Conclussion: The parasite charge in treated animals with 45 kDa immunogen was negative in Nut group.
Key words: immunogen, nutritional modifications, Trichinella spiralis.
Resumen
La Trichinellosis es una zoonosis endémica, cosmopolita, sus huéspedes son, ratas, cerdo y otros mamíferos entre ellos el hombre, la presencia de Trichinellosis se debe a la ingestión de carne de cerdo insuficientemente cocinada, afecta a países con bajos recursos económicos. Se han caracterizado Inmunógenos, siendo el inmunodominante el de 45 kDa, efectivo contra T. spiralis, desafortunadamente no ha cristalizado en una vacuna. Se han descrito efectos de desnutrición (DN) sobre órganos linfáticos. Los mecanismos de defensa del huésped son alterados con DN proteico-calórico (DPC). Objetivo: Evaluar el efecto protector de 2 inmunógenos de T. spiralis en ratas Long Evans con modificación Nutricional e infectado con T. spiralis Metodología: 80 ratas Long Evans de 30 días de edad, divididas en 2 grupos: 40 Nut con 24 % de proteína y 40 DN con 12 % de proteína de los cuales se subdividieron en 8 sub grupos con tratamiento: a) 10 animales control b)10 animales infectados con T. spiralis, c) 10 animales inmunizados con antígeno soluble total (AST), d) 10 animales inmunizados con inmunógeno de 45 kDa de T. spiralis (esquema de inmunización una aplicación cada semana por 4 ocasiones), retados a la 1era semana de la culminación de inmunización, sacrificadas a la 6 sexta semana post-infección. Parámetros a evaluar: Determinación de la carga parasitaria mediante la Digestión Artificial (D/A), Determinación de las características morfológicas de la célula nodriza por la técnica de compresión de tejidos, detección de la respuesta inmune por WB. Resultados: Con la técnica de D/A, se obtuvieron en los diferentes tratamientos, de las ratas Nut, DN, Inmunizadas e Infectadas. Mostró diferencia significativa en la cantidad de LI que se presentaron en 30gr de músculo estriado. los grupos controles de ratas Nut y DN sin infección, ausencia de LI, y en los grupos de ratas Nut Infectadas, se recolectaron 200 µl de LI, para el grupo de DN infectado se recolecto 400 µl de LI, en el grupo de Nut inmunizadas con AST e infectadas, se recolectó 10 µl de LI, mientras que en las tratadas con DN se recuperaron 100µl de LI. En el tratamiento de ratas Nut inmunizadas con antígeno de 45 kDa más infección de T. spiralis, no presento LI, mientras que en las tratadas con DN se recuperaron 10 µl de LI, con modificaciones morfológicas. Conclusión: la carga parasitaria en animales tratados con inmunógeno de 45 kDa nutridos fue negativa.
Palabras clave: inmunogéno, modificaciones nutricionales, Trichinella spiralis.
Introducción
La Trichinellosis es una zoonosis endémica, en resurgimiento, de distribución mundial. Los principales huéspedes de T. spiralis son humanos, ratas, cerdo y otros mamíferos14,15,18. En humanos la presencia de Trichinellosis es debido a la ingestión de carne de cerdo insuficientemente cocinada (Chorizo, carnitas, etc), afecta especialmente a países con bajos recursos económicos14 T. spiralis se encuentra entre los patógenos con mayor complejidad antigénica, por consecuencia la enfermedad causada en humanos y animales representa un grave problema en el diagnostico confundiéndose con otros procesos infecto-contagiosos. Se han caracterizado algunos Inmunógenos especialmente los producidos por el esticosoma siendo el inmunodominante el de 45 kDa utilizado para protección, siendo efectivos contra T. spiralis, pero desafortunadamente no se ha cristalizado en una vacuna8. Se han realizado estudios epidemiológicos de los años 2000-2005 (Zacatecas, México) donde se ha detectado la presencia de T. spiralis en perro, rata y cerdo, los cuales son huéspedes, que permiten su permanencia como una zoonosis3,6,17. La T. spiralis se encuentra entre los patógenos con mayor complejidad antigénica, esta enfermedad tiene problemas al diagnostico en los humanos y animales, pero la técnica de Wester Blot (WB) detecta el patrón característico del triplete que oscila entre 43, 45 y 48 kDa común en la enfermedad. Dependiendo de la carga parasitaria se presenta la respuesta clínica14,17. En 30 animales nutridos inmunizados con AST previa infección de T. spiralis obtuvieron menor número de LI por medio de la técnica de Digestión Artificial (D/A), por otro lado se desencadeno respuesta inmune detectada por Wb ya que presento Ac – anti T. spiralis definida las bandas en estos animales, El AST induce respuesta protectora contra T. spiralis8. A mediados del Siglo XIX se describieron por primera vez efectos de la desnutrición sobre los órganos linfáticos. Los tejidos linfáticos son vulnerables a los efectos dañinos de la desnutrición, la atrofia linfoide es característico en estado de desnutrición1. Es característico que infecciones por parásitos estimulen un mecanismo de defensa y una respuesta inmunológica. El estudio de la respuesta inmune en afecciones parasitarias, es importante debido a que causa problemas en la salud pública, especialmente afecta a países con bajos recursos económicos11,14. Es importante el porcentaje de personas que se ven afectados por parasitosis, ya que estos infectan millones de personas, causándoles infecciones de tipo crónico19. La problemática anterior aunada a una mala nutrición o a una desnutrición proteico-energética y a la limitada difusión de este hallazgo da lugar a que la enfermedad sea un problema de más de 50 años, en los países en vías de desarrollo para la Organización Mundial de la Salud (OMS) y el Fondo para la Agricultura y la Alimentación (FAO)19,21. Magnificando los efectos de la DN por problemas de diarrea ya que existe una estrecha relación entre DN, así la diarrea puede comprometer el estado de nutrición de las personas10.
Se sabe que todas las células inmunes y sus productos, tales como las inter-leucinas, interferones y del complemento, dependen de reacciones metabólicas que emplean nutrientes como co-factores críticos para sus acciones y actividades5. La mayoría de los mecanismos de defensa del huésped se alteran con la desnutrición proteico - calórico (DPC)1,2,5. Factores como el estado nutricional, hormonal, sexo, edad de las personas, pueden modificar la respuesta inmunológica6.
Objetivo general: Evaluación Del efecto protector de 2 inmunógenos de Trichinella. spiralis en ratas Long Evans con modificación nutricional e infectado con Trichinella. spiralis
a) OBJETIVOS PARTICULARES: a) Ratas Long Evans con modificación nutricional nutridas (Nut) y desnutridas (DN), b) Reproducir en ratas Long Evans Nut y DN la infección a T. spiralis c) Evaluar Carga Parasitaria en animales Nut y DN e inmunizados con el Antígeno Soluble Total de T. spiralis (AST) e inmunógeno de 45 kDa.
El modelo experimental utilizado fueron 80 ratas Long Evans hembras de 30 días de edad pos-destete, las cuales se dividieron en dos grupos: 40 ratas Nut (Dieta normal 24% de Proteína), 40 ratas DN (Dieta de 12% de proteína) de cada grupo se hicieron 4 subgrupos:
a) 10 ratas control Nut y DN.
b) 10 ratas Nut y DN e infectadas con T. spiralis.
c) 10 ratas Nut y DN e inmunizadas con el AST utilizando el siguiente esquema de inmunización (una aplicación cada semana por 4 ocasiones), infectados con 200 LI de T. spiralis vía oral en la primera semana posterior a la culminación del esquema de inmunización, sacrificadas a las 6ta semana post –infección con T. spiralis.
d) 10 ratas Nut y DN inmunizadas con el inmunógeno de 45 kDa, se utilizó el siguiente esquema de inmunización (una aplicación cada semana por 4 ocasiones), infectadas con 200 LI de T. spiralis vía oral, una semana posterior a la culminación del esquema de inmunización, se sacrificaron a la 6ta semana post-infección con T. spiralis.
Parámetros evaluados: 1.- Se realizó toma de muestra sanguínea del seno retroorbital: (post-tratamiento de AST e inmunógeno de 45 kDa y al sacrificio de los grupos de estudio).
Se caracterizó la respuesta inmune (IgG) a T. spiralis por WB en todos los grupos de estudio. Se evaluó en todos los grupos de estudio la carga parasitaria mediante la D/A, los tratados con inmunización de AST y con el inmunógeno de 45 kDa. Se evaluó la célula nodriza (observación de los cambios en su estructura morfológica) mediante la técnica de compresión de tejido en todos los grupos de estudio. Las Técnicas utilizadas: Elusión del inmunógeno de 45 kDa del músculo infectado con larvas de Trichinella spiralis se obtuvo el AST el cual se le realizó electroforesis (SDS-PÁGE), reduciendo en condiciones del 10% geles de poliacrilamida. En la porción del gel que contenía el triplete característico de 42, 43 y 45 kDa se separo por elusión, con solución de Tris 10mM, a un pH de 8.10, adicionándole inhibidores de proteasa, posteriormente se homogenizó mediante centrifugación a 12,100 x gravedades a 4° C durante 30 min. La proteína que se obtuvo del sobre nadante se le realizo la determinación de concentración de proteína por el método de Bradford. Posteriormente se filtro mediante las membranas que permitió el paso del inmunógeno de 45 kDa., el sobre nadante se tomo para ser analizado por el SDS-PAGE reducido a 10%, en el gel para confirmar la presencia de este inmunógeno. Posteriormente estas fracciones se utilizaron como inmunógeno4.
Corrimiento electroforético en geles de poliacrilamida (PAGE): Para separar el AST e inmunógeno de 45 kDa se realizaron corrimientos electroforéticos en minigeles de poliacrilamida (PAGE) en condiciones reductoras. Se utilizaron geles de 7 x 7 cm preparados con dodecil sulfato de sodio (SDS) de acuerdo a la metodología descrita por Laemmli et al12, a concentración de acrilamida al 11%, la relación acrilamida – bisacrilamida fue de 1:60 en el gel separador. El tiempo de corrimiento, fue de 2 hrs a 100 Volts. El AST y el inmunógeno de 45 kDa se prepararon por ebullición durante 5 min. En una solución reductora, Tris-HCL 1 M, pH = 6.8, glicerol 20%; SDS al 2%, azul de bromo fenol al 0.5%, EDTA; H2O, ditiotreitol 5 mM y 2 β-mercaptoetanol al 5%. Se utilizaron los siguientes marcadores de peso molecular: Fosforilasa (97 kDa), albúmina sérica bovina (68 kDa), ovalbúmina (43 kDa), anhidrasa carbónica (24 kDa), lisosima (14 kDa); Se usó una cámara PROTEAN II xi Cell (Bio-Rad), aplicando un tiempo de corrimiento de 2 hrs con el voltaje de 100 volts ya que se obtuvo el corrimiento se tiñó uno de los geles con azul de Coomassie, se destiñó con solución destiñidora, luego con solución aclaradora, posteriormente fue secado el gel en membranas de papel celofán, en el aparato de GELDRYER MODEL 583 of BIO-RAD, los geles no teñidos fueron transferidos a papel de nitrocelulosa12. WB: El producto obtenido del corrimiento en gel de poliacrilamida se transfirió al papel de nitrocelulosa (NC), El papel con las proteínas transferidas de acuerdo con el método descrito por Towbin20, utilizando una cámara de Trans blot-cell Electrophoretic Transfer Cell (Bio-Rad) con el buffer de transferencia (25 mM Tris, pH 8.3, 192 mM glicina, 20% de MEOH y .025 – 0.1% de SDS) a 35 volts a 4ºC durante toda la noche
una vez transferidas las proteínas al papel de NC, se procedió al revelado con tinción verde rápido (fast green al 0.1%) por 5 min. Con agitación constante, se retiró el colorante, decolorándose en agua destilada verificando la presencia de proteínas. El papel de NC se cortó en tiras, se procedió a cubrirlos con solución bloqueadora PBS-leche descremada en polvo al 3% y azida de sodio al 0.15% manteniéndose a 4ºC, con agitación continua por toda la noche. Se lavó 3 veces con PBS el papel (cada una por 10 min). Posterior a esto se continuó con incubación del (primer Ab) suero de rata diluido 1:100 con PBS- leche en polvo al 3% incubado 90 min. a temperatura ambiente con agitación constante. Se lavó por dos ocasiones durante 10 min. Con PBS-Tween 20, al 0.3% tres veces con PBS por un lapso de 10 min. Se incubó con (segundo Ab) anti-IgG de rata marcada con peroxidasa dilución 1:1000 así como PBS-leche en polvo al 3% durante 90 min. a temperatura ambiente con agitación constante. Después fueron lavados 2 veces por 10 min. Con PBS Tween 20 al 0.3%, tres veces con PBS durante 10 min. Las bandas de proteínas se revelaron con 3,3´diamino-benzidina (DAB), 50 mg. en 100 ml de PBS, agregándole 10µl de peróxido de hidrógeno al 30% manteniendo a 4ºC, y posteriormente se lavó cada tira por tres ocasiones en agua destilada, dejándose secar a medio ambiente (20). D/A: El proceso se realizó a 37°C por 24 hrs según el método descrito por Del Río et al7, donde se colocó 30 gr. de tejido infectado triturado en un tamiz de tul en forma de saco; suspendido en una solución de 0.03% de pepsina (10,000u), HCL al 37% (0.2M) en 1lt de agua destilada, se colocó en un embudo de separación., trascurridas 24hrs se procedió a separar las LI que se depositaron en el fondo del embudo de separación, se realizó tres lavados de PBS, para evitar su desnaturalización de LI, por ultimo se midió la cantidad de LI presentes y se observaron al microscopio. Técnica de compresión: Posterior al sacrificio de los murinos en experimentación, se les tomo .5gr de tejido de diafragma, masetero, lengua y pierna, para compactar a presión dos porta objetos de vidrio, y verificar la presencia de la LI en los tratamientos correspondientes, prosiguiendo a la observación al microscopio óptico de luz con el objetivo de 10x, 20X y 40X. Diseño de Tratamientos: Completamente al azar. Diseño Experimental Se utilizó un diseño experimental completamente al azar, el cual es representado por el siguiente modelo general: Yij = µ + Ai + Bj + eijK. Yij = porcentaje de reactores. µ = es la medida común en todas las unidades experimentales antes de aplicar las inmunizaciones. Ai = es el i-ésimo nivel de inmunógenos (con y sin inmunizar). Bj = es el j-ésimo diagnóstico. AB = es la interacción del i-ésimo nivel de A y j-ésimo nivel de B. eij = es el error experimental. La comparación múltiple de medias se realizó mediante la prueba de rango, múltiple de Tukey con P = 0.05 22. Finalmente, los datos fueron analizados a través del sistema de análisis estadístico (SAS, 1998).
Resultados
Al utilizar la técnica de Compresión de tejidos, no se observo LI de T. spiralis en los grupos controles Nut y DN sin infección, pero para los diferentes tratamientos se muestran los siguientes resultados.
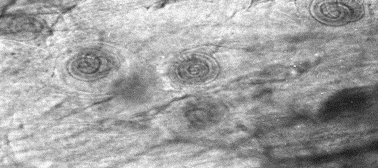
Se observó con la técnica directa de de compresión de tejido, en ratas Nut e Infectadas con T. spiralis la presencia de la LI en el diafragma, masetero, lengua, pierna con las características morfológicas propias de LI en espiral y con su quiste bien formado (el complejo de la célula nodriza) como se muestra en la fotografía 1.
Fotografía 1.- Tejido de masetero de rata Nut Infectada utilizando microscopio óptico de luz a 10x en el centro se observa una célula nodriza con 2 LI de T. spiralis.
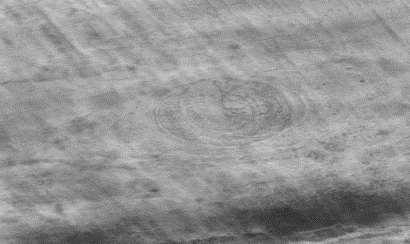
Se observó con la técnica directa de de compresión de tejido, en ratas DN e Infectadas con T. spiralis la presencia de la LI en el diafragma, masetero, lengua, pierna con las características morfológicas propias de LI como se muestra en la fotografía 2.
Fotografía 2.- Tejido de masetero de DN Infectada utilizando microscopio óptico de luz a 10x se observa varias células nodrizas con LI de T. spiralis.
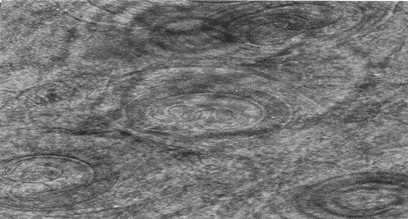
Se observó con la técnica directa de de compresión de tejido, en ratas Nut inmunizadas con el AST e infectadas con T.spiralis la presencia de la LI en el diafragma, masetero, lengua, pierna con modificaciones de la célula nodriza de T. spiralis (fotografía 3).
Fotografía 3.-Tejido de masetero de rata Nut inmunizada con el AST e infectada con T. spiralis, con la técnica de compresión de tejido, estuvo presente la LI con modificaciones de la célula nodriza y mayor vascularización, (microscopio óptico de luz 20x).
Se observó con la técnica directa de de compresión de tejido, en ratas DN inmunizadas con el AST e infectadas con T.spiralis la presencia de la LI en el diafragma, masetero, lengua, pierna con modificaciones de la célula nodriza T. spiralis (fotografía 4).
Fotografía 4.- Tejido de masetero de rata DN inmunizada con el AST e infectada con T. spiralis, con la técnica de compresión de tejido, estuvo presente la LI con modificaciones de la célula nodriza y mayor vascularización, (microscopio óptico de luz a 20x).
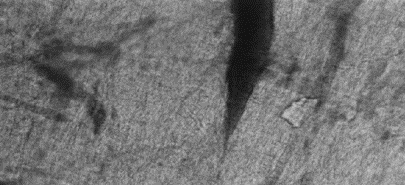
Se observó con la técnica directa de compresión de tejido, en ratas Nut inmunizadas con el inmunógeno de 45 kDa e infectadas con T.spiralis tejidos con mayor vacularización en el diafragma, masetero, lengua, pierna y no se detecto la célula nodriza de T. spiralis (fotografía 5).
Fotografía 5.- Tejido de masetero de rata Nut inmunizada con el inmunógeno de 45 kDa e infectada con T. spiralis, con la técnica de compresión de tejido, no estuvo presente la LI y solo una mayor vascularización, (microscopio óptico de luz a 20x).
Se observó con la técnica directa de de compresión de tejido, en ratas DN inmunizadas con el inmunógeno de 45 kDa e infectadas con T.spiralis tejidos con mayor vacularización en el diafragma, masetero, lengua, pierna y la célula nodriza de T. spiralis con modificaciones (fotografía 6).
Fotografía 6.- Tejido de masetero de rata DN inmunizada con el inmunógeno de 45 kDa e infectada con T. spiralis, con la técnica de compresión de tejido, estuvo presente la LI con modificaciones de la célula nodriza (microscopio óptico de luz 20x).
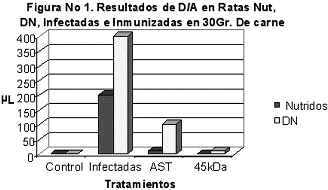
Los resultados que se obtuvieron con la técnica de D/A, en los diferentes tratamientos, de las ratas Nut, DN, Inmunizadas e Infectadas. Mostró la cantidad de LI que se presentaron en 30gr de músculo estriado. En la figura 1 se observa a los grupos controles de ratas Nut y DN sin infección, en los grupos de ratas Nut Infectadas, se recolectaron 200 µl de LI, así también para el grupo de DN infectado se recolecto 400 µl de LI. Al ser utilizado el tratamiento de Nut inmunizadas con AST e infectadas, recolectaron 10 µl de LI, mientras que en las tratadas con DN se recuperaron 100µl de LI. Así también para el tratamiento de ratas Nut inmunizadas con antígeno de 45 kDa más infección de T. spiralis, no presento paquete de LI, mientras que en las tratadas con DN se recuperaron 10 µl de LI, (figura 1).
El estudio estadístico reporto un P < 0.001 para el Inmunógeno de 45 kDa en animales nutridos en relación con los otros grupos de estudio y así mismo fue significativo el efecto de protección del AST en animales Nut y DN en relación con los grupos de animales Nutridos y DN infectados con T. spiralis.
En los resultados obtenidos con la técnica de Wester Blot se observó que tanto ratas Nut y DN Infectadas, resultaron positivas a esta técnica, haciéndose presente el reconocimiento antigénico reconociendo el triplete de 42,45 y 48 kDa característico en la infección por T. spiralis. En el grupo de animales inmunizados con el AST Nut y DN todos presentaron el reconocimiento del triplete de 42,45 y 48 kDa y en el caso de inmunizados con el inmógeno de 45 kDa solo 4 del grupo de Nut presento la detección del epítope de 45 kDa y en grupo de DN fue negativo. Los sueros obtenidos del sacrificio de los grupos de Nut y DN inmunizados y posteriormente infectados fueron positivos.
Discusión
Nuestros resultados demostraron que el inmunógeno de 45 kDa en animales Nut tuvo un efecto de protección total ya que posterior a la infección no se encontró el parasito ni a la compresión ni a la D/A y en DN disminuyo la carga parasitaria pero si permitió el desarrollo del parasito. Los resultados de protección ha esta parasitosis son pocos, se sabe que en animales infectados e inmunizados con el antígeno de 45 kDa desencadenó una respuesta inmune protectora en contra de la parasitosis. En el presente estudio se demuestra la importancia del estado nutricional en la respuesta inmune.
Conclusión
El inmunógeno de 45 kDa presento un efecto de protección estudio significativo con un P = 0.001 en animales nutridos. Así mismo en animales desnutridos el inmunógeno de 45 kDa un efectos de protección de un P = 0.005. El estado nutricional juega un papel importante en los resultados en la infección y en la respuesta inmunológica.
Referencias
1. Beisel WR. 1982. Single nutrients and immunity. Am J Clinics of Nutrition. 35: 417-468. [ Links ]
2. Bendich A, Chandra RK. 1990. Micronutrients and immune function. New York: New York Academy of Sciences. [ Links ]
3. Berumen VT, Muñoz EJJ. Moreno MAG. 2002. Trichinellosis en perros callejeros de la ciudad de Zacatecas de México. Parasitol. Latinoam. FLAP. Vol. 57: 72-74. [ Links ]
4. Chapa RMR, Salinas T, Aguilar A, Martínez M. 1992. Recognition of Trichinella spiralis muscle larvae antigens by sera from human infected with this parasite and its potential use in diagnosis. Revista Latino Americana de Microbiología Abril-junio. Vol.34 No. 2. 95-99. [ Links ]
5. Chandra RK. 1990. Micronutrients and immune functions, an overview. Ann NY Acad Sci. 587: 9-16. [ Links ]
6. Chávez GEG, Saldivar ES, Muñoz EJJ, Moreno GMA. 2006. Trichinellosis una zoonosis vigente. REDVET. Vol VII,No. 5. 1-19. http://www.veterinaria.org/revistas/redvet [ Links ]
7. Del Río A, Herrera RM, Herrera R. 1986. Triquinelosis experimental extracción de antígenos y procedimientos para detectar anticuerpos. Archv. Invest. Med 17: 359-567.
8. García MEA. 2000. Evaluación del Efecto Protector del Antígeno Soluble Total del Trichinella spiralis en Modelo Experimental. Tesis de Maestría Centro de Biología Experimental UAZ. [ Links ]
9. Guerra M. 2005. Aportes tecnológicos en las intervenciones nutricionales poblacionales. Anales Venezolanos de Nutrición. Vol 18. 1-16 [ Links ]
10. Gutiérrez M, Carías D, Cioccia AM, Hervia P. 2006. Efecto de la diarrea sobre la utilización de nutrientes en ratas con desnutrición proteico-calórica o proteica. Archivos Latinoamericanos de Nutrición. 56 n. 1-15. [ Links ]
11. Hernández B.L, López R.C. 2006. Frecuencia de la relación que existe entre la desnutrición y las enfermedades infecciosas gastrointestinales y respiratorias en el área metropolitana en niños de 1 a 6 años. www.tuobra.unam.mx/publicadas/050819000753 [ Links ]
12. Laemmli UK, Cheng SH, Adolph K, Paulson JR, Brown J, Baumbach WR. 1970. Cleavaje of structural proteins during the assembly of the head of bacteriophage T4 Nature 227: 680-685. [ Links ]
13. Moreno, GMA, 1994. Característica de la Respuesta Inmune a Trichinella spiralis; Tesis Doctoral. Universidad Nacional Autónoma de México. Facultad de Medicina. pp. 4-9. [ Links ]
14. Moreno GA, Reveles HG, Castañeda CV, Saldívar ES, Muñoz EJ. 2001. Características de la Respuesta Inmune en la Infección por T. spiralis en Cerdo. Memorias del XIX Congreso Nacional de Investigación Biomédica. Monterrey Nuevo León. [ Links ]
15. Moreno I. 1994. Regulación de la respuesta inmune en parasitosis. Servicio Inmunología Centro Investigación Clínica; Sesión Plenaria Segunda Ponencia. Madrid. [ Links ]
16. Montilva M., Ferrer M.A., Nieto R., Ontiveros Y., Duran L., Mendoza M.A. 2003. Uso del Método Necesidades Básicas Insatisfechas en la detección de comunidades con riesgos de desnutrición. Anales Venezolanos de Nutrición. Vol 16 n.1-8. [ Links ]
17. Muñoz, EJ, Rivas GJ, Reveles HG, Reveles HM, Berumen DTV, Moreno MAG. 2004. Huéspedes que permiten la permanencia de Trichinella spiralis en el estado de Zacatecas. Revista Electrónica de Veterinaria REDVET, Vol. V, No. 11. 1-20. http://www.veterinaria.org/revistas/redvet [ Links ]
18. Philip J, Gagliardo LF, Sabin EA, Betchen AB, Ghosh K, Oblak JB and Appleton JA. 1999. Dominance of Immunoglobulin G2c in the Antiphosphorylcholine Response of Rats Infected with Trichinella spiralis. Infection and Immunity. Vol. 6. No 9. 4661-4667. [ Links ]
19. Roitt I, Brostoff J, Male D. 2000. Inmunológia. Editorial. Harcourt. 5 ta ed. Madrid España. pp. 243. [ Links ]
20. Tobwin HT, Sthahelin T, Gordon J. 1979. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocelulose sheets. Procedure and some applications. Proct. Nathl. Acad Sci. USA 76: 4350. [ Links ]
21. Vega FL. 1999. Hitos Conceptuales en la Historia de la Desnutrición Proteico-Energética. Salud Pública de México. vol .41, no.4. [ Links ]
22. Steel R-G.D., Torrie J.H., Dickey D.A. 2000. Procedures Statistics Biometrical Aproach. Series in probability and statics. 3era ed. McGraw-Hill. [ Links ]