Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT v.26 n.2 Caracas 2007
Efecto del consumo de aceite crudo de palma o maíz sobre la oxidación in vitro de la HDL plasmática de conejos. Oxidación in vitro de HDL de conejos
Tosca I Scorza1, Holger Neptalí Ortiz2, Oscar Rodríguez S3, Candelaria Alfonso-Pérez4
1Profesor Titular. Cátedra de Fisiopatología, Escuela de Medicina J.M.Vargas, Facultad de Medicina, UCV.
2Profesor Agregado. Cátedra de Bioquímica, Escuela de Enfermería, Facultad de Medicina, UCV.
3Profesor Agregado. Cátedra de Fisiopatología, Escuela de Medicina J.M.Vargas, Facultad de Medicina, UCV.
4Profesor Agregado. Sección Cardio-Renales, Instituto de Medicina Experimental, Facultad de Medicina, UCV.
Institución: Departamento de Ciencias Fisiológicas, Escuela de Medicina J.M.Vargas, Facultad de Medicina, UCV.
Dirección: Tosca Scorza. Cátedra de Fisiopatología, Escuela de Medicina J.M.Vargas, Facultad de Medicina, UCV, toscascorza@hotmail.com No hay separatas disponibles.
Agradecimiento: Este trabajo fue financiado por el CDCH, mediante los proyectos Nº 09.5688-2004 y 09.00.5704.04
Resumen
Se investigó la susceptibilidad a la oxidación in vitro de las HDLs de conejos por acción del Cu2+. Los conejos fueron alimentados durante 3 meses con un suplemento de 10 % de aceite crudo de palma o de maíz. Las HDLs aisladas por ultracentrifugación y dializadas se oxidaron con 10 µM de Cu2+, la generación de dienos conjugados se midió mediante análisis espectroscópico a 234 nm. La fase de retardo del grupo alimentado con aceite crudo de palma fue de 145 min con respecto a 94 min del grupo que recibió aceite de maíz (p< 0.05%). Se concluye que la ingesta de aceite de palma rico en carotenos y tocoferoles incrementó la protección contra las oxidaciones in vitro, de los ácidos grasos poliinsaturados de
Palabras claves: Oxidación HDL, aceite de palma, conejo
Abstract
We investigated the in vitro susceptibility to copper-induced oxidation of the rabbits HDLs fed during 3 months with 10 % supplementary diet of crude palm oil or corn oil. The isolated HDLs by ultracentrifugation were dializated and oxidated following the addition of 10 µM Cu2+, the conjugated dienes were analysed by spectroscopic monitoring at 234 nm. The kinetics change of lag-phase of the group feed with crude palm oil was longer (145 min) with respect to the group feed with corn oil (94 min) (p<0,05). We concluded that the consumed of the crude palm oil, rich in carotenes and tocotrienols, increase the protection in vitro of HDLs unsatured fatty acids oxidation.
Key words: HDL oxidation, palm oil, rabbit
Introducción
El aceite de palma obtenido del fruto de la palma (Elaies guineensis), constituye la segunda fuente más abundante de aceite vegetal a nivel mundial1, contiene entre
De acuerdo con los estudios clásicos de Hegsted, Keys y sus colegas5,6, el aceite de palma rico en ácidos grasos saturados: ácido palmítico (38%) sería ubicado en el grupo de las grasas saturadas y según las fórmulas de predicción establecidas, el consumo de aceite de palma induciría aumento en la concentración de colesterol plasmático, ya que, las grasas saturadas pueden duplicar la concentración plasmática de colesterol, los poliinsaturados lo disminuyen, mientras que, los monoinsaturados tiene poco efecto. Sin embargo, el aceite de palma tiene alto contenido del ácido graso monoinsaturado oleico (C18:1,n-9) y antioxidantes, que modifican su comportamiento respecto al aceite de coco7.
Estudios epidemiológicos y experimentales han demostrado la relación entre concentración plasmática de colesterol y riesgo de afección cardiovascular8,14. Existen evidencias que en esta relación también son importantes la concentración de la lipoproteína de alta densidad (HDL) y la concentración de triacilglicéridos plasmáticos.
En relación a
Desde el punto de vista clínico, la hipertrigliceridemia, es un factor independiente de enfermedades coronarias y está íntimamente relacionado con aumento de remanentes de VLDL, lipoproteínas de densidad intermedia y LDL pequeñas densas23. La prevención de la aterogénesis causante de infarto al miocardio, una de las principales causas de muerte en Venezuela, se basa entre otras estrategias en disminuir la concentración de LDLc, aumentar la concentración de HDLc y disminuir la susceptibilidad a la oxidación de estas lipoproteínas23,25. En relación con
El aceite de palma y sus derivados, son los únicos productos naturales en el mercado mundial con apreciables cantidades de tocotrienoles, en particular de γ-tocotrienol que puede reducir la concentración del colesterol plasmático, mediante la inhibición de la enzima Hidroximetil-glutaril-coenzima A-reductasa hepática que regula la síntesis del colesterol, lo cual también pudiera modificar la estructura y estabilidad de
El objetivo de este trabajo fue comparar la susceptibilidad de la oxidación in vitro de las HDLs, de conejos alimentados durante 3 meses con suplemento de aceite crudo de palma o maíz, mediante la cuantificación de los dienos conjugados que se generan en la peroxidación de los ácidos grasos poliinsaturados.
Métodos
Conejos de la raza Nueva Zelanda de
En la curva del transcurso de la reacción se evaluó (i) el tiempo de retardo de la oxidación y (ii) la velocidad máxima de formación de dienos conjugados. El tiempo de retardo está relacionado con la resistencia a la oxidación de los lípidos insaturados contra la oxidación inducida por el ión Cu2+. Este tiempo es directamente proporcional al contenido de antioxidantes y equivale a la intersección entre las rectas a y b de la figura 1. Estas rectas corresponden a las pendientes de la fase de retardo y de la fase de la velocidad máxima de oxidación lipídica respectivamente36,37. El porcentaje de ácidos grasos insaturados, sustrato de la oxidación se determinó por cromatografía en fase gas-líquida, previa extracción de los lípidos con cloroformo-metanol en proporción 2:1 (v/v) y agua38. Como antioxidante se utilizó 10 mg de butil-hidroxi-tolueno (BHT)/100 ml de solvente. Los lípidos se transesterificaron a ésteres metílicos de ácidos grasos utilizando 5 ml de la mezcla anhídrica metanol: benceno: ácido sulfúrico en proporción 80:10:1 (v: v: v) en reflujo a 80º C por una hora. Los ésteres metílicos se extrajeron dos veces con 5 ml de hexano. La fase orgánica se lavó con agua a 4º C y se filtró sobre papel Whatman® número 1. Los ésteres metílicos de las ácidos grasos se analizaron en un cromatógrafo marca Hewlett- Packard modelo 6890, con detector de llama, columna capilar de
Resultados
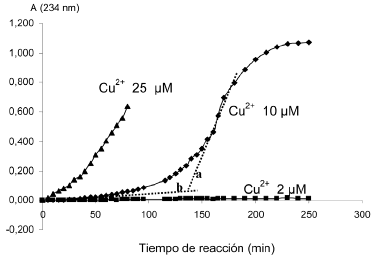
En la figura Nº 1, se observa el efecto de la concentración de Cu2+ sobre la absorbancia a 234 nm, cuando se peroxidan las HDLs, con lo cual se determinó la cantidad óptima del oxidante Cu2+ para efectuar la peroxidación in vitro. En la celda de reacción la cantidad óptima de Cu2+ fue 10 µM; valores inferiores prolongaron la fase de retardo e incrementaron el tiempo de análisis. Por otra parte, el uso de altas concentraciones de Cu2+ (25 µM) produjo una rápida peroxidación de
Figura 1.- Efecto de la concentración del Cu2+ en la cinética de la peroxidación de los ácidos grasos poliinsaturados de
Con 25 µM de Cu2+ no se observa la fase de retardo, con 2 µM de Cu2+ la concentración de dienos conjugados no incrementa en 250 min. Con 10 µM de Cu2+ se observa una fase de retardo y la velocidad máxima de oxidación. La intersección de las rectas a y b corresponde a la fase de retardo.
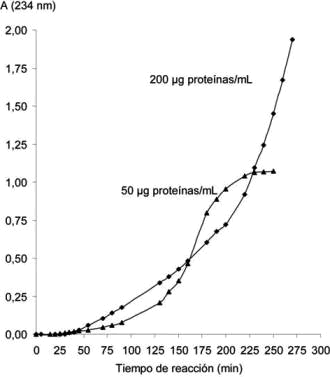
Figura 2.- Efecto de la concentración de proteínas de
Con 200 µg de proteínas/mL, la concentración de dienos conjugados supera la capacidad de detección del equipo, con 50 µg de proteínas/mL se pudo evaluar la cinética hasta 250 min.
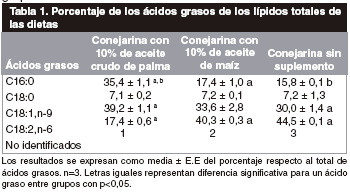
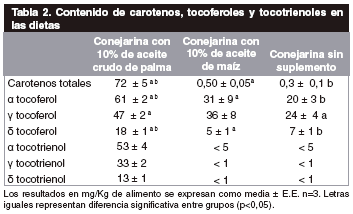
En la tabla Nº I, se muestra el porcentaje de los diferentes ácidos grasos contenido en las dietas utilizadas, en la tabla Nº II el contenido de los carotenos, tocoferoles y tocotrienoles en las dietas y la tabla Nº III los resultados de la fase de retardo y de la velocidad máxima de la cinética de peroxidación de los ácidos grasos poliinsaturados de
La dieta suplementada con aceite crudo de palma contiene mayor porcentaje de ácido graso saturado C16:0 (35,4%) y menor cantidad de ácido linoleico, C18:2,n-6 (17,4%) respecto a la dieta suplementada con aceite de maíz que contiene 17,4% y 40,3% respectivamente (tabla Nº I), lo cual debe influir en la disponibilidad de ácidos grasos poliinsaturados en
En la dieta con aceite crudo de palma, el contenido de carotenos (72 mg/Kg) y de tocoferoles más tocotrienoles (225 mg/Kg) es superior al contenido en la dieta con el aceite de maíz (tabla II), estos antioxidantes, son un importante factor dietético que pudo haber incrementado la protección contra las oxidaciones de
No se encontró diferencias (p<0,05) en la velocidad máxima de peroxidación entre los grupos con aceite crudo de palma y de maíz, posiblemente porque el porcentaje de los ácidos grasos poliinsaturados, 35,8 % y 40,6 % (resultados preliminares) de
El concepto de un transporte reverso de colesterol, con la importancia de
En apoyo a estos resultados, son los estudios experimentales realizados en conejos, donde se encontró menor concentración de malondialdehído (un marcador de peroxidación lipídica) en tejidos aórticos en los animales que recibieron un suplemento de vitamina E del aceite de palma53, igualmente en ratas se ha demostrado el efecto protector del aceite crudo de palma, sobre el stress oxidativo54,55. En humanos, la administración de vitamina E, aumentó la resistencia a la oxidación de
Agradecimiento
A
1. Cottrell RC. Introduction: nutritional aspects of palm oil. J Clin Nutr 1991; (53): 989S-100S
2. Go SH, Choo YM, Ong SH. Minor constituents of palm oil. J Am Oil Chem Soc. 1985; (62): 237-40
3. Nagendran B, Unnithan U, Choo Y, and Sundram K. Charasteristics of red palm oil, a carotene-and vitamin E- rich refined oil for food uses. Food Nutr Bull. 2000; 21 (2): 189-94
4. Sundram K, Sambanthamurthi R, Tan YA. Palm fruit chemistry and nutrition. Asia Pac J Clin Nutr. 2003; 12 (3): 355-62
5. Hegsted DM, Mc Gandy RB, Mayers ML, Tare FJ. Quantitative effects of dietary fat on serum cholesterol in man. Am J Clin Nutr. 1965; 17: 281-95
6. Key A, Anderson J, and Grande F. Serum cholesterol response to change in the diet. Metabolism 1965 (14) 747-8
7. Wilson TA, Nicolosi RJ, Kottyla T, Sundram K, Kritchevsky D. Different palm oil preparations reduce plasma cholesterol concentrations and aortic cholesterol accumulation compared to coconut oil in hypercholesterolemic hamsters. J Nutr Biochem. 2005; (10): 633-40
8. Castelli W. Lipoproteins and cardiovascular disease: biological basis and epidemiological studies. Value Health 1998 Jul-Aug;1 (2): 105-9
9. Castelli WP. Cholesterol and lipids in the risk of coronary artery disease: the Framingham study. Can J Cardiol (suppl A) 1988; (Jul): 5-10
10. Assmann G. Lipoproteins and the prediction of coronary heart disease. Internal Medicine for the specialist.1989; September: 14-19
11. Kwiterovich PO. State-of-the-Art update and review: Clinical trials of lipid-lowering agents. Am J Cardiol. 1998; (82): 3u-17u
12. Duarte MA, Scorza T. Efecto de dietas suplementadas con ácidos grasos saturados o poliinsaturados sobre parámetros hematológicos, hemostáticos y lipoproteicos: relación con modificaciones histológicas en aorta torácica y abdominal. Acta Cient Venez. 2004; (55): 264-275
13. Martucci A, Scorza T, de Ron AT, Pujol I. Lesiones arteriales en Conejos hipercolesterolémicos con dietas ricas en aceite de palma y contenido variable de antioxidantes. Rev Soc Venez Cien Morfol. 1997; (3):43-50
14. Martucci A; Scorza T, de Ron AT, Pujol I, Hamana N. Hipercolesterolemia crónica en conejos. Agregación plaquetaria y lesiones en la aorta abdominal. Rev Fac Medic. 1998; (21): 24-30
15. Badimon JJ, Badimon L, Fuster V. Regression of atherosclerotic lesions by high density lipoprotein plasma fraction in the cholesterol-fed rabbits. J Clin Invest. 1990; (85): 1234-41
16. Watson AD, Berliner JA, Hama SY, Ladu BN, Faull KF, Fogelman AM et al. Protective effect of high density lipoprotein associated paraoxonase. J Clin Invest. 1995; (96): 2882-91
17. Miyazaki A, Rahim AT, Ohta T, Morino Y, Horiuchi S. High density lipoprotein mediates selective reduction in cholesterol esters from macrophage foam cells. Biochim Biophys Acta. 1992; (1126): 73-80
18. Viles-Gonzalez JF, Fuster V, Corti R, Badimon JJ. Emerging importance of HDL cholesterol in developing high-risk coronary plaques in acute coronary syndromes. Curr Opin Cardio. 2003; 18: 286-94
19. Chapman MJ, Bruckert E. The atherogenic role of triglycerdes and small, dense low density lipoproteins: impact of ciprofibrate therapy. Atherosclerosis 1996; suppl 124: S21-S28
20. Austin MA. Plasma triglyceride and coronary heart disease. Arteriosclerosis Thromb 1991; 11: 2-4
21. Patsch JR. Trglyceride-rich lipoprotein and atherosclerosis. Atherosclarosis. 1994; (110): S23-S26
22. Chapman MJ, Bruckert E. The atherogenic role of triglycerides and small, dense low density lipoproteins: impact of ciprofibrate therapy. Atherosclerosis. 1996; 124: S21-S28
23. Nagyová A, Kudlacková M, Klanová J. LDL and HDL oxidation and fatty acid composition in vegetarians. Ann Nutr Metab. 2001; (45): 148-51
24. Schnell J, Anderson R, Stegner J, Schindler S, Weiberg R. Effects of a high polyunsaturated fat diet and vitamin E supplementation on high-density lipoprotein oxidation in humans. Atherosclerosis. 2001; (159): 459-66
25. Nagano Y, Arai H, Kita T. High density lipoprotein loses its effect to stimulate efflux of cholesterol from foam cells alter oxidative modification. Proc Natl Acad Sci. 1991; (88): 6457-61
26. Black T, Wang P, Maeda N, Coleman R. Palm tocotrienoles protect ApoE +/- mice from diet-induced atheroma formation. J Nutr. 2000; (19): 2420-6
27. Morel D, DiCorleto P, Chisolm G. Endotelial and smooth muscle cells alter low density lipoprotein in vitro by free radical oxidation. Arteriosclerosis. 1984; (4): 357-64
28. Rissanen T, Voutilainen S, Nyssonen K, Salonen J. Atherosclerosis and coronary heart disease. Exp Biol Med. 2002; (10): 900-7
29. Sundram K, Sambanthamurthi R, Tan YA. Palm fruit chemistry and nutrition. Asia Pac J clin Nutr. 2003; (3): 355-62
30. Shafiee M, Carbonneau M, d´Huart J, Descomps B, Legar C. Synergistic antioxidative properties of phenolics from natural origin toward low-density lipoproteins depends on the oxidation system. J Med Food Summer. 2002; (2): 69-78
31. Kritchevsky D. Impact of red palm oil on human nutrition and health. Food Nutr Bull. 2002; (2): 182-7
32. Gapor AB, Berger KG, Hashimoto T, et al. Effects of processing on the content and composition of tocopherols and tocotrienols in palm oil. In: Pushparajah E, Rajadurai M, eds. The palm oil product technology in the eighties. Kuala Lumpur: Incorporated Society of planters 1983: 145-56
33. Arrol S, Mackness MI. Durrington PN. Vitamin E supplementation increases the resistence of both LDL and HDL to oxidation and increases cholesteryl ester transfer activity. Atherosclerosis. 2000; (150): 129-34
34. Giacopini MI, Ortiz H, Bosch V. Oxidación de las lipoproteínas de alta y baja densidad del plasma humano y su correlación con los ácidos grasos de los fosfolípidos. Rev Fac Med. UCV. 2002;(25): 17-19
35. Markwell M, Hass S, Bieber L, Tolbert N. A modification of the Lowry procedure to simplify determination in membrane and lipoprotein samples. Anal Biochem. 1978; (87): 206-10
36. Arrol S, Mackness MI, Durington PN. Vitamin E supplementation increases the resistance of both LDL and HDL to oxidation and increases cholesteryl ester transfer activity. Atherosclerosis. 2000; (150): 129-34
37. Pinchuk I, Lichtenberg D. The mechanism of action of antioxidants against lipoprotein peroxidation, evaluation based on kinetic experiments. Progr Lip Res. 2002; (41): 279-314
38. Folch J, Lees M, Sloane GH. A simple method for the isolation and purification of total lipids from animal tissue. J Biol Chem. 1957; (228): 497-509
39. Kang K, Cherian G y Sim J (1998) Tocopherols, retinol and carotenes in chiken egg and tissues as influenced by dietary palm oil. J Food Sci. 63(4): 592-5
40. Esterbauer H, Striel G, Puhl H, Rotheneder M: Continuous monitoring of in vitro oxidation of human low density lipoprotein. Free Radic Res Commun. 1989; (6): 67-75
41. Esterbauer H, Jurgens G, Quehenberger O, Koller E: Auto-oxidación of human low density lipoprotein: loss of polyunsaturated fatty acids and vitamin E and generation of aldehydes. J Lipid Res. 1987; (28): 495-509
42. Esterbauer H, Dieber-Rotheneder M, Waeg G, Striegl G, Jürgens G: Biochemical, structural and functional properties of oxidized low-density lipoprotein. Chem Res Toxicol. 1990; (3): 77-92
43. Black T, Wang P, Maeda N, Coleman R. Palm tocotrienols protect apoE +/- mice from diet-induced atheroma formation. J Nutr. 2000; (19): 2420-6
44. Coni E, Benedetto R, Pasquale M, Masell R, Modesti D, Mattei R, Carlini E. Protective effect of oleuropein, an olive oil biophenol, on low density lipoprotein oxidizability in rabbits. Lipids.2000; (35): 45-54
45. Glomset JA. The plasma lecithin-cholesterol acyltransferase reaction. J Lipid Res. 1968; (9): 155-167
46. Rubin EM, Krauss RM, Spangler EA, Vertuyfit JG, Clift SM. Inhibition of early atherogenesis in transgenic mice by human aoilipoprotein AI. Nature. 1991; 19 Sept. (353): 265-67
47. Badimon JJ, Badimon L, Fuster V. Regression of atherosclerotic lesions by high density lipoprotein plasma fraction in the cholesterol-fed rabbit. J Clin Invest. 1990; (85): 1234-41
48. Miyazaki A, Rahim AT, Ohta T, Morino Y, Horiuchi S. High density lipoprotein mediates selective reduction in cholesteryl esters from macrophage foam cells. Biochim Biophys Acta. 1992; (1126): 73-80
49. Macness M, Arrol S, Abbot C, Durington P. Protection of low density lipoprotein against oxidative modification by high density lipoprotein associated paraoxonase. Atherosclerosis. 1993; (104): 129-35
50. Watson AD, Berliner JA, Hama SY, Ladu BN, Fault KF, Fogelman AM et al. Protective effect of high density lipoprotein associated paraoxonase. J Clin Invest. 1995; (96): 2882-91
51. Rifici VA, Khachadurian AK. Effects of dietary vitamin C and E supplementation on the copper mediated oxidation of HDL and on HDL mediated cholesterol efflux. Atherosclerosis. 1996; (127): 19-36
52. Bonnefont-Rousselot D, Motta C, Khalil AO, Sola R,
53. Ismail NM, Abdul Ghafar N, Jaarin K, Khine JH, Top GM. Vitamin E and factors affecting atherosclerosis in rabbits fed a cholesterol-rich diet. Int J Food Sci Nutr.2000; (51): S79-94
54. Ganaffa AA, Socci RR, Eatman D, Silvestrov N, Abukhalaf IK, Bayorh MA. Effect of palm oil on oxidative stress-induced hypertension in Sprague-Dawley rats. Am J Hypertens. 2002; (8): 725-31
55. Pereira TA, Shahi GS, Das NP. Effects of dietary palm oil on serum lipid peroxidation, antithrombin III, plasma cyclic AMP, and platelet aggregation. Biochem Med Metab Biol. 1991; (3): 326-32
56. Princen HMG, van Poppel G, Vogelezang C, Buytenhek R, Kok FJ. Supplementation with vitamin E but not β-carotene in vivo protects low density lipoprotein from lipid peroxidation in vitro. Arteriosclerosis and thrombosis 1992; (12): 554-562