Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT v.27 n.1 Caracas jun. 2008
Estrés y vitaminas antioxidantes en pacientes diabeticos Tipo 2
Sánchez M. Maribel C1, Rodríguez A. Rubén A.1, Martín D. Verónica2, Sepúlveda P. Liliana E.3, Sutil N. Rosalía4, Contreras Freddy5, Mary Lares6, Eukaris Maurera7.
1Residente Post grado de Cirugía General
2Residente de Medicina Interna Hospital Dr. Victorino Santaella Ruiz, Coordinadora del Ambulatorio Eloina Zapata. Venezuela.
3Residente Hospital Dr. Victorino Santaella Ruiz, Venezuela.
4Profesor Titular Departamento de Farmacología, Facultad de Ciencias de la Salud, Universidad de Carabobo – Valencia. Venezuela.
5Médico Internista, Prof Agregado Fisiopatología FM-UCV. Venezuela.
6Biólogo. Dra. en Nutriciòn. Escuela de Nutrición UCV, Venezuela.
7Médico Rural
Resumen
La hiperglicemia incrementa la producción de radicales libres, sobrepasando la capacidad defensiva antioxidante. Objetivo: determinar el estrés oxidativo, defensa antioxidante y el consumo de alimentos ricos en vitaminas A y E, en 24 pacientes de 35-55 años con diagnóstico reciente de diabetes tipo 2, que acudieron a la Consulta de Diabetes del HUAL en el 2004 y del HVS en el 2005 Metodología: Se determinó la concentración de malondialdehido (MDA) para evaluar el estrés oxidativo, a través del método de sustancias reactivas al ácido tiobarbitúrico (TBARS). La defensa antioxidante mediante la determinación sérica de vitamina A y E por cromatografía líquida de alta eficiencia. El colesterol total (CT) y los triglicéridos (TG) por el método enzimático colorimétrico y el consumo de alimentos ricos en antioxidantes a través de un cuestionario de consumo. Resultados: El MDA estuvo dentro de límites normales (1,617±1,520mm/l), las vitaminas antioxidantes A, E y E estandarizada a los lípidos se encontraron por debajo del punto de corte antioxidante (44,372 ± 25,411µg/dl y 1051,704 ± 499,805 µg/dl y 1.090,041 ± 665,89 µg/dl respectivamente), el consumo de vitamina E fue 16.432,02 ±22.552,55 µg, mientras que el de vitamina A alcanzó valores de 1.863,325 ± 1.559,677 µg. En conclusión, no se encontró estrés oxidativo en etapas tempranas de la Diabetes, pero sí una disminución de los niveles séricos de las vitaminas A y E que puede ser atribuida a la disminución del consumo de la vitamina E, ya que la vitamina A se encontraba por encima de los niveles antioxidantes.
Palabras Claves: Diabetes Mellitus (DM).Estrés Oxidativo, Vitaminas antioxidantes.
Abstract
Hyperglicemia increases free radicals generation, surpassing the antioxidant defense capacity. Objective: to assess the oxidative stress, antioxidant defense, and consumption of food rich in vitamins A and E, in 24 patients aged 35-55 years with recent diagnosis of type 2 diabetes, attending to the HUAL Diabetes Unit Care in 2004 and the HVS Diabetes Unit Care in 2005. Methodology: The malon-dialdehyd (MDA) concentration was assessed to evaluate the oxidative stress using the tio-barbituric acid-reactive substances (TBARS) method. The antioxidant defense was assessed by the serum concentration of vitamins A and E through high-performance liquid chromatography; total cholesterol (CT) and triglycerides (TG) were assessed by the colorimetric enzymatic method and the consumption of food rich in antioxidants, using a food-consumption questionnaire. Outcomes: MDA was within normal limits (1.617±1.520mm/l); antioxidant vitamins A, E, and lipids-standardized vitamin E, were below the cut-off point for antioxidants (44.372±25.411µg/dl, 1051.704±499.805 µg/dl and 1090.041±665.89 µg/dl respectively); the vitamin E consumption was 16432.02 ±22552.55 µg, and the vitamin A consumption reached values of 1863.325±1559.677 µg. Conclusions: An oxidative stress in early stages of Diabetes was not observed, except for a decrease in serum levels of vitamins A and E, which can be due to the decrease in the consumption of vitamin E, as the vitamin A was above the antioxidant levels.
Key Words: Diabetes mellitus (DM), Oxidative stress, antioxidant vitamins.
Recibido: 06/01/2008 Aceptado: 05/03/2008
Introducción
La diabetes es definida como un trastorno metabólico caracterizado por el aumento de los niveles de glicemia, debido a una menor disponibilidad de la insulina, causada por la resistencia periférica de esta hormona, disfunción secretora o ambas. Por su larga evolución, es considerada como un trastorno crónico, de base genética, que afecta con mayor frecuencia a individuos mayores de 40 años1.
Hoy en día, representa un problema de salud pública, con una elevada prevalecía a nivel mundial. En Venezuela, más de un millón de personas padecen de diabetes, de las cuales la mitad se encuentran sin diagnóstico. De los casos diagnosticados, el 78% son diabéticos tipo 2, el 17,9% son diabéticos tipo 1 y un 4,1% pertenecen a otros tipos de diabetes2. En el estado Carabobo, existe un alto índice de pacientes con esta enfermedad; encontrándose que en el último semestre del año 2001, 360 personas fueron diagnosticadas como diabéticos; de éstos, 23 (6,38%) fueron diabéticos tipo 1, 324 (90%) diabéticos tipo 2 y 13 (3,61%) pertenecen a otros tipos de diabetes3. Los niveles elevados de glicemia desencadenan mecanismos de defensa, entre los cuales están: la proteolisis en el músculo y la gluconeogénesis a partir de aminoácidos y de intermediarios del ciclo del ácido cítrico en el hígado, la oxidación de ácidos grasos y la formación de cuerpos cetónicos. Estas alteraciones llevan a cambios en indicadores bioquímicos que sugieren una posible situación de estrés oxidativo4. Se ha postulado que el mecanismo por el cual la hiperglicemia produce estrés oxidativo, es a través de la vía de los polioles y el aumento de la autoxidación de la glucosa, que operando de manera conjunta, causan el aumento de los radicales libres, los cuales a su vez desencadenan daño general a las proteínas mediante la fragmentación y oxidación de los lípidos5,6.
La importancia de este estudio radica en el análisis del comportamiento del sistema oxidante-antioxidante en un grupo de pacientes con diagnóstico reciente de DM (menor a cinco años); esto con el fin de detectar modificaciones en etapas tempranas que reflejen estrés oxidativo para así ofrecer un nuevo enfoque en el tratamiento de esta patología. Se disminuiría así la incidencia de sus complicaciones y por consiguiente, se aumenta la sobrevida de los pacientes. Fue determinado en los pacientes estudiados, el nivel de estrés oxidativo mediante sustancias reactivas al ácido tiobarbitúrico (TBARS), el nivel sérico de vitamina A (retinol), vitamina E (alfatocoferol), con corrección de la cifra absoluta de ésta última en función de los niveles de colesterol total y triglicéridos. Asimismo, se describeel consumo de alimentos ricos en vitaminas antioxidantes y se relaciona el nivel de estrés oxidativo con el de vitaminas antioxidantes A, E y E estandarizada, y el nivel de las vitaminas A y E con el consumo de las vitaminas.
Pacientes, materiales y métodos
Esta investigación corresponde a un estudio descriptivo tipo transversal y de campo. Se trabajo con individuos diabéticos tipo 2, ya diagnosticados según los parámetros establecidos por la Asociación Americana de Diabetes, citado en el Consenso Nacional de Diabetes Venezuela 20037. Estos sujetos pertenecen a ambos sexos, porque no se ha descrito ninguna relación entre el sexo y la DM; se espera que la no consideración de esta variable no interfiere en los resultados. Sus edades están comprendidas entre 35-55 años, ya que a esta edad es cuando se realizan la mayoría de los diagnósticos de DM. Tienen un tiempo de diagnóstico menor a 5 años y para el momento de su enrolamiento al estudio no recibían vitaminas antioxidantes, ni presentaban complicaciones agudas o crónicas de dicha enfermedad. Es importante señalar que todos ellos fueron seleccionados de los pacientes que acuden a la Consulta de Diabetes del Hospital Universitario Dr. Ángel Sarralde (HUAL) y del Hospital Dr. Victorino Santaella Ruiz (HVS).
Se le elaboró una historia clínica por cada paciente para evaluar los parámetros que incidieran en el desarrollo del estrés oxidativo y el manejo de la intolerancia a la glucosa (Ver anexo 1). De la misma manera, fue determinado el consumo de antioxidantes a través de un cuestionario de frecuencia de consumo de alimentos ricos en vitaminas antioxidantes validado y estandarizado por Yépez y cols8 (Ver anexo 2). Posteriormente, se tomó una muestra sanguínea a cada paciente, previo ayuno de 12 horas, con el fin de realizar las determinaciones correspondientes al estudio.
Determinación de Malondialdehido (MDA): Según método estandarizado por Cano y Cols9 y modificado en la Clínica de Dislipidemias, Departamento de Farmacología-medicina, Valencia. La peroxidación lipídica da origen a transformaciones profundas de la membrana celular, dando lugar a una serie de productos de descomposición como el malondialdehido (MDA), el cual se emplea como indicador directo del daño celular y de la peroxidación lipídica.
Para su determinación se emplea el método colorimétrico de sustancias reactivas al ácido tiobarbitúrico (TBARS). Esta técnica se fundamenta en un procedimiento que comprende una etapa de precipitación proteica, durante la cual se incorporael ácido tiobarbitúrico que produce una reacción directa con la fracción de malondialdehido presente en el suero. Esta fracción fue separada del mismo agregando butanol. El producto de MDA se determinó por colorimetría en un espectrofotómetro a una longitud de onda de 532 nm9,10.
Determinación de Alfa-Tocoferol y Retinol: Se determinó a través de cromatografía líquida de alta eficiencia, conocida como cromatografía líquida de fase reversa (HPLC), según el método desarrollado por el Internacional Vitamina A Consultive Group (IVACG)11 y estandarizado para vitamina A y vitamina E por Márquez y Cols12. Este método consiste en la partición de la muestra de suero en una fase estacionaria hidrofóbica (frecuentemente cadena C-18 enlazadas covalentemente a partículas de sílice) y una fase móvil polar. El tiempo en el cual los compuestos de la muestra fluyen dependen de su polaridad. La detección de los componentes separados por HPLC se realizó espectrofotométricamente, (rango UV para retinol y retinil acetato). La cuantificación de los componentes se logró por comparación de las alturas de los picos con las de los estándares de las curvas (analítico y estándar interno). La adición de un estándar interno (all trans retinil acetato) ayuda a la corrección por pérdidas durante la extracción y análisis12.
Determinación sérica de colesterol total, triglicéridos y estandarización de vitamina E: Al suero obtenido de los pacientes se le determinó TG y CT mediante el método enzimático colorimétrico. Esta determinación de lípidos es utilizada para prevenir un error al clasificar las deficiencias de vitamina E en pacientes con alteraciones lipídicas, no solamenteporque existe relación estadísticamente significativa con los lípidos, sino porque el grado de deficiencia clínica de esta vitamina, produce daño a la membrana celular. Así mismo, los indicadores de peroxidación lipídica in vivo se correlacionan con el tocoferol solamente después de que los valores absolutos de vitamina E se estandarizan o ajustan con los lípidos12,13,14.
Consumo de fuentes de alimentos ricos en vitaminas antioxidantes: El consumo de alimentos ricos en vitaminas A y E se realizó a través de una metodología semicuantitativa (cuestionario de frecuencia), validado y estandarizado por los médicos nutrólogos Yépez y Cols8, donde se registra la cantidad promedio de porciones consumidas diaria, semanal y mensual. Cada porción fue especificada en un tamaño estándar.
El cuestionario contiene una lista de 40 alimentos, los cuales se seleccionaron como las mayores fuentes de vitaminas A y E en su función antioxidante. Los cálculos para determinar las cantidades de vitaminas antioxidantes provenientes de cada alimento se realizaron tomando como referencia los valores referidos en las tablas de composición de alimentos publicados en el Instituto Nacional de Nutrición15 y para el caso de la vitamina E que no existen datos en las mencionadas tablas, se tomaron como referencia los datos publicados por Mahan y Arlin16.
Analisis estadístico
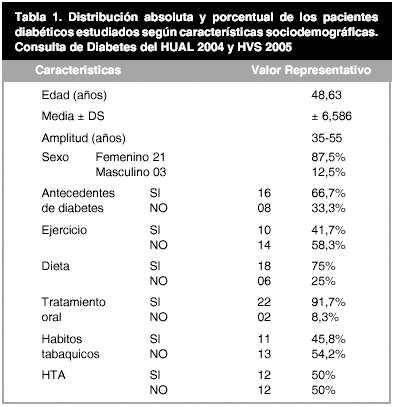
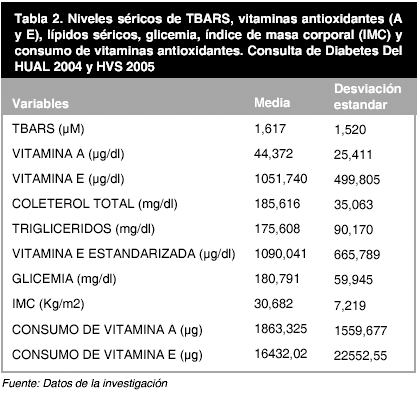
Se calculó frecuencia y porcentaje en el caso de las variables nominales (Tabla 1) y en el caso de las variables continúas se calculó la media y la desviación estándar (Tabla 2).
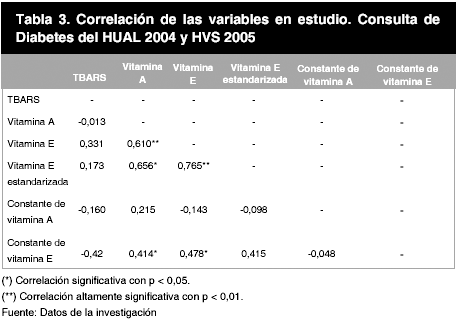
Se comprobó si la distribución era Normal o no usando la prueba Kolmogorov-Smirnoff para una sola muestra. Para las correlaciones bivariadas del TBARS respecto a las variables dependientes se utilizo el coeficiente no paramétrico de Spearman. (Tabla 3).
Se construyó un modelo de regresión lineal múltiple, en este, la variable dependiente fue el TBARS, las variables independientes o explicativas fueron vitamina A (VitA), vitamina E (VitE), vitamina E estandarizada (VitEs), consumo de vitamina A (ConsVitA) y consumo de vitamina E (ConsVitE), previo a este análisis, se estimaron los coeficientes de correlación rho de Spearman.
El procedimiento utilizado fue de eliminación hacia atrás; del total de variables introducidas en el modelo de regresión, solo 3 resultaron estadísticamente significativas y fueron: vitaminaA, vitamina E y constante de vitamina A. La variación porcentual explicada de estas 3 variables fue 83,2% (esto indica que el 83,2% de la variación de TBARS se debe al cambio en las variables explicativas o independientes). Se considero un valor significativo si p < 0,05 y altamente significativo si p < 0,01.
Se considero un valor significativo si p < 0,05 y altamente significativo si p < 0,01.
El modelo final resultó estadísticamente significativo y fiable. F = 6,003 (p = 0,019).
Se evidenció disminución en 0,0306 unidades de TBARS por cada aumento en una unidad de vitamina A (t = 3,278; p = 0,011); también se encontró aumento en 0,0016 unidades de TBARS por cada aumento en una unidad de vitamina E (t = 3,698; p = 0,006) por último, se evidenció aumento de TBARS en 0,00033 unidades por cada aumento en una unidad de la constante de vitamina A (t = 3,250; p = 0,012); las variables excluidas fueron: constante de vitamina E y vitamina E estandarizada.
Un estudio previo de la colinealidad demostró que la tolerancia no excede el valor mínimo, siendo la vitamina A la más contributaria (0,734) seguido por la vitamina E (0,659) y por último la constante vitamina A (0,603). El factor de inflación de varianza resultó óptimo en ese sentido (FIV > 1) lo que indica ausencia de colinealidad entre las variables independientes. Así, el modelo final de regresión lineal múltiple vendría dado por:
TBARS = -0,0146 - 0,0306 VitA + 0,0016 VitE + 0,00033 ConsVitA
Resultados
La edad de los pacientes estudiados estuvo comprendida entre los 35 y 55 años, con una edad media de 48,63 años. El tiempo de diagnóstico de diabetes fue inferior a 5 años. El mayor porcentaje de personas diabéticas lo obtuvo el sexo femenino, con el 87,5%, en contraste con el sexo masculino que fue de 12,5%. Del total de las muestras, el 66,7% tiene antecedentes de diabetes.
En cuanto al ejercicio, el 41,7% de los pacientes realizaban ejercicio, mientras que el restante 58,3% no realizaban ningún tipo de actividad física. El 75% Cumplía con la dieta adecuada a esta patología, como parte del tratamiento, en contraste con un 25% que no lo hacen. El 91,7% tiene tratamiento vía oral y un 8,3%, aun no tienen tratamiento. En relación con los hábitos tabáquicos, el 45,8% fuma y el 54,2% no. Por ultimo, se encuentra que la mitad (50%) de los pacientes diabéticos cursan además con hipertensión arterial (HTA) y la mitad restante no cursa ni con ésta ni con ninguna otra patología relevante.(Tabla 1).
En la tabla 2, se observan los valores promedios y Desviaciones Standard de las variables cuantitativas analizadas en estos pacientes diabéticos. El valor promedio de TBARS fue de 1,617 ± 1520 µM de MDA. Los niveles séricos de vitamina A fueron de 44,372 ± 25,411 µg/dl, mientras que los niveles séricos de vitamina E fueron de 1051,740 ± 499,805 µg/dl. Se determinó el nivel sérico de colesterol total con un valor de 185,616 ± 35,063 mg/dl y los triglicéridos con niveles de 175,608 ± 90,170 mg/dl. Con los lípidos se estandarizó la vitamina E obteniéndose valores de 1090,041 ± 665,789 µg /dl. La glicemia mostró cifras de 180,791 ± 59,945 mg/dl. El índice de masa corporal (IMC) resultó con valores de 30,682 ± 7,219 Kg/m2. El nivel de consumo de vitaminas antioxidantes fue para la vitamina A de 1863,325 ± 1559,677 µg y para la vitamina E de 16432,02 ± 22552,55 µg.
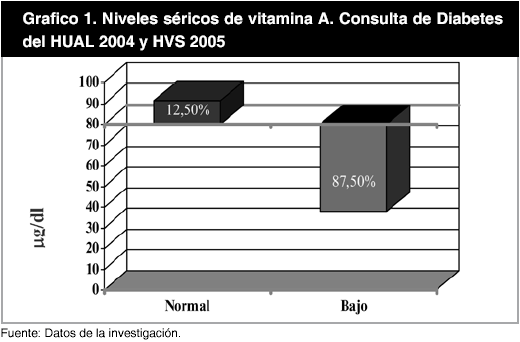
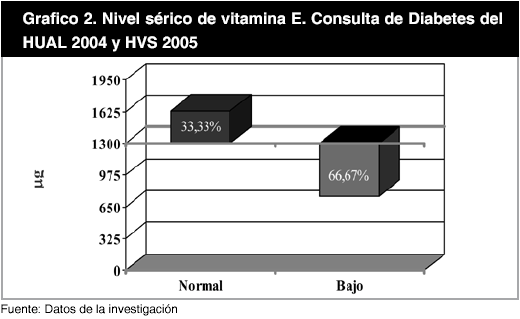
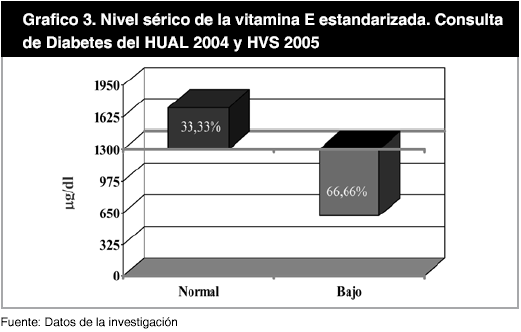
Por otra parte, al aplicar el punto de corte antioxidante para los niveles séricos de las vitaminas analizadas, se encontró que para la vitamina A (80 µg /dl), el 87,50% de los pacientes estaba por debajo del nivel antioxidante deseable, presentando un promedio de 39,47 ± 20,42 µg/dl y solo el 12,50% de los pacientes presentaron niveles antioxidantes deseables; con un valor promedio de 92,68 ± 5,33 µg/dl. Este hecho se mantuvo en cuanto a la vitamina E, en donde el 66,67% estuvo por debajo de 1300 µg/dl, nivel correspondiente a α-tocoferol, con una media de 701,15 ± 304,19 µg/dl, mientras que un 33,33% de los pacientes alcanzaron niveles séricos antioxidantes, con un valor promedio de 1.646,32 ± 218,66 µg/dl. Al estandarizar la vitamina E a los lípidos TG y CT se obtuvo que un 33,33% presentó un valor promedio de 1.718,08 ± 291,92 µg/dl y un 66,66% por debajo del punto de corte con una media de 616,38 ± 281,48µg/dl (Gráfico 1, 2 y 3).
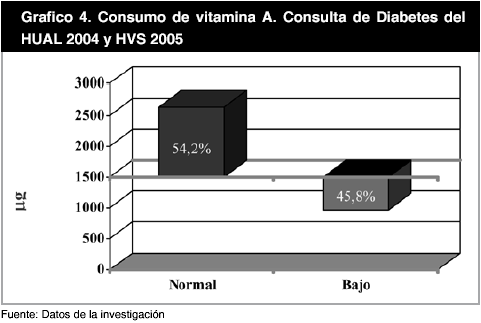
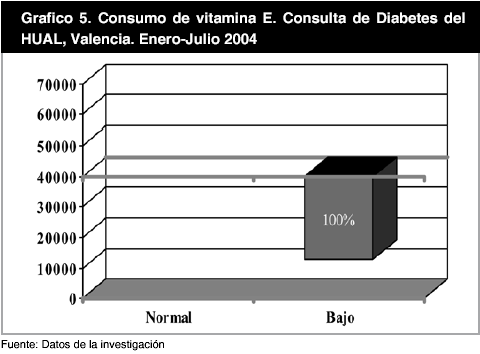
El nivel de consumo de vitaminas antioxidantes fue igualmente representado a través de gráficos, de tal manera que en el gráfico 4 se observa como el 45,8% de la población en estudio presenta un consumo de vitamina A inferior a 1.500 µg y el 54,2% restante se encuentra por encima de este valor (Gráfico 4), mientras que el segundo grupo expreso valores promedios de 2.948,34 ± 2.097,21 µg. Al analizar el consumo de la vitamina E, se encontró que todos los individuos estudiados (100%), se encontraban por debajo del punto de corte conocido (40.000 µg), presentando como nivel promedio 12.907,95 ± 9.207,76 µg (Gráfico 5).
Entre la vitamina A y E se encontró una relación directa y altamente significativa de 0,610 (p < 0,01),. De igual manera, existe una correlación directa y significativa entre la vitamina A y la vitamina E estandarizada de 0,656 (p < 0,05). Otra correlación significativa encontrada fue entre la vitamina E y E estandarizada, con una magnitud de 0,765 (p < 0,01). Por último, hubo correlación moderada entre el consumo de vitamina E con valor sérico de vitamina A, E y E estandarizada. (Tabla 3).
Discusión
Los sujetos estudiados, estaban dentro de un grupo etáreo de 35 -55 años, con una media de 48,63 años, coincidiendo con la publicación del Consenso Nacional de Diabetes Tipo 27, donde se reporta que el rango de edades entre 45 a 64 años es responsable de la mayor prevalencia de DM, representando a nivel mundial un 44% del total de individuos con esta enfermedad; un 35% en los Países Desarrollados y un 49% en los Países en vías de Desarrollo. En cuanto al sexo, estos mismos autores hacen referencia a que existe una mayor prevalencia de la Diabetes en el género femenino que en el masculino, lo cual coincide con el presente estudio donde se encontró que el 83,3% de los pacientes estudiados pertenecían al sexo femenino.
En cuanto a los antecedentes familiares, tal como se mencionó anteriormente, la DM tiene una base genética1 hecho que es corroborado en este estudio, donde el 66,7% de la población estudiada presentó antecedentes familiares de esta patología. Otro parámetro a considerar en la historia clínica fue el ejercicio físico, observándose que sólo el 41,7% de los individuos de este estudio, realizan actividad física. Además, se consideraron sólo algunos aspectos específicos de la dieta en la Diabetes. El tratamiento dietético persigue básicamente dos objetivos: normalizar el peso (por lo general excesivo en la DM), y contribuir a la consecución de la normoglicemia17; en este grupo de pacientes estudiados un 75% mantienen un control dietético adecuado para esta patología.
Otra característica valorada fue la presencia de hábitos tabáquicos, los cuales son capaces de incidir directamente en el desarrollo de estrés oxidativo, y en consecuencia, provocar la aparición de las complicaciones en el paciente diabético17; sin embargo, se encontró que menos de la mitad de los sujetos estudiados (45,8%), en algún momento de su vida presentaron hábitos tabáquicos.
No sólo los hábitos tabáquicos son causantes de las complicaciones cardiacas en los diabéticos, también se ha encontrado una estrecha relación entre esta enfermedad y la HTA, dada por una serie de mecanismos fisiopatológicos dentro de los cuales se destaca un posible efecto a nivel del sistema nervioso central (SNC) entre la intolerancia glucosada y la HTA. Otro mecanismo implicado en este hecho es el papel que ejerce la insulina en la reabsorción de sodio a nivel de los túbulos renales, encontrándose que pequeños aumentos en los niveles de insulina plasmática, causan un mayor reabsorción de sodio y por ende HTA, hecho que se evidencia más que todo en los pacientes diabéticos tipo 2. De la misma manera, alteraciones en el sistema renina-angiotensina causan un incremento en la sensibilidad del endotelio a las catecolaminas, y por lo tanto vasoconstricción18. En este sentido un 50% de los individuos ya cursaban con HTA, aún cuando estaban en control médico.
En lo referente al índice de masa corporal (IMC), destaca el hecho de que los individuos en estudio presentan una clara tendencia a desarrollar obesidad; diferentes estudios19,20 concuerdan con estos resultados, destacando la estrecha relación entre DM y obesidad.
Los valores de glicemia (180,791 ± 59,945 mg/dl) reflejan el mal control metabólico que tienen estos pacientes, bien sea por transgresiones dietéticas, sedentarismo, incumplimiento del tratamiento o instauración inadecuada del mismo, hecho que fomenta el desarrollo del estrés oxidativo en esta patología, lo cual concuerda con lo reportado por Kimoto y Cols21,22.
La determinación del MDA permite establecer de manera directa el daño celular producido por la peroxidación lipídica, el cual puede ponerse en evidencia a través del TBARS. Elejalde, et al; 200123 han utilizado el MDA como un indicador del estrés oxidativo en enfermedades como diabetes, accidentes cerebro vasculares, enfermedad de Alzheimer, Insuficiencia renal, infarto del miocardio, Colitis ulcerosa, pancreatitis, cáncer, entre otros Clapés, et al;24, evaluaron el estrés oxidativo en 30 pacientes diabéticos con más de 8 años de diagnóstico y un adecuado control representado por sujetos sanos; determinaron el MDA mediante TBARS, encontrando valores significativamente superiores en pacientes diabéticos (8,33 ± 2,90nm/ml), en comparación con los individuos sanos (4,51 ± 1,40nm/ml). También determinaron la concentraciòn de glutatión reducido (antioxidante endógeno), el cual demostró valores más bajos en los sujetos diabèticos (4,75 ± 2,31nm/ ml) en contraste con los sujetos control (8,30 ± 1,52 nmol/ml). De igual forma se reportò una disminución significativa de la enzima catalasa, con valores de 16,21 ± 18,25 contra 65,78 ± 24,78 U/ml, mientras la enzima superóxido dismutasa tuvo una disminución no significativa, concluyendo que las alteraciones bioquímicas observadas en los pacientes diabéticos tipo 2, estaban íntimamente relacionadas con el desarrollo de las complicaciones de esta enfermedad.
El presente trabajo evidencia hallazgos distintos al evaluar el estrés oxidativo en pacientes diabéticos, mediante determinación de MDA. La obtención de valores en rangos considerados como normales (1,617 ± 1,520µM) puede ser atribuido al escaso tiempo de exposición de los sujetos de estudio a la enfermedad, pues los mismos se encontraban en de los primeros años de diagnóstico de la DM, muchos de ellos tratados farmacológicamentes; por lo que se puede decir que el estrés oxidativo aún no se había manifestado en esta etapa de la DM. Estos datos concuerdan con los hallazgos reportados por Dierckx y Cols22, quienes informaron niveles de MDA disminuidos en pacientes diabéticos (0,687 ± 0,212 µM), además, lo compararon con un grupo control de pacientes sanos (0,545 ± -0,101 µM), reportando niveles mucho menores de MDA. El presente estudio a su vez contrasta con el estudio de Chugh y Cols25, quien encontró niveles significativamente altos de MDA en pacientes diabéticos de reciente diagnóstico.
En relación al valor sérico de las vitaminas antioxidantes, vitaminas A y E, las cuales arrojaron valores de 44,372 ± 25,411 µg/dl y 1051,740 ± 499,805µg/dl respectivamente, lo cual representan valores antioxidantes que se encuentran por debajo de lo considerado como normal (80µg/dl para vitamina A y 1300µg/dl para vitamina E). Este resultado indica un incremento del riesgo de presentar daños celulares que afectan la fisiología de distintos órganos y tejidos, tales como: endotelio, miocardio, riñón y SNC entre otros; como consecuencia de un aumento en la producción de radicales libres, reflejada en el incremento de la peroxidación de lípidos y proteínas, lo cual debilita de manera importante la defensa antioxidante en este grupo de pacientes14.
Torres y Cols26, en un estudio realizados en 10 ratas wistar diabéticas y 10 ratas control, encontraron que las ratas diabéticas tenían niveles de vitaminas A y E muy por debajo del grupo control, lo cual demuestra, que en la diabetes está presente una alteración en el estatus antioxidante aún cuando estos resultados no se pueden extrapolar al humano, en el presente estudio también se encontraron valores de las vitaminas antioxidantes inferiores al punto de corte internacional. De la misma manera, West27, tras realizar una investigación en pacientes diabéticos tipo 1 y 2, evidenció el daño oxidativo en estos pacientes y una disminución tanto de enzimas como de vitaminas antioxidantes. El autor concluye que en el estatus redox celulary la defensa antioxidante podrían pasar a jugar un papel importante en la diabetes y en el síndrome metabólico. Otro estudio fue el realizado por Maxwell y Cols28, quienes determinaron la actividad antioxidante y la producción de radicales libres en muestras serológicas de pacientes con diabetes mellitus insulino dependiente (DMID) y no insulino dependiente (DMNID), ambos grupos sin complicaciones, y lo compararon con un grupo control de sujetos no diabéticos. Se obtuvo que los pacientes con DMID y con DMNID, mostraron niveles de vitamina C y E muy bajas, mientras que en el grupo control los niveles de estas vitaminas eran normales; los autores llegaron a la conclusión de que un defecto significativo en la defensa antioxidante incrementaría la vulnerabilidad al daño oxidativo y el desarrollo de las complicaciones en la diabetes.
En los individuos involucrados en el presente estudio se encontraron valores séricos de colesterol total dentro de rangos aceptables (185,616 ± 35,063 mg/dl), según los parámetros establecidos por el Consenso Venezolano de Lípidos 200229. Sin embargo, los niveles séricos de TG presentaron un ligero incremento (175,608 ± 90,170 mg/dl). Esto coincide con el estudio realizado por Sandoval y cols30 y con el de Cuneo31, quienes estudiaron niveles séricos de lípidos en pacientes diabéticos y encontraron niveles normales de colesterol y una hipertrigliceridemia, de leve a moderada.
El consumo de vitamina A en los pacientes fue inferior a 1.500µg en el 50% de los pacientes con un valor promedio de 1.023,81 ± 307,09µg y en el 50% restante, se obtuvo un valor promedio de 2.948,34 ± 2.097,21µg. Analizando la muestra de forma global se encontró un valor de 1986,07 ± 1,75µg. En cuanto a la vitamina E el (100%) de los sujetos estudiados tenían consumo por debajo de los niveles mínimos antioxidantes (40.000µg), con un nivel promedio 12.907,95 ± 9.207,76µg,
Algunos autores aseguran que la dieta no guarda relación con el nivel sérico de vitaminas antioxidantes22; lo cual está en concordancia con este estudio, donde el valor promedio de consumo de vitamina A estuvo por encima de los requerimientos exigidos como antioxidantes; mientras los niveles séricos de esta vitamina, se encontraron por debajo de los mismos. En cuanto a la vitamina E, se encontró que tanto el consumo y el nivel sérico de nuestros pacientes se encontraba por debajo de los niveles antioxidantes.
Blanco y Cols19 estudiaron el consumo de vitaminas antioxidantes (A y E), de Zinc y cobre, observando una disminución en el consumo de la vitamina A; a diferencia de lo encontrado en el presente estudio. Con relación a la vitamina E, estos autores reportan un incremento de la misma, hecho que no concuerda con nuestra investigación.
Un dato importante encontrado en esta investigación, fue la relación directa entre los niveles séricos de las vitaminasA y E, es decir, que al encontrarse disminuidos los niveles séricos de la vitamina A, también estaban disminuidos los niveles séricos de la vitamina E y E estandarizada. Por su parte, el TBARS no presentó correlación con las vitaminas A y E. Este hecho resulta paradójico si lo comparamos con otros estudios como el realizado por Blanco y cols19, quienes señalan que los antioxidantes producen disminución en los marcadores de estrés oxidativo. Otro estudio que apoya el hecho de que las vitaminas antioxidantes causan disminución en los marcadores de estrés oxidativo es el realizado por Chugh y Cols25, quienes determinaron el nivel de estrés oxidativo, en un grupo de pacientes con DMIN y Otros con DMNID, ambos con diagnóstico reciente. Este grupo obtuvo niveles de malonil-dialdehído significativamente altos y una disminución de los niveles de glutatión y de vitamina E durante la etapa no controlada de diabetes, indicando la producción de radicales libres, inducidos por la peroxidación lipídica. Después de 4 semanas de suplementación con vitamina E los niveles de MDA disminuyeron y aumentaron los nivelesde glutatión sugiriendo un efecto beneficioso de la vitamina E. Los autores demostraron que fue una evidencia de estrés oxidativo en diabetes cuando posterior a la suplementación de vitamina E, se obtuvo una disminución de los marcadores de estrés oxidativo.
Con base a los datos obtenidos, se concluye que el indicador utilizado para la detección de la presencia de estrés oxidativo (MDA) arrojó un valor sérico que corresponde a lo establecido como normal de tal manera que el estrés oxidativo en esta etapas temprana no fue lo suficientemente importante y significativo para manifestarse en este grupo de diabéticos.
En cuanto a los niveles de defensa antioxidante de estos individuos, representados por las vitaminas A y E, estuvieron disminuidos, al igual que los niveles séricos de vitamina E estandarizados a los lípidos. En este sentido los niveles séricos de vitamina E por debajo del punto de corte antioxidante pudieran atribuirse al bajo consumo de vitamina a través de las fuentes exógenas que la proveen. Por lo tanto, aún tomando en cuenta el tamaño muestral, como una limitación, estos resultados pudieran sugerir la suplementación racional de antioxidantes en este tipo de pacientes, con el objetivo de retardar la aparición del estrés oxidativo y por ende aparición de las complicaciones de la diabetes tipo 2. Sin embargo se requieren nuevos estudios que corroboren este planteamiento.
Referencias
1. Fauci A, Braunwald E, Isselbacher K, Wilson J, Martin J, Kasper D, Hauser S, Longo D. Harrison principios de medicina interna. Vol. 2. 14a ed. Madrid: España, Editorial McGraw-Hill interamericana; 1998. [ Links ]
2. Chacín L. (1999, Abril). Diabetes en Venezuela. Diabetes al día. http://www.diabetesaldia.com/diabetes_en_venezuela.htm#scene_1. [Cónsulta: 2002, Mayo 27]. [ Links ]
3. Fundación Instituto Carabobeño para la Salud. División de enfermedades crónicas y programa de diabetes Segundo informe semestral de morbilidad. Valencia: INSALUD; 2001. [ Links ]
4. Mathews C y Van Holde K. Bioquímica. 2ª ed. Madrid: Editorial McGraw-Hill interamericana, 1996. [ Links ]
5. Walts G y Playford I. Dislipoproteinaemia and hiperoxidant stress in the pathogenesis of endothelial dysfunction in non-insulin-dependent. En: Use of antioxidant nutrients in the prevention and treatment of type 2 diabetes. American College of Nutrition, 2001; 20(5): 336s-338s. [ Links ]
6. Ruhe R y McDonalds R. Use of antioxidant nutrients in prevention and treatment of type 2 diabetes. American College of Nutrition, 2001; 20(5): 363s-369s. [ Links ]
7. Sociedad Venezolana de Endocrinología y Metabolismo. Consenso Nacional de Diabetes Tipo 2, Venezuela 2003. Caracas: Sociedad Venezolana de Endocrinología; 2003. [ Links ]
8. Yépez RD, Yépez CE, Márquez M y Sutil de Naranjo R. Consumo de fármacos, enfermedades crónicas y hábito personales como factor de riesgo de cataratas seniles. Revista oftalmológica venezolana, 2001; 57(2):74-82. [ Links ]
9. Cano C, Bermúdez V, Sulbaran G, Morales R, Medina M, Amell A, Souki A, Ambard M, Núñez N, García D, Restrepo H, Vargas ME, Seyli H y Cruz A. Influencia de la edad y el sexo en el balance oxidación antioxidación. Arch Ven. farm y terp 2001; 20(1): 63-68. [ Links ]
10. Márquez N, Parra M, Mendoza F y Ramírez Y. Estrés oxidativo en pacientes con diagnostico de síndrome coronario agudo que ingresan a la unidad de cuidados coronarios de la Ciudad Hospitalaria Dr Enrique Tejera, en el periodo Enero-Mayo del 2003. TEG-UCV. [ Links ]
11. International vitamin A: contemporary group. Biochemical methodology for the assessment of vitamin A status. IVAAG editors; 1982. [ Links ]
12. Márquez M, Yépez CE, Sutil-Naranjo R, Rincón M. Aspectos básicos de determinación de las vitaminas antioxidantes E y A. Investigación clínica, 2002; 43(3): 191-204. [ Links ]
13. Traber MG y Jialal I. Measurement of lipid soluble vitamins further adjustment needed?. Lancet, 2000; 355: 2013-2014. [ Links ]
14. Márquez M, Yépez CE, Sútil R, Rincón M. Vitaminas A y E aspectos básicos y su importancia en la aterosclerosis, 2003 Publicaciones CDCH-UC. Deposito Legal lf55320036102480, ISBN 980-233-361-1. [ Links ]
15. Ministerio de Sanidad y Asistencia Social Instituto Nacional de Nutrición. Tabla de composición de alimentos para uso practico. Caracas: Venezuela, Dirección Técnica. División de Investigación en alimentos; 1994. Publicación N° 50. Serie cuadernos azules. [ Links ]
16. Mahan K. y Krause Arlin M. Nutrición y Dietoterapia. México, Editorial Mc Graw-Hill; 1995. [ Links ]
17. Figuerola D y Reynals E. Diabetes Mellitus. En Farreras/Rozman Medicina Interna. Vol. 2. 13a ed. Barcelona España: Ediciones Doyma SA y Mosby-Doyma Libros SA; 1996. p. 1933-1969. [ Links ]
18. Hernández M y Cortez A. Diabetes mellitus y enfermedades cardiovasculares. En Cortéz Alfredo Diabetes Mellitus. Caracas Venezuela: D´Vinni; 1999. p. 267-283. [ Links ]
19. Blanco J, Socarrás M, González D y Licea M. Algunos indicadores de la dieta en un grupo de pacientes diabéticos tipo 2 de Centro Habana. Revista Cubana Aliment Nutr 2002;16(1):23-30 URL. http://bvs.sld.cu/revistas/ali/vol16102/ali04102.htm [ Links ]
20. Espinosa A, Parra A y Caraveo V. En Nutriología Médica. México: Editorial Médica Panamericana, 1995; p.291-307. [ Links ]
21. Kimoto K, Suzuki K, Kizaki T, Hitomi Y, Ishida H, et al. Glicazida protege a las células α pancreáticas del daño por peróxido de hidrógeno. FENA Diabetes 2003; 1: 1-6. [ Links ]
22. Dierckx N, Horvath G, van Gils C, Vertommen J, van de Vliet J, De Lee M y Keenoy B. Oxidative stress status in patients with diabetes mellitus: relation to diet. Eur J Clin Nutr. 2003; 57 (8): 999-1008. [ Links ]
23. Elejalde J. Estrés oxidativo, enfermedades y tratamientos antioxidantes. An Med Interna (Madrid) 2001; 18(6): 326-335. [ Links ]
24. Clapés S, Torres O, Companioni M, Villariño U, Broche F y Céspedes E. Peroxidación lipídica y otros indicadores de estrés oxidativo en pacientes diabéticos. Rev Cubana Invest Biomed 2001; 20(2): 93-98. [ Links ]
25. Chugh S, Kakkar R, Karla S y Sharma A. An evaluation of oxidative stress in diabetes mellitus during uncontrolled and controlled state and after vitamin E supplementation. Journal Association Physicians India, 1999; 47(4): 380-383. [ Links ]
26. Torres M, Canal J y Pérez C. Oxidative stress in normal and diabetic rats. Physiological Research, 1999; 48: 203-208. [ Links ]
27. West I. Radicals and oxidative stress in diabetes. Diabet Med. 2000;17(3): 171-180. [ Links ]
28. Maxwell SRJ, Thomason H, Sandler D, et al. Antioxidant status in patients with uncomplicated insulin-dependent and non-insulin-dependent diabetes mellitus. Eur J Clin Invest 1997; 27: 484-490. [ Links ]
29. Obregón O. Consenso Venezolano de Lípidos. Internacional Lipid Information Burau. Capitulo Venezuela. [ Links ]
30. Sandoval K, Scovino M, Yunez M, González J, González D y González N. Niveles séricos de la proteína transportadora de esteres de colesterol (CETP) y perfil lipídico de los pacientes diabéticos tipo 2. Unidad de diabetes Dr. Enrique Tejera. Salus. Revista de la Facultad de Ciencias de la Salud-Universidad de Carabobo, 2003; 7(1): 13-20. [ Links ]
31. Cuneo C. Lipoproteínas de alta densidad (HDL) y enfermedad coronaria. Rev Fed Arg Cardiol 2001; 30: 103-111. [ Links ]