Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT v.27 n.1 Caracas jun. 2008
Variables hemodinamicas versus hormonas endoteliales en hipertensos y diabéticos tipo 2 con disfunción endotelial
Christian Fouillioux1, Freddy Contreras2, Mary Lares3, Luis Magaldi4, Claudia La Mayda6, Betsy Pacheco7, Manuel Velasco5.
1Médico Residente, Dpto. de imagenología. HUC. Caracas -Venezuela.
2Médico Internista, Profesor Agregado de Fisiopatología FM/UCV- Caracas-Venezuela. E-mail: sicontreras@cantv.net
3Biólogo del Laboratorio de Investigaciones de Endocrinología y Enfermedades Metabólicas del Hospital Militar Dr. Carlos Arvelo y Profesor de la FM-UCV. Caracas-Venezuela.
4Profesor Agregado de Farmacología. FM-UCV. Caracas-Venezuela.
6Médico Residente Dpto. Medicina Interna. Hospital Victorino Santaella. Los Teques. Estado Miranda. Venezuela.
7Médico Residente Dpto. de Anestesiología. HUC.- Caracas -Venezuela.
5Clinical Pharmacology Unit, Vargas Medical School, UCV. Caracas, Venezuela.Resumen
La leptina es una hormona peptídica de 167 aminoácidos secretada por el tejido adiposo. Funciona principalmente como una señal de saciedad, actuando en el hipotálamo, pero dadas sus estrechas conexiones con el sistema inflamatorio y endotelial, se ha planteado que además ejerce una acción reguladora sobre la presión arterial, interactuando con el ON (óxido nítrico) y la PCR (proteína C reactiva). La PPF (prueba presora por frío) es una prueba simple que determina en forma indirecta disfunción endotelial. Objetivos: En este trabajo se evaluaron indicadores bioquímicos (PCR, leptina y ON) e indicadores hemodinámicos (PAS y PAD: presión arterial sistólica y diastólica) durante la realización de una PPF en sujetos hipertensos y diabéticos tipo 2 para determinar la presencia de disfunción endotelial. Métodos: Se incluyeron 43 sujetos, hombres y mujeres, de edades entre 25-60 años divididos en 3 grupos: 15 voluntarios sanos, 13 pacientes con hipertensión, y 15 pacientes con diabetes tipo 2. Una historia médica integral fue obtenida para cada sujeto, incluyendo reposo. Durante el experimento, de 30 minutos de duración, se administró solución salina 0,9%. La PPF, se realizó para medir la reactividad cardiaca al minuto 15. Las variables cardiovasculares (FC, PAS y PAD), fueron medidas en el minuto 0, 16 y 30. Muestras séricas se extrajeron al comienzo y al final del experimento, y tras determinar las variables bioquímicas, se realizó el análisis estadístico. Resultados: La PPF provocó un aumento significativo de la PA y el pulso en todos los grupos. No se apreciaron diferencias significativas para la PCR y la leptina en todos los grupos, pero sí se apreciaron diferencias manifiestas entre grupos para el óxido nítrico (p < 0,05). Los cálculos de sensibilidad y especificidad para las variables bioquímicas individuales no resultaron de significancia estadística o clínica como marcadores de disfunción endotelial, pero sí se halló asociación entre la leptina junto a oxido nítrico (sensibilidad: 20%; especificidad: 80%). Conclusión: La PCR, leptina y ON no mostraron asociación directa y significativa con las variables hemodinámicas en este estudio, aunque se evidenciaron relaciones entre el ON según grupo y entre las variables bioquímicas cuando fueron evaluadas en conjunto.
Palabras clave: Hipertensión, diabetes tipo 2, leptina, proteína C reactiva, óxido nítrico.
Summary
Leptin is a 167 aminoacid long peptidic hormone, secreted by adipose tissue. Works mainly in the hypothalamus a thirst signal, but given its closed connections with inflammatory and endothelial systems, also has been described that it may exert a regulatory control over blood pressure (BP), interacting with NO (nitric oxide) and CRP (C reactive protein). The CPT (cold pressor test) is a simple test that indirectly determines endothelial dysfunction. Objectives: In this work, biochemical indicators (CRP, leptin and ON) and hemodynamical indicators (systolic and diastolic BP) were performed and evaluated in hypertensives, type 2 diabetics and control subjects, during a single CPT for assessment of endothelial dysfunction. Methods: A total of 43 subjects, males and females aged 25-60 years and divided in three groups: 15 healthy volunteers, 13 hypertensives and 15 patients with type 2 diabetes were included in the study. A complete clinical history was obtained from each subject and a complete physical examination, including an electrocardiogram was carried out. During the assay of 30 minutes, 0.9% saline was infused intravenously. CPT was performed to assess the cardiovascular reactivity at minute 15. The cardiovascular variables (systolic and diastolic BP) were measured in minute 0, 16 and 30. In addition, serum variables were extracted at the beginning and in the end of the experiment and statistical analysis was performed. Results: CPT caused in all subjects a significant increase of BP and pulse. There were no significant differences to CPR and leptin in all groups, although we observed significant differences for nitric oxide (p < 0.05). Sensibility and specificity for all biochemical variables resulted in non significant statistical or clinical importance as markers of endothelial dysfunction, however a positive association was found when leptin and NO were evaluated together (sensibility: 20%; specificity: 80%). Conclusion: CRP, leptin and NO did not shown any direct and significant association with the hemodynamical variables in this study, although a relationship was noted between NO according to group and biochemical variables when studied altogether.
Word keys: Hypertension, type 2 diabetes, leptin, C reactive protein, nitric oxide.
Recibido: 28/10/2007 Aceptado: 03/12/2007
Introducción
Recientemente se ha llegado a la conclusión de que los adipocitos no son sólo depósitos de energía sino también una fuente de sustancias metabólicamente activas como FNTα (factor de necrosis tumoral α), angiotensinógeno, prostaglandinas, estrógenos y el producto del gen ob, la leptina (Stenvinkel, 2000). La leptina es una hormona peptídica de 167 aminoácidos transcrita por el gen ob, siendo descrita por primera vez en 1994 (Zhang et al, 1994).
Esta hormona es secretada primariamente por el tejido adiposo blanco, aunque se halla también en la grasa parda (Auwerx y Staels, 1998). La característica que se le describe con mayor frecuencia es funcionar como una señal de saciedad actuando en el hipotálamo, para lo cual atraviesa la barrera hematoencefálica (Banks, 2004; Banks et al, 1996) e interviene sobre las señales que regulan la ingesta de alimento: principalmente inhibe la síntesis del neuropéptido Y, el cual es un potente estimulante del apetito (Naveilhan et al, 1999).
La leptina logra la mayoría de sus efectos metabólicos interactuando con receptores específicos localizados en el sistema nervioso central y en tejidos periféricos. El receptor de la leptina es una citocina de clase I, de la cual también forman parte el receptor de la Interleucina-6, el receptor del interferón y de la hormona de crecimiento (Tartaglia, 1997). Se expresa además en otros tejidos, como el riñón, el sistema cardiovascular, hepatocitos, células hematopoyéticas e islotes pancreáticos (Margetic et al, 2002). Debido a la existencia de receptores periféricos, se está vinculando la leptina al desarrollo de obesidad e hipertensión arterial; así como en la regulación e integración metabólica (Friedman y Halaas, 1998; Rahmouni et al, 2005).
La secreción de leptina es proporcional a la cantidad de tejido adiposo, y su concentración plasmática se incrementa marcadamente en individuos obesos. Esta hiperleptinemia dio lugar a la hipótesis de resistencia a la leptina en pacientes obesos, donde un defecto en el receptor o en los mediadores intracelulares siguientes produciría niveles elevados de la hormona en plasma, sin lograr su efecto final de forma completa; de manera muy similar al síndrome de resistencia a la insulina (Considine et al, 1996; Dandona et al, 2005). Es por este motivo que el uso terapéutico de la leptina como agente antiobesidad no ha sido aplicable porque muchos pacientes con obesidad presentan resistencia a la hormona (Cock y Auwerx, 2003).
La relación entre obesidad e hipertensión está ampliamente documentada desde hace varios años (Hovell, 1982; Kannel et al, 1967; Masuo et al, 2001; Niskanen et al, 2004; Rahmouni et al, 2005; Sharma y Grassi, 2001; Thakur et al, 2001; York et al, 2004). Se ha especulado, dada la fuerza de esta asociación, que la masa adiposa sirve como un importante tejido en la regulación de la presión arterial, y a pesar que los mecanismos que subyacen a esta teoría no están completamente aclarados (Davy y Hall, 2004), se le ha atribuido a la leptina ser el vínculo entre ellas (Aizawa-Abe et al, 2000).
Cuando se remueven las terminaciones simpáticas de los vasos sanguíneos y se administra leptina, se produce vasodilatación que se ha vinculado con aumento en la síntesis de óxido nítrico (ON), de forma dosis-dependiente (Fruhbeck, 1999; Lembo et al, 2000). Esta síntesis de ON estimulada por la leptina se lleva a cabo en el endotelio (Beltowski et al, 2002; Winters et al, 2000), por lo cual también se le denomina EDNO (Oxido Nítrico Derivado del Endotelio). El endotelio actualmente se considera como un órgano paracrino, dado que produce y libera una cantidad enorme de factores contráctiles y relajantes (Hintze, 2001). Sin embargo, existe la posibilidad de que no solamente el óxido nítrico sea el único componente responsable de la vasodilatación, sino que se trate de una cascada de eventos que finalmente conducen a la misma, probablemente a través de la inherencia de otros factores como el EDHP (Factor Hiperpolarizante Derivado del Endotelio) (Matsuda et al, 2003).
La administración continua crónica de leptina en modelos animales y humanos con el sistema nervioso intacto, produce un aumento sostenido en la actividad del sistema simpático (Carlyle et al, 2002; Shek et al, 1998; Mark et al, 2003). El significado fisiológico de esta característica está vinculado a funciones metabólicas e inmunológicas; y más importante, relacionado con la regulación de la presión arterial (PA: presión arterial; PAD: presión arterial sistólica y PAD: presión arterial diastólica) dado que al incrementar la actividad simpática se produce un aumento reflejo de la presión (Eikelis et al, 2003; Haynes et al, 1997; Lohmeier et al, 2005).
Por todo esto, el balance entre el efecto presor de la leptina, a través de la activación simpática y el efecto vasodilatador hipotensor, determinarán el resultado final de la leptina sobre la regulación de la PA (Antic et al, 2003). En voluntarios sanos tras administración de leptina, al conjugarse la acción vasodilatadora producto de la secreción de ON y de la estimulación simpática, no se evidencia un cambio apreciable en la PA (Kuo et al, 2001; Mitchell et al, 2001; Vecchione et al, 2003).
Se ha estudiado también la participación de la adventicia en la relación de la leptina y el control arterial. La túnica adventicia, la capa más externa de los capilares, consiste en fibras de colágeno, fibras elásticas, fibroblastos y vasa vasorum; fue considerada durante muchos años como una capa de soporte, pero evidencias recientes sugieren una mayor importancia (Fernández-Alfonso, 2004; Verlohren et al, 2004). Estas consideraciones derivan del hecho que muchos vasos sanguíneos están rodeados de tejido adiposo en diferentes cantidades y la presencia de grasa perivascular, disminuye la respuesta constrictora de la aorta de rata frente a la noradrenalina. Esto es debido a la liberación de un factor relajante derivado del adipocito (Soltis y Cassis, 1991). Por lo cual un tejido que normalmente se remueve de las preparaciones de órgano aislado no solamente tiene función de soporte sino que también participa en el control del tono vascular (Fernández-Alfonso, 2004).
La proteína C reactiva (PCR) es un marcador de inflamación, pero está emergiendo en los últimos años como un indicador de riesgo cardiovascular (Ridker, 2001), llegándose incluso a considerar como factor pronóstico de angina estable y de infarto de miocardio (Panteghini, 2004). La PCR puede contribuir también por sí misma a la enfermedad vascular inhibiendo la óxido nítrico sintetasa, incrementando la activación del inhibidor de plasminógeno y causando efectos proinflamatorios directos sobre las células endoteliales (Pasceri et al, 2000; Sesso et al, 2003). La PCR, se le ha postulado como un marcador de disfunción endotelial, particularmente la PCR HS (High Sensitivity: ultra sensible) (Soltero, 2002; Szmitko et al, 2003; Verma et al, 2003).
La PCR es sintetizada primariamente en el hígado y regulada por citocinas, de las cuales la más importante es la interleucina-6 (IL-6) (Juge-Aubry y Meier, 2002). Para establecer la relación entre PCR y leptina, por el hecho de que ambas moléculas se hallan elevadas en obesidad e inflamación, se han estudiado los niveles plasmáticos de éstas en voluntarios sanos, encontrando que existe una asociación positiva independiente de factores como el IMC (índice de masa corporal), hábito tabáquico o alcohol (Shamsuzzaman et al, 2004).
La obesidad se caracteriza por hiperleptinemia y resistencia del hipotálamo al efecto anoréxico de la hormona. En la mayoría de los casos la obesidad además se acompaña de hiperinsulinemia y resistencia a la insulina (Moran y Phillip, 2003). La insulina por su parte estimula la producción de ON y este efecto está disminuido en la obesidad (Jiang et al, 1999).Otro estudio demostró que la insulina y la leptina comparten los mismos mecanismos de señalización, incluyendo activación de la fosfatidilinositol 3 kinasa, el cual está involucrado en la liberación endotelial de ON (Vecchione et al, 2003).
Por todo lo anterior, existen abundantes evidencias de relaciones entre obesidad–hipertensión arterial, leptina–insulina–óxido nítrico, todo ello en el contexto del funcionalismo endotelial (Das, 2001; Niswender y Schwartz, 2003; Sweeney, 2002; Triggle et al, 2003). Un método indirecto clásico para medir el mismo es la prueba presora por frío (PPF) (Hines y Brown, 1936; McMurray y Jaques, 1959; Velasco et al, 1982). Esta prueba se ha utilizado desde 1933, como indicador de cambios en la presión arterial en sujetos expuestos a un estímulo estándar. El procedimiento para la misma consiste en la inmersión de la mano en agua a 4-6 ºC de temperatura por 1 o 2 minutos (Mitchell et al, 2004; Velasco et al, 1997; Victor et al, 1987). El estado dentro del ciclo menstrual en las mujeres aporta diferencias significativas en el resultado de la PPF (Kowalczyk et al, 2006).
La prueba presora por frío a través de la nocicepción activa el sistema simpático, y esto incrementa la demanda de oxígeno miocárdico (aumentan la frecuencia cardiaca y la presión arterial) (Kjaer et al, 2003). Al aumentar la necesidad de oxígeno se produce vasodilatación de las arterias coronarias y este mecanismo es mediado por la liberación de ON desde el endotelio (Velasco et al, 1997). Esta misma prueba produce constricción en arterias coronarias ateroscleróticas y en pacientes diabéticos, lo cual es un indicador de disfunción endotelial (Nitenberg et al, 1998; Nitenberg et al, 2004).
La disfunción endotelial se caracteriza por reducción en la biodisponibilidad de vasodilatadores secretados por el endotelio, en particular del ON y en el aumento de los factores constrictores derivados del mismo (Perticone et al, 2001). Esto lleva finalmente a la existencia de un estado proinflamatorio en el mismo (Bonetti et al, 2003) dado por el desbalance entre las fuerzas reguladoras.
El endotelio vascular además de ser una barrera de permeabilidad altamente selectiva, cumple múltiples funciones relacionadas con la homeostasis, siendo uno de los principales tejidos reguladores del tono vascular (Endemann y Schiffrin, 2004). En respuesta a varios estímulos, libera sustancias vasoactivas ya sea de tipo vasodilatador como, la bradicinina, la prostaciclina, la serotonina, la histamina, la sustancia P y principalmente el ON que es el más poderoso vasodilatador,o sustancias vasoconstrictoras tales como, los tromboxanos, el ácido araquidónico, las prostaglandinas, la trombina, la nicotina, la angiotensina II y la endotelina−1 (Baumgartner-Parzer y Waldhausl, 2001; Sumpio et al, 2002), siendo éstas dos últimas, las sustancias vasoconstrictoras más potentes. (Bonetti et al, 2003). Todas estas sustancias participan directa o indirectamente, en la regulación del tono vascular y en la homeostasis y es claramente comprensible que la disfunción endotelial esté siempre presente en la hipertensión arterial ya sea como un fenómeno primario o como consecuencia de la presión arterial elevada (DiBona, 2004).
Objetivo
Evaluar indicadores bioquímicos (PCR, leptina y ON) e indicadores hemodinámicos de disfunción endotelial (PAS y PAD) durante la PPF en sujetos hipertensos y diabéticos tipo 2.
Metodología
Este estudio fue revisado y aprobado por el CENABI (Centro Nacional de Bioética) y por el Comité de Bioética del FONACIT (Fondo Nacional de Ciencia, Tecnología e Investigación). El CENABI además, vigiló y supervisó que los experimentos fueran ejecutados con las normas de buenas prácticas clínicas y las normas contempladas en los códigos de bioética de experimentación en seres humanos (Castillo, 2006).
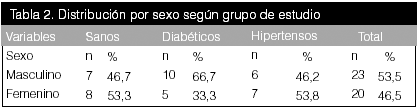
Se seleccionaron 42 sujetos, mayores de edad, y menores de 60 años tanto de sexo masculino como femenino distribuidos de esta manera: 14 sujetos sanos, 13 hipertensos y 15 con el diagnóstico de diabetes tipo 2. En el caso de los pacientes hipertensos y diabéticos, tenían cinco o más años de evolución desde el diagnóstico de su cuadro clínico.
El método de selección fue a través de un muestreo aleatorio realizando una encuesta sobre factores de riesgo Cardiovascular de la Consulta de Diabetes del Departamento de Medicina Interna del Hospital Victorino Santaella, previo consentimiento escrito del paciente, en el lapso comprendido entre febrero de 2005 y abril 2005. Los hipertensos no diabéticos y controles fueron captados a través de la atención preventiva en dicha consulta. La condición de diabetes fue definida a través de los criterios de la American Diabetes Association para el 2004, (Diagnosis and Classification of Diabetes Mellitus,2004), y la condición de hipertensión fue definida igualmente siguiendo las recomendaciones del VI Reporte de Nacional Comité para la Hipertensión (The sixth report of the Joint National Committee on prevention, detection, evaluation, and treatment of high blood pressure, 1997); a los efectos se incluyeron como hipertensos clase 1, a los sujetos con una presión arterial diastólica de 90-104 mmHg y clase 2 a los sujetos con una presión arterial diastólica entre 105-114 mmHg.
Para la selección de los pacientes se utilizaron los siguientes criterios:
Criterios de inclusión:
1. Consentimiento del paciente para participar en el estudio
2. Hipertensión arterial clase 1 ó 2 (para el grupo de pacientes hipertensos).
3. Hipertensión arterial sistólica aislada (para el grupo de pacientes hipertensos).
4. Diabetes mellitus tipo 2 (para el grupo de pacientes diabéticos).
5. No presentar patologías de base (grupo control).
Criterios de exclusión:
1. Hábito alcohólico severo (CAGE 3) (Ewing, 1984).
2. Contextura pequeña (peso ≤ a 40 Kg y/o IMC ≤19 Kg/m2).
3. Enfermedades asociadas: Tirotoxicosis, síndrome de Cushing, artritis reumatoide, anemia hemolítica, hepatopatía, hiperparatiroidismo, enfermedad de Paget, insuficiencia renal terminal, síndrome de malabsorción intestinal, diabetes tipo 1, cardiopatía isquémica aguda, hipertensión arterial con daño a órgano blanco reciente (últimos 6 meses); para este último aspecto, se realizará un banco de pruebas básicas (Glicemia, urea, creatinina, examen de orina, EKG, fondo de ojo) complementado con la historia clínica.
4. Uso de drogas: Levotiroxina de reemplazo, glucocorticoides, insulina, sildenafil, labetalol, bromocriptina, bloqueadores y estimulantes de receptores adrenérgicos.
Se procedió en la primera parte del estudio a incorporar en una encuesta de elaboración propia los datos que incluyeron: filiación, antecedentes familiares, actividad física, factores de riesgo cardiovascular: hipertensión, diabetes, dislipidemias, hábito tabáquico, consumo de alcohol, tratamiento dietético y/o farmacológico y parámetros analíticos que incluyeron hematología completa, glucemia basal, urea y creatinina.
En la segunda parte del estudio, se realizó la determinación de los parámetros antropométricos: peso, talla, índice de masa corporal, y variables hemodinámicas (PA, Pulso, EKG). Una vez seleccionados los pacientes, se distribuyeron en tres grupos a saber: 14 sujetos controles (voluntarios sanos), 13 sujetos hipertensos de clases 1 y 2 y 15 sujetos diabéticos tipo 2; estos dos últimos grupos compensados desde el punto de vista metabólico y hemodinámico.
Para la realización de este estudio clínico experimental, controlado, con una duración de 30 minutos, cada uno de los sujetos que formaron este ensayo fue citado al laboratorio en la mañana (7:00 am), de acuerdo a un cronograma en aproximadamente 6 meses desde junio-diciembre 2005, cumpliendo con las siguientes condiciones basales:
Ayuno de 14 horas.
No haber realizado ejercicio físico el día del estudio ni el día anterior.
Suspensión con 5 días de anticipación, de cualquier tratamiento antihipertensivo. Suspensión de hipoglicemiantes orales sólo el día del estudio.
Los pacientes en el día del estudio, fueron examinados de acuerdo al esquema que se describe a continuación.
a) Presión arterial medida con esfigmomanómetro de mercurio y con Dynamap®.
b) Frecuencia cardiaca con electrocardiograma.
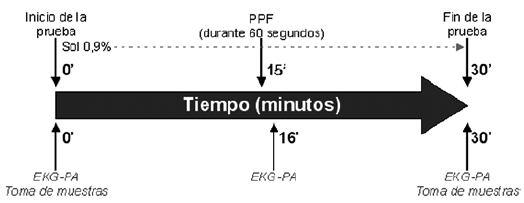
Tras la cateterización de las vías periféricas, con el paciente en la camilla, monitor cardíaco y Dynamap® conectado y encendido, se dió inicio al experimento, contándose este tiempo como minuto 0. En este momento se extrajeron 20 mL de sangre distribuidos en: 3 tubos secos (tapa roja), 1 tubo con EDTA (tapa lavanda) y un tubo con heparina (tapa azul celeste). Además se le realizó un EKG control de 12 derivaciones y medición de la presión arterial. A los 15 minutos, considerando este tiempo suficiente para la estabilización de los parámetros cardiovasculares, se realizó la prueba presora por frío sometiendo a inmersión el brazo derecho (mano, hasta aproximadamente 2/3 distales del antebrazo) con agua enfriada a 0 – 4 ºC durante 60 segundos. Al terminar el minuto de la PPF, se realizó nuevamente un EKG de 12 derivaciones y toma de presión arterial (minuto 16). Al minuto 30, previa observación, se tomaron nuevamente 20 mL de sangre, con la misma distribución anterior. En este punto, tras realizar otro EKG de 12 derivaciones y la toma de la PA, se dio por finalizado el experimento.
El siguiente diagrama ilustra el protocolo seguido:
Tras la toma de muestras en los tubos con tapa roja, secos, destinados a la química, fueron centrifugados para aislar el plasma y este se congeló a -70ºC en los contenedores del laboratorio (Seifarth et al, 2004).
Los estudios bioquímicos realizados en este plasma, producto de la toma de muestras al minuto 0 y al minuto 30, fueron los siguientes:
a) Leptina por método de IRMA: Immunoradiometric Assay con kit proveído por Diagnostic Systems Laboratories (445 Medical Center Blvd. Webster Texas 77598-4217 USA. (Blum et al, 1997; Ma et al, 1996).
b) PCR HS: por inmunoturbidimetría, con kit proveído por laboratorio Boehringer Mannheim Systems Tina-quant® CRP, (Mannheim, Alemania) (Roberts et al, 2001).
c) Óxido Nítrico por colorimetría, con kit de Cayman Chemical Company (Moshage, 1997).
Tras la aplicación de la PPF, se agrupó a los pacientes según su reactividad (en positiva o negativa) tomando como criterio el cambio en el valor de su PA (Velasco et al, 1997). Se procedió a obtener la diferencia entre la PAS (presión arterial sistólica) y PAD (presión arterial diastólica) al minuto 0 y al minuto 151 (Choh et al, 2005):
∆PAS0–15: PAS0 – PAS15
∆PAD0–15: PAD0 – PAD15
Si ∆PAS0–15 ≥ 15 mmHg y/o ∆PAD0–15 ≥ 12 mmHg se consideró como reactividad positiva, situación esperable en pacientes con disfunción endotelial (Seneviratne et al, 1983; Velasco et al, 1997; Velasco et al, 1982).
Si ∆PAS0–15 < 15 mmHg y/o ∆PAD0–15 <12 mmHg se consideró como reactividad negativa.
Se han propuesto varios valores para la definición de PPF reactiva, incluyendo incrementos de 10 mmHg de aumento en la PAS (Velasco et al, 1997) hasta 20 mmHg (Greene et al, 1965). En un informe por Woisetschlager, un incremento de 14,1 mmHg en la PAS por la PPF, es suficiente para predecir la aparición de preeclampsia en mujeres embarazadas (Woisetschlager et al, 2000). En este trabajo, se tomó como valor límite 15 mmHg por considerarlo un valor promedio del cambio de presión.
Análisis Estadístico
Se realizaron pruebas descriptivas (media, desviación estándar, y porcentajes) de las variables hemodinámicas y bioquímicas. Las correlaciones entre los diferentes puntos de los valores obtenidos se basaron en coeficientes de correlación paramétricos de tipo seriadas (ANOVA) y Chi2. Se consideró un valor estadístico significativo si p < 0,05 y altamente significativo si p < 0,01. Para la realización de las pruebas de sensibilidad y especificidad, se utilizó el teorema de Bayes (Dawson-Saunders y Trapp, 1997; Medical College of Wisconsin, 2006), según las siguientes fórmulas:

Para todos los análisis estadísticos y las figuras se utilizó el programa SPSS 13.0 para Windows (SPSS Inc.© 2004).
Resultados
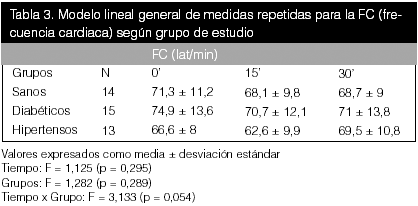

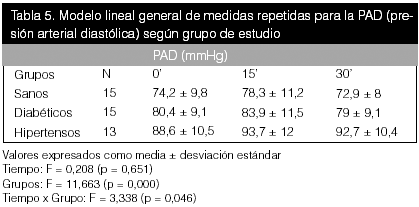
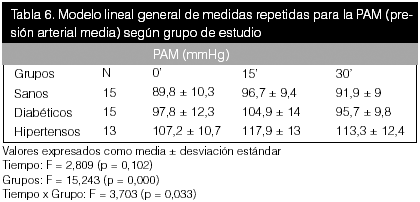

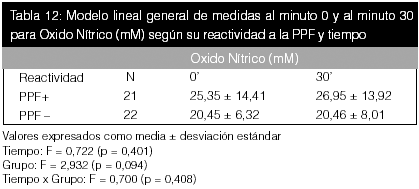
Como se puede observar en las tablas precedentes, no hubo diferencias estadísticas entre el tiempo para ninguna de las variables bioquímicas en estudio, pero sí se apreciaron diferencias entre grupos para el óxido nítrico (p < 0,05).
En estas tablas (10, 11 y 12), al realizar la comparación lineal de medidas repetidas, no se evidenciaron diferencias significativas en el tiempo ni según grupo para las variables.
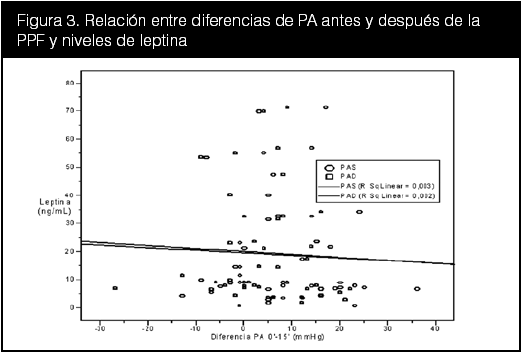
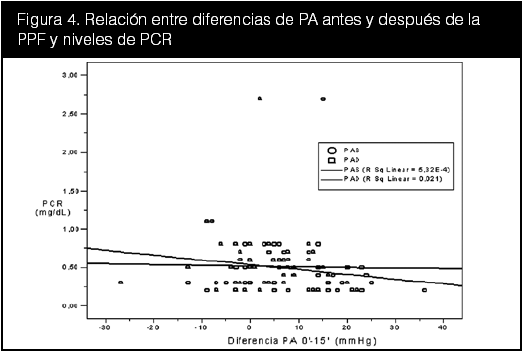
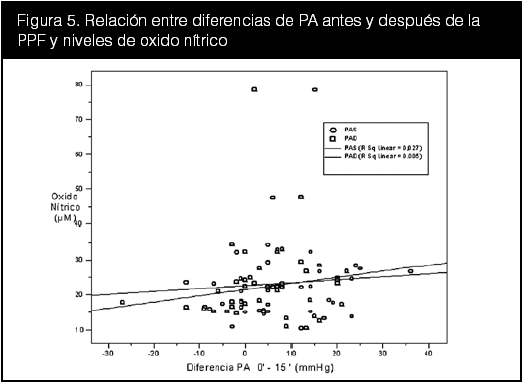
Se graficaron entonces separadamente las diferencias entre la PA entre el minuto 0 y el minuto 15 (∆PAS0–15 y ∆PAD0–15) con los parámetros bioquímicos y se aplicó una regresión lineal. Los resultados de estas dispersiones se muestran en las figuras 3, 4 y 5.
En la figura 3 hay una correlación negativa leve entre los niveles de leptina y el cambio de PAS y PAD tras la PPF. Para esta figura se utilizó la leptina al minuto 0, dado que no hubodiferencias significativas entre los momentos de la toma de muestras (ver tabla 10). En la figura 4 se aprecia igualmente una correlación negativa leve para la PCR en la curva de regresión. También se utilizó la PCR al minuto 0. La correlación entre los niveles de óxido nítrico y PPF ilustrada en la figura 5, muestra una asociación positiva reducida, con un valor de coeficiente de regresión de 0,003 para la PAS y de 0,002 para la PAD.
Por medio de un análisis con modelo Bayesiano se calculó la prevalencia, especificidad y sensibilidad de la leptina como marcador de la reactividad a la PPF (tabla 13). El punto de corte se obtuvo de la tabla 8. En la tabla 14, se calcularon estos índices para la PCR.
Aplicando el mismo modelo, se analizó la relación entre PPF y oxido nítrico (tabla 15). El punto de corte se tomó considerando los valores obtenidos en la tabla 7.
Discusión
El método estándar aceptado en la actualidad para el diagnóstico de disfunción endotelial, es la medición de diámetros arteriales con ultrasonido en la arteria braquial. Esto se logra evocando una reacción de hiperemia reactiva usandoacetilcolina, y midiendo el cambio de diámetro de la arteria (Celermajer et al, 1992). Esta prueba sin embargo, es poco práctica por su complejidad y de alto costo por los equipos necesarios. Desde hace algún tiempo, se ha venido utilizando la medición de parámetros bioquímicos con la finalidad de evitar esta prueba, y contar con un método sencillo que permita demostrar la presencia de disfunción endotelial y alteraciones en las rutas metabólicas.
En este trabajo se probaron el ON, la PCR y la leptina como indicadores bioquímicos de disfunción endotelial en una población de pacientes hipertensos y diabéticos, frente a un indicador indirecto de disfunción endotelial como lo es la PPF.
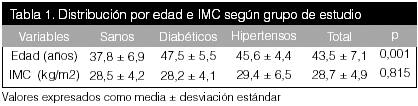
La muestra estudiada presentó características que limitaron su análisis, como diferencias en la edad y el IMC elevado. El IMC promedio se ubicó en 28,7 kg/m2, sin evidenciarse diferencias estadísticamente significativas entre los 3 grupos, con lo cual puede afirmarse que los pacientes del estudio, tanto los controles como los otros grupos presentan sobrepeso, según la clasificación vigente de obesidad (Aronne, 2002). Asimismo, se apreciaron diferencias significativas en cuanto a la edad de los grupos, lo que los torna heterogéneos contaminando otras comparaciones. Aún así, se pueden obtener algunos hallazgos valiosos.
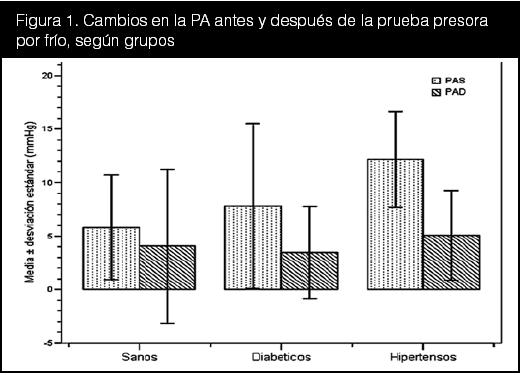
Con respecto a las variables hemodinámicas, se puede observar que hubo diferencias significativas entre los grupos para todas las variables hemodinámicas (p < 0,01), y para la PAS en el tiempo con un valor de p = 0.05. Al correlacionar tiempo con grupo, también se obtuvo una diferencia manifiesta (p < 0,05) en todas las variables. El cambio en los valores de PA fue más notorio en los hipertensos, según se demuestra en la figura 1. La diferencia promedio fue positiva en todos los grupos. Estos resultados fueron los esperados y concuerdan con los resultados descritos en la literatura.
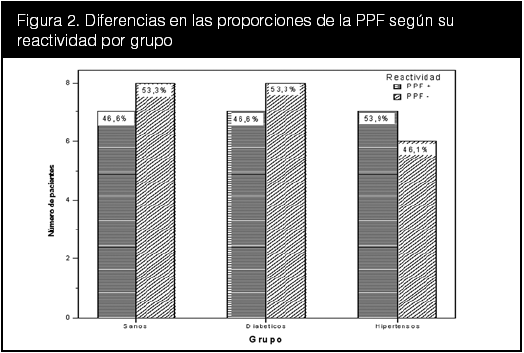
La distribución según reactividad a la PPF (figura 2), traza una proporción uniforme entre los grupos de sanos, diabéticos e hipertensos, éste último grupo con 7% más de pacientes con reactividad positiva a la prueba frente los otros dos grupos. Se esperaba que el grupo control presentara mayor cantidad de sujetos con reactividad negativa a la PPF, y se puede atribuir esta escasa diferencia a las limitaciones antes mencionadas. A esta distribución se le realizó una prueba de Chi2, obteniéndose un valor de Chi2 = 0,803, sin hallarse diferencias estadísticamente significativas entre los grupos (p = 0,669).
En otros estudios se ha determinado que hasta en un 29,7% de sujetos normales puede hallarse una PPF con reactividad positiva (Feldt y Wenstrand, 1942). Esto se debe a que puede hallarse disfunción endotelial en sujetos sanos y particularmente en aquellos con familiares con hipertensión, lo cual señala una predisposición genética a la misma (Velasco et al, 1997; Velasco et al, 1982).
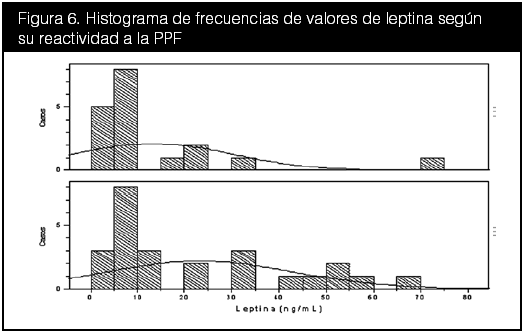
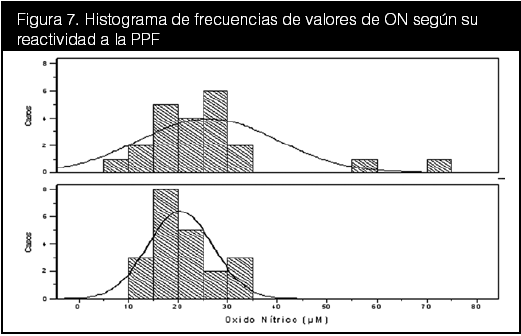
Se compararon entonces los indicadores bioquímicos con los indicadores hemodinámicos, estos últimos en forma de reactividad a la PPF. Con respecto a las diferencias entre grupos, tanto la leptina como el ON demostraron diferencias numéricas notorias en cuanto a sus medias, pero cuentan con desviaciones altas y no son estadísticamente significativas. Para visualizar mejor las diferencias entre los niveles de leptina y ON frente a su reactividad en la PPF, se realizó un histograma de frecuencias de ambas distribuciones (figuras 6 y 7).
La leptina mostró una distribución inversa al cambio de presión en la prueba presora por frío. En la figura 6, se aprecia que la curva de normalidad se desplaza hacia la izquierda en pacientes PPF+ con respecto a los PPF- (media de ~15 vs 22 ng/mL). Se mencionó anteriormente que la leptina tiende a encontrarse elevada en personas con obesidad, y disminuida en personas con un peso normal, por lo cual se evaluó el IMC de la distribución por reactividad a la PPF (tabla 16).
Como puede observarse, no se hallaron diferencias estadísticamente significativas en el IMC para esta distribución, dado que a pesar de tener valores ligeramente desiguales ambos grupos presentan sobrepeso. Esta escasa diferencia puede ser la causante del desplazamiento en las curvas de la figura 6, sin embargo otros estudios deben confirmar este hallazgo.
En las figuras 3, 4 y 5 se realizaron correlaciones entre los valores de los indicadores bioquímicos y el cambio en los valores de PA durante la PPF. En ninguna de ellas se apreció alguna correlación significativa, con leves curvas negativas para la leptina y positivas para el ON, lo cual corrobora el hallazgo anterior de que a mayor cambio positivo en la PA, menor es el nivel sérico de leptina en los pacientes. Con respecto al ON, se observó que en pacientes considerados no reactivos, los valores de ON son ligeramente menores que en los con reactividad positiva a la PPF, lo cual apoya otras investigaciones donde niveles bajos se han encontrado en pacientes sanos y viceversa (Heiss et al, 2006; Kleinbongard et al, 2006; Rondón et al, 2002).
La clinimetría practicada, es decir, los valores de sensibilidad, especificidad, valor predictivo positivo, negativo y prevalencia de leptina versus PPF (tabla 13), no evidencian alguna correlación trascendente entre ambos, razón por la cual disminuye la aplicabilidad clínica de la precitada asociación. Igualmente ocurre con la relación de PCR y de ON con las variables de la PPF (tablas 14 y 15).
Para observar la relación entre PCR y ON se ejecutó una curva de regresión lineal, separando los grupos según su reactividad al PPF, ponderando entonces el peso relativo de cada grupo a la asociación. En la figura 8, se aprecia que la asociación se presenta con mayor fuerza para el grupo con PPF positiva.
Estos hallazgos indican que a pesar de que en nuestra data no se obtuvo una correlación clara entre la PPF y el ON como se esperaba, sí existe relación entre los marcadores bioquímicos entre sujetos. Si consideramos que en la hipertensión esencial existe un estado inflamatorio persistente en la esfera endotelial, y esta inflamación condiciona algún grado de disfunción endotelial, el ON a pesar de estar elevado no es muy eficiente como vasodilatador, y por ende observamos los niveles elevados ya referidos. Todavía existe controversia en cuanto a la utilidad clínica del ON, incluso se han establecido diferencias entre la concentración de niveles de nitrato (NO3-) y nitrito (NO2-). Estos componentes juntos contribuyen a la medición del ON, (NOx), y se ha demostrado que los niveles de nitrito son los principales indicadores de la funcionalidad de la sintetasa endotelial de óxido nítrico, no así los de nitrato (Lauer et al, 2001). Para profundizar el valor de este hallazgo en nuestra data, sería necesario, además de establecer el tipo de ON predominante, determinar la cantidad de especies reactivas de oxígeno presentes, puesto que estas últimas son determinantes en la efectividad del ON plasmático (Heitzer et al, 2001). Además, evidencias recientes muestran que los niveles de oxido nítrico difieren si son tomados de arterias o de venas, encontrándose niveles más bajos en los últimos (Cicinelli et al, 1999).
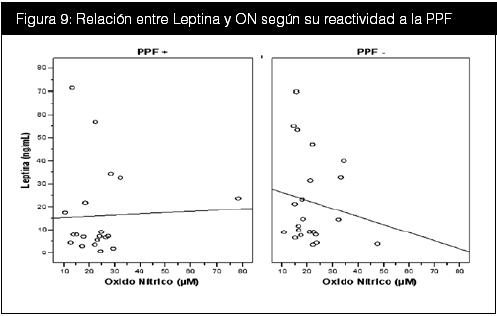
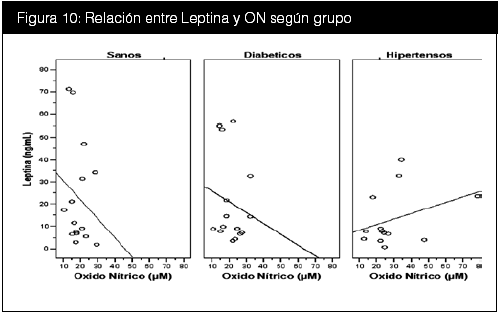
Se realizó además una curva de regresión lineal entre la leptina, el ON según su reactividad a la PPF (figura 9).y según grupo (figura 10).
Se aprecia claramente la asociación inversa entre sujetos con una PPF negativa y esta asociación es aún más marcada cuando se separa a los sujetos según su grupo; sujetos sanos y diabéticos presentaron una correlación negativa, mientras que los pacientes hipertensos presentan una correlación positiva.
Anteriormente se determinó que el grupo con PPF negativa, presentaba un IMC ligeramente mayor que el grupo con PPF positiva. En este último grupo, ocurre que a mayor leptina, mayor oxido nítrico. En vista de que la leptina aumenta en proporción directa al IMC y el ON aumenta según el grado de disfunción endotelial, y los pacientes hipertensos presentan disfunción endotelial, no es arriesgado hipotetizar que si se encuentran ambos indicadores elevados aumentaría la especificidad de presentar una verdadera disfunción endotelial, puesto que un ON elevado con leptina baja es más factible en pacientes normales y ambos elevados fueron característicos de los pacientes hipertensos. Para tal fin en la tabla 17 se realizaron los cálculos de prevalencia, especificidad y sensibilidad para valores de leptina y ON elevados. El problema de este razonamiento radica en los pacientes diabéticos, dado que según la fisiopatología de la diabetes, también presentan disfunción endotelial en algún grado y en esta hipótesis entrarían como falsos negativos por la baja sensibilidad.
Probablemente en trabajos con muestras mayores se puedan aclarar estos puntos y determinar la aplicabilidad clínica verdadera de estos indicadores.
Otro aspecto importante a señalar es que la reactividad positiva a la PPF no refleja necesariamente disfunción endotelial, puesto que puede deberse a alguna alteración en las vías de la PPF. En este trabajo se asume que los pacientes no presentan trastornos en las vías de conducción nerviosa necesarias para una respuesta fisiológica a la PPF, y en base a esta afirmación se realizaron los estimados de sensibilidad y especificidad, por lo cual no son necesariamente exactos.
Conclusiones
En este trabajo se demostró que existe una relación importante entre los marcadores bioquímicos y hemodinámicos para los grupos de pacientes estudiados. Se hallaron relaciones de concordancia entre el ON y la leptina, como indicadores de disfunción endotelial independientemente de factores como el IMC o la patología preexistente, con una alta especificidad pero sin arrojar una sensibilidad de importancia. Estudios subsecuentes podrán arrojar mayores datos que permitan confirmar estos datos.
La prueba presora por frío ha demostrado ser una herramienta con alto potencial, tanto para el estudio de mecanismos subyacentes al desarrollo de patologías en la esfera cardiovascular como endocrinas. Ha despertado un interés reciente como herramienta de diagnóstico en otras investigaciones (Choh et al, 2005; Kowalczyk et al, 2006; Roatta et al, 1998; Tousoulis et al, 2006; Tousoulis et al, 1997), donde se ha retomado su uso con diversas aplicaciones. El presente trabajo también pone de manifiesto la utilidad de esta prueba y se recomienda su uso para futuras investigaciones.
Agradecimiento
Los autores agradecen el financiamiento del FONACIT, institución que facilito los recursos que hicieron posible esta investigación, mediante el proyecto S12001000300.
Referencias
1. Aizawa-Abe, M., Ogawa, Y., Masuzaki, H., Ebihara, K., Satoh, N., Iwai, H., et al. (2000). Pathophysiological role of leptin in obesity-related hypertension. J Clin Invest; 105(9): 1243-1252. [ Links ]
2. Antic, V., Dullo, A. y Montano, J. (2003). Multiple mechanisms involved in obesity-induced hypertension. Heart, Lung and Circulation 12: 84-93. [ Links ]
3. Aronne, L. J. (2002). Classification of Obesity and Assessment of Obesity-Related Health Risks. Obesity Res; 10(90002): 105S-115. [ Links ]
4. Auwerx, J. y Staels, B. (1998). Leptin. Lancet 351(9104): 737-742. [ Links ]
5. Banks, W. A. (2004). The many lives of leptin. Peptides 25(3): 331-338. [ Links ]
6. Banks, W. A., Kastin, A. J., Huang, W., Jaspan, J. B. y Maness, L. M. (1996). Leptin enters the brain by a saturable system independent of insulin. Peptides 17(2): 305-311. [ Links ]
7. Baumgartner-Parzer, S. M. y Waldhausl, W.K. (2001). The endothelium as a metabolic and endocrine organ: its relation with insulin resistance. Exp Clin Endocrinol Diabetes 109 Suppl 2: S166-179. [ Links ]
8. Beltowski, J., Wojcicka, G. y Borkowska, E. (2002). Human leptin stimulates systemic nitric oxide production in the rat. Obes Res; 10(9): 939-946. [ Links ]
9. Blum, W. F., Englaro, P., Hanitsch, S., Juul, A., Hertel, N. T., Muller, J., et al. (1997). Plasma leptin levels in healthy children and adolescents: dependence on body mass index, body fat mass, gender, pubertal stage, and testosterone. J Clin Endocrinol Metab; 82(9): 2904-2910. [ Links ]
10. Bonetti, P. O., Lerman, L. O. y Lerman, A. (2003). Endothelial dysfunction: a marker of atherosclerotic risk. Arterioscler Thromb Vasc Biol; 23(2): 168-175. [ Links ]
11. Carlyle, M., Jones, O. B., Kuo, J. J. y Hall, J.E. (2002). Chronic cardiovascular and renal actions of leptin: role of adrenergic activity. Hypertension; 39: 496-501. [ Links ]
12. Castillo, A. (2006). Bioética (1 ed.). Caracas: Disinlimed C.A. [ Links ]
13. Celermajer, D. S., Sorensen, K. E., Gooch, V. M., Miller, Sullivan, I. D., Lloyd, J. K., et al. (1992). Non-invasive detection of endothelial dysfunction in children and adults at risk of atherosclerosis. The Lancet; 340(8828): 1111-1115. [ Links ]
14. Cicinelli, E., Ignarro, L. J., Schonauer, L. M., Matteo, M. G., Galantino, P. y Falco, N. (1999). Different plasma levels of nitric oxide in arterial and venous blood. Clinical Physiology; 19(5): 440-442. [ Links ]
15. Cock, T. A. y Auwerx, J. (2003). Leptin: cutting the fat off the bone. Lancet; 362(9395): 1572-1574. [ Links ]
16. Considine, R. V., Sinha, M. K., Heiman, M. L., Kriauciunas, A., Stephens, T. W., Nyce, M. R., et al. (1996). Serum immunoreactive-leptin concentrations in normal-weight and obese humans. N Engl J Med; 334(5): 292-295. [ Links ]
17. Choh, A. C., Czerwinski, S. A., Lee, M., Demerath, E. W., Wilson, A. F., Towne, B., et al. (2005). Quantitative Genetic Analysis of Blood Pressure Response During the Cold Pressor Test. American Journal of Hypertension; 18(9): 1211-1217. [ Links ]
18. Dandona, P., Aljada, A., Chaudhuri, A., Mohanty, P. y Garg, R. (2005). Metabolic syndrome: a comprehensive perspective based on interactions between obesity, diabetes, and inflammation. Circulation; 111(11): 1448-1454. [ Links ]
19. Das, U.N. (2001). Is obesity an inflammatory condition?. Nutrition; 17(11-12):953-966. [ Links ]
20. Davy, K. P. y Hall, J.E. (2004). Obesity and hypertension: two epidemics or one?. Am J Physiol Regul Integr Comp Physiol; 286(5): R803-813. [ Links ]
21. Dawson-Saunders, B. y Trapp, R. (1997). Cap. 5: Probabilidad y temas relacionados. En: Bioestadística médica (2 ed., pp. 77-97). México: Manual Moderno. [ Links ]
22. Diagnosis and Classification of Diabetes Mellitus. (2004). Diabetes Care; 27(90001): 5S-10. [ Links ]
23. DiBona, G. F. (2004). The sympathetic nervous system and hypertension: recent developments. Hypertension; 43(2): 147-150. [ Links ]
24. Eikelis, N., Schlaich, M., Aggarwal, A., Kaye, D. y Esler, M. (2003). Interactions between leptin and the human sympathetic nervous system. Hypertension; 41(5): 1072-1079. [ Links ]
25. Embury, D. H. y Doery, J.C. (1988). Tina Quant immunoturbidometric kit for C-reactive protein adapted to the Cobas FARA centrifugal analyzer. Clin Chem; 34(11): 2381. [ Links ]
26. Endemann, D. H. y Schiffrin, E.L. (2004). Endothelial dysfunction. J Am Soc Nephrol; 15(8): 1983-1992. [ Links ]
27. Ewing, J. A. (1984). Detecting alcoholism. The CAGE questionnaire. Jama; 252(14): 1905-1907. [ Links ]
28. Feldt, R. H. y Wenstrand, D.E.V. (1942). The cold-pressor test in subjects with normal blood pressure : Report of observations on 350 subjects, with special reference to the family history. American Heart Journal; 23(6): 766-771. [ Links ]
29. Fernández-Alfonso, M. S. (2004). Regulation of vascular tone: the fat connection. Hypertension; 44(3): 255-256. [ Links ]
30. Forrester, R. L., Collinge, W., Hashimoto, P. y Worrall, J. (1976). Evaluation of a discrete-sample computer-directed clinical analyzer. Clin Chem; 22(2): 211-216. [ Links ]
31. Friedman, J. M., y Halaas, J.L. (1998). Leptin and the regulation of body weight in mammals. Nature; 395(6704): 763-770. [ Links ]
32. Fruhbeck, G. (1999). Pivotal role of nitric oxide in the control of blood pressure after leptin administration. Diabetes; 48(4): 903-908. [ Links ]
33. Green, L. C., Wagner, D. A., Glogowski, J., Skipper, P. L., Wishnok, J. S. y Tannenbaum, S.R. (1982). Analysis of nitrate, nitrite, and [15N]nitrate in biological fluids. Anal Biochem; 126(1): 131-138. [ Links ]
34. Greene, M. A., Boltax, A. J., Lustig, G. A. y Rogow, E. (1965). Circulatory dynamics during the cold pressor test. The American Journal of Cardiology, 16(1): 54-60. [ Links ]
35. Haynes, W. G., Sivitz, W. I., Morgan, D. A., Walsh, S. A. y Mark, A.L. (1997). Sympathetic and cardiorenal actions of leptin. Hypertension; 30(3 Pt 2): 619-623. [ Links ]
36. Heiss, C., Lauer, T., Dejam, A., Kleinbongard, P., Hamada, S., Rassaf, T., et al. (2006). Plasma Nitroso Compounds Are Decreased in Patients With Endothelial Dysfunction. J Am Coll Cardiol; j.jacc.2005.2006.2089. [ Links ]
37. Heitzer, T., Schlinzig, T., Krohn, K., Meinertz, T. y Munzel, T. (2001). Endothelial Dysfunction, Oxidative Stress, and Risk of Cardiovascular Events in Patients With Coronary Artery Disease. Circulation; 104(22): 2673-2678. [ Links ]
38. Hines, J. E. A. y Brown, G.E. (1936). The cold pressor test for measuring the reactibility of the blood pressure: Data concerning 571 normal and hypertensive subjects. American Heart Journal, 11(1): 1-9. [ Links ]
39. Hintze, T. H. (2001). Prologue: Nitric oxide--hormones, metabolism, and function. Am J Physiol Heart Circ Physiol; 281(6): H2253-2255. [ Links ]
40. Horn, R., Geldszus, R., Potter, E., von zur Muhlen, A. y Brabant, G. (1996). Radioimmunoassay for the detection of leptin in human serum. Exp Clin Endocrinol Diabetes; 104(6): 454-458. [ Links ]
41. Hovell, M. F. (1982). The experimental evidence for weight-loss treatment of essential hypertension: a critical review. Am J Public Health; 72(4): 359-368. [ Links ]
42. Jiang, Z. Y., Lin, Y. W., Clemont, A., Feener, E. P., Hein, K. D., Igarashi, M., et al. (1999). Characterization of selective resistance to insulin signaling in the vasculature of obese Zucker (fa/fa) rats. J Clin Invest; 104(4): 447-457. [ Links ]
43. Juge-Aubry, C. E. y Meier, C.A. (2002). Immunomodulatory actions of leptin. Mol Cell Endocrinol; 194(1-2): 1-7. [ Links ]
44. Kannel, W. B., Brand, N., Skinner, J. J. Jr., Dawber, T. R. y McNamara, P.M. (1967). The relation of adiposity to blood pressure and development of hypertension. The Framingham study. Ann Intern Med; 67(1): 48-59. [ Links ]
45. Kjaer, A., Meyer, C., Nielsen, F. S., Parving, H. H. y Hesse, B. (2003). Dipyridamole, cold pressor test, and demonstration of endothelial dysfunction: a PET study of myocardial perfusion in diabetes. J Nucl Med; 44(1): 19-23. [ Links ]
46. Kleinbongard, P., Dejam, A., Lauer, T., Jax, T., Kerber, S., Gharini, P., et al. (2006). Plasma nitrite concentrations reflect the degree of endothelial dysfunction in humans. Free Radical Biology and Medicine, 40(2): 295-302. [ Links ]
47. Kowalczyk, W. J., Evans, S. M., Bisaga, A. M., Sullivan, M. A. y Comer, S.D. (2006). Sex differences and hormonal influences on response to cold pressor pain in humans. J Pain; 7(3): 151-160. [ Links ]
48. Kuo, J. J., Jones, O. B. y Hall, J.E. (2001). Inhibition of NO synthesis enhances chronic cardiovascular and renal actions of leptin. Hypertension; 37(2Part 2): 670-676. [ Links ]
49. Lauer, T., Preik, M., Rassaf, T., Strauer, B.E., Deussen, A., Feelisch, M., et al. (2001). Plasma nitrite rather than nitrate reflects regional endothelial nitric oxide synthase activity but lacks intrinsic vasodilator action. PNAS; 98(22): 2814-12819. [ Links ]
50. Lembo, G., Vecchione, C., Fratta, L., Marino, G., Trimarco, V., dAmati, G., et al. (2000). Leptin induces direct vasodilation through distinct endothelial mechanisms. Diabetes; 49(2): 293-297. [ Links ]
51. Lohmeier, T. E., Hildebrandt, D. A., Warren, S., May, P. J. y Cunningham, J.T. (2005). Recent insights into the interactions between the baroreflex and the kidneys in hypertension. Am J Physiol Regul Integr Comp Physiol; 288(4):R828-836. [ Links ]
52. Ma, Z., Gingerich, R. L., Santiago, J. V., Klein, S., Smith, C. H. y Landt, M. (1996). Radioimmunoassay of leptin in human plasma. Clin Chem; 42(6):942-946. [ Links ]
53. Margetic, S., Gazzola, C., Pegg, G. G. y Hill, R.A. (2002). Leptin: a review of its peripheral actions and interactions. Int J Obes Relat Metab Disord; 26(11):1407-1433. [ Links ]
54. Mark, A. L., Rahmouni, K., Correia, M. y Haynes, W.G. (2003). A leptin-sympathetic-leptin feedback loop: potential implications for regulation of arterial pressure and body fat. Acta Physiol Scand; 177(3): 345-349. [ Links ]
55. Masuo, K., Mikami, H., Ogihara, T. y Tuck, M.L. (2001). Familial obesity, sympathetic activation and blood pressure level. Blood Press; 10(4): 199-204. [ Links ]
56. Matsuda, K., Teragawa, H., Fukuda, Y., Nakagawa, K., Higashi, Y. y Chayama, K. (2003). Leptin causes nitric-oxide independent coronary artery vasodilation in humans. Hypertens Res; 26(2): 147-152. [ Links ]
57. McMurray, G. y Jaques, L. (1959). Capillary resistance and blood pressure changes associated with pain due to local cooling: cold pressor test. J Appl Physiol; 14: 813-816. [ Links ]
58. Medical College of Wisconsin. (2006). Online Clinical Calculator. Fecha de acceso: 10 de agosto de 2006, tomado de: http://www.intmed.mcw.edu/clincalc/bayes.html [ Links ]
59. Miles, L.E., Lipschitz, D.A., Bieber, C.P. y Cook, J.D. (1974). Measurement of serum ferritin by a 2-site immunoradiometric assay. Anal Biochem; 61(1):209-224. [ Links ]
60. Mitchell, J. L., Morgan, D. A., Correia, M. L., Mark, A. L., Sivitz, W. I. y Haynes, W.G. (2001). Does leptin stimulate nitric oxide to oppose the effects of sympathetic activation?. Hypertension; 38(5): 1081-1086. [ Links ]
61. Mitchell, L., MacDonald, R. y Brodie, E. (2004). Temperature and the cold pressor test. J Pain; 5(4): 233-237. [ Links ]
62. Moran, O. y Phillip, M. (2003). Leptin: obesity, diabetes and other peripheral effects-a review. Pediatr Diabetes; 4(2): 101-109. [ Links ]
63. Moshage, H. (1997). Nitric Oxide Determinations: Much Ado About NO- Thing?. Clin Chem; 43(4): 553-556. [ Links ]
64. Naveilhan, P., Hassani, H., Canals, J. M., Ekstrand, A. J., Larefalk, A., Chhajlani, V., et al. (1999). Normal feeding behavior, body weight and leptin response require the neuropeptide Y Y2 receptor. Nat Med; 5(10): 1188-1193. [ Links ]
65. Niskanen, L., Laaksonen, D. E., Nyyssonen, K., Punnonen, K., Valkonen, V. P., Fuentes, R., et al. (2004). Inflammation, abdominal obesity, and smoking as predictors of hypertension. Hypertension; 44(6): 859-865. [ Links ]
66. Niswender, K. D. y Schwartz, M.W. (2003). Insulin and leptin revisited: adiposity signals with overlapping physiological and intracellular signaling capabilities. Front Neuroendocrinol; 24(1): 1-10. [ Links ]
67. Nitenberg, A., Paycha, F., Ledoux, S., Sachs, R., Attali, J. R. y Valensi, P. (1998). Coronary artery responses to physiological stimuli are improved by deferoxamine but not by L-arginine in non-insulin-dependent diabetic patients with angiographically normal coronary arteries and no other risk factors. Circulation; 97(8): 736-743. [ Links ]
68. Nitenberg, A., Valensi, P., Sachs, R., Cosson, E., Attali, J. R. y Antony, I. (2004). Prognostic value of epicardial coronary artery constriction to the cold pressor test in type 2 diabetic patients with angiographically normal coronary arteries and no other major coronary risk factors. Diabetes Care; 27(1): 208-215. [ Links ]
69. Panteghini, M. (2004). Role and importance of biochemical markers in clinical cardiology. Eur Heart J; 25(14): 1187-1196. [ Links ]
70. Pasceri, V., Willerson, J. T. y Yeh, E.T. (2000). Direct proinflammatory effect of C-reactive protein on human endothelial cells. Circulation; 102(18): 2165-2168. [ Links ]
71. Perticone, F., Ceravolo, R., Pujia, A., Ventura, G., Iacopino, S., Scozzafava, A., et al. (2001). Prognostic significance of endothelial dysfunction in hypertensive patients. Circulation; 104(2): 191-196. [ Links ]
72. Rahmouni, K., Correia, M. L., Haynes, W. G. y Mark, A.L. (2005). Obesity-associated hypertension: new insights into mechanisms. Hypertension; 45(1): 9-14. [ Links ]
73. Ridker, P. M. (2001). High-sensitivity C-reactive protein: potential adjunct for global risk assessment in the primary prevention of cardiovascular disease. Circulation; 103(13): 1813-1818. [ Links ]
74. Roatta, S., Micieli, G., Bosone, D., Losano, G., Bini, R., Cavallini, A., et al. (1998). Effect of generalised sympathetic activation by cold pressor test on cerebral haemodynamics in healthy humans. J Auton Nerv Syst; 71(2-3): 159-166. [ Links ]
75. Roberts, W. L., Moulton, L., Law, T. C., Farrow, G., Cooper-Anderson, M., Savory, J., et al. (2001). Evaluation of Nine Automated High-Sensitivity C-Reactive Protein Methods: Implications for Clinical and Epidemiological Applications. Part 2. Clin Chem; 47(3): 418-425. [ Links ]
76. Rondón, S., Cluet, I., Rossell, M. y Alvarez, T. (2002). Niveles séricos de óxido nítrico en adolescentes con antecedentes hereditarios de hipertensión arterial sistémica. Arch Venez Puer Ped; 65(4): 159-164. [ Links ]
77. Seifarth, C. C., Miertschischk, J., Hahn, E. G. y Hensen, J. (2004). Measurement of serum and plasma osmolality in healthy young humans--influence of time and storage conditions. Clin Chem Lab Med; 42(8): 927-932. [ Links ]
78. Seneviratne, B. I., Linton, I., Wilkinson, R., Rowe, W. y Spice, M. (1983). Cold pressor test in diagnosis of coronary artery disease: echophonocardiographic method. Br Med J (Clin Res Ed); 286(6382): 1924-1926. [ Links ]
79. Sesso, H. D., Buring, J. E., Rifai, N., Blake, G. J., Gaziano, J. M. y Ridker, P.M. (2003). C-Reactive Protein and the Risk of Developing Hypertension. JAMA; 290(22): 2945-2951. [ Links ]
80. Shamsuzzaman, A. S., Winnicki, M., Wolk, R., Svatikova, A., Phillips, B. G., Davison, D. E., et al. (2004). Independent association between plasma leptin and C-reactive protein in healthy humans. Circulation; 109(18): 2181-2185. [ Links ]
81. Sharma, A. M. y Grassi, G. (2001). Obesity and hypertension: cause or consequence?. J Hypertens; 19(12): 2125-2126. [ Links ]
82. Sharp, A. M., Walters, C. A., Wong, S. D. y Caterson, I.D. (1992). IRMA and RIA compared for assessing dexamethasone suppression of corticotropin in plasma. Clin Chem; 38(1): 149-. [ Links ]
83. Shek, E. W., Brands, M. W. y Hall, J.E. (1998). Chronic leptin infusion increases arterial pressure. Hypertension; 31(1 Pt 2): 409-414. [ Links ]
84. The sixth report of the Joint National Committee on prevention, detection, evaluation, and treatment of high blood pressure. (1997). Arch Intern Med; 157(21): 2413-2446. [ Links ]
85. Soltero, I. (2002). La proteína C reactiva: un marcador para el proceso aterosclerótico. En: AVA (Ed.), Aterosclerosis al día (5ta ed., pp. 285-300). Caracas: Asociación Venezolana de Aterosclerosis. [ Links ]
86. Soltis, E. E. y Cassis, L.A. (1991). Influence of perivascular adipose tissue on rat aortic smooth muscle responsiveness. Clin Exp Hypertens A; 13(2): 277-296. [ Links ]
87. Stenvinkel, P. (2000). Leptin and blood pressure--is there a link? Nephrol Dial Transplant; 15(8): 1115-1117. [ Links ]
88. Sumpio, B. E., Riley, J. T. y Dardik, A. (2002). Cells in focus: endothelial cell. Int J Biochem Cell Biol; 34(12): 1508-1512. [ Links ]
89. Sweeney, G. (2002). Leptin signalling. Cell Signal; 14(8): 655-663. [ Links ]
90. Szmitko, P. E., Wang, C. H., Weisel, R. D., de Almeida, J. R., Anderson, T. J. y Verma, S. (2003). New markers of inflammation and endothelial cell activation: Part I. Circulation; 108(16): 1917-1923. [ Links ]
91. Tartaglia, L. A. (1997). The leptin receptor. J Biol Chem; 272(10): 6093-6096. [ Links ]
92. Thakur, V., Richards, R. y Reisin, E. (2001). Obesity, hypertension, and the heart. Am J Med Sci; 321(4): 242-248. [ Links ]
93. Tousoulis, D., Antoniades, C., Charakida, M., Toutouzas, K., Trikas, A., Stefanadi, E., et al. (2006). Cold pressor test as a marker for the detection of early stage coronary atherosclerosis. Int J Cardiol; Artículo en Prensa. [ Links ]
94. Tousoulis, D., Davies, G., Tentolouris, C., Crake, T. y Toutouzas, P. (1997). Inhibition of nitric oxide synthesis during the cold pressor test in patients with coronary artery disease. Am J Cardiol; 79(12): 1676-1679. [ Links ]
95. Triggle, C. R., Hollenberg, M., Anderson, T. J., Ding, H., Jiang, Y., Ceroni, L., et al. (2003). The endothelium in health and disease--a target for therapeutic intervention. J Smooth Muscle Res; 39(6): 249-267. [ Links ]
96. Tsikas, D. (2006). Analysis of nitrite and nitrate in biological fluids by assays based on the Griess reaction: Appraisal of the Griess reaction in the l-arginine/nitric oxide area of research. Journal of Chromatography B; En prensa.(doi:10.1016/j.jchromb.2006.07.054). [ Links ]
97. Vecchione, C., Aretini, A., Maffei, A., Marino, G., Selvetella, G., Poulet, R., et al. (2003). Cooperation between insulin and leptin in the modulation of vascular tone. Hypertension; 42(2): 166-170. [ Links ]
98. Velasco, M., Gomez, J., Blanco, M. y Rodriguez, I. (1997). The cold pressor test: pharmacological and therapeutic aspects. Am J Ther; 4(1): 34-38. [ Links ]
99. Velasco, M., Urbina-Quintana, A., Andrews-Figueroa, P., Nieves, D., Hernandez, E., Guevara-Casado, J., et al. (1982). Effect of indoramin and propranolol on cardiovascular response to cold in hypertensive patients. Clin Pharmacol Ther; 32(1): 7-11. [ Links ]
100. Verlohren, S., Dubrovska, G., Tsang, S. Y., Essin, K., Luft, F. C., Huang, Y., et al. (2004). Visceral periadventitial adipose tissue regulates arterial tone of mesenteric arteries. Hypertension; 44(3): 271-276. [ Links ]
101. Verma, S., Buchanan, M. R. y Anderson, T.J. (2003). Endothelial function testing as a biomarker of vascular disease. Circulation; 108(17): 2054-2059. [ Links ]
102. Victor, R. G., Leimbach, W. N. Jr., Seals, D. R., Wallin, B. G. y Mark, A.L. (1987). Effects of the cold pressor test on muscle sympathetic nerve activity in humans. Hypertension; 9(5): 429-436. [ Links ]
103. Winters, B., Mo, Z., Brooks-Asplund, E., Kim, S., Shoukas, A., Li, D., et al. (2000). Reduction of obesity, as induced by leptin, reverses endothelial dysfunction in obese (Lep(ob)) mice. J Appl Physiol; 89(6): 2382-2390. [ Links ]
104. Woisetschlager, C., Waldenhofer, U., Bur, A., Vlcek, M., Riedl, A. M. y Hirschl, M.M. (2000). Different blood pressure response to the cold pressor test predicts preeclampsia. American Journal of Hypertension; 13(4, Supplement 1):S301-S301. [ Links ]
105. York, D. A., Rossner, S., Caterson, I., Chen, C. M., James, W. P., Kumanyika, S., et al. (2004). Prevention Conference VII: Obesity, a worldwide epidemic related to heart disease and stroke: Group I: worldwide demographics of obesity. Circulation; 110(18): e463-470. [ Links ]
106. Zhang, Y., Proenca, R., Maffei, M., Barone, M., Leopold, L. y Friedman, J.M. (1994). Positional cloning of the mouse obese gene and its human homologue. Nature; 372(6505): 425-432. [ Links ]