Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT vol.31 no.1 Caracas mar. 2012
Comparación de la biodisponibilidad de un producto test conteniendo SULTAMICILINA comprimidos de 375 mg de liberación inmediata de Laboratorios GENVEN (LETI, S. A. V.) contra la SULTAMICILINA de referencia (Unasyn®) tabletas de 375 mg de Laboratorios PFIZER, luego de administrar una dosis única en voluntarios sanos
Comparison of the bioavailability of a test product containing Sultamicillin tablets of 375 mg immediate release Laboratorios GENVEN (LETI, SAV) against sultamicillin reference (Unasyn ®) 375 mg tablets of PFIZER, after single dose administration in healthy volunteers
Hugo Cohen Sabban1; María González Yibirín2
1 Cro Bio Solution.Av Córdova 2625 5 F. Buenos Aires - Argentina.
2 Laboratorios LETI. SAV, Guarenas, Estado Miranda, Venezuela.
Resumen
Objetivo: El objetivo del estudio es evaluar la biodisponibilidad comparada entre dos formulaciones de liberación inmediata de Sultamicilina 375 mg, luego de una administración única, en un mismo grupo de voluntarios sanos.
Métodos: El estudio se realizó en 12 voluntarios sanos de ambos sexos.
Los voluntarios recibieron de acuerdo al esquema asignado por la aleatorización y en dos períodos, una dosis única por vía oral de un comprimido de una formulación conteniendo 375 mg de Sultamicilina de Laboratorios Genven (Leti,S.A.V.), o una tableta del producto de referencia Unasyn®, de Laboratorios Pfizer. La administración se realizó en ayuno de 10 horas de duración y se mantuvo por dos horas después de suministrado el fármaco. Entre ambos períodos se realizó un lavado de tres días. Los voluntarios que recibieron el producto test en el primer período recibieron el producto de referencia y viceversa. Durante cada período del estudio se obtuvieron doce muestras de sangre: antes de la dosis (tiempo cero), a los 20, 40, 60, 80, 100, 120, 150, 180, 240, 300 y 360 minutos.
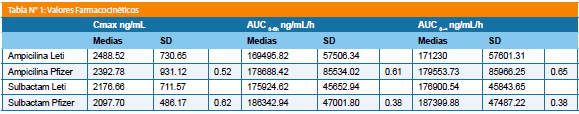
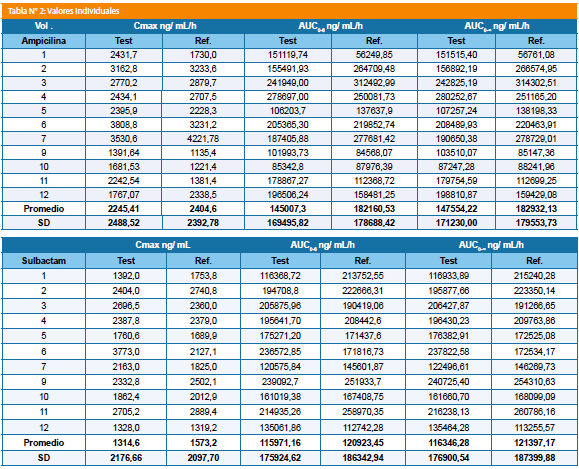
Resultados: Para ampicilina las variables farmacocinéticas fueron: formulación test Cmax 2.488.52+/-730.65 ng/mL y para ampicilina referencia 2.392,78+/-931,12 ng/mL; para las AUC0-6 fueron de 169.495,82+/-57506,34 ng/mL/h para la formulación test y de 178.688,42+/-85.534,02 ng/mL/h para la formulación de referencia, para la AUC0-∞ los valores resultantes fueron 171.230+/-57.601,31 ng/mL/h para la formulación test y de 179.553,73+/-85.966 ng/mL/h para la formulación de referencia.
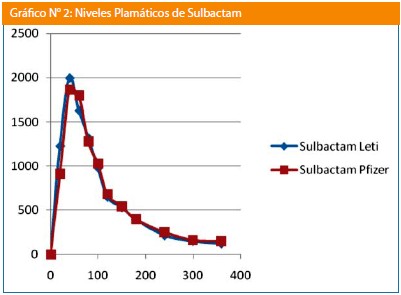
Para el sulbactam las variables farmacocinéticas fueron: formulación test, Cmax: 2.176,66+/-711,57 ng/mL y para la referencia 2.097,70+/-486,17 ng/mL; las AUC0-6 fueron de 175.924,62+/-45.652,94 ng/mL/h para la formulación test y de 186.342,94+/-47.001,80 ng/mL/h para la formulación de referencia, para la AUC0-∞ los valores resultantes fueron 176.900,54+/-45.843,65 ng/mL/h para la formulación test y de 187.399,88+/-47.487,22 ng/mL/h para la formulación de referencia.
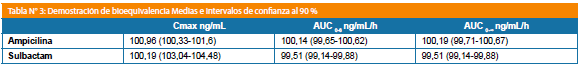
Los parámetros farmacocinéticos para Ampicilina y Sulbactam, Cmax, AUC0-6 y AUC0-∞ Log-transformados así como sus intervalos de confianza al 90% se encontraron entre los márgenes aceptados para que los productos sean considerados bioequivalentes.
Conclusiones: Ambos productos son bioequivalentes y por lo tanto intercambiables.
Palabras Clave: Ampicilina, sulbactam, sultamicilina, bioequivalencia.
Abstract
Objective: Evaluated the comparative bioavailability of two formulations of immediate release 375 mg Sultamicillin after a single administration in the same group of healthy volunteers.
Methods: The study was conducted in 12 healthy volunteers of both sexes. The volunteers were assigned according to the randomization scheme and two periods, a single oral dose of one tablet of a formulation containing 375 mg of Sultamicillin Genven (Leti, S.A.V.) Laboratories, or the reference product Unasyn®, Pfizer Laboratories. The administration was carried out in fast of 10 hours and continued for two hours after administering the drug. Between the two periods was a washout period of three days. Volunteers who received the test product in the first period will receive the reference product and vice versa. During each period of twelve samples were obtained from blood: pre-dose (time zero) 20, 40, 60, 80, 100, 120, 150, 180, 240, 300 and 360 minutes.
Results: For ampicillin pharmacokinetic parameters were Cmax test formulation 2.488.52+/-730.65 ng/mL and reference formulation 2.392,78+/-931.12 ng/mL; for AUC0-6 were 169.495,82+/-57.506,34 ng/mL/h for the test formulation and 178.688,42+/-85.534,02 ng/mL/h for the reference formulation, for the AUC0-∞ the resulting values were 171.230+/- 57.601,31 ng/mL/h for the test formulation and 179.553,73+/- 85.966 ng/mL/h for the reference formulation.
For sulbactam pharmacokinetic parameters were: Cmax: test 2.176,66+/-711.57 ng/mL and reference 2.097,70+/- 486.17 ng/mL; the AUC0-6 were 175.924,62+/-45.652,94 ng/ mL/h for the test formulation and 186.342.94+/-47.001,80 ng/mL/h for the reference formulation, for the AUC0-∞ the resulting values were 176.900.54+/-45.843,65 ng/mL/h to formulation test and 187.399,88+/-47.487,22 ng/mL/h for the reference formulation.
The pharmacokinetic parameters for Ampicillin and Sulbactam, Cmax, AUC0-6 and AUC0-∞ and log transformed confidence intervals 90% were among the accepted margins for the products are considered bioequivalent.
Conclusions: Both products are bioequivalent and therefore interchangeable.
Key Words: Ampicillin, sulbactam, sultamicillin, bioequivalence.
Recibido: 28/11/2011 Aceptado: 28/01/2012
Introducción
La sultamicilina es un éster doble en el que la ampicilina y el inhibidor de la betalactamasa, sulbactam, están unidos mediante un grupo metileno. La sultamicilina es el éster sulfona oximetilpenicilinato de la ampicilina. Después de la administración oral, la sultamicilina se hidroliza durante la absorción a sulbactam y ampicilina en una proporción molar 1:1 en la circulación sistémica. Su biodisponibilidad es del 80% y no es afectada si se administra después de la alimentación. Los niveles máximos de ampicilina en suero después de la administración de sultamicilina son aproximadamente el doble de los alcanzados con una dosis igual de ampicilina oral. Las vidas medias de eliminación son de alrededor de 0,75 y 1 hora para sulbactam y ampicilina, respectivamente, en voluntarios sanos; se excreta un 50% a 75% de cada agente en la orina, en forma inalterada. Las vidas medias de eliminación se incrementan en pacientes de edad avanzada y en aquellos con disfunción renal.
Aunque el sulbactam no posee actividad antibacteriana útil, excepto contra Neisseriaceae, Acinetobacter calcoaceticus, Bacteroidesspp, Branhamella catarrhalis y Pseudomonas cepacia, los estudios bioquímicos en sistemas bacterianos libres de células han demostrado que es un inhibidor irreversible de varias betalactamasas importantes, que se presentan en los gérmenes resistentes a la penicilina. La propiedad del sulbactam de evitar la destrucción de las penicilinas por parte de microorganismos resistentes se confirma en estudios con gérmenes completos, que utilizan cepas resistentes, en los que el sulbactam despliega efectos sinérgicos notables cuando se administra junto con las penicilinas, mientras que posee poco o ningún efecto sobre la actividad de la penicilina en el ataque contra cepas sensibles.
El componente bactericida de la sultamicilina es la ampicilina, que al igual que la bencilpenicilina actúa frente a microorganismos sensibles durante la etapa de multiplicación activa, por inhibición de la biosíntesis de mucopéptidos de la pared celular. Tiene acción bactericida y su efecto depende de su capacidad para alcanzar y unirse a las proteínas que ligan penicilinas (PBP-1-PBP-3) localizadas en la membrana citoplasmática bacteriana. Las bacterias que se dividen en forma rápida son las más sensibles a la acción de las penicilinas. La sultamicilina posee el mismo espectro de acción básico que la ampicilina y cubre los gérmenes que han adquirido resistencia a la ampicilina por producción de betalactamasas. La sultamicilina es efectiva contra un amplio espectro de bacterias grampositivas y gramnegativas, incluidas Staphylococcus aureus y epidermidis (incluso cepas resistentes a la penicilina y algunas resistentes a la meticilina) Streptococcus pneumoniae, Morganella morganii; especies de Citrobacter; Neisseria meningitidis y Neisseria gonorrhoeae. Streptococcus faecalis y otras especies de Streptococcus; Haemophilus influenzae y parainfluenzae (cepas betalactamasa-positivas y negativas); Branhamella catarrhalis; anaerobios incluso Bacteroides fragilis y especies relacionadas; Escherichia coli; especies de Klebsiella; especies de Enterobacter1,2.
Los efectos adversos más frecuentemente reportados para la Sultamcilina incluyen: diarrea, náuseas, moniliasis genital, dolor abdominal, reacciones de hipersensibilidad, moderada elevación de las enzimas hepáticas, nefritis, anemia hemolítica.
Objetivo
Evaluar en voluntarios sanos la biodisponibilidad comparativa entre dos formulaciones de Sultamicilina, luego de la administración de una dosis única de un comprimido o una tableta de 375 mg, de una formulación de estudio de Laboratorios Genven, (LETI, S.A.V.), contra una de referencia, UNASYN®, de Laboratorios PFIZER.
Pesquisar, evaluar, registrar e informar sobre eventos adversos que se observen durante el estudio
Diseño del estudio
Estudio abierto, randomizado, balanceado, con control activo, de dosis única, cruzado, con dos períodos de ensayo separados por un período de descanso de tres días, y administración del producto en ayunas de 10 horas de duración. Consiste en la administración a cada sujeto por vía oral de un comprimido de 375 mg de Sultamicilina de liberación inmediata del producto test de Laboratorios Genven, (LETI, S.A.V.) o una tableta del producto de referencia UNASYN® de Laboratorios Pfizer. Se incluyeron 12 voluntarios sanos. Los voluntarios firmaron el consentimiento informado antes de ingresar en el estudio. Se ingresaron sujetos adultos sanos (21 a 55 años) de ambos sexos, con Índice de masa corporal entre 18 y 27 Kg/m2 inclusive. Con evaluaciones médicas y los análisis de laboratorio (bioquímica, hematología y orina) sin alteraciones significativas. Serología negativa para HIV, hepatitis B, C, y sífilis. Ausencia de antecedentes para ingesta de alcohol y drogas de abuso. Alta probabilidad de cumplimiento de los procedimientos establecidos en el protocolo: ingesta de los fármacos en estudio, obtención de las muestras de sangre, visitas de seguimiento y requerimientos adicionales para llevar a cabo el estudio.
No se incluyeron: Pacientes con hipersensibilidad conocida al medicamento administrado o a los materiales utilizados, que presentasen cualquier condición o antecedente que, de acuerdo al criterio del Investigador Médico, pudiese ser considerado como factor de riesgo para la administración de SULTAMICILINA o pueda alterar la farmacocinética de dicho principio activo.
Sujetos que hubiesen participado en un ensayo clínico previo en las doce semanas previas al presente estudio, o que hubiesen recibido algún tipo de medicación dentro de las 4 semanas previas al inicio del estudio sin autorización del médico investigador.
Sujetos que hubiesen recibido anestesia dentro de los dos meses previos al estudio. Sujetos que fumen más de 10 cigarrillos por día, sujetos que hubiesen donado sangre dentro de los dos meses previos al inicio del estudio, embarazo o lactancia.
Luego del procedimiento de aleatorización, en cada periodo del estudio se obtuvieron doce muestras de sangre: antes de la dosis (tiempo cero) y 20, 40, 60, 80, 100, 120, 150, 180, 240, 300 y 360 minutos luego de la administración del producto.
Finalizado el período de descanso, se realizó el cruce de administración de los productos y se volvieron a obtener muestras de sangre en los tiempos antes mencionados.
Durante toda la realización del estudio, se interrogó directamente sobre la presencia de algún evento adverso.
El grado de los eventos observados fue clasificado utilizando la siguiente escala.
1. Leve: es molesto, pero no requiere atención médica y no limita las actividades diarias.
2. Moderado: es tolerable, pero requiere atención médica y limita parcialmente las actividades diarias.
3. Severo: es intolerable, requiere atención médica y/o suspensión del tratamiento y limita completamente las actividades diarias.
4. Serio: Causa la muerte, o requiere hospitalización del sujeto, porque el evento puede ser o no una amenaza vital.
Se analizó el contenido de Ampicilina y Sulbactam de todas las muestras obtenidas durante el estudio mediante un método de cromatografía liquida de alta presión acoplado a espectrometría de ultra violeta, específico, sensitivo y validado. Las muestras de 0 h (previas a la administración de SULTAMICILINA) fueron analizadas y consideradas como dato basal.
Parámetros de biodisponibilidad evaluados
Para el análisis de biodisponibilidad de las dos formulaciones, la variable principal fue el área bajo la curva (AUC) calculada a partir de las concentraciones plasmáticas de Ampicilina y Sulbactam. En el análisis cinético se consideró el AUC0-t y el AUC0-inf. También se tuvo en cuenta la concentración máxima (Cmax) y el tiempo en el que aparece (Tmax).
El AUC0-inf se calculó mediante la suma de dos AUC parciales: a) AUC0-t abarcando todos los tiempos de muestreo y calculada mediante la regla trapezoidal, y b) AUC0-inf, que representa la exposición total a la droga extrapolada a infinito; calculada como la suma del AUC0-t, y el cociente C/K, siendo C la ultima concentración detectable y K la pendiente de la recta obtenida mediante regresión lineal a partir de los puntos correspondientes a la fase de eliminación del fármaco. Para determinar el número de puntos utilizados en el cálculo de K, se comenzó la regresión a partir del primer punto después de la Cmax.
Resultados
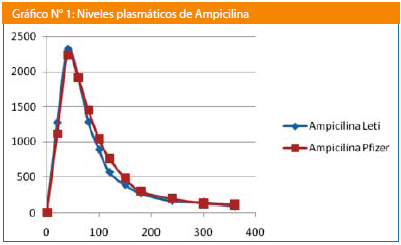
Para ampicilina las variables farmacocinéticas fueron Cmax test 2.488.52+/-730.65 ng/mL y para referencia 2.392.78+/- 931.12 ng/mL; para las AUC0-6 fueron de 169.495.82+/- 57.506.34 ng/mL/h para la formulación test y de 178.688.42+/- 85.534.02 ng/mL/h para la formulación de referencia, para la AUC0-∞ los valores resultantes fueron 171.230+/-57.601.31 ng/mL/h para la formulación test y de 179.553,73+/-85.966,25 ng/mL/h para la formulación de referencia.
Para el sulbactam las variables farmacocinéticas fueron Cmax: test 2.176.66+/-711.57 ng/mL y para la referencia 2.097.70+/-486.17 ng/mL; para las AUC0-6 fueron de 175.924.62+/-45.652.94 ng/mL/h para la formulación test y de 186.342.94+/-47.001.80 ng/mL/h para la formulación de referencia, para la AUC0-∞ los valores resultantes fueron 176.900.54+/-45.843.65 ng/mL/h para la formulación test y de 187.399.88+/-47.487.22 ng/mL/h para la formulación de referencia (Tabla N° 1).
Los parámetros farmacocinéticos para ampicilina y sulbactam, Cmax, AUC0-6 y AUC0-∞ Log-transformados así como sus intervalos de confianza al 90% se encontraron entre los márgenes aceptados para que los productos sean considerados bioequivalentes (Tabla N° 3).
La acción de un antimicrobiano depende de múltiples factores, siendo los más importantes la acción antibacteriana (efecto bacteriostático o bactericida) y la sensibilidad del microorganismo a este antimicrobiano. Sin embargo, es también muy importante el proceso desde que se administra el antimicrobiano hasta que finalmente llega al tejido infectado, el verdadero sitio de acción; en este sentido es muy importante lo que acontece en el nivel central, especialmente en aquellas infecciones que se presentan en la sangre, y también lo que ocurre en los tejidos, para lo cual es importante entender los conceptos de farmacocinética y farmacodinamia.
En función de su mecanismo de acción, las drogas antibacterianas se dividen en fármacos antiinfecciosos dependientes del tiempo o de la concentración.
Tiempo > CIM (T> CIM): es el porcentaje acumulado de tiempo (24 horas) durante el cual la concentración de la droga supera a la CIM.
Este parámetro (mejor expresado por tc > CIM) se utiliza esencialmente para predecir la eficacia de antibióticos dependientes del tiempo (por ejemplo, en el caso de los β lactámicos, glucopeptidos, macrólidos, clindamicina y oxazolidinonas). Las drogas que pertenecen a este grupo muestran aumento escaso o nulo del efecto cuando se incrementa la concentración.
Razón pico/CIM (Cmax/CIM): es el nivel pico dividido por la CIM. En la literatura, el Cmax/CIM también se expresa como pico/CIM, índice o cociente inhibitorio. El parámetro se utiliza para predecir o describir el efecto antibacteriano de los antibióticos cuya eficacia depende de la concentración. Los aminoglucósidos y las quinolonas muestran mayor actividad con concentraciones más elevadas3,4.
AUC /CIM: es el AUC de concentración-tiempo sobre 24 horas dividido por la CIM. Cuando no se especifica ningún otro período se asume que el AUC es el valor de 24 horas en estado de equilibrio. Este índice AUC/CIM se emplea para predecir la eficacia de antibióticos cuyo efecto depende de la concentración5,6.
En un estudio efectuado en pacientes con otitis media usando β-lactámicos, macrólidos y cotrimoxazol, se encontró que hubo 80 a 85% de eficacia clínica y microbiológica cuando la concentración del antimicrobiano fue superior que la CIM (T > CIM) por un tiempo mayor de 40 a 50% del intervalo entre dos dosis de ese antimicrobiano7.
Hay evidencias de que la actividad antibacteriana depende del tiempo sobre la CIM; se alcanza un efecto bacteriostático si el T > CIM es de 30 a 40% del intervalo entre dos dosis, y un efecto bactericida si el T > CIM es de 60 a 70% del intervalo entre dos dosis.
En los fármacos cuya actividad depende de la concentración plasmática pick del antimicrobiano sobre la CIM (Cmáx/CIM). Como al aumentar la concentración pick, también aumenta el área bajo la curva, la relación área bajo la curva sobre la CIM (AUC/CIM) está íntimamente relacionada con el primero. Estas dos variables son los mejores predictores de resultado clínico para aquellos antimicrobianos que se comportan según este modelo. Además estos antimicrobianos tienen importante efecto post-antibiótico.
En un estudio con ciprofloxacina en neumonía nosocomial, la relación AUC/CIM fue el factor predictor más importante de respuesta clínica y microbiológica. Aquellos pacientes que tuvieron AUC/CIM < 125 presentaron respuesta clínica adecuada en 42% y microbiológica en 26%; en cambio, aquellos pacientes que tuvieron AUC/CIM >125 presentaron respuesta clínica adecuada en 80% y microbiológica en 82%8.
En este estudio los productos además de demostrar bioequivalencia y por lo tanto intercambiabilidad, se mantienen encima de las CIM efectivas para los gérmenes sensibles en todo el intervalo de dosis, lo que garantiza su efectividad terapéutica4,5,6,7,8.
Referencias
1. Merza J. Guía de la terapéutica antimicrobiana. 2008. Pág. 48. [ Links ]
2. Casellas y col. Actividad in vitro de niveles sérico y urinarios de Amoxicilina y Amoxicilina Sulbactam sobre 820 cepas de Echerichia Coliaisladas de infecciones urinarias bajas extrahospitalarias. Rev. Chil. Infect. 2003; 20(1):11-18. [ Links ]
3. Amsden G W, Ballow C H, Betino J S. Pharmacokinetics and Pharmacodynamics of Antiinfective Agents. Mandell, Douglas & Bennetts Principles and Practice of Infectious Diseases. Mandell G L, Bennett J E, Dolin R editores. 5th ed 2000; Churchill Livingstone, Philadelphia pp: 253-60. [ Links ]
4. Craig W A. Pharmacokinetics / Pharmacodinamics parameters: rationale for antibacterial dosing on mice and men. Clin Infect Dis 1998; 26: 1-12. [ Links ]
5. Burgess D. Pharmacodinamics principles of antimicrobial therapy in the prevention of resistance. Chest 1999; 115: 19S-23S. [ Links ]
6. Craig W A, Ebert S C. Killing and re-gowth of bacteria in vitro: A review. Scand J Infect Dis 1991; 74: 63-70. [ Links ]
7. Craig W A, Andes D. Pharmacokinetics and pharmacodinamics of antibiotics in otitis media. Pediatr Infect Dis J 1996; 15: 255-9. [ Links ]
8. Moore R D, Lietman P S, Smith C R. Clinical response to aminoglycoside therapy: importance of the ratio of peak concentration to minimum inhibitory concentration. J Infect Dis 1987; 155: 93-9. [ Links ]