Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT vol.31 no.4 Caracas dic. 2012
Susceptibilidad in vitro de candida spp. aisladas de la cavidad oral de pacientes VIH/sida a itraconazol, clotrimazol y ketoconazol
In vitro susceptibility of Candida spp. isolated fromthe oral cavity of HIV / AIDS patients to itraconazole, clotrimazole and ketoconazole
Jerez Puebla LE, Fernández CM, Illnait MT, Perurena MR, Rodríguez I y Martínez G.
Laboratorio Nacional de Referencia de Micología INSTITUTO DE MEDICINA TROPICAL "PEDRO KOURÍ" Autopista Novia del Mediodía, km 6 ½. La Habana, Cuba
Autor para correspondencia: Luis E. Jerez (email: ljerezp@ipk.sld.cu)
Resumen
Introducción: La candidiasis orofaríngea (COF) permanece como una de las principales infecciones oportunistas en pacientes infectados con el virus de la inmunodeficiencia humana (VIH) y con el síndrome de inmunodeficiencia adquirida (sida), y aunque su incidencia ha disminuido con la introducción de la terapia antirretroviral de alta eficacia, continúa siendo una afección característica en estos pacientes. Materiales y Métodos: En el presente trabajo se realizó un estudio de susceptibilidad in vitro mediante la metodología del CLSI, frente a itraconazol, ketoconazol y clotrimazol de 144 aislamientos clínicos de Candida, aisladas de la cavidad oral de pacientes infectados con el VIH/sida con cuadros clínicos de COF. Resultados: La identificación de los aislamientos demostró que más del 90 % pertenecían a Candida albicans. Al determinar el patrón general de susceptibilidad frente a los azoles estudiados mediante el método de microdilución en caldo del documento M27-A2 del Clinical and Laboratory Standard Institute, C. albicans exhibió valores de concentración mínima inhibitoria (CMI) en un rango de 0,01 a 8µg/mL para el itraconazol y el ketoconazol y de 0,01 a 2 µg/mL para el clotrimazol. Sólo el 2,1 % de los aislamientos mostró franca resistencia frente al itraconazol, en tanto que el 3,5 % quedó clasificado dentro de la categoría susceptible dosis-dependiente para este triazol. La mayoría de los aislamientos de C. albicans mostraron valores de CMI frente al ketoconazol y al clotrimazol menores a 0.06 µg/mL, siendo de un 96,9% (129 aislamientos) y de un 97,7% (129 aislamientos), respectivamente. El clotrimazol tuvo una mejor actividad in vitro comparado con los restantes azoles frente a los aislamientos estudiados. Conclusión: Candida spp. Mostró una elevada sensibilidad in vitro a los azoles estudiados. Se hace necesario continuar realizando estudios epidemiológicos para determinar los patrones de susceptibilidad y tasas de resistencias frente a los agentes antifúngicos.
Palabras claves: susceptibilidad in vitro; Candida; itraconazol; ketoconazol; clotrimazol, candidiasis orofaríngea; VIH/sida.
Abstract
Introduction: The oropharyngeal candidiasis (OFC) remains as one of the principal opportunistic infections in patients infected with the human immunodeficiency virus (HIV) and with the acquired immunodeficiency syndrome (aids), and although his incidence has declined with the introduction of the highly active anti-retroviral therapy (HAART), remains as a typical complaint in these patients. Materials and Methods: A study of antifungal in vitro susceptibility testing, following the CLSI methodology, was realized against itraconazole, ketoconazole and clotrimazole of 144 clinical isolations of Candida, isolated from the oral cavity of patients infected with HIV/aids, with clinical pictures of OFC. Results: The isolations identification, demonstrated that more than 90% belonged to Candida albicans. The determination of the general pattern of susceptibility, following the document M27-A2 of the Clinical and Laboratory Standard Institute, against to the studied azoles by means of the method of microdilution in liquid medium, show that the majority of C. albicans isolates showed values of MIC against ketoconazole and clotrimazole lower than 0.06 µg/mL, representing a 96,9% (129 isolations) and a 97,7% (129 isolations), respectively. C. albicans exhibited the widest range of minimal inhibitory concentration (MIC). Only 2.1% of the isolations showed resistance against to itraconazole, while 3.5 % remained classified in the category sensible dose - dependent for this triazole. The majority of the strains showed values of MIC against ketoconazole and clotrimazole below 0.06 µg/mL. The clotrimazole had a better in vitro activity compared with the remaining azoles opposite to the isolations. Conclusion: Candida spp. showed a high in vitro sensibility to the azoles studied. It becomes necessary the maintenance of epidemiologic studies for the determination of susceptibility patterns and of resistances rates against to the antifungal agents.
Keywords: in vitro antifungal susceptibility testing; Candida; itraconazole; ketoconazole; clotrimazole, oropharyngeal candidiasis; HIV/aids.
Recibido: 06/02/0012 Aceptado: 16/09/2012
Declaro que no hay conflicto de intereses en este artículo de investigación.
Agradecimientos: Deseamos agradecer a Ana María, Ada, Rosa, Mayra, compañeras del Departamento de Medios de cultivo y esterilización y fregado por toda la ayuda dada.
Introducción
La candidiasis orofaríngea (COF) es la infección fúngica más frecuente entre los pacientes infectados por el virus de inmunodeficiencia humana (VIH), y ha sido estimado que más del 90% de estos pacientes desarrollan esta infección oportunista en algún momento durante la progresión de su enfermedad1.
Hasta la introducción de los nuevos triazoles en la década de 1990 y su amplio uso tanto para el tratamiento de las micosis superficiales como el de las sistémicas, no se consideraba imprescindible el disponer de métodos de estudio de la susceptibilidad in vitro a los antifúngicos. Aunque es indudable el valor terapéutico de los azoles, en los últimos años se han observado episodios de COF que no han respondido adecuadamente a este tratamiento y se han descrito aislamientos clínicos que han sido resistentes in vitro a ketoconazol, fluconazol y/o a itraconazol2-4.
Dentro de los métodos de referencia para realizar los estudios de susceptibilidad in vitro en levaduras, destacan los recomendados por el CLSI (Clinical and Laboratory Standards Institute), anteriormente denominado NCCLS (National Committee for Clinical Laboratory Standards). Esta institución ha desarrollado y publicado un método de referencia aprobado para las pruebas de microdilución en caldo de especies de Candida (documento M27-A2 del CLSI) para determinar la susceptibilidad a varios agentes antimicóticos5. Recientemente, este método se ha modificado en el documento M27-A3 del CLSI, el cual incorpora puntos de corte para el voriconazol, posaconazol y a las equinocandinas para la pruebas de susceptibilidad en levaduras de importancia clínica. Los puntos de corte interpretativos motivados por los datos, determinados con el uso de este método, están disponibles para pruebas de susceptibilidad de especies de Candida al fluconazol, al itraconazol, al voriconazol, a la flucitosina y a las equinocandinas6. En resumen, estas metodologías de referencia constituyen las pruebas de referencia para determinar la susceptibilidad in vitro en levaduras de importancia médica6,7.
Por todo lo anterior, es importante que se desarrollen trabajos locales en diferentes regiones que permitan evaluar la tendencia de la susceptibilidad in vitro de los aislamientos de Candida.
Objetivo
Determinar los niveles de susceptibilidad in vitro de aislamientos de Candida spp. aislados de la cavidad oral de pacientes infectados por el VIH/sida a tres antimicóticos de uso común, disponibles en nuestro laboratorio en el momento del estudio: itraconazol, ketoconazol y clotrimazol.
Materiales y métodos
Ciento cuarenta y cuatro aislamientos de Candida, procedentes de exudados micológicos de la cavidad bucal de 137 individuos de ambos sexos seropositivos al VIH, sin discriminar el estadio de la infección, atendidos en el período comprendido entre septiembre de 2007 a marzo de 2008 fueron estudiados en el Laboratorio Nacional de Referencia de Micología del Instituto Pedro Kourí, Cuba. Todos tenían diagnóstico clínico de candidiasis orofaríngea y ninguno había llevado tratamiento antifúngico previo. Estos aislamientos se encontraban conservados en agua destilada estéril a temperatura ambiente.
Antes de realizar las pruebas de identificación fenotípicas cada aislamiento fue subcultivado al menos dos veces en agar papa-dextrosa para asegurar su pureza y viabilidad. La identificación de los aislamientos fue llevada a cabo mediante el uso del sistema comercial de identificación de levadura API 20C (bioMérieux, Inc, Hazelwood, Mo.).
Antifúngicos: Se ensayaron tres antifúngicos: itraconazol, ketoconazol y clotrimazol, (SIGMA I 6657, SIGMA K 1003, y SIGMA C 2812, respectivamente) con una potencia del 100%.
Prueba de Susceptibilidad in vitro: Las CMI de los tres derivados azólicos fueron determinadas en placas de ELISA (Enzyme-Linked ImmunoSorbent Assay) de 96 pocillos siguiendo el método de microdilución en medio líquido del documento M27-A2 del CLSI y de la metodología propuesta por el EUCAST. Se dispensó el medio de cultivo RPMI 1640 a razón de 200 μL/pozo en la 1era columna y 100 μL/pozo de la 3era a la 12ma. Posteriormente se añadieron 100 μL/pozo de la solución del antifúngico diluido 1:100 en dimetilsulfóxido en el mismo medio de cultivo en las columnas 2 y 3. A partir de esta última, se realizaron diluciones seriadas al doble hasta la columna 11 descartándose 100 μL/pozos. De esta forma se obtuvo un gradiente de concentración desde la columna 2 a la 11 de 16 μg/mL hasta 0.03 μg/mL. Las placas así preparadas fueron debidamente rotuladas y almacenadas a – 70 °C hasta el momento de su utilización. Una vez inoculadas los aislamientos de Candida spp. las concentraciones finales probadas de los antifúngicos ensayados estuvieron comprendidas entre 0.01 y 8 μg/mL.
Se utilizaron las cepas Candida krusei ATCC 6258 y Candida parapsilosis ATCC 22019 como controles de la calidad.
Se determinó la CMI 50 como la concentración más baja del antifúngico que inhibió el 50% del crecimiento de la especie de Candida, respecto a su control de crecimiento.
Se asumieron los criterios de sensibilidad (<0.125 µg/mL) y resistencia (>1 µg/mL) aprobados por el CLSI para especies de Candida en medio RPMI 1640 para el itraconazol, quedando en la categoría sensible-dosis dependientes (S-DD) aquellos aislamientos cuyas CMI estuvieron en el intervalo de 0,125 a 0,5 µg/mL
La lectura de los resultados se realizó visualmente, llevándose a cabo con la ayuda de un visor de aumento (Gallenkamp, CNW-325).
Análisis Estadístico
Utilizando el programa estadístico EpiInfo versión 5.01, se establecieron los rangos de susceptibilidad de los valores obtenidos para las drogas utilizadas, así como fueron determinados los porcentajes acumulativos de CMI frente a las diferentes concentraciones de las drogas empleadas.
Resultados
En este estudio, la identificación de los aislamientos aislados a partir de los exudados realizados mostró un gran predominio de C. albicans (91,7%) con respecto a las restantes especies no albicans identificadas (8.3%).
C. albicans exhibió para los tres derivados azólicos, el rango más amplio respecto al del resto de las especies, destacando solo un aislamiento de C. famata obtenido, el cual demostró un alto grado de resistencia frente al ketoconazol. Los valores de CMI de los tres derivados azólicos de los aislamientos son reflejados en la Tabla No.1.
Todos los aislamientos de especies de Candida diferentes a C. albicans fueron sensibles al itraconazol. Sólo 3 aislamientos de C. albicans (2.3%) mostraron resistencia a este triazol y 5 aislamientos de esta especie (3.8%) quedaron clasificadas dentro de la categoría sensible-dosis dependiente. La CMI para los restantes azoles evaluados fue menor a 0,125 µg/mL en la gran mayoría de los aislamientos, como se muestra en la Tabla No.2.
Las proporciones de aislamientos para las cuales las CMI de ketoconazol y clotrimazol presentaron valores inferiores a 0.06 μg/mL fueron de un 96.9% y 97.7%, respectivamente, para las especies de Candida albicans estudiadas. En C. albicans solo se reportaron tres aislamientos con valores de CMI superiores a 1 μg/mL para el ketoconazol; entretanto para el clotrimazol solo hubo una cepa que mostró un valor de CMI superior a 1 μg/mL y otra que presentó un valor de 0.25 μg/mL.
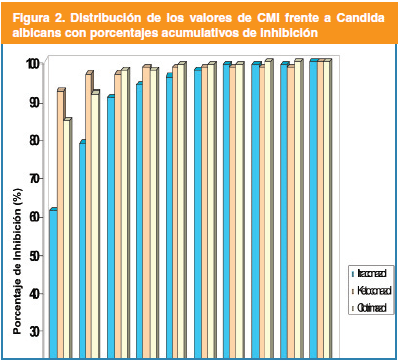
Discusión
La candidiasis orofaríngea causada por levaduras del género Candida, principalmente Candida albicans, es la infección oportunista más comúnmente diagnosticada en pacientes infectados por el VIH/sida8,9. Aunque esta infección no suele comprometer la vida, la inmunosupresión sostenida vista en estos pacientes facilita la recurrencia de la infección10.
C. albicans sigue siendo la especie de levadura más frecuentemente aislada a partir de cualquier proceso infeccioso en el hombre. Aún cuando en los últimos años se está experimentando un cambio epidemiológico en estas infecciones, de un amplio predominio de C. albicans a un porcentaje más elevado de especies diferentes a C. albicans, esta sigue siendo la especie más importante desde el punto de vista patogénico, clínico y epidemiológico11-13.
En este estudio obtuvimos un alto porcentaje de aislamientos de C. albicans, lo cual confirma su predominio en las infecciones orales de pacientes infectados por el VIH/sida. Este resultado es semejante a lo reportado por Kuriyama et al.14 en Inglaterra, en donde a partir de 618 aislamientos clínicos de Candida encontraron un 93.2% de la especie C. albicans. Igualmente, en estudios realizados en México por Sánchez-Vargas et al.15, por Badiee et al.16 en Irán, y Hamza et al.17 En Tanzania, demostraron un 83.5%, 50%, y 83,4% respectivamente, de aislamientos de Candida albicans procedentes de este tipo de pacientes. No obstante, otros trabajos notificados en la literatura internacional en estos últimos años explican el cambio epidemiológico que están experimentando las infecciones por el género Candida: de un amplio y casi absoluto predominio de Candida albicans a un mayor porcentaje de las especies no albicans. Ejemplo de ello lo demuestran los trabajos de Belazi et al.18 en Grecia; Pfaller et al.19 en Estados Unidos de Norteamérica; Skrodeniene et al.20 en Lituania, y Lee et al.21 en Sudcorea, todos los cuales aislaron e identificaron un porcentaje de especies no albicans, como C. krusei, C. tropicalis, C. glabrata y C. parapsilosis que variaron desde un 4% hasta un 22%.
Aún cuando no se cuentan con puntos de cortes en el documento del CLSI que clasifiquen en sensibles o resistentes in vitro a aislamientos de Candida frente al ketoconazol y el clotrimazol, antifúngicos que se evaluaron en este estudio, nos dimos a la tarea de determinar los valores de CMI frente a estos imidazoles que son de amplio uso en Cuba en el tratamiento de micosis superficiales, cutáneas y mucocutáneas23.
Hasta la fecha el clotrimazol ha sido utilizado como un agente de referencia para evaluar antimicóticos de nuevas generaciones. Se utiliza con gran frecuencia en la candidiasis oral y vulvovaginal como agente tópico, por su amplio espectro de acción en la candidiasis mucocutánea y por su disponibilidad debido al bajo costo de este imidazol24. Aunque son pocos los reportes en la literatura acerca de la susceptibilidad in vitro al clotrimazol en levaduras, algunos estudios como el de Pelletier et al.24 realizado en los Estados Unidos de Norteamérica con 87 niños infectados por el VIH que presentaban una candidiasis orofaríngea, obtuvieron como resultado que la resistencia in vitro al clotrimazol, considerándola por presentar una CMI superior a 1 µg/mL, estaba altamente asociado con una resistencia clínica a la terapia con derivados azólicos; y que la resistencia in vitro al clotrimazol se correlacionaba con una candidiasis refractaria a nivel de mucosa24. Otra investigación realizada por Hamza et al.17 en Tanzania en la cual evaluó más de 200 aislamientos de Candida frente al clotrimazol y otros derivados azólicos encontraron una alta sensibilidad frente a este imidazol, resultado semejante al reportado en este estudio.
En cuanto al ketoconazol, agente imidazólico de amplio espectro, obtuvimos un alto grado de sensibilidad in vitro en los aislamientos evaluados. Resultados similares han sido reportados por Dieng et al.25 en Senegal y Alexander et al.26 en los Estados Unidos, los cuales evidenciaron en la mayoría de aislamientos de Candida spp procedentes de pacientes infectados por el VIH/sida que presentaban lesiones orales, unas CMI inferiores a 0,125 µg/mL. De interés fue el hallazgo de una cepa de C. famata con una CMI de 8 µg/mL frente al ketoconazol. No obstante a ser una especie poco descrita en infecciones humanas causadas por levaduras, Migliorati et al.27 en los Estados Unidos, y Odio28 en Costa Rica han reportados aislamientos de C. famata con CMI elevadas frente a este imidazol en pacientes VIH/sida con cuadros clínicos de candidiasis orofaríngea y con infecciones fúngicas invasivas, respectivamente.
El itraconazol, derivado triazólico de amplio espectro de acción, tuvo una actividad similar a los restantes azoles. Del total de aislamientos estudiados, solo 3 (todas C. albicans) mostraron resistencia frente al itraconazol, para un 2,3% de resistencia. Resultados similares de resistencia frente a este triazol fueron obtenidos por Magaldi et al.29 en Venezuela, SantAna et al.2 en Brasil y Alexander et al.26 quienes reportaron porcentajes de resistencia inferiores al 4% en cada caso.
En este trabajo, 5 aislamientos (3.5%), de la especie C. albicans, quedaron clasificados dentro de la categoría susceptible dosis-dependiente (SDD), para el itraconazol. En esta categoría quedan incluidas todas los aislamientos cuya CMI presenta un valor intermedio entre los de sensibilidad y resistencia, para las cuales el empleo in vivo de altas dosis del antifúngico, pudiera favorecer una respuesta exitosa al tratamiento30.
Las actividades comparativas de los antifúngicos azólicos contra los aislamientos clínicos de C. albicans mostraron que el clotrimazol tuvo una actividad ligeramente superior que el ketoconazol y más efectiva comparada con el itraconazol al inhibir a más del 90% de los aislamientos a una concentración de 0,01 μg/mL. Estos resultados son similares a los obtenidos por Martínez-Suárez y Rodríguez Tudela, quienes en un estudio comparativo de cinco derivados azólicos (ketoconazol, itraconazol, fluconazol, miconazol y clotrimazol) encontraron que las CMIs más bajas correspondieron al ketoconazol, clotrimazol y miconazol31. En un trabajo más reciente desarrollado por Kuriyama et al.14 en Inglaterra, evaluaron 10 agentes antifúngicos, y de ellos el ketoconazol tuvo los valores de actividad in vitro más bajas frente a Candida albicans.
Los resultados obtenidos de la susceptibilidad in vitro de las especies de Candida estudiadas demuestran la alta eficacia de los derivados azólicos empleados como buenas opciones terapéuticas en la candidiasis orofaríngea, teniendo en cuenta que dichos estudios en levaduras constituyen una herramienta beneficiosa en predecir el éxito clínico, pero permanece solo como uno de varios factores que pueden impactar en la respuesta clínica32.
Las pruebas de susceptibilidad in vitro han demostrado tener gran utilidad en los estudios epidemiológicos, de vigilancia de los patrones de susceptibilidad en poblaciones de microorganismos a determinados antimicrobianos, como se evidencia en este estudio donde predominó un alto grado de sensibilidad a los azoles estudiados frente a las especies de Candida, así como, para el descubrimiento de nuevos fármacos y para predecir posibles fracasos terapéuticos en la práctica médica32. Por lo anterior, es de vital importancia continuar desarrollando trabajos de investigación que permitan optimizar, la correlación de los resultados in vitro con la respuesta in vivo para aquellos fármacos, en los que aún no se disponen de puntos de cortes estandarizados de sensibilidad y resistencia, y de esa forma contar con una vigilancia de la resistencia a los antimicóticos que se utilizan en la práctica clínica.
Conclusiones
C. albicans continúa siendo la principal especie dentro del género Candida aislada de procesos infecciosos en humanos. Es importante, por tanto, conocer los niveles de sensibilidad y resistencia frente a los azoles que más comúnmente se utilizan en nuestro medio.
En este estudio evidenciamos una baja sensibilidad in vitro de los aislamientos de Candida estudiados frente a los azoles evaluados.
Referencias
1. Thompson GR 3rd, Patel PK, Kirkpatrick WR, Westbrook SD, Berg D, Erlandsen J, Redding SW, Patterson TF. Oropharyngeal candidiasis in the era of antiretroviral therapy. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2010; 109:488-95. [ Links ]
2. Sant'Ana Pde L, Milan EP, Martinez R, Queiroz-Telles F, Ferreira MS, Alcântara AP, Carvalho MT, Colombo AL. Multicenter Brazilian study of oral Candida species isolated from AIDS patients. Mem Inst Oswaldo Cruz. 2002; 97:253-7. [ Links ]
3. Kuriyama T, Williams DW, Bagg J, Coulter WA, Ready D, Lewis MA. In vitro susceptibility of oral Candida to seven antifungal agents. Oral Microbiol Immunol. 2005; 20:349-53. [ Links ]
4. Gaitan-Cepeda LA, Ceballos Salobreña A, López Ortega K, Arzate Mora N, Jiménez Soriano Y. Oral lesions and immune reconstitution syndrome in HIV+/AIDS patients receiving highly active antiretroviral therapy. Epidemiological evidence. Med Oral Patol Oral Cir Bucal. 2008; 13:85-93. [ Links ]
5. Clinical and Laboratory Standards Institute (CLSI). Reference method for broth dilution antifungal susceptibility testing of yeasts: Approved standard, 3rd. ed. CLSI document M27-A3. Wayne, PA: CLSI, 2008. [ Links ]
6. Johnson E M. Issues in antifungal susceptibility testing. J Antimicrob Chemother 2008; 61 Suppl 1: i13-8. [ Links ]
7. Arikan S. Current status of antifungal susceptibility testing methods. Med Mycol 2007; 45: 569-87. [ Links ]
8. da Silva CA, Costa Dourado MI, Dahia SR, Harzheim E, Rutherford GW. Oral manifestations of HIV infection in patients receiving highly active antiretroviral therapy (HAART) in Bahia, Brazil. J Public Health Dent. 2008; 68:178-81. [ Links ]
9. Thompson GR 3rd, Patel PK, Kirkpatrick WR, Westbrook SD, Berg D, Erlandsen J, Redding SW, Patterson TF. Oropharyngeal candidiasis in the era of antiretroviral therapy. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2010; 109:488-95. [ Links ]
10. Thompson GR 3rd, Patel PK, Kirkpatrick WR, Westbrook SD, Berg D, Erlandsen J, Redding SW, Patterson TF. Oropharyngeal candidiasis in the era of antiretroviral therapy. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2010;109:488-95. [ Links ]
11. Tsang CS, Chu FC, Leung WK, Jin LJ, Samaranayake LP, Siu SC. Phospholipase, proteinase and haemolytic activities of Candida albicans isolated from oral cavities of patients with type 2 diabetes mellitus. J Med Microbiol. 2007; 56(10):1393-8. [ Links ]
12. Dongari-Bagtzoglou A, Dwivedi P, Ioannidou E, Shaqman M, Hull D, Burleson J. Oral Candida infection and colonization in solid organ transplant recipients. Oral Microbiol Immunol. 2009; 24:249-54. [ Links ]
13. Rosenbach A, Dignard D, Pierce JV, Whiteway M, Kumamoto CA. Adaptations of Candida albicans for growth in the mammalian intestinal tract. Eukaryot Cell. 2010; 9:1075-86. [ Links ]
14. Kuriyama T, Williams DW, Bagg J, Coulter WA, Ready D, Lewis MA. In vitro susceptibility of oral Candida to seven antifungal agents. Oral Microbiol Immunol. 2005; 20:349-53. [ Links ]
15. Sánchez-Vargas LO, Ortiz-López NG, Villar M, Moragues MD, Aguirre JA, Cashat-Cruz M, Lopez-Ribot JL, et al. Oral Candida isolates colonizing or infecting human immunodeficiency virus-infected and healthy persons in Mexico. J Clin Microbiol. 2005; 43: 4159–62. [ Links ]
16. Badiee P, Alborzi A, Davarpanah MA, Shakiba E. Distributions and antifungal susceptibility of Candida species from mucosal sites in HIV positive patients. Arch Iran Med. 2010; 13:282-7. [ Links ]
17. Hamza OJ, Matee MI, Moshi MJ, Simon EN, Mugusi F, Mikx FH, Helderman WH, Rijs AJ, van der Ven AJ, Verweij PE. Species distribution and in vitro antifungal susceptibility of oral yeast isolates from Tanzanian HIV-infected patients with primary and recurrent oropharyngeal candidiasis. BMC Microbiol. 2008; 12:135-38. [ Links ]
18. Belazi M, Velegraki A, Koussidou-Eremondi T, Andreadis D, Hini S, Arsenis G, Eliopoulou C, Destouni E, Antoniades D. Oral Candida isolates in patients undergoing radiotherapy for head and neck cancer: prevalence, azole susceptibility profiles and response to antifungal treatment. Oral Microbiol Immunol. 2004; 19: 347-51. [ Links ]
19. Pfaller MA, Boyken L, Hollis RJ, Messer SA, Tendolkar S, Diekema DJ. In vitro susceptibilities of Candida spp. to caspofungin: four years of global surveillance. J Clin Microbiol. 2006; 44:760-3. [ Links ]
20. Skrodeniene E, Dambrauskiene A, Vitkauskiene A. Susceptibility of yeasts to antifungal agents in Kaunas University of Medicine Hospital. Medicina (Kaunas). 2006; 42:294-9. [ Links ]
21. Lee JS, Shin JH, Lee K, Kim MN, Shin BM, Uh Y, Lee WG, Lee HS, Chang CL, Kim SH, Shin MG, Suh SP, Ryang DW. Species distribution and susceptibility to azole antifungals of Candida bloodstream isolates from eight university hospitals in Korea. Yonsei Med J. 2007; 48:779-86. [ Links ]
22. Cuenca-Estrella M, Rodriguez-Tudela JL. The current role of the reference procedures by CLSI and EUCAST in the detection of resistance to antifungal agents in vitro. Expert Rev Anti Infect Ther. 2010; 8:267-76. [ Links ]
23. Llovera-Suárez V, Fernández CM. Susceptibilidad in vitro de aislamientos vaginales de Candida frente a clotrimazol y nistatina. Rev Cubana Med Trop. 2003; 55:135-45. [ Links ]
24. Pelletier R, Peter J, Antin C, Gonzalez C, Wood L, Walsh TJ. Emergence of resistance of Candida albicans to clotrimazole in human immunodeficiency virus-infected children: in vitro and clinical correlations. J Clin Microbiol. 2000; 38:1563-8. [ Links ]
25. Dieng Y, Faye-Niang MA, Ndour-Diop A, Sow PS, Dieng T, Soumare M, et al. Antifungal drug susceptibility of Candida causing oropharyngeal candidiasis in HIV infected patients. Dakar Med. 2001; 46(1):4-7. [ Links ]
26. Alexander BD, Byrne TC, Kelly L., Smith T, Kimberly E., Hanson A, Kevin J., Anstrom JR., Perfect L, Reller B. Comparative Evaluation of Etest and Sensititre YeastOne panels against the Clinical and Laboratory Standards Institute M27-A2 reference broth microdilution method for testing Candida susceptibility to seven antifungal agents. J Clin Microbiol. 2007; 45: 698–706. [ Links ]
27. Migliorati CA, Birman EG, Cury AE. Oropharyngeal candidiasis in HIV-infected patients under treatment with protease inhibitors. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2004; 98(3):301-10. [ Links ]
28. Odio CM. Antifungal therapy for infants, children and adolescents with suspected or documented invasive fungal infection. Drugs Today (Barc). 2010; 46 Suppl C: 33-46. [ Links ]
29. Magaldi S, Mata S, Hartung C, Verde G, Deibis L, Roldán Y, Marcano C. In vitro susceptibility of 137 Candida sp. isolates from HIV positive patients to several antifungal drugs. Mycopathologia. 2001; 149:63-8. [ Links ]
30. Walmsley S, King S, McGeer A, Ye Yanna, Richardson S. Oropharyngeal candidiasis in patients with human immunodeficiency virus: Correlation of clinical outcome with in vitro resitance, serum azole levels and immunosuppression. CID. 2001;32:1554-61. [ Links ]
31. Martínez-Suárez JV, Rodríguez-Tudela JL. Patterns of in vitro activity of itraconazole and imidazole antifungal agents against Candida albicans with decreased susceptibility to fluconazole from Spain. Antimicrob Agents Chemother. 1995; 39:1512-16. [ Links ]
32. Rex JH, Pfaller MA., Walsh TJ, Chaturvedi V, Espinel-Ingroff A, Ghannoum MA, Gosey LL, Odds FC, Rinaldi MG, Sheehan DJ, Warnock DW. Antifungal susceptibility testing: practical aspects and current challenges. Clin Microbiol Rev. 2001; 14:643-58. [ Links ]















