Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT vol.31 no.4 Caracas dic. 2012
Efecto de Alendronato y Pamidronato administrado por vía subcutánea en la densidad mineral ósea en animales de experimentación
Effect of Alendronate and Pamidronate administered subcutaneously in bone mineral density in experimental animals
Autores: Virga Carolina, Aguzzi Alejandra, De Leonardi Adriana.
Lugar de trabajo: Cátedra de Farmacología y Terapéutica B, Departamento de Patología Bucal, Facultad de Odontología UNC.
Correspondencia: Prof. Dra. Carolina Virga. Haya de la Torre s/n Ciudad Universitaria Córdoba Argentina. (cp 5009) tel: 0351-155493860, fax: 54-351-4337438. cvirga@odo.unc.edu.ar
Resumen
Los bifosfonatos constituyen un grupo de fármacos capaces de modular el recambio óseo y disminuir su remodelado cuando existe una reabsorción excesiva. El objetivo de este estudio fue investigar por diagnóstico radiográfico, el efecto de formulaciones subcutáneas en base a Alendronato (AL) y Pamidronato (PA) a nivel óseo. Materiales y métodos: las fórmulas farmacéuticas fueron preparadas con una dosificación para AL de 0,5 mg/Kg de peso, y para PA de 0,6 mg/Kg. Se les adicionó buffer especiales, con un pH final de 5,5 en medios estériles. El control (C) fue solución fisiológica. El efecto de Al y PA se evaluó en ratas machos Wistar normales (n=64), con un peso de 160 ± 20 g, divididas en 4 grupos. La droga se inyectó en forma subcutánea en tiempos 0, 7, 15, 30, 60 y 90 días postquirúrgica. Se tomaron radiografías de las tibias, inmediatamente posterior a la cirugía y en cada uno de los tiempos experimentales. Las placas fueron reveladas en forma automática con aparato Kodac XP (1100) Las muestras fueron analizadas con el Software Image ProPlus versión 4,1 de Media Cibernetics. Este software mide densidad óptica obteniendo valores numéricos que son registros de las siguientes zonas: hueso medular, hueso cortical, zona problema y área circundante a la zona problema. La comparación de los datos fue realizada por análisis de la variancia. Resultados: los estudios radiográficos demostraron que AL desde el día 0 comienza a aumentar la densidad mineral ósea promedio (DMO), encontrándose el pico máximo a los 30 días con un valor de 157,9 DMO, comenzando a declinar hasta el día 60 donde los valores se estabilizan, llegando al día 90 con un valor de 156,1. PA se comporta igual al inicio del tratamiento pero tiene su pico máximo a los 45 días con un valor de 161,8, declinando en los días posteriores y estabilizándose a los 90 días con un valor de 156,2. El control permanece en el tiempo con valores estables a partir de los 15 días por debajo de 152,4. (P <0,001). Conclusión: Este estudio sugiere que la aplicación subcutánea de bisfosfonatos puede ser efectiva como un complemento en la terapia para la reducción de la resorción ósea después de las cirugías orales.
Palabras clave: Bisfosfonatos. Reabsorción ósea. Implantes dentales.
Abstract
Bisphosphonates are a class of drugs capable of modulating bone turnover and decrease their repairs when there is excessive reabsorbtion. The aim of this study was to investigate radiographic diagnostic of subcutaneous formulations based on Alendronate (AL) and Pamidronate (PA). Materials and methods: The pharmaceutical formulations were prepared with dosing for AL of 0.5 mg / kg weight, and BP of 0.6 mg / kg. They added special buffer with a pH of 5.5 in sterile media. The control (C) was saline. Results: Radiographic studies showed that AL from day 0 begins to increase mean bone mineral density (BMD), finding the peak at 30 days with a value of 157.9, beginning to decline until day 60 where the values stabilize, reaching at day 90 with a value of 156.1. PA behaves just the start of treatment but has its peak at 45 days with a value of 161.8, declining in the following days and stabilized after 90 days with a value of 156.2. The control remains in stable values over time from 15 days down from 152.4. (P <0.001). Conclusion: This study suggests that subcutaneous application of bisphosphonates may be effective as an add-on therapy to reduce bone reabsorbtion after oral surgery.
Keywords: Bisphosphonates. Bone reabsorbtion. Dental implant.
Recibido: 12/08/2012 Aceptado: 21/10/2012
Introducción
Los bifosfonatos son fármacos seguros y efectivos para el tratamiento de enfermedades con reabsorción ósea, incluyendo osteoporosis, enfermedad de Paget, e hipercalcemia relacionada con malignidad, basado en su capacidad de disminuir la tasa de recambio óseo a través de la inhibición de la diferenciación de osteoclastos y la disminución de su actividad y sobrevida. (1-4)
La acumulación ósea de bifosfonato luego de tratamientos prolongados produce una extrema inhibición de la tasa de remodelación lo que aumenta el riesgo de fractura o cambios en las propiedades materiales del hueso, con la misma consecuencia; retardo en la consolidación de fracturas y osteonecrosis de la mandíbula, lo que ha obligado a replantear cual es la duración prudente del tratamiento de la osteoporosis con estos fármacos. (5,6)
Estos fármacos actúan sobre el metabolismo y función de los osteoclastos; son liberados durante la resorción ósea e internalizados por los osteoclastos permitiendo la inhibición de la resorción ósea y favoreciendo la inducción de la apoptosis de los osteoclastos. Al no ocurrir reabsorción ósea y liberación de las proteínas inductoras de hueso como la proteína nitrogenada ILG1, ILG 0, el hueso viejo no se regenera y no forma nuevo tejido óseo. (7,8)
Alendronato. Este medicamento es de uso oral, se usa para tratar la enfermedad de Paget de los huesos, para prevenir o tratar la osteoporosis, para tratar la hipercalcemia. Se calcula que la vida media de ésta es de unos 10 años. Al ingerir una tableta, el paciente no se puede sentar o parar por un mínimo de 30 minutos, ya que puede causar problemas graves de estómago o esófago por lo que debe permanecer parado por lo menos 30 minutos después de tomar esta medicina. Se debe tomar alendronato exactamente como lo indique el médico tratante. No se debe usar este medicamento en cantidades mayores o por más tiempo de lo recomendado (9-11)
El Pamidronato pertenece a la clase de los amino-bisfosfonatos. Aunque no se conoce con exactitud su mecanismo de acción, se acepta que estos compuestos actúan principalmente por inhibición de la resorción ósea. Esta droga se adsorbe a la superficie mineralizada expuesta en las superficies de erosión del hueso, a las que cubre anclando su grupo geminal P-C-P en la hidroxiapatita orientando su grupo amino hacia los osteoclastos, las células responsables de la osteólisis. La presencia de pamidronato impide la adhesión de los osteoclastos a la superficie de erosión así como su activación y con ello disminuye la cantidad y la profundidad de las excavaciones en el tejido mineralizado (lagunas de Howship). En los esquemas de administración oral, inhibe la función resortiva del osteoclasto, sin afectar su vitalidad (acción no citotóxica), preservando la modulación fisiológica de la actividad de las células óseas. Se postula que la carencia de actividad citotóxica sobre el osteoclasto permite corregir los trastornos metabólicos del hueso sin perturbar la calidad del tejido mineralizado. (12-14) El objetivo de este estudio fue investigar por diagnóstico radiográfico, el efecto de formulaciones subcutáneas en base a Alendronato (AL) y Pamidronato (PA) a nivel óseo.
Materiales y Métodos
1- Preparación de las formulaciones: Se prepararon soluciones de AL y PA para ser aplicados por vía subcutánea. La fórmula farmacéutica con AL se hizo con una dosificación de 0.5 mg/Kg de peso corporal, y la de PA con una dosificación de 0,6 mg/Kg de peso corporal. Se les adicionó buffers especiales, con un pH final de 5,5 en medios estériles. El Control empleado(C) fue solución salina.
2- Animales de experimentación: Cuarenta y ocho ratas macho de la línea Wistar de peso 160 ± 20 g, fueron divididas en 3 grupos de 16 ratas cada uno. . Los animales de este grupo recibieron semanalmente 0,3 ml/100 g de peso corporal de solución salina por vía subcutánea cercana a la intervención quirúrgica y recibieron agua corriente de red como agua de bebida. Otro grupo (AL) se le administró semanalmente 0,5 mg de AL/Kg de peso corporal por vía subcutánea profunda en el miembro posterior izquierdo cercano a la zona quirúrgica. El tercer grupo recibió tratamiento con (PA) durante el tiempo el experimento y con las mismas condiciones quirúrgicas.
Los animales se mantuvieron en bioterio en jaulas colectivas con alimento balanceado y agua de bebida ad libitum, a una temperatura de 22-26 ºC, con un ciclo luz-oscuridad: 12hs-12hs durante el tiempo que duró el experimento. El manejo de los animales siguió los lineamientos del Nacional Institute of Health (NIH) para el uso y cuidado de animales de experimentación (Publication N. 85-23, Rev 1985). Los animales fueron anestesiados con una solución de ketamina/xilazina en relación 8 mg/1.28mg respectivamente por cada 100 g de peso corporal. Previa asepsia del campo quirúrgico con yodopovidona, se hizo con bisturí Bard Parker y hoja Nº 15, una incisión longitudinal en las tibias y se decoló la facsia hasta llegar a exponer el hueso. Con una fresa número 6 y rotación manual para no producir necrosis ósea, se realizó una cavidad en la parte plana de cada tibia hasta llegar al hueso medular. Dicha cavidad no fue rellenada con ningún material. Luego de realizadas las intervenciones quirúrgicas, se recolocaron los planos en posición y se suturó la herida con hilo reabsorbible.
Al finalizar los experimentos se procedió a la eutanasia de los animales mediante inyección intracardíaca de cloruro de potasio, bajo anestesia general.
3- Estudios radiográficos: Los tiempos experimentales fueron 7, 15, 30, 60, 90 días. Se tomaron radiografías de las tibias, inmediatamente posterior a la cirugía y en cada uno de los tiempos experimentales. Se utilizó aparato de Rx DSJ 70 KW de rendimiento, por técnica de cono corto, con tiempo de exposición de 0,4 décimas de segundo. Distancia foco-placa 5 cm con películas radiográficas Kodak de alta sensibilidad de tamaño3 x 4 cm. periapicales. Las placas fueron reveladas en forma automática con aparato Kodac XP (1100).
Las muestras fueron analizadas con el Software Image ProPlus versión 4,1 de Media Cibernetics, diseñado para trabajar con microscopios confocales Olympus. Este software mide densidad óptica (escala de grises) obteniendo valores numéricos que son registros de las siguientes zonas: hueso medular, hueso cortical, zona problema y área circundante a la zona problema.
4- Estudios estadísticos: La comparación de los datos fue realizada por análisis de la variancia a dos criterios de clasificación (tratamientos: C, AL, PA, y tiempos de tratamiento: 0, 7. 15, 30 60 y 90 días). Se estableció nivel de significación a p<0,05
Resultados
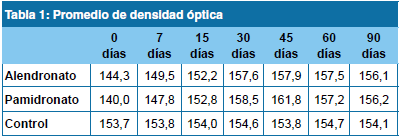
El análisis de las radiografías muestra para AL a los 0 días un DMO promedio de 144,3 llegando a los 90 días a un valor de 156,1. Para PA los valores fueron a los 0 días 140,0 y a los 90 días 156,2. El C registró un valor de 153,7 el primer día de tratamiento, llegando a los 90 días a un promedio de 154,1. (Tabla 1)
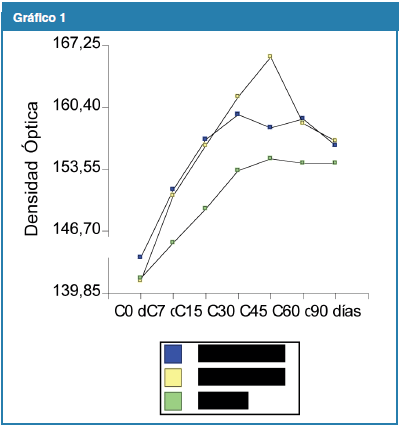
Al comparar los valores de DMO, AL desde el día 0 comienza a aumentar la DMO promedio encontrándose el pico máximo a los 30 días con un valor de 157,9 de DMO y empieza a declinar hasta el día 60 donde los valores se estabilizan, llegando al día 90 con un valor de 156,1.
PA se comporta igual que AL al inicio del tratamiento pero tiene su pico máximo a los 45 días con un valor de 169,6, declinando en los días posteriores y estabilizándose a los 90 días con un valor de 156,7. El C revela el comportamiento de fisiológico del hueso frente a un proceso inflamatorio provocado por injuria, con valores estables a partir de los 30 días. (Gráfico 1)
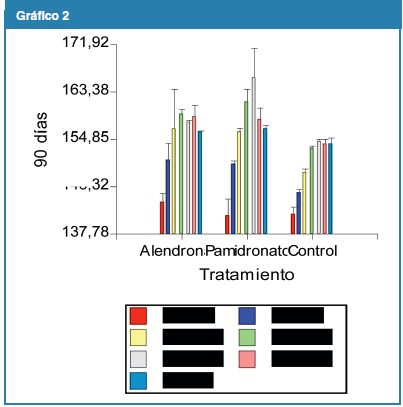
Al realizar las pruebas estadísticas se evidenció que no hubo diferencias significativas en ningún tiempo para los grupos experimentales. Al comparar AL con grupo C se encontraron diferencias significativas a los 30 días (p=0,004) y a los 45 días (p=0,004); mientras que al analizar PA con el grupo C se hallaron diferencias estadísticamente significativas a los a los 7 días (p=0,007), a los 15 días (p=0,005) y a los 30 días (p=0,03). (Gráfico 2)
Discusión
Nuestro modelo experimental en ratas macho tiende a reproducir el ambiente periimplantario, haciendo una cirugía en el hueso y evaluando sólo el efecto de las drogas en la neoformación ósea, elemento indispensable como soporte de futuros implantes dentales.
Muchos autores han informado las complicaciones de utilizar tanto AL como PA por las distintas vías de administración. Una de estas complicaciones es la osteonecrosis maxilar producida en los pacientes con patologías sistémicas como el cáncer, que reciben bisfosfonatos por vía intravenosa como el PA y zolendronato, y pacientes que reciben bisfosfonatos orales para el tratamiento de la osteoporosis (15-17).
Es por ello que nuestro estudio analizó la efectividad de estas drogas, por vía subcutánea en la zona de la cirugía, para evitar efectos colaterales indeseables. Para evidenciar los efectos colaterales por acción sistémica, estudiamos radiográficamente las patas contralaterales sin cirugía. Los datos revelaron, en todos los grupos experimentales, un comportamiento estable en el tiempo sin cambios en la DMO, lo que estaría indicando la ausencia de acción farmacológica por efecto sistémico.
Es sabido que el incremento en la DMO es sólo uno de los aspectos del fortalecimiento óseo. Otras variables influyen también, como por ejemplo la configuración trabecular del hueso, el tamaño, la forma, la arquitectura ósea y el índice de recambio óseo (18).
Nuestra investigación reveló que si bien PA fue más efectivo que AL, ambas drogas, en esta forma farmacéutica, promueven la neoformación ósea, con valores similares de promedio de DMO en los tiempos experimentales largos.
En contraste con nuestros resultados Yaffe A. y col han demostrado que AL después de 1, 2 y 3 semanas (durante la fase de formación de hueso), no aumentó la cantidad de hueso o de la densidad ósea visual en el tiempo, comparado con el control. Cuando AL se inyectó de 3, 4 y 5 semanas, la masa ósea aumentó en un 70% y 166%, respectivamente, en comparación con el control (19).
Por otro lado Ammann P. y col confirmaron que el tratamiento local con PA en una sola dosis administrado en forma subcutánea conduce a un aumento significativo en la DMO, el volumen y la fuerza de curación de fracturas en ratas. Si bien no es el mismo modelo experimental ya que usan ratas hembras ovacterizadas y una sola dosificación. Coincidimos en los resultados frente a PA, con la diferencia que nuestro plan estratégico de tratamiento incluye una dosis semanal (20).
En conclusión, este estudio sugiere que la aplicación subcutánea de bisfosfonatos puede ser efectiva como un complemento en la terapia para la reducción de la resorción ósea después de las cirugías orales.
Referencias
1. Licata AA. Discovery, clinical development and therapeutic uses of Bisphosphonates. Ann Pharmacother. 2005; 39:668-77. [ Links ]
2. Russell RG. Bisphosphonates: The first 40years. 2011 May 1. [ Links ]
3. Leu C-T, Luegmayr Eva, Freedman LP, et al. (2006) Relative binding affinities of bisphosphonates for human bone and relationship to antiresorptive afficacy. Bone 38: 628-636. [ Links ]
4. Van Beek ER, Cohen LH, Leroy IM, et al. (2003) Differenciating the mechanisms of antiresorptive action of nitrogen containing bisphosphonates. Bone 33: 805-11. [ Links ]
5. Merigo E, Manfredi M, Meleti M, et al. (2006) Bone necrosis of the jaws associated with bisphosphonate treatment: a report of twenty-nine cases. Acta Biomed 77:109-17. [ Links ]
6. Batch JA, Couper JJ, Rodda C, et al. (2003) Use of bisphosphonate therapy for osteoporosis in childhood and adolescence. J Paediatr Child Health 39: 88-92. [ Links ]
7. Migliorati CA, Schubert MM, Peterson DE, et al. (2005) Bisphosphonate-associated osteonecrosis of mandibular and maxillary bone. Cancer 104:83-93. [ Links ]
8. Chiandussi S, Biasotto M, Dore F, et al. (2006) Clinical and diagnostic imaging of bisphosphonate-associated osteonecrosis of the jaws. Dentomaxillofac Radiol 35:236-43. [ Links ]
9. Ascott-Evans BH, Guanabens N, Kivinen S, et al. (2003) Alendronate prevents loss of bone density associated with discontinuation of hormone replacement therapy: a randomized controlled trial. Archives of Internal Medicine 163:789-94. [ Links ]
10. Bagger YZ, Tanko LB, Alexandersen P, et al. (2003) Alendronate has a residual effect on bone mass in postmenopausal danish women up to 7 years after treatment withdrawal. Bone 33:301-7. [ Links ]
11. Bergstrom JD, Bostedor RG, Masarachia PJ, et al. (2000) Alendronate is a specific, nanomolar inhibitor of farnesyl diphosphate synthase. Arch Biochem Biophys 373:231-41. [ Links ]
12. Zacharin M, Bateman J. (2002) Pamidronate treatment of osteogenesis imperfecta: lack of correlation between clinical severity, age at onset of treatment, predicted collagen mutation and treatment response. J Pediatr Endocrinol Metab 15:163-74. [ Links ]
13. Maksymowych WP, Lambert R, Jhangri GS, et al. (2001) Clinical and radiological melioration of refractory peripheral spondyloarthritis by pulse intravenous pamidronate therapy. J Rheumatol 28:144-55. [ Links ]
14. Krieg MA, Seydoux C, Sandini L, et al. (2001) Intravenous pamidronate as treatment for osteoporosis after heart transplantation: a prospective study. Osteoporos Int 12:112-6. [ Links ]
15. Marx RE. (2003) Pamidronate (Aredia) and Zoledronate (Zometa) induced avascular necrosis of the jaws: A growing epidemic. J Oral Maxillofac Surg 61:1115-7. [ Links ]
16. Ruggiero SL, Mehrotra B, Rosenberg TJ, et al. (2004) Osteonecrosis of the jaws associated with the use of bisphosphonates: a review of 63 cases. J Oral Maxillofac Surg 62:527-34. [ Links ]
17. Bagan JV, Murillo J, Jiménez Y, et al. (2005) Avascular jaw osteonecrosis in association with cancer chemotherapy: series of 10 cases. J Oral Pathol Med 34:120-3. [ Links ]
18. Altundal H, Guvener O. (2004) The effect of alendronate on resorption of the alveolar bone following tooth extraction. Int J Oral Maxillofac Surg 33:286-93. [ Links ]
19. Yaffe A; Kollerman R; Bahar H; et al. (2003) The influence of alendronate on bone formation and resorption in a rat ectopic bone development model. J Periodontol 74(1): 44-50. [ Links ]
20. Cruz Júnior AF, Buchpiguel C, Guarniero R, Barbieri A. (2011) Pamidronate and zoledronate effects in the increment of bone mineral density and histomorphometry in rats. Acta Cirúrgica brasileira 26(2):114-20. [ Links ]