Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT vol.31 no.4 Caracas dic. 2012
Efecto de la restricción física sobre el papel de los receptores 5-HT1A en la proliferación linfocitaria
Matilde Medina Martel1, Fili Fazzino2; Lucimey Lima3
1. Cátedra de Bioquímica C. Escuela de Bioanálisis. Universidad Central de Venezuela. PhD en Bioquímica. Tesis realizada en el laboratorio de Neuroquímica del Instituto Venezolano de Investigaciones Científicas.
2. Laboratorio de Neuroquímica. Instituto Venezolano de Investigaciones Científicas. MSc en Microbiología.
3. Laboratorio de Neuroquímica. Instituto Venezolano de Investigaciones Científicas. MD, PhD en Bioquímica.
Correspondencia: Dra. Lucimey Lima, correo: lucimeylima@gmail.com
Resumen
El estrés afecta el sistema inmunológico, sin embargo, no hay reportes sobre receptores de serotonina en linfocitos. Se estudiaron los receptores 5-HT1A y la proliferación linfocitaria de ratas macho adultas luego de restricción física. Fueron colocadas en cajas de Plexiglass durante 5 horas diarias por 1, 3 ó 5 días. Se extrajo sangre cardíaca, se aislaron los linfocitos por gradiente de densidades y adhesión al plástico; se cultivaron con el agonista 8-hidroxi-di-n-propil-aminotetralina (8-OH-DPAT) ó el antagonista N-(2-(4-(2-metoxifenil)-1-piperazinetil)-N-(2-piridinil) ciclohexanocarboxamida (WAY-100635) de los receptores 5-HT1A y del mitógeno concanavalina A. La proliferación se midió con sales de tetrazolio. La 8-OH-DPAT no afectó la proliferación. El WAY-100635 disminuyó la proliferación. La restricción física aumentó la sensibilidad al efecto del WAY-100635, lo cual podría deberse a cambios en la expresión o a una modulación funcional de los receptores por efecto del estrés, como se ha reportado previamente en cerebro de rata.
Palabras clave: estrés, linfocitos, receptores 5-HT1A
Abstract
Stress affects the immune system, however, little is known about the effects on specific modifications of lymphocytes serotonin receptors. The effects of restraint stress on the role of 5-HT1A receptors in lymphocyte proliferation were evaluated in male adult rats. They were placed in Plexiglass boxes, during 5 daily hours for 1, 3 or 5 consecutive days. Next day a blood sample was obtained by cardiac punction. Lymphocytes were isolated by density gradient and adhesion to plastic. They were cultured with agonist 8-hydroxy-di-n-propyl-aminotetralin (8-OH-DPAT) or antagonist N-(2-(4-(2-methoxyphenyl)-1-piperazinyl) ethyl)-N-(2-pyridiyl) cyclohexanecarboxamide (WAY-100635) of 5-HT1A receptors and the mitogen concanavalin A. Proliferation was measured by tetrazolium salts. 8-OH-DPAT did not modify cell proliferation; WAY-100635 diminished it. Restraint stress increased the susceptibility to effect of WAY-100635. These results suggest changes in the expression or functional modulation of 5-HT1A receptors in lymphocytes by stress, similar to previous reports on serotonergic system in rat brain.
Key words: stress, 5-HT1A receptors, lymphocytes.
Recibido: 21/06/2012 Aceptado: 24/08/2012
Introducción
La serotonina (5-HT) ejerce efectos biológicos a través de la unión a siete tipos de receptores específicos, 5-HT1 a 5-HT7, los cuales han sido clasificados, a su vez, en varios subtipos según sus características moleculares y farmacológicas (Hoyer y col., 2002; Hannon y Hoyer, 2008). Los receptores 5-HT1A participan en la regulación de procesos fisiológicos como: alimentación (Kow y col., 1992), actividad gastrointestinal (Pan y Galligan, 1995), emotividad (Julius, 1998), nocicepción (Erb y col., 1997), funciones inmunes (Aune y col., 1994) y neuroendocrinas (Hoyer y col., 2002) y están involucrados en la fisiopatogenia de desórdenes afectivos como ansiedad y la depresión mayor (Fajardo y col., 2003). Se expresan a nivel del sistema nervioso central (Radja y col., 1992; Hoyer y col., 2002) y en varios tejidos a nivel periférico, como bazo, riñón neonatal, intestino (Kobilka y col., 1987) y células del sistema inmune(Aune y col., 1993). Los receptores 5-HT1A han sido caracterizados en linfocitos T humanos (Aune y col., 1993) y de rata (Sempere y col., 2003) y participan en la regulación de la proliferación en respuesta a mitógenos (Sempere y col., 2004; González y col., 2007).
Los glucocorticoides y el estrés pueden producir cambios en la expresión (Chalmers y col., 1993; Kieran y col., 2010) y en la función (Matsuzaki y col., 2009) de los receptores 5-HT1A a nivel central y podrían tener repercusiones similares a nivel linfocitario, lo que resultaría un enlace entre estrés, receptores 5-HT1A y alteraciones funcionales de los linfocitos T. Los efectos del estrés sobre el sistema inmunitario dependen, entre otras cosas, del tiempo de exposición al agente estresante (Bowers y col., 2008), pero el impacto del mismo sobre estos receptores a nivel linfocitario, ha sido poco estudiado. Por todo lo antes mencionado, este trabajo tiene como principal objetivo estudiar el efecto de tres protocolos de estrés por restricción física, con diferencias en la duración, sobre el papel de los receptores 5-HT1A en la proliferación linfocitaria basal y en respuesta al mitógeno concanavalina A (Con A).
Materiales y métodos
Animales. Se emplearon ratas Sprague-Dawley, macho, adultas, de 250 ± 30 gramos de peso, expuestas a ciclos de luz-oscuridad de 12 horas, a temperatura controlada y con libre acceso a agua y alimentos.
Restricción física. Las ratas fueron introducidas en celdas de Plexiglass bien ventiladas especialmente diseñadas para tal fin y elaboradas en el Instituto Venezolano de Investigaciones Científicas de acuerdo con pautas establecidas (Kvetnansky y col., 1992; Sempere y col., 2003), durante 5 horas diarias por 1, 3 ó 5 días consecutivos. Los animales no fueron sometidos a compresión, ni a dolor. Las ratas del grupo control permanecieron en jaulas individuales con una mínima intervención, únicamente durante el aseo de las jaulas, realizado en forma interdiaria. El protocolo fue aprobado por el Comité de Etica del IVIC.
Obtención de las muestras.Al día siguiente a la última sesión de estrés, entre 8:00 y 9:00 a.m., las ratas fueron anestesiadas con dietil-éter y se les extrajo sangre por punción cardíaca, la cual fue mezclada con heparina sódica, 1000 UI/ml, a una proporción de 200 µl (200 UI)por cada 10 ml de sangre, y empleada posteriormente para la obtención de linfocitos.
Linfocitos. Se aislaron por gradiente de densidades (Boyum, 1968) mediante el uso de Histopaque 1.077 g/L (Sigma) y adhesión diferencial al plástico durante 1 hora a 37°C en medio Roswell Park Memorial Institute (RPMI) 1640 Sigma suplementado con suero fetal bovino al 10% y gentamicina 100 mg% (Sempere y col., 2004).
Ensayos de cultivo. Se emplearon placas de cultivo de 96 pozos de fondo cóncavo, a razón de 2x105 células viables/pozo y se evaluó el efecto del agonista de los receptores serotonérgicos 5-HT1A, la 8-hidroxi-di-n-propil-aminotetralina (8-OH-DPAT) y del antagonista (N-(2-(4-(2-metoxifenil)-1-piperazinetil)-N-(2-piridinil) ciclohexanocarboxamida trihidrocloruro (WAY-100635) a diferentes concentraciones, en ausencia o en presencia de Con A, un mitógeno de linfocitos T, a una concentración sub-óptima de 2 μg/ml (Sempere y col., 2004). El grado de proliferación se midió a las 72 horas mediante el empleo de sales de tetrazolio (MTT) y la medición de la densidad óptica a 540 nm (Mossmann, 1983) en un lector de microplacas Tekan Genios.
Análisis estadístico. Se empleó el programa Excel de Microsoft para el cálculo de promedios, desviación estándar, error estándar y aplicación de la prueba t de Student. El programa InStat, versión 3, se empleó para realizar los análisis de varianza (ANOVA). Los resultados se expresaron como la media ± el error estándar de la media y se consideró estadísticamente significativo un valor de p<0,05 (Sokal y Rohlf, 1979).
Resultados
Efecto de la Concanavalina A.
La Con A produjo un incremento significativo de la proliferación basal tanto en controles como en animales sometidos a 1, 3 ó 5 días de restricción física (datos no mostrados).
Restricción física por un día
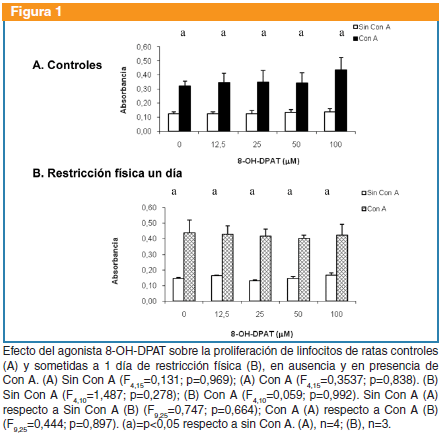
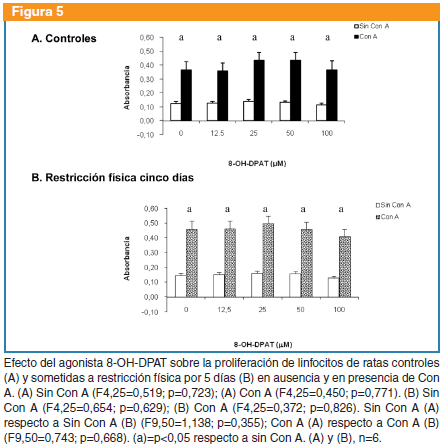
8-OH-DPAT: no produjo cambios en la proliferación linfocitaria basal (F4,15=0,131; p=0,969) o en presencia de Con A (F4,15=0,354, p=0,837) de ratas controles, ni en la proliferación basal (F4,10=1,487; p=0,278) o en presencia de Con A (F4,10=0,059; p=0,992) de las ratas sometidas a restricción. No se observaron diferencias entre controles y sometidos a restricción respecto a la proliferación basal (F9,25=0,747; p=0,664) o en presencia de Con A (F9,25=0,444; p=0,897) (Figura 1).
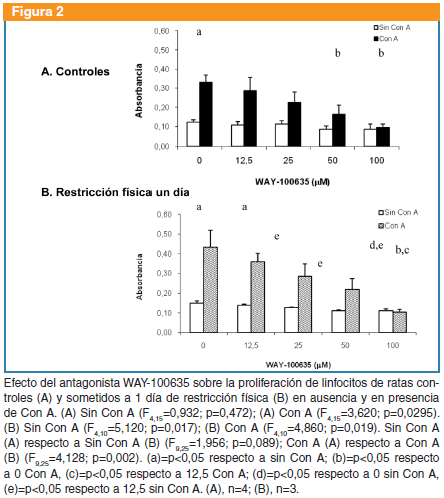
WAY-100365: no produjo cambios en la proliferación basal de ratas controles (F4,15=0,932; p=0,472), pero sí en presencia de Con A (F4,15=3,620, p=0,029). Este antagonista produjo cambios significativos en la proliferación basal (F4,10=5,120; p=0,017) y en presencia de Con A (F4,10=4,860; p=0,019) en el grupo sometido a restricción. La proliferación basal no fue diferente entre controles y sometidos a restricción (F9,25=1,956; p=0,089). La proliferación en presencia de Con A fue diferente entre controles y sometidos a restricción (F9,25=4,128; p=0,002) (Figura 2).
Restricción física por tres días
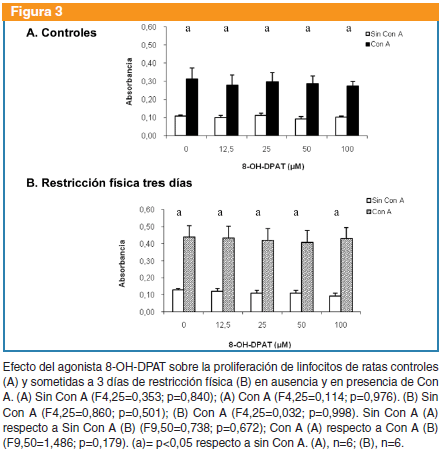
8-OH-DPAT: no produjo cambios en la proliferación linfocitaria de ratas controles en ausencia (F4,25=0,353; p=0,840) o en presencia de Con A (F4,25=0,114, p=0,976), ni de ratas sometidas a restricción en ausencia (F4,25=0,860; p=0,501) o en presencia de Con A (F4,25=0,032; p=0,998). No se observaron diferencias entre controles y sometidos a restricción con respecto a la proliferación basal (F9,50=0,738; p=0,672) o en presencia de Con A (F9,50=1,486; p=0,179) (Figura 3).
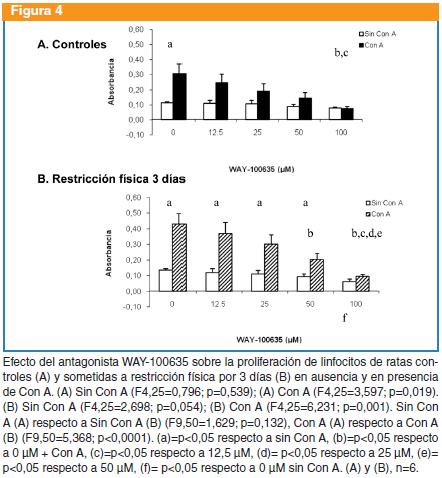
WAY-100365: no produjo cambios en la proliferación basal de ratas controles (F4,25=0,796; p=0,539), pero si en presencia de Con A (F4,25=3,597, p=0,019). En el grupo sometido a restricción, el WAY-100635 no produjo cambios significativos en la proliferación basal (F4,25=2,698; p=0,054), pero sí en presencia de Con A (F4,25=6,231; p=0,001). No hubo diferencias entre controles y sometidos a restricción con respecto a la proliferación basal (F9,50=1,629; p=0,132), pero sí en presencia de Con A (F9,50=5,368; p<0,0001) (Figura 4).
Restricción física por cinco días
8-OH-DPAT: no produjo cambios en la proliferación basal (F4,25=0,519; p=0,723) o en presencia de Con A (F4,25=0,450, p=0,771) de ratas controles; ni en la proliferación basal (F4,25=0,654; p=0,629) o en presencia de Con A (F4,25=0,372; p=0,826) del grupo sometido a restricción. No se observaron diferencias entre controles y sometidos a restricción con respecto a la proliferación basal (F9,50=1,138; p=0,355) o en presencia de Con A (F9,50=0,743; p=0,668) (Figura 5).
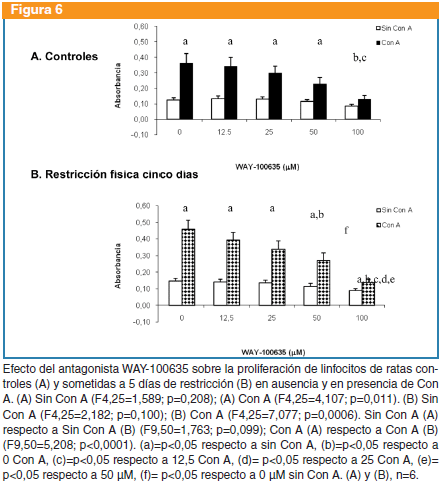
WAY-100365: en ratas controles, el WAY-100635 no produjo cambios en la proliferación basal (F4,25=1,589; p=0,208), pero sí en presencia de Con A (F4,25=4,107, p=0,011). En el grupo sometido a restricción, este antagonista no produjo cambios significativos en la proliferación basal (F4,25=2,182; p=0,100), pero si en presencia de Con A (F4,25=7,077; p=0,0006). No hubo diferencias entre controles y sometidos a restricción con respecto a la proliferación basal (F9,50=1,763; p=0,099) pero sí en presencia de Con A (F9,50=5,208; p<0,0001) (Figura 6).
Discusión
El agonista de los receptores 5-HT1A, la 8-OH-DPAT, no produjo incrementos significativos en la proliferación linfocitaria basal o en respuesta a la Con A, tanto en controles como en ratas sometidas a restricción física por 1, 3 ó 5 días. Estos resultados coinciden con trabajos previos (Sempere y col., 2004) realizados en ratas no estresadas, en los cuales se observó que la 8-OH-DPAT, en un amplio rango de concentraciones, no modificó la proliferación de linfocitos de rata, ni en condiciones basales, ni en presencia del mitógeno. Se ha reportado que la 8-OH-DPAT disminuye el efecto inhibitorio que ejercen antagonistas de los receptores 5-HT1A como metitepina (Aune y col., 1994) ode agonistasβ-adrenérgicos como isoproterenol (Sempere y col., 2004) sobre la proliferación de linfocitos T cultivados en presencia de mitógenos. El restablecimiento de la proliferación linfocitaria en presencia de la 8-OH-DPAT podría producirse a través de la modulación de los niveles intracelulares de AMPc (Mizrahi y col., 2004), ya que el incremento del AMPc intracelular disminuye la proliferación y su disminución la aumenta (Naderi y col., 2005), por lo cual la estimulación de los receptores 5-HT1A favorecería la proliferación a través de la disminución de los niveles intracelulares de AMPc (Sempere y col., 2004, Lima y col., 2007).La 8-OH-DPAT tiene una alta afinidad por los receptores 5-HT1A, pero puede unirse con menor afinidad a los receptores 5-HT7 (Faure y col, 2006; Filip y Bader, 2009), por lo cual no podría descartarse que la ausencia de efecto observada en presencia de este agonista sobre la proliferación se deba parcialmente a la activación de los receptores 5-HT7,los cuales han sido identificados en linfocitos (Arroyo, 2009; León Ponte y col., 2009) y podrían aumentar el contenido intracelular de AMPc al ser estimulados en estas células (Hoyer y col., 2002). También podría considerarse un efecto máximo de los receptores 5-HT1A que no permita modificaciones ocasionadas por el agonista.
El WAY-100635, un antagonista silencioso y altamente selectivo de los receptores 5-HT1A, produjo disminución de la proliferación linfocitaria, tanto en ausencia como en presencia de Con A. Estudios previos han demostrado este efecto inhibidor del WAY-100635 sobre la proliferación de linfocitos T de ratas no estresadas (Sempere y col., 2004) y de humanos (González y col., 2007) en cultivo, pero no se había evaluado el impacto del estrés sobre el efecto inhibitorio del WAY-100635 en la proliferación linfocitaria. Aune y col. (1994) demostraron que los antagonistas de los receptores 5-HT1A, metitepina, NAN-190 y pindobind,producían disminución de la proliferación de linfocitos T humanos, lo cual estuvo asociado al aumento en los niveles de AMPc intracelulares.En presencia de Con A, los linfocitos mostraron una mayor sensibilidad al efecto inhibitorio del antagonista WAY-100635, tanto en controles como en estresados. Esto podría deberse al aumento del número de sitios 5-HT1A reportado en estas células después del tratamiento in vivo con Con A (Aune y col., 1993; Sempere y col., 2003), así como del ARNm y la proteína de estos receptores (Abdouh y col, 2001). La restricción física moduló el efecto inhibidor de este antagonista sobre la proliferación celular, ya que los estresados fueron más sensibles a la droga, posiblemente debido al incremento en su expresión,a alteraciones funcionales que afectaran el acoplamiento de estos receptores a proteínas G o a cambios en la expresión de proteínas asociadas a vías de señalización intracelular, lo que incluye a las proteínas G, como se ha demostrado en el rafe dorsal de rata (Fairchild y col., 2003) y en otros tipos de receptores acoplados a proteínas G (Javan y col., 2006), esto en respuesta a tratamiento con glucocorticoides y ala exposición a estrés, respectivamente.
Con respecto al tiempo de estrés, luego de 1 día de restricción se observó una mayor susceptibilidad de los linfocitos al efecto inhibitorio del WAY-100635 en ausencia de Con A, lo cual difiere de lo observado a 3 y 5 días de restricción. Sin embargo, en presencia del mitógeno, la suceptibilidad al WAY-100635 fue similar entre los tres protocolos. Esta diferencia podría deberse al desarrollo de mecanismos adaptativoscelulares al estrés sostenido por 3 y 5 días. Estos mecanismos podrían incluir cambios en la modulación de receptores de 5-HT y de mediadores de estrés como glucocorticoides, neuropéptidos y catecolaminas.Otros investigadores han reportado que el tiempo es crítico en cuanto a los efectos del estrés sobre la respuesta proliferativa linfocitaria (Bauer y col., 2001; Silberman y col., 2004; Satoh y col, 2006; Frick y col., 2009), pero esto es difícil de determinar porque depende de diversos factores inherentes al modelo en estudio (especie, sexo, edad, tejido, entre otros). Sin embargo, varios aspectos son comunes entre los diferentes sistemas estudiados.
Estos resultados nos indican que el estrés no sólo es un modulador de los receptores 5-HT1A a nivel cerebral (Kieran y col, 2010; Morrison y col, 2011; Jovanovic y col., 2011),tejido en el que se ha asociado a alteraciones en varios parámetros del sistema serotonérgico central que están involucradas en trastornos depresivos o de ansiedad (Savitz y col., 2009; Fajardo y col. 2003), sino que también sucede a nivel linfocitario.Esta relación estrés-receptores serotonérgicos-linfocitos, aunque ha sido poco estudiada, podría ser clave en la fisiopatogenia de las alteraciones inmunitarias reportadas en individuos estresados (Cohen y col., 2007; Miller y col., 2009) y en deprimidos (Weinstein y col., 2010).
Conclusiones
Aunque el agonista 8-OH-DPAT no aumentó la proliferación linfocitaria en presencia de una concentración sub-óptima de Con A, no puede descartarse que este efecto se deba, al menos parcialmente, a la activación de otros receptores serotonérgicos como los receptores 5-HT7 o a un estado ya activado de estos receptores. No obstante, el efecto inhibitorio producido por un antagonista altamente específico y silencioso como el WAY-100635, indica que los receptores 5-HT1A son susceptibles de bloqueo y desempeñan un papel importante en la proliferación linfocitaria. En cuanto al tiempo de estrés, la diferencia principal entre los tres protocolos se observó en ausencia del mitógeno y podría reflejar cambios adaptativos en la expresión y función de receptores celulares luego de estrés prolongado cuando se añade una estimulación como la ocasionada por la Con A. La mayor sensibilidad al antagonista WAY-100635 en presencia de Con A por parte de los linfocitos provenientes de animales sometidos a 1, 3 y 5 días de restricción respecto a sus controles, sugiere que la restricción física podría modular la actividad de los receptores 5-HT1A a través de cambios en la expresión de los mismos, de las proteínas Gi/o u otras proteínas involucradas en las vías de señalización, sobre todo en condiciones de activación celular. Estos resultados sustentan la importancia de profundizar en el estudio de los efectos moduladores del estrés sobre la función del sistema serotonérgico linfocitario para conocer su participación en la fisiopatogenia de desórdenes inmunitarios o psiquiátricos que se producen como consecuencia de situaciones de estrés prolongado.
Agradecimientos. FONACIT, Proyecto G-1387. CDCH de la Universidad Central de Venezuela por el financiamiento de la Beca Sueldo Nacional de la Prof. Matilde Medina M.
Referencias
1. Abdouh, M., Storring, J. M., Riad, M., Paquette, Y., Albert, P. R., Drobetsky, E., Kouassi, E. (2001). Transcriptional mechanisms for induction of 5-HT1A receptor mRNA and protein in activated B and T lymphocytes. J. Biol. Chem., 276: 4382-4388. [ Links ]
2. Arroyo, R. D. (2009). Expresión de los receptores 5-HT7 en linfocitos de ratas sometidas a estrés. Trabajo especial de grado para optar al título de Magister Scientiarum. Instituto Venezolano de Investigaciones Científicas. [ Links ]
3. Aune, T. M., Golden, H. W., McGrath, K. M. (1994). Inhibitors of serotonin synthesis and antagonists of serotonin 1A receptors inhibit T lymphocyte function in Vitro and cell-mediated immunity in vivo. J. Immunol., 153: 489-498. [ Links ]
4. Aune, T. M., McGrath, K. M., Sarr, T., Bombara, M.P., Kelley, K. (1993). Expression of 5-HT1a receptors on activated human T cells. The Journal of Immunology, 151: 1175-1183. [ Links ]
5. Bauer, M. E., Perks, P., Lightman, S. L., Shanks, N. (2001). Restraint stress is associated with changes in glucocorticoid immunoregulation. Physiol. Behav., 73: 525-532. [ Links ]
6. Bøyum, A. (1968). Isolation of mononuclear cells and granulocytes from human blood. J. clin. Invest., 21: 77-79. [ Links ]
7. Bowers, S.L., Bilbo, S. D., Dhabbar, F. S., Nelson, R.J. (2008). Stressor-specific alterations in corticosterone and immune responses in mice. Brain, Behav and Immun., 22: 105-113. [ Links ]
8. Chalmers, D.T., Kwak, S.P., Mansour, A., Akil, H., Watson, S.J. (1993). Corticosteroids regulate brain hippocampal 5-HT1A receptor mRNA expression. J. Neurosc., 13: 914-923. [ Links ]
9. Cohen, F., Kemeny, M. E., Zegans, L. S., Johnson, P., Kearney, K. A., Sittes, D. P. (2007). Immune function declines with unemployment and recovers after stressor termination. Psychosom. Med. 69: 225-234. [ Links ]
10. Erb, C., Klein, J., Köppen, A., Löffelholz, K., Jeltsch, H., Cassel, J. C. (1997). Modulation of hippocampal acetylcholine release after fimbria-fornix lesions and septal transplantation in rats. Neurosc. Lett., 231: 5-8. [ Links ]
11. Fairchild, G., Leitch, M. M., Ingram, C. D. (2003). Acute and chronic effects of corticosterone on 5-HT1A receptor-mediated autoinhibition in the rat dorsal raphe nucleus. Neuropharmacology, 45: 925-934. [ Links ]
12. Fajardo, O., Galeno, J., Urbina, M., Carreira, I., Lima, L. (2003). Serotonin, serotonin 5-HT1A receptors and dopamine in blood peripheral lymphocytes of major depression patients. IntImmunopharmacol., 3: 1345-1352. [ Links ]
13. Faure, C., Mnie-Filali, O., Scarna, H., Debonnel, G., Haddjeri, N. (2006). Effects of the 5-HT7receptorantagonistSB-269970 on rat hormonal and temperatureresponses to the 5-HT1A/7receptoragonist8-OH-DPAT. Neurosc. Lett., 404: 122-126. [ Links ]
14. Filip, M., Bader, M. (2009). Overview on 5-HTreceptors and theirrole in physiology and pathology of the central nervous system. Pharmacol. Rep., 61: 761-777. [ Links ]
15. Frick, L. R., Arcos, M. L., Rapanelli, M., Zappia, M. P., Brocco, M., Mongini, C., Genaro, A. M., Cremaschi, G. A. (2009). Chronicrestraint stress impairs T-cellimmunity and promotestumor progression in mice. Stress, 12: 134-143. [ Links ]
16. González, A., Fazzino, F., Castillo, M., Mata, S., Lima, L. (2007). Serotonin, 5-HT1A serotonin receptors and proliferation of lymphocytes in major depression patients. Neuroimmunomodulation, 14: 8-15. [ Links ]
17. Hannon, J., Hoyer, D. (2008). Molecular biology of 5-HT receptors. Behav. Brain Res., 195: 198-213. [ Links ]
18. Hoyer, D., Hannon, J.P., Graeme, M. (2002). Molecular, pharmacological and functional diversity of 5-HT receptors.Pharmacol. Biochem. Behav., 71: 533-554. [ Links ]
19. Javan, M., Kazemi, B., Ahmadiani, A., Motamedi, F. (2006). Dexamethasone mimics the inhibitory effect of chronic pain on the development of tolerance to morphine analgesia and compensates for morphine induced changes in G proteins gene expression. Brain Res., 1104: 73-79. [ Links ]
20. Jovanovic, H., Perski, A., Berglund, H., Savic, I. (2011). Chronic stress is linked to 5-HT(1A) receptor changes and functional disintegration of the limbic networks. Neuroimage, 55: 1178-1188. [ Links ]
21. Julius, D. (1998). Serotonin receptor knockouts: a moody subject. Proc. Natl. Acad. Sci. U S A., 95: 15153-15154. [ Links ]
22. Kieran, N., XM, O., AH, I. (2010). Chronic social defeat downregulates the 5-HT1A receptor but not Freud-1 or NUDR in the rat prefrontal cortex. NeurosciLett. 469: 380-384. [ Links ]
23. Kobilka, B. K., Frielle, T., Collins, S., Yang-Feng, T., Kobilka, T. S., Francke, U., Lefkowitz, R. J., Caron, M. G. (1987). An intronless gene encoding a potential member of the family of receptors coupled to guanine nucleotide regulatory proteins. Nature, 329: 75-79. [ Links ]
24. Kow, L. M., Tsai, Y. F., Wang, L., Pfaff, D. W. (1992). Electrophysiological analyses of serotonergic actions on neurons in hypothalamic ventromedial nucleus in vitro: receptor subtypes involved and implications for regulation of feeding and lordosis behaviors. Chin. J. Physiol., 35: 105-121. [ Links ]
25. Kvetnansky, R., Goldstein, D. S., Weise, V. K., Holmes, C., Szemeredi, K., Bagdy, G., Kopin, I. J. (1992). Effects of handling or immobilization on plasma levels of 3,4-dihydroxyphenylalanine, catecholamines, and metabolites in rats. J. Neurochem., 58: 2296-2302. [ Links ]
26. León-Ponte, M., Ahern, G.A., OConnell, P. J. (2007). Serotonin provides an accesory signal to enhance T-cell activation by signaling through the 5-HT7 receptor. Blood, 109: 3139-3146. [ Links ]
27. Lima, L., Urbina, M., Fazzino, F., Carreira, I., Mata, S. (2007). Theserotonergic system in peripheral lymphocytes of major depression patients. Recent Advances and Research Updates., 8: 183-189. [ Links ]
28. Matsuzaki, H., Izumi, T., Matsumoto, M., Togashi, H., Yamaguchi, T., Yoshida, T., Watanabe, M., Yoshioka, M. (2009). Early postnatal stress affects 5-HT1A receptor function in the medial prefrontal cortex in adult rats. Eur. J. Pharmacol., 615: 76-82. [ Links ]
29. Miller, G., Rohleder, N., Cole, S. W. (2009). Chronic interpersonal stress predicts activation of Pro- and Anti-inflammatory signalling pathways six months later. Psychosom. Med., 71: 57-62. [ Links ]
30. Mizrahi, C., Stojanovic, A., Urbina, M., Carreira, I., Lima, L. (2004). Differential cAMP levels and serotonin effects in blood peripheral mononuclear cells and lymphocytes from major depression patients. Int. Immunopharmacol., 4: 1125-1133. [ Links ]
31. Morrison, K. E., Swallows, CL, Cooper, MA. (2011). Effects of dominance status on conditioned defeat and expression of 5-HT1A and 5-HT2A receptors. Physiol. Behav., 104:283-90. [ Links ]
32. Mossmann, T. (1983). Rapid colorimetric assay for cellular growth and survival application and cytotoxicity assays. J. Immunol. Methods., 65: 55-63. [ Links ]
33. Naderi, S., Wang, J. Y. J., Chen, T. T., Gutzkow, K. B., Blomhoff, H. K. (2005). cAMP-mediated inhibition of DNA replication and S phase progression: involvement of Rb, p21Cip1,and PCNA. Mol. Biol. Cell., 16: 1527-1542. [ Links ]
34. Pan, H., Galligan, J. J. (1995). Effects of 5-HT1A and 5-HT4 receptor agonists on slow synaptic potentials in enteric neurons. Eur. J. Pharmacol., 278: 67-74. [ Links ]
35. Radja, F., Daval, G., Hamon, M., Vergé, D. (1992). Pharmacological and physicochemical properties of pre-versus postsynaptic 5-hydroxytryptamine1A receptor binding sites in the rat brain: a quantitative autoradiographic study. Journal of Neurochemistry, 58: 1338-1346. [ Links ]
36. Savitz, J., Lucki, I., Drevets, WC. (2009). 5-HT(1A) receptor function in major depressive disorder. Prog. Neurobiol., 88: 17-31. [ Links ]
37. Satoh, E., Edamatsu, H., Omata, Y. (2006). Acute restraint stress enhances calcium mobilization and proliferative response in splenic lymphocytes from mice. Stress, 9: 223-30. [ Links ]
38. Sempere, T., Cedeño, N., Urbina, M., Lima, L. (2003). 8-[3H]-hydroxy-2-(di-n-propylamino)tetralin binding sites in blood lymphocytes of rats and the modulation by mitogens and immobilization. J. Neuroimmunol., 138: 8-16. [ Links ]
39. Sempere, T., Urbina, M., Lima, L. (2004). 5-HT1A and β-adrenergic receptors regulate proliferation of rat blood lymphocytes. Neuroimmunomodulation, 11: 307-315. [ Links ]
40. Silberman, D. M., Ayelli-Edgar, V., Zorrilla-Zubilete, M., Zieher, L. M., Genaro, A. M. (2004). Impaired T-cell dependent humoral response and its relationship with T lymphocyte sensitivity to stress hormones in a chronic mild stress model of depression. Brain Behav. Immun., 18: 81-90. [ Links ]
41. Sokal, R. R., Rohlf, F. J. (1979). Biometria, principios y métodos estadísticos en la investigación biológica. Primera Edición, H. Blume Ediciones, España. [ Links ]
42. Weinstein, A. A., Deuster, P., Francis, J. L., Bonsall, R.W., Tracy, R. P., Kop, W. J. (2010). Neurohormonal and inflammatory hyper-responsiveness to acute mental stress in depression. Biol. Psychol. Doi:10.1016/j.biopsycho.2010.01.016. [ Links ]