Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT vol.32 no.4 Caracas dic. 2013
Tuberculosis anal en paciente con el síndrome de inmunodeficiencia adquirida (SIDA)
Lilian María Mederos a, Gilberto Fleites b, Miguel Angel Acosta b, Lidunka Valdés b, Vianka Calás b, María Rosarys Martínez a, Ernesto Montoro a.
a Laboratorio Nacional de Referencia e Investigaciones de Tuberculosis/Micobacterias Centro Colaborador OPS/OMS (IPK).
b Hospital Nacional de Referencia para la Atención a Pacientes VIH/sida (IPK).
a,b Instituto de Medicina Tropical Pedro Kourí (IPK), Autopista Novia del Mediodía Km 6 ½, Lisa La Habana, Cuba.
Resumen
La tuberculosis extrapulmonar se localiza más frecuentemente en pleura, ganglios linfáticos, meninges, aparato genito- urinario y el sistema osteoarticular. La tuberculosis anal o perianal es una forma de presentación extrapulmonar raramente encontrada; puede manifestarse de forma, verrugosa, lupoide o miliar y ulcerativa siendo esta la más común. En este estudio se describe el primer caso de doble fisura anal asociada a una infección por Mycobacterium tuberculosis en un paciente cubano con el síndrome de inmunodeficiencia adquirida (sida), pese a tener un buen nivel inmunitario gracias a la terapia anti-retroviral. El tratamiento mediante el esquema de drogas anti-bacilares del Programa Nacional de Control de la Tuberculosis fue exitoso.
Palabras claves: tuberculosis anal - perianal, Mycobacterium tuberculosis, sida.
Abstract
Extrapulmonary tuberculosis is most frequently found in pleura, lymph nodes, meninges, genito-urinary tract and the osteoarticular system. Anal or perianal tuberculosis is a rare extrapulmonary presentation, and can be found as ulcerative form (the most common), verrucous, lupoid or miliary. In this study we described the first case of double anal fissure associated to infection by Mycobacterium tuberculosis in a Cuban patient with acquired immunodeficiency syndrome with good immunological status thanks to the anti-retroviral therapy. Treatment was successful with the first-line regimen of drugs of the National Program for the Control of Tuberculosis.
Key words: anal-perianal tuberculosis, Mycobacterium tuberculosis, AIDS.
Recibido: 20/09/2012 Aceptado: 21/01/2013
Introducción
La tuberculosis (TB) desde tiempos remotos ha sido uno de los grandes flagelos de la humanidad. La TB pulmonar es la que predomina mundialmente, sin embargo esta enfermedad puede también presentarse en localizaciones extrapulmonares, o ambas, describiéndose como enfermedad diseminada. La creciente incidencia de estas infecciones se debe principalmente a la aparición del virus de inmunodeficiencia humana (VIH), agente causal del síndrome de inmunodeficiencia adquirida (SIDA), considerado pandemia desde hace algunas décadas1-5.
La TB anal y perianal es una forma de presentación extremadamente rara dentro de las localizaciones de la infección extrapulmonar. Presenta características clínicas semejantes a otras afecciones frecuentes en esa zona, por lo que ocasiona frecuentemente un diagnóstico tardío. Habitualmente el diagnóstico definitivo se obtiene por biopsia quirúrgica de la lesión luego de presentar el paciente un prolongado cuadro de ulceración, el cual no responde a la terapia antibiótica. La TB anal y perianal se puede asociar en muchos casos a la tuberculosis intestinal6-10.
Aproximadamente el 35 % de los pacientes VIH/SIDA presentan manifestaciones anorrectales como sepsis perianal, condilomas anales, enfermedad hemorroidal, diarrea crónica, úlcera anal y tumores anorrectales. La tuberculosis anal o perianal se puede presentar como una enfermedad independiente, sin el antecedente de tuberculosis previa o sin enfermedad pulmonar activa, en estos pacientes esta entidad debe tenerse en cuenta dentro del diagnóstico diferencial11,12.
El objetivo de este estudio es describir el primer caso de fisura anal asociada a infección por Mycobacterium tuberculosis en un paciente cubano con el síndrome de inmunodeficiencia adquirida.
Descripción del caso
Paciente masculino de la raza blanca, con antecedentes de salud, que en julio de 2001 a los 49 años es ingresado por un síndrome febril prolongado y tos productiva, con estertores húmedos pulmonares bilaterales. Se diagnostica una bronconeumonía bilateral, y adicionalmente se constatan lesiones orales compatibles con candidiasis. Los resultados del laboratorio muestran hemoglobina 10 g/L, leucocitos 4.7 x 109/L (segmentados 69, linfocitos 23, monocitos 07, eosinófilos 01), eritrosedimentación 126 mm, creatinina 74.7 mmol/L, glicemia 4.4 mmol/L. Los estudios de esputo realizados tanto bacteriológico como cultivo BAAR fueron negativos, así como los hemocultivos y estudios serológicos para descartar otras infecciones bacterianas o micóticas. De forma empírica se aplica tratamiento durante 10 días con Cefpodoxima (100 mg) 1 tab c/12 horas y Ketoconazol (200 mg) 1 tab/día, con remisión completa clínico-radiológica. Antes del alta se recibe un informe positivo de serología VIH, con confirmación por Western Blot, por lo que se declara como caso VIH. El recuento de linfocitos T CD4 es de 7% con 119 células (leucocitos 5.0 x 109/L y linfocitos 034) –la determinación de carga viral no estaba disponible en ese momento –, por lo que se categoriza como paciente sida por deterioro inmunológico, y se indica terapia anti-retroviral de gran actividad (TARGA) con zidovudina (AZT, cápsula 100 mg, 600 mg/día) y lamivudina (3TC, tableta 150 mg, 300 mg/día).
Se realiza seguimiento por consulta externa, evidenciándose progresiva mejoría inmunológica según el conteo de linfocitos T CD4:
Noviembre 2003: 14% con 665 cels/mm3 (leucocitos 11.6, linfocitos 041).
Septiembre 2004: 18% con 810 cels/mm3 (leucocitos 9.0, linfocitos 050). En este momento se añade a la biterapia con AZT y 3TC una tercera droga: nevirapina (tab 200 mg, 400 mg/día).
Abril 2005: 21% con 866 cels/mm3 (leucocitos 9.6, linfocitos 043), con carga viral en 390 copias/mL (primera vez que se realiza este estudio en el paciente).
Mayo 2006: 22% con 704 cels/mm3 (leucocitos 10.0, linfocitos 032).
Julio 2007: 25% con 880 cels/mm3 (leucocitos 8.0, linfocitos 044), con carga viral en 420 copias/mL.
Junio 2008: 27% con 819 cels/mm3 (leucocitos 6.9, linfocitos 044).
Abril 2009: 25% con 849 cels/mm3 (leucocitos 7.9, linfocitos 043), con carga viral indetectable.
Enero 2010: 25% con 1015 cels/mm3 (leucocitos 11.6, linfocitos 035).
A lo largo de todos estos años el paciente mantuvo una perfecta adherencia a la TARGA, sin complicaciones por su enfermedad ni por el tratamiento.
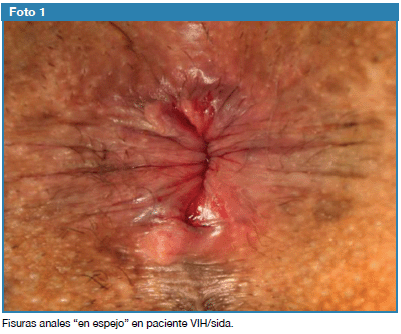
El 12 de diciembre de 2010 acude a la consulta de cirugía del IPK por dolor anal y sangramiento a la defecación, y al examen físico se constatan dos fisuras anales ubicadas en horas 12 y 6 del reloj (fisuras en espejo) (Foto 1). Se opera el 15 de diciembre de 2010, realizando fisurectomía doble bajo anestesia espinal. El estudio anátomo-patológico confirma el diagnóstico de fisura anal, sin evidencia de neoplasia. Por la presencia local de una secreción blanquecina grumosa se recomendó la toma de muestra para estudio BAAR. La muestra fue descontaminada y cultivada a 370C. Las lecturas se realizaron semanalmente, tres semanas después se detectó la presencia de BAAR por el examen por cultivo y coloración de Zielh Neelsen, los tubos presentaron codificación 7- 8, la cepa fue identificada por las pruebas bioquímicas establecidas, demostrando la presencia de Mycobacterium tuberculosis 13,14. Por lo que se indicó realizar colonoscopía que detecta la presencia de pólipos y colitis inespecífica, más el exámen anátomo-patológico no detecta presencia de BAAR. La intradermorreación cutánea de Mantoux fue negativa, con anergia (0 mm).
Se aplica de forma ambulatoria el tratamiento normado por el Programa Nacional de Control de la Tuberculosis, con isoniacida, rifampicina, etambutol y pirazinamida. El paciente tuvo buena adherencia al tratamiento con una evolución satisfactoria, tres meses después se repite el cultivo BAAR, obteniendo codificación 0.
Discusión
La tuberculosis extrapulmonar se presenta en el 10-20% del total de pacientes tuberculosos inmunocompetentes, sin embargo en personas inmunodeprimidas la infección extrapulmonar se incrementa de forma significativa, particularmente en los pacientes VIH/sida donde la localización extrapulmonar puede alcanzar el 60% de los casos. Las localizaciones mas frecuentes son: pleura, ganglios linfáticos, meninges, aparato genito-urinario, el sistema osteoarticular, siendo el resto de las localizaciones muy infrecuentes 15-22.
La tuberculosis gastrointestinal ha disminuido en la población inmunocompetente, gracias al desarrollo de las terapias antituberculosas y el consumo de la leche pasteurizada, de forma que actualmente representan sólo el 1% de los casos de tuberculosis extra-pulmonar, y cuando aparecen generalmente son de localización íleo-cecal. 23-25 Sin embargo en pacientes inmunocomprometidos la variante intestinal ha sufrido un aumento 26-28. Mientras que la tuberculosis pulmonar se presenta con frecuencia en pacientes inmunocompetentes, en la medida en que disminuye el conteo de linfocitos T CD4 aumenta la incidencia de las formas extrapulmonares, por lo que una forma de prevención sería el inicio temprano de la terapia anti-retroviral, antes de que ocurra la bancarrota inmunológica 29-31. Se plantea la existencia de una potenciación recíproca entre el bacilo de Koch y el VIH; el bacilo estimula la propagación del virus mediante la liberación de factores de crecimiento, y a su vez la inmunosupresión por el virus deteriora las funciones de la inmunidad celular (linfocitos B y T, células asesinas naturales, macrófagos) que permiten la reactivación de micobacterias latentes 32.
La tuberculosis anal y perianal es una variante raramente diagnosticada y reportada, sin embargo se calcula que está presente al menos en el 1-3% de los pacientes con infecciones extrapulmonares 8, 24,25. Los síntomas son semejantes a los de otras afecciones de la zona, lo que hace difícil su diagnóstico, por lo que para obtener un mejor diagnóstico se utiliza la clasificación clínica de Altınöz33 que se basa en el aspecto morfológico y distingue cuatro subtipos33: ulcerativo, verrucoso, lupoide y miliar. La forma ulcerativa es la más común, y se presenta como una úlcera superficial y dolorosa, de bordes bien definidos, cubierta por material pseudomembranoso, y con frecuencia existe drenaje mucopurulento. La forma verrugosa es generalmente causada por Mycobacterium bovis y con frecuencia abarca el margen y el canal anal, provocando condilomas. La forma lupoide es secundaria a focos primarios de tuberculosis en otras partes del cuerpo y se presenta como un nódulo pequeño, redondeado, pardorojizo, en el que se desarrolla ulteriormente una ulceración central. La forma miliar anal se asocia a una tuberculosis diseminada multi-orgánica 33-36. Puede desarrollarse una fístula perianal, que generalmente comienza en una glándula profunda de la pared del recto o del ano, y a veces es el resultado del drenaje de un absceso anorrectal, pero a menudo no se puede identificar la verdadera causa 37-38.
El diagnóstico diferencial debe hacerse en primer lugar con la enfermedad de Crohn y la colitis ulcerativa idiopática, pero también con el cáncer ano-rectal, la sarcoidosis, y con otros procesos granulomatosos asociados a infecciones: Chlamydia trachomatis, amebiasis cutánea, actinomicosis y otras micosis profundas, sífilis, linfogranuloma venéreo, y la hidradenitis supurada 39,40. La enfermedad de Crohn en su atípica localización ano-rectal es particularmente problemática para el diagnóstico diferencial, en particular porque en muchos casos de tuberculosis anal la baciloscopía es repetidamente negativa, haciéndose un diagnóstico de Crohn por exclusión, con una larga demora en el inicio del tratamiento anti-tuberculoso 41.
La patogenia de la colonización de la región anal–perianal por el bacilo tuberculoso es mal conocida, y se postulan varios mecanismos42-45: 1) diseminación hematógena a partir de focos pulmonares primarios ya controlados, que se reactivan ulteriormente; 2) ingestión de bacilos en esputo a partir de un foco pulmonar activo; 3) diseminación directa a partir de órganos o estructuras vecinas; 4) a lo largo de canales linfáticos a partir de ganglios regionales infectados; 5) transmisión durante el sexo anal, lo que nunca ha sido probado. El diagnóstico tardío de la tuberculosis anal o perianal puede llevar al paciente a la muerte por diseminación miliar de los bacilos 35,35.
El paciente que presentamos en este estudio resulta interesante por tratarse del primer caso reportado en nuestro país entre los pacientes VIH/sida, además porque la infección se desarrolló en una etapa de inmunocompetencia inducida por el tratamiento anti-retroviral. La no existencia de lesiones tuberculosas en el recto y el colon descartan la posibilidad de una colonización descendente. Esta forma de presentación extra-pulmonar planteará siempre un problema diagnóstico que dificulta el diagnóstico precoz, por la amplia gama de diagnósticos diferenciales de las ulceraciones anales y perianales, y lo infrecuente de esta localización de la infección45-46.
Referencias
1. American Thoracic Society and Centers for Disease Control and Prevention. Control of tuberculosis in the United States. Am Rev Respir Dis 1992;146:1623- 1633. [ Links ]
2. Raviglione M, Snidar D, Kochi A. Global epidemiology of tuberculosis. Morbidity and mortality of a worldwide epidemic. JAMA 1995; 273:220-226. [ Links ]
3. Rieder HL, Snider DE Jr, Cauthen GM. Extrapulmonary tuberculosis lymphadenitis in the United States. Am Rev Respir Dis 1990;141:347-351. [ Links ]
4. Sehgal V, Wagh S. Cutaneous tuberculosis. Current concepts. Int J Dermatol 1990;29:237-52. [ Links ]
5. Rojas A, La Cruz H, Salinas P, Rangel D, Hernández M. Adenitis tuberculosa inguinal. Reporte de um caso. MedULA, 2006;15:37-39. [ Links ]
6. Harland R, Varkey B. Anal tuberculosis: reporto of two cases and literature review. Am J Gastroenterol 1992;87:1488-1489. [ Links ]
7. Candela F, Serrano P, Arriero J, Teruel A, Reyes D, Calpena R. Perianal disease of tuberculous origin: report of a case and review of the literature. Dis Colon Rectum 1999;42:110-112. [ Links ]
8. Miteva L, Bardarov E. Perianal tuberculosis: a rare case of skin ulceration?. Acta Derm Venereol 2002;82:481-482. [ Links ]
9. Fernández JM, Rocha JL, Villanueva E, Sierra E. Tuberculosis anorrectal. Reporte de un caso. Rev Gastroenterol Mex, 2007;72:40-42. [ Links ]
10. Urrejola G, Villalón R, Rodríguez N. Ulceración perianal: dos casos de uma rara manifestación de tuberculosis. Ver Med Chile 2010;138:220-222. [ Links ]
11. Chung C, Choi C, Kwok S, Leung K, Lau W, Li A. Anal and perianal tuberculosis: a report of three cases in 10 years. J R Coll Surg Edinb 1997;42:189-190. [ Links ]
12. Albandea M, Aguilar V, Gonzalo J, Rosales JM. Causa emergente de dolor abdominal y fiebre: tuberculosis intestinal. Rev Esp Enferm Dig 2009;101:44. [ Links ]
13. Organización Panamericana de la Salud. MANUAL para el diagnóstico bacteriológico de la tuberculosis. Normas y Guía técnica. Parte 1 Baciloscopia, 2008. [ Links ]
14. Organización Panamericana de la Salud. MANUAL para el diagnóstico bacteriológico de la tuberculosis. Normas y Guía técnica. Parte 2 Cultivo, 2008. [ Links ]
15. Ozates M, Kemaloglu S, Gurkan F, Ozkan U, Hosoglu S, Simsek MM. CT of the brain in tuberculous meningitis. A review of 289 patients. Acta Radio 2000;41:13-17. [ Links ]
16. Narang P, Narang P, Narang R, Mendiratta DK, Sharma SM, Tyagi NK. Prevalence of tubercolous lymphadenitis in children in Wrarha district, Maharashtra State, India. Int J Tuberc Lung Dis 2005; 9:188-194. [ Links ]
17. Eastwood JB, Corbishley CM, Grange JM. Tuberculosis and kidney. J Am Soc Nephrol 2001;12:1307. [ Links ]
18. Dronda F, Suzacg C. Pericardial tuberculosis complicated with heart tamponade as presentation form acquired immunodeficiency syndrome. Clin Esp 1997;197:502-506. [ Links ]
19. Bresky G, Silva N, Madariaga J. Esofagitis tuberculosa en un paciente HIV positivo. Ver Med Chile 2007;135:1323-1326. [ Links ]
20. Bendayan D, Littman K, Polansky V. Active tuberculosis and human immunodeficiency vírus co-infection in Israel: a retrospective study. Isr Med Assoc J 2010;12:100-103. [ Links ]
21. Ramdial PK, Sing Y, Subrayan S, Calonje E, Aboobaker J, Sidney C, Sookdeo D, Ramburan A, Madiba TE. Granulomas in acquired immunodeficiency syndrome -associated cutaneous Kaposi sarcoma: evidence for a role for Mycobacterium tuberculosis. J Cutan Pathol 2010;37:827-834. [ Links ]
22. Mederos LM, Bandera JF, Valdés L, Capó V, Fleites G, Martínez MR, Montoro E. Meningitis y diseminación tuberculosa en paciente con el síndrome de inmunodeficiencia adquirida (sida). Arch Ven Farm Terap 2010;29:35-38. [ Links ]
23. Chung CC, Choi CL, Kwok SP, Leung KL, Lau WY, Li AK. Anal and perianal tuberculosis: a report of three cases in 10 years. J R Coll Surg Edinb 1997; 42:189-90. [ Links ]
24. Romelaer C, Abramowitz L. Abcès tuberculeux de la marge anale. À propos de deux cas et revue de la littérature. Gastroentérologie Clinique et Biologique. 2007; 31:94-6. [ Links ]
25. Sultan S, Azria F, Bauer P, Abdelnour M, Atienza P. Anoperineal tuberculosis: diagnostic and management considerations in seven cases. Dis Colon Rectum 2002; 45:407-10. [ Links ]
26. Demir K, Okten A, Kaymkoglu S, Dicer D, Besisik F, Cevikbas V. Tuberculose peritonites-report of 26 cases, detailing diagnostic and therapeutic problem. Eur J Gastroenterol Hepatol 2001;13:581-585. [ Links ]
27. Morales A, Espinoza E, Mejía R, Oré V. Tuberculosis entero peritoneal: descripción de 25 casos. Ver Situa 1999;7:35-41. [ Links ]
28. Velázquez J, Szigefhi M, Panace R, Morales R, Márquez S, Pefaur J. Micobacteriosis hepato-esplénica, forma inusual de probable tuberculosis extrapulmonar. Caso clínico y revisión bibliográfica. Ver Chil Infect 2007;24:59-62. [ Links ]
29. Jones BE, Young SM, Antoniskis D, Davidson PT, Kramer F, Barnes PF. Relationship of the manifestations of tuberculosis to CD4 cell counts in patients with human immunodeficiency virus infection. Am Rev Respir Dis. 1993;148:1292-7. [ Links ]
30. Lawn SD, Myer L, Edwards D. Short-term and long-term risk of tuberculosis associated with CD4 cell recovery during antiretroviral therapy in South Africa. AIDS. 2009; 23:1717-25. [ Links ]
31. Jaryal A, Raina R, Sarkar M, Sharma A. Manifestations of tuberculosis in HIV/ AIDS patients and its relationship with CD4 count. Lung India 2011; 28:263-6. [ Links ]
32. Gupta PJ. Ano-perianal tuberculosis - solving a clinical dilemma. African Health Sciences 2005; 5:345-347. [ Links ]
33. Altınöz H, Köse E, Kula Ö, Keser B, Karagöz T. Pulmonary tuberculosis complicated by anal tuberculosis. Turkish Resp J 2003; 4:142–143. [ Links ]
34. Harland R, Varkey B. Anal tuberculosis: report of two cases and literature review. Am J Gastroenterol 1992;87:1488-1491. [ Links ]
35. Betlloch I, Banuls J, Sevilla A, Morell A, Botella R, Román R. Perianal tuberculosis. Int J Dermatol 1994;33:270-271. [ Links ]
36. Chung C, Choi C, Kwok S, Leung K, Lau W, Li A. Anal and perianal tuberculosis: a report of three cases in 10 years. J R Coll Surg Edinb 1997;42:189-190. [ Links ]
37. Betlloch I, Banuls J, Sevila A, Morell A, Botela R, Román R. Perianal tuberculosis. Int J Dermatol 1994;33:270-271. [ Links ]
38. Akgun E, Tekin F, Ersin S, Osmanoglu H. Isolated perianal tuberculosis. Neth J Med 2005;63:115-7. [ Links ]
39. Romelaer C, Abramowitz L. Abcès tuberculeux de la marge anale: À propos de deux cas et revue de la littérature. Gastroentérologie Clinique et Biologique 2007; 31:94-96. [ Links ]
40. Bravo FG, Gotuzz E. Cutaneous tuberculosis. Clin Dermatol 2007; 25: 173–180. [ Links ]
41. Yaghoobi R, Khazanee A, Bagherani N, Tajalli M. Gastrointestinal tuberculosis with anal and perianal involvement misdiagnosed as Crohns disease for 15 years. Acta Dermato-Venereologica 2010; 91: 348-349. [ Links ]
42. Le Bourgeois PC, Poynard T, Modai J, Marche C, Avril MF, Chaput JC. Peri-anal ulceration. Tuberculosis should not be overlooked. Presse Med. 1984; 13:2507- 2509. [ Links ]
43. Musch E, Tunnerhoff-Mucke A. Tuberculous anal fistula in acquired immunologic deficiency syndrome. Z Gastroenterol. 1995; 33:440-444. [ Links ]
44. Jayanthi V, Robinson RJ, Malathi S, Rani B, Balambal R, Chari S, Taghuram K, Madanagopalan N, Mayberry JF. Does Crohns disease need differentiation from tuberculosis? J Gastroenterol Hepatol. 1996; 11:183-186. [ Links ]
45. Geminiano E, Peña JP, Villanueva E, Alvarez JF, Parrado J. Cirugía anorrectal en pacientes infectados por el vírus de la inmunodeficiencia humana. Gastroenterol Mex 2000;65:152-158. [ Links ]
46. Berdaji M. Practice parameters for the management of anal fissures. Dis Colon Rectum 2004;47:2003-2007. [ Links ]