Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT vol.33 no.1 Caracas mar. 2014
OMACOR® (Una formulación concentrada de Ácidos Omega 3), en el tratamiento de los triglicéridos elevados
OMACOR ® (A concentrated formulation Omega 3 Acid) in the treatment of high triacylglycerols
Coordinadores: Elsy Rodríguez de Roa1, María González Yibirín2, Jairo Ruiz3.
Ver lista de autores al final.
1 Médico Cardiólogo, 2 Director Médico de Laboratorios Leti, S.A.V., 3 Gerente Médico de Estudios Clínicos, Laboratorios Leti, S.A.V.
Resumen
Antecedentes: La hiperlipidemia es una condición clínica frecuente que favorece el desarrollo de ateroesclerosis. Los triglicéridos (TG) son considerados un factor muy importante en esto. Los ácidos grasos n-3 reducen los triglicéridos y están asociados con menor riesgo de muerte súbita en pacientes post infarto del miocardio, protección que podría ser efectiva en pacientes sin evidencia de enfermedad previa.
Métodos: Estudio prospectivo de Farmacovigilancia, abierto, multicéntrico, nacional, para evaluar eficacia de Omacor® en reducir hipertrigliceridemia. Después de cuatro semanas de dieta, se evaluó perfil lipídico en ayuno (TG, Colesterol total, LDL-C, VLDL-C, HDL-C, Colesterol no HDL) así como Glicemia, AST y ALT. Aquel paciente que continuaba con triglicéridos mayores a 150 mg por dL, pasaba a la siguiente fase del estudio, que consistía en el suministro de Omacor®, un gramo vía oral, BID, durante 6 semanas.
Resultados: Se analizaron por intención a tratar 185 pacientes. Con Omacor® se reportó un descenso significativo en Peso, IMC, PAD y PAS (p<0.001). El tratamiento redujo en forma significativa todas las variables lipídicas en estudio (CT, HTG, LDL-C, No-HDL-C; p<0.001) con un incremento del C-HDL (p 0.002). La HTG se redujo 33% (p<0.001) y el No-HDL-C, 14% (p<0.001). Al final, 59,77% de los pacientes logró estar en meta (TG<150 mg/dL), con Omacor® y dieta, en comparación a 4.47% con dieta.
Conclusiones: La administración de Omacor® durante seis semanas en pacientes con HTG resultó segura, con un descenso significativo de todas las variables lipídicas y glicemia.
Palabras claves: Ácidos Omega 3, Triglicéridos, Omacor®.
Abstract
Background: Hyperlipidemia is a common condition that promotes atherosclerosis development. Triglycerides are being considered a very important factor. n-3 fatty acids lower triglycerides and have been associated with lower risk of sudden death in patients with myocardial infarction and could be effective in patients without evidence of prior cardiovascular disease.
Methods: We performed a prospective, open, multicenter, pharmacovigilance study, to evaluate Omacor® effectiveness in reducing triglyceride levels. After four weeks with patients underwent diet, we made lipid profile in fasting, measuring triglycerides, total cholesterol, LDL-C, VLDL-C, HDL-C, Non- HDL-C and glucose, AST and ALT. Patient who continued triglycerides above 150 mg/dL were passed to next phase of study with Omacor®, 1 gr orally, BID for 6 weeks.
Results: 185 patients were analyzed by ITT. Treatment with Omacor® reported a significant decrease in weight, BMI, DBP and SBP (p<0.001). In this study, the effect of treatment significantly reduced all lipid variables studied (CT, HTG, LDL-C, non-HDL-C; p<0.001) with an increase in HDL-C (p 0.002). HTG was reduced by 33% (p<0.001) and non-HDL-C 14% (p<0.001). After treatment, 59.77% achieved with diet plus Omacor® the target of TG<150mg/dL compared with the 4.47% only diet.
Conclusions: The administration of Omacor® for six weeks in patients with HTG was safe, with a significant decrease in all lipid and glycemic variables.
Keywords: Omega 3 fatty acids, Triglycerides, Omacor®
Recibido: 20/10/2013 Aceptado: 21/11/2013
Introducción
El efecto protector sobre el riesgo cardiovascular de los alimentos ricos en ácidos grasos poliinsaturados (AGPI) n-3 procedentes de vertebrados marinos1,2, y de la vitamina E3, ha generado un gran interés durante los últimos 20 años4. Desde que se describió la baja tasa de enfermedad coronaria en la población esquimal con una dieta rica en aceite de pescado5, varios estudios han investigado y confirmado los efectos antiaterogénicos, antitrombóticos y antiarrítmicos de los AGPI n-3 3-8.
Aunque no existía un consenso respecto al mecanismo de acción subyacente2, el centro de interés fue la capacidad de reducir los triglicéridos con los AGPI n-3 a dosis altas (se autorizó el registro para esta indicación4) y de modificar la composición de la membrana del cardiomiocito, permitiendo su incorporación a la misma e incrementando el umbral arrítmico por efecto sobre los canales iónicos2-4. Se observó un papel protector del pescado en la prevención secundaria de la enfermedad coronaria en el Diet And Reinfarction Trial (DART)9.
En el estudio GISSI-Prevenzione10 realizado entre octubre de 1993 y septiembre de 1995, en un total de 11.324 pacientes que habían sobrevivido a un infarto de miocardio reciente (~ 3 meses) se asignaron aleatoriamente suplementos de AGPI n-3 (1 g diario, n= 2.836), vitamina E (300 mg diarios, n= 2.830), ambos productos (n= 2.830) o ninguno de ellos (control, n= 2.828) durante 3,5 años. El tratamiento con AGPI n-3, redujo significativamente el riesgo de la variable de valoración principal (disminución del riesgo relativo del 10% [IC del 95%, 1-18] mediante un análisis de dos vías; 15% mediante un análisis de cuatro vías).
Los ácidos grasos n-3 que se encuentran en el pescado8, se han asociado, aunque de manera no estadísticamente significativa (estudio JELIS) con un menor riesgo de muerte súbita en sujetos sin evidencia de enfermedad cardiovascular previa.
Diferentes guías Americanas y Europeas de Cardiología11,12,13 recomiendan la ingesta de 1 g/día de los dos ácidos grasos omega-3, el ácido eicosapentaenoico (EPA) y ácido docosahexaenoico (DHA) para la prevención de secundaria después de un infarto de miocardio11,12,13, sobre todo la prevención de muerte súbita14. Estas recomendaciones se basan en evidencia científica que abarca literalmente miles de publicaciones y es considerada como evidencia tipo B.
Omacor® actúa sobre los lípidos plasmáticos reduciendo el nivel de los triglicéridos15 dando como resultado el descenso del colesterol VLDL (lipoproteínas de muy baja densidad) y también actúa sobre la homeostasia sanguínea y la presión arterial. Omacor® reduce la síntesis hepática de triglicéridos puesto que el EPA y el DHA son malos substratos para las enzimas responsables de la síntesis de triglicéridos e inhiben la esterificación de otros ácidos grasos15.
El aumento de la β-oxidación de ácidos grasos en los peroxisomas del hepatocito también contribuye al descenso de los triglicéridos, reduciendo la cantidad de ácidos grasos libres disponibles para su síntesis16. La inhibición de esta síntesis disminuye el VLDL16. Omacor® aumenta el LDL-colesterol en algunos pacientes con hipertrigliceridemia, si bien se ha demostrado que el aumento se produce en aquellos pacientes con los niveles de LDL-C más bajos16. El aumento en HDLcolesterol es menor que el que se observa después de la administración de fibratos, y no es constante.
Durante el tratamiento con Omacor® se disminuye la producción de tromboxano A2 y aumenta ligeramente el tiempo de hemorragia10. No se han observado efectos significativos sobre los demás factores de coagulación.
Este estudio fue realizado con el objetivo de evaluar el efecto sobre los triglicéridos del concentrado de etil éster de ácidos grasos omega-3, Omacor®, en pacientes con hiperlipidemia que no respondieron adecuadamente a una dieta terapéutica.
Materiales y métodos
Diseño: Se realizó un estudio prospectivo, post comercialización de Farmacovigilancia, abierto, multicéntrico y nacional (estados Aragua, Anzoátegui, Bolívar, Carabobo, Distrito Capital, Lara, Miranda, Monagas, Nueva Esparta, Táchira, Yaracuy y Zulia) para evaluar la eficacia de Omacor® en la reducción de los niveles de triglicéridos, en pacientes que al inicio del estudio tuviesen niveles de triglicéridos entre 150 mg/dL y 500 mg/dL y que acudieron a la consulta de los investigadores.
Pacientes: Se incluyeron pacientes de ambos sexos, con edades entre 18-80 años, con niveles de triglicéridos de >150 y <500 mg/dL, después de 4 semanas de la dieta tipo 1, prescrita para control de triglicéridos. El IMC estuvo entre 25 y 40 Kg/m2 y en aparente buen estado de salud, determinado por historia clínica, examen físico, ECG de 12 derivaciones y pruebas de laboratorio de rutina (perfil 20). Todos los pacientes fueron suficientemente informados sobre el estudio y firmaron el consentimiento informado.
Se excluyeron pacientes con hipotiroidismo primario, hipersensibilidad a los ácidos omega-3 y al pescado, que estuviesen ingiriendo medicación que contuviera ácidos grasos omega-3 (concentrado de aceite de pescado, aceite de hígado de bacalao o harina de pescado) durante las 10 semanas del período de dieta. Pacientes con Infarto de miocardio u otra enfermedad cardiovascular grave en los 6 meses precedentes al estudio, enfermedad psicológica grave, drogadicción o alcoholismo conocido.
Tampoco se incluyeron pacientes que estuviesen recibiendo medicación hipolipemiante, pacientes con dolor muscular o debilidad, historia de pancreatitis, historia reciente de enfermedad de riñón, hígado, pulmón, enfermedades gastrointestinales o cáncer. Pacientes con diabetes mal controlada o que reciben tratamiento con insulina. Mujeres embarazadas o lactantes, ni mujeres en edad fértil que no estén usando un método anticonceptivo confiable, como anticonceptivos orales o implantados y esterilización quirúrgica. Pacientes en tratamiento hormonal (cualquier tipo excepto contraceptivos hormonales a bajas dosis [etinilestradiol 2μg]), medicamentos anticonvulsivos, medicamentos inmunomoduladores, antibióticos, antifúngicos y antivirales, así como pacientes que necesitaran el uso de warfarina.
para pacientes dislipidémicos durante un período de 4 semanas, al término de las cuales se realizó nuevo control de lípidos séricos (triglicéridos [TG], Colesterol total [TC], colesterol LDL [LDL-C], colesterol VLDL [VLDL-C], colesterol HDL [HDL-C], no HDL-colesterol [No-HDL-C]), así como glicemia, transaminasa glutámico oxaloacética y transaminasa glutámico pirúvica. Aquellos que mantuvieron los criterios de inclusión (TG>150 mg/dL y <500 mg/dL), fueron ingresados al estudio recibiendo tratamiento médico con un concentrado de etil éster de ácidos grasos omega-3 (Omacor®) a una dosis de 1 gr BID, durante 6 semanas.
Finalmente, luego de recibir este tratamiento con Omacor®, se procedió a realizar un nuevo análisis de lípidos sanguíneos posterior a un ayuno de 14 horas; además se realizó la medición de la glicemia, transaminasas y examen físico e interrogatorio de eventos adversos.
Del total de los 232 pacientes incluidos en el estudio, 47 fueron excluidos del análisis por diversas razones (33 [70,21%] no se presentaron a la consulta post tratamiento, 12 [25,53%] fueron excluidos por haber recibido conjuntamente drogas hipolipemiantes [estatinas o fibratos] u otras violaciones del protocolo [no cumplimiento de criterios de inclusión]).
Método estadístico: Los datos antropométricos y de laboratorio recogidos, así como los eventos adversos, fueron analizados desde el punto de vista de estadística descriptiva para parámetros de distribución normal (edad, presión arterial, estatura) y con pruebas no paramétricas (Test de rangos de Wilcoxon) para los lípidos séricos dada su distribución no gaussiana de acuerdo al resultado de la prueba de normalidad de Kolmogorov- Smirnov. Las variables cualitativas fueron expresadas como frecuencia absoluta y relativa (porcentaje) y se realizó prueba de Chi cuadrado para evaluación de la asociación considerada estadísticamente significativa cuando p<0,05
Resultados
Se ingresaron al estudio 232 pacientes de los que 185 fueron analizados por intención de tratamiento (aquellos pacientes que hubiesen tomado al menos una dosis del fármaco y tuviesen una evaluación posterior al suministro del tratamiento farmacológico).
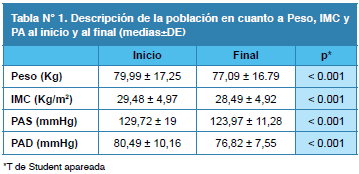
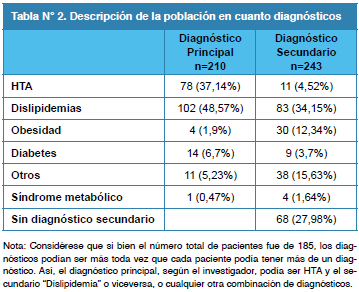
De los pacientes analizados, 101 (54,59%) fueron del sexo femenino y 81 (43,78%) del sexo masculino (en tres casos no se reportó el género). La edad promedio fue de 51,89 ± 13,62 años y el IMC fue de 29,48 ± 4,97. Otras características demográficas están detalladas en las Tablas 1 y 2.
Dos pacientes (0,86% del total de pacientes ingresados) fueron retirados por otras razones: una paciente presentó fractura de fémur por caída de su propia altura, lo cual se consideró sin relación con el tratamiento; una segunda paciente presentó cefalea, malestar, vómitos, diarrea e insomnio después de 5 días de administración del fármaco y este se suspendió.
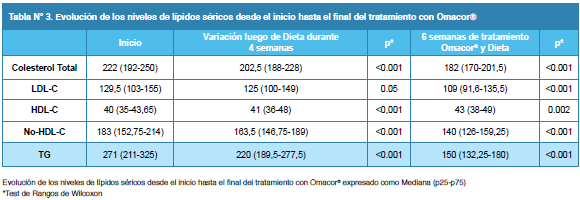
Se observó un descenso significativo en los niveles de triglicéridos, del C-Total, C-LDL, no-C-HDL y una elevación significativa en los niveles de C-HDL (Tabla 3).
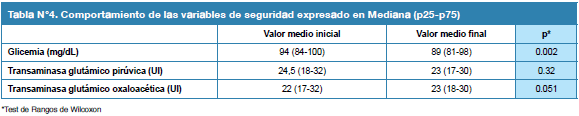
Se observó igualmente, un descenso de los niveles promedio iniciales de la glicemia con significancia estadística pero no clínica, sin variación en las transaminasas (Tabla 4).
EL control del nivel de TG (≤150 mg/dL) fue alcanzado por el 64,23% de los pacientes. Con dieta fue alcanzado por el 4,46% del total, mientras que cuando se sumó el uso de Omacor®, se alcanzó en el 59,78% de los casos en 6 semanas de tratamiento activo (Figura 1).
Efectos adversos: La administración de Omacor® resultó segura durante la seis semanas del tratamiento. Trece pacientes, de los 185 pacientes incluidos por ITT, desarrollaron efectos adversos. No se reportaron acontecimientos adversos graves en ningún paciente durante el desarrollo del estudio.
Las reacciones adversas más frecuentes fueron del tipo gastrointestinal (6/185, [3,24%]): regurgitación, dispepsia, estreñimiento, pirosis y diarrea. Las menos frecuentes fueron urticaria, prurito, hipotensión, mareos, insomnio de leve intensidad que no ameritaron ni tratamiento ni suspensión del fármaco en estudio. En tres pacientes no se describió el tipo del efecto adverso presentado.
Discusión
Omacor® es el único medicamento que contiene EPA y DHA con aprobación en la prevención secundaria del infarto17,18. Es bien conocido que la hiperlipidemia es una condición clínica frecuente, asociada a la hipertensión arterial, síndrome metabólico y diabetes, y que se potencian una a otra favoreciendo el desarrollo y la progresión de la ateroesclerosis y complicaciones cardiovasculares19,20. El manejo terapéutico depende tanto del nivel de riesgo del paciente, así como del nivel individual o combinado de las variables lipídicas que queramos modificar16.
En este trabajo, el nivel promedio de TG fue de 278,03 mg/ dL para el momento del ingreso (mediana 271). El perfil promedio de ingreso (Tabla N°1) revela una población con sobrepeso por IMC>25 (90% IMC>25) y nivel promedio de PA>130/80mmHg categorizada en nivel Normal Alto por la Sociedad Europea de Hipertensión19. Con el tratamiento con Omacor® se observó un descenso significativo en estas variables antropométricas: Peso (p<0.001; -2,90 Kg, 4%), IMC (p<0.001; 0,99 kg/m2, 3%), y de los niveles de PAS -5,75 mmHg (p<0.001) y PAD -3,67 mmHg (p<0.001).
En la población participante se observó como diagnóstico primario la presencia de HTA el 37,14% de los casos y todos presentaron algún tipo de dislipidemia (mixta o HTG). También hubo obesidad (1,9% como diagnóstico primario y 12,34% secundario) y diabetes (6,7% como diagnóstico principal y 3,7% diagnóstico secundario). La asociación de HTA, HTG y obesidad, entre otros, dan origen al llamado síndrome metabólico21, que conduce a disfunción endotelial y activación de citoquinas y oxidación que acelera el proceso aterotrombótico22. Los AGPI n-3 producen una reducción de la presión arterial (PA) dependiente de la dosis23. En pacientes hipertensos tratados con dosis altas (3-6 g/día) de AGPI n-3 se observa una reducción de la presión arterial sistólica (PAS)/diastólica (PAD) de 3,4-5,5/2,5-3,5 mmHg23. Todo esto demostró, en este estudio abierto y de farmacovigilancia, el efecto beneficioso de Omacor® en el manejo de estas alteraciones metabólicas.
En el presente estudio el efecto del tratamiento con Omacor ® redujo en forma significativa todas las variables lipídicas en estudio (CT, HTG, C-LDL, C-no HDL; p<0.001) con un incremento del C-HDL (p 0.002). El nivel de TG y de C-no HDL, con respecto a la dieta, se redujo en 33% (p<0.001) y 14% (p<0.001), respectivamente. Al final del tratamiento, un 59,77% de los pacientes logró con la monoterapia con Omacor® más dieta estar en meta de TG<150 mg/dL en comparación del 4,46% sólo con dieta.
Estos datos revelan que Omacor® mejoró de forma significativa las variables que intervienen en el riesgo cardiovascular.
En el estudio de Paris24, se estudió la relación de la HTG como factor de riesgo para enfermedad aterotrombótica; en este estudio, Fontbonne y col., determinaron que el nivel de TG en ayunas fue un fuerte predictor independiente de riesgo de muerte por ECV. Fue un estudio prospectivo, realizado en hombres con diabetes Mellitus (DM2) o intolerancia glucosada, con un seguimiento de 11 años. Se encontró que la tasa de mortalidad por ECV fue seis veces mayor en los pacientes con un nivel de TG> 123 mg/dL, independientemente del nivel de colesterol (CT). Sin embargo, otros autores afirman no encontrar mayor relación entre la HTG en ayunas o postprandial, la ECV y el síndrome cardiometabólico, sugerido porque una reducción de concentración de HTG en pacientes con DM2 no corrige habitualmente la concentración de apoA-II25, por lo tanto, se ha incorporado al análisis el colesterol no HDL (no-HDL)26, el cual se ha considerado un marcador sustituto de la HTG y representa igualmente al resto de las partículas residuales de quilomicrones y lipoproteínas de muy baja densidad (VLDL), todas significativamente aterogénicas y en cierto modo relacionadas con la HTG postprandial en los síndromes cardiometabólicos26. Omacor redujo significativamente los valores de esta variable aterogénica No-HDL-C de una mediana inicial de 183 a 140 mg/dL al final del tratamiento, con una p<0.001.
La evaluación de la HTG postprandial, fue evidente en el estudio realizado en los países nórdicos27, en el que se investigó la relación entre los TG medidos no en ayunas y los eventos CV. Se incluyó en el análisis un total de 13.981 mujeres y hombres con un seguimiento de 26 años. La incidencia acumulada de eventos CV aumentó en forma proporcional y significativa en relación al aumento de los TG postprandiales (p<0.001 para la tendencia), lo cual no fue evidente para los TG medidos en ayunas. Es evidente que en un plasma rico en TG se forman más LDL tipo B. El LDL tipo B es altamente aterogénico e induce más disfunción endotelial28.
Las concentraciones medias de HDL-C bajas están frecuentemente asociadas a la obesidad y síndrome metabólico21, unida a la ausencia de terapias efectivas para elevar el HDLC, puede representar una preocupación en la estrategia preventiva de la enfermedad arterial coronaria. Se ha observado que un 50% de los pacientes que se presentan con SCA tienen concentraciones sub óptimas de HDL-C29,30. En todo caso, hace una especial referencia al HDL-C, indicando que no hay objetivos específicos dados por evidencia, aunque los valores de HDL-C elevados predicen regresión de aterosclerosis, y el HDL-C bajo está asociado a un exceso de episodios cardiovasculares y de mortalidad, incluso si el HDL-C bajo concurre con un LDL-C en objetivos de 70mg/dl29,30.
Los ácidos grasos omega- 3 (DHA y EPA), son capaces de reducir la HTG en un 20–45% de manera dependiente de la dosis administrando entre 2 y 4g/día31. Aumentan la degradación intracelular de las lipoproteínas que contienen apolipoproteína B-100, inhibiendo la secreción de VLDL y reduciendo la concentración de HTG31. También aceleran la eliminación de los quilomicrones mediante el aumento de la actividad de la lipoproteína-lipasa31, el aumento de la conversión de VLDL a lipoproteínas de baja densidad (LDL), la disminución de la síntesis de LDL y la reducción de la lipemia postpandrial31, por lo cual las guías para el manejo de las dislipidemias de la Sociedad Europea de Cardiología13 los recomienda con una clase de recomendación IIa, nivel de evidencia B; igualmente la Food and Drug Administration (FDA)32 ha aprobado el uso de ácidos grasos n-3, específicamente Omacor (fármacos con prescripción), como terapia adjunta a la dieta si las concentraciones de HTG son > 5,6 mmol/L (496 mg/dL).
En un estudio japonés33 en pacientes con hipercolesterolemia, se observó una reducción del 19% en los eventos CV en pacientes con historia de enfermedad arterial coronaria y de 18% en aquellos que no la tenían pero esta disminución en el grupo sin enfermedad coronaria no fue estadísticamente significativa comparado con el grupo control (que no recibía EPA); no obstante, aunque los datos disponibles no son concluyentes y parece que su eficacia clínica no guarda relación con la reducción del LDL-C, se redujo la incidencia de eventos CV en pacientes de alto riesgo con síndrome metabólico y, por lo tanto, con un patrón dislipidémico de TG altos/HDL-C baja.
En este punto es importante mencionar algo con respecto al tratamiento con Omacor®, dado que se demostró que durante las seis semanas de administración, se redujo en forma significativa el nivel de glicemia en ayunas (p 0.002) por lo que podría ejercer un efecto importante en el control del síndrome metabólico.
La administración de Omacor® resultó segura durante la seis semanas, sólo a un paciente (0,5%) se le suspendió el fármaco por reacción adversa que no ameritó hospitalización, ni administración de fármacos adicionales. Las reacciones adversas más frecuentes son del tipo gastrointestinal (3,24%). Las transaminasas descendieron durante el tratamiento con Omacor® y no se reportaron acontecimientos adversos graves.
Conclusiones: La administración de Omacor® durante seis semanas en pacientes con HTG resultó segura, con un descenso significativo de la glicemia y de las variables lipídicas relacionadas, en especial los TG que se redujeron en 33% y del C-No HDL en un 14%. Esta monoterapia permitió alcanzar la meta en el nivel de HTG<150 mg/dl en aproximadamente 60% de los pacientes y su perfil de seguridad, hace favorable el uso en combinaciones con otros fármacos para potenciar el efecto hipolipemiante.
Referencias
1. Albert C, Campos H, Stampfer M, Ridker P, Manson J, Willet W and MA J. Blood levels of long-chain n-3 fatty acids and the risk of sudden death. New Engl J Med. 2002; 346:1113-8. [ Links ]
2. Investigadores del GISSI-Prevenzione* (Gruppo Italiano per lo Studio della Sopravvivenza nelllnfarto miocardico). Suplementos de ácidos grasos poliinsaturados n-3 y vitamina E en la dieta tras el infarto de miocardio: resultados del ensayo clínico GISSI-Prevenzione. Lancet. 1999; 354(9117):447-455. [ Links ]
3. Jha P, Flather M, Lonn E, Farkouh M, Yusuf S. The antioxidant vitamins and cardiovascular disease: a critical review of epidemiological and clinical trial data. Ann. Intern. Med. 1995; 123: 860-72. [ Links ]
4. Simopoulos AP. Omega-3 fatty acids in health and disease and growth and development. Am. J. Clin. Nutr. 1991; 54: 438-63. [ Links ]
5. Dyerberg J, Bang HO, Stoffersen E, et al. Eicosapentaenoic acid and prevention of thrombosis and atherosclerosis? Lancet. 1978; 2(8081):117-9. [ Links ]
6. Simopoulos AP. Omega-3 fatty acids and the prevention-management of cardiovascular disease. Canad. J. Physiol. Pharmacol. 1997; 75: 234-39. [ Links ]
7. Marchioli R, Di Pasquale A. Per i Ricercatori GISSI-Prevenzione. Il quadro di riferimento biochimico, farmacologico, epidemiológico del GISSI-Prevenzione. G Ital Cardiol. 1993; 23: 933-64. [ Links ]
8. Bang HO, Dyerberg J, HjØorne N. The composition of food consumed by Greenland Eskimos. Acta Med Scand. 1976; 200: 69-73. [ Links ]
9. Burr ML, Fehily AM, Gilbert JF, et al. Effects of changes in fat, fish, and fibre intakes on death and myocardial reinfarction trial (DART). Lancet. 1989; 2 (8666): 757-61. [ Links ]
10. Marchioli R, on behalf of GISSI-Prevenzione Investigators. Treatment with n-3 polyunsaturated fatty acids after myocardial infarction: results of GISSI-Prevenzione trial. Eur Heart J. 2001; 22:D85–D97. [ Links ]
11. Kris-Etherton PM, Harris WS, Appel LJ, for the AHA Nutrition Committee. Omega-3 fatty acids and cardiovascular disease. New recommendations from The American Heart Association. Aterioscler Thromb Vasc Biol. 2003; 113:2363-2372. [ Links ]
12. Antman EM, ACC/AHA Guidelines for the management of patients with ST elevations myocardial infarction. 2004. Available in www.acc.org [ Links ]
13. De Backer G, Ambrosioni E, Borch-Johnsen K, Brotons C, Cifkova R, Dallongeville J, et al. European guidelines on cardiovascular disease prevention in clinical practice. Third Join Task Force of European and Other Societies on Cardiovascular Disease Prevention In Clinical Practice. Eur Heart J. 2003; 24:1601-1610. [ Links ]
14. Marchioli R, Barzi F, Bomba E, Chieffo C, Di Gregorio D, Di Mascio R, et al. Early Protection Against Sudden Death by n-3 Polyunsaturated Fatty Acids After Myocardial Infarction: Time-Course Analysis of the Results of the Gruppo Italiano per lo Studio della Sopravvivenza nellInfarto Miocardico (GISSI)-Prevenzione. Circulation. 2002; 105:1897-1903. [ Links ]
15. Harris W, Bulchandani D. Why do omega 3 fatty acids lower serum triglycerides? Curr Opin Lipidol. 2006; 17:387-93. [ Links ]
16. Bays H, Maki K, McKenney J, Snipes R, Meadowcroft A, Schroyer R, et al.: Long-term up to 24-month efficacy and safety of concomitant prescription omega-3-acid ethyl esters and simvastatin in hypertriglyceridemic patients. Current Medical Research & Opinion, 2010; 26(4): 907–915. [ Links ]
17. Agencia española de medicamentos y productos sanitarios. Ficha técnica OMACOR 1000 mg. http://www.aemps.gob.es/cima/pdfs/es/ft/65476/FT_65476.pdf [ Links ]
18. Servicio Autónomo de Contraloría Sanitaria del Ministerio del Poder Popular para la Salud. Oficio de aprobación de indicaciones y posología de Omacor 1000 mg Cápsulas Blandas. Documento en Archivo de Laboratorios Leti, SAV. [ Links ]
19. Reiner Z, Catapano AL, De BG, Graham I, Taskinen MR, Wiklund O, et al. ESC/EAS Guidelines for the management of dyslipidaemias: the Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS). Eur Heart J. 2011; 32:1769-818. [ Links ]
20. Mancia Guiseppe, Fagard Robert, Narkiewicz Krzysztof, Redon Josep, Zanchetti Alberto, et al. The Task Force for the management of arterial hypertension of the European Society of Hypertension (ESH) and of the European Society of Cardiology (ESC). Journal of Hypertension, 2013, 31:1281–1357. [ Links ]
21. Alberti K.G.M.M., Eckel Robert H., Grundy Scott M., Zimmet Paul Z., Cleeman James I., et al. Harmonizing the Metabolic Syndrome A Joint Interim Statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity. Circulation. 2009; 120:1640-1645. [ Links ]
22. International Diabetes Federation. The IDF consensus worldwide definition of the Metabolic Syndrome. 2006. Available in http://www.idf.org/webdata/docs/IDF_Meta_def_final.pdf [ Links ]
23. Bao DQ, Mori TA, Burke V, Puddey IB, Beilin LJ. Effects of dietary fish and weight reduction on ambulatory blood pressure in overweight hypertensives. Hypertension. 1998; 32:710-717.
24. Fontbonne A, Eschwege E, Cambien F, Richard JL, Ducimetire P, Thibuli N, et al. Hypertriglyceridemia as a risk factor coronary heart disease mortality in subjects with impaired glucose tolerance or diabetes. Results from the 11 year followed-up of the Paris Prospective Study. Diabetologia. 1989; 32:300-304. [ Links ]
25. Chapman MJ, Ginsberg HN, Amarenco P, Andreotti F, Boren J, Catapano AL, et al, for the European Atherosclerosis Society Consensus Panel. Triglyceride-rich lipoproteins and high-density lipoprotein cholesterol in patients at high risk of cardiovascular disease: evidence and guidance for management. Eur Heart J. 2011; 32:1345-61. [ Links ]
26. The Emerging Risk Factors Collaboration. Major lipids, Apolipoproteins, and risk of vascular disease. JAMA. 2009; 302:1993-2000. [ Links ]
27. NordeshtGaard BG, Benn M, Schnohr P, Tybjaerg-Hansen A. Nonfasting triglycerides and risk of myocardial infarction, ischemic heart disease, and death in men and women. JAMA. 2007; 298:299-3018. [ Links ]
28. Berneis KK, Krauss RM. Metabolic origins and clinical significance of LDL heterogencity. J Lipid Res. 2002; 43:1363-1379. [ Links ]
29. Sachdeva A, Cannon CP, Deedwania PC, Labresh KA, Smith Jr SC, Dai D, et al. Lipid levels in patients hospitalized with coronary artery disease: an analysis of 136,905 hospitalizations in Get with the Guidelines. Am Heart J. 2009; 157:111–117. [ Links ]
30. Pintó X, Millán J, Muñoz A, Corbella E, Hernández-Mijares A, Zuñiga M, et al. A very high prevalence of low HDL cholesterol in Spanish patients with acute coronary syndromes. Clin Cardiol. 2010; 33:418-23. [ Links ]
31. Balk EM, Lichtenstein AH, Chung M, Kupelnick B, Chew P, Lau J. Effects of omega-3 fatty acids on serum markers of cardiovascular disease risk: a systematic review. Atherosclerosis. 2006; 189: 19–30. [ Links ]
32. FDA: Approval letter. http://www.accessdata.fda.gov/drugsatfda_docs/appletter/2007/021853s000,%20021654s016ltr.pdf [ Links ]
33. Yokoyama M, Origasa H, Matsuzaki M, Matsuzawa Y, Saito Y, Oikawa S, et al. Effects of eicosapentaenoic acid on major coronary events in hypercholesterolemic patients (JELIS): a randomized open-label, blinded endpoint analysis. Lancet. 2007; 369: 1090–98. [ Links ]