Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT vol.33 no.3 Caracas set. 2014
Señalización de la adrenomedulina en el vermis del cerebelo de la rata (adrenomedullin signaling in rat cerebellar vermis)
Adrenomedullin signalling in rat cerebellar vermis
Figueira Leticia e Israel Anita
Laboratorio de Neuropéptidos. Facultad de Farmacia. Universidad Central de Venezuela. Caracas - Venezuela.
*Correspondencia: Apartado Postal 50176, Sabana Grande 1050A, Caracas, Venezuela. E-mail: astern88@gmail.com
Resumen
La adrenomedulina (AM) es un péptido ubicuo que se encuentra en el cerebelo, y que ejerce sus acciones a través de la activación de diversas vías de señalización; sin embargo, en el vermis cerebeloso estas vías aún son desconocidas. En el presente estudio se evaluaron las posibles vías de señalización que median la acción de la AM en el vermis cerebeloso, así como los subtipos de receptores de AM involucrados. Para ello, ratas macho Sprague Dawley fueron sacrificadas, se disecó el vermis cerebeloso y estimuló el tejido in vitro con AM, en presencia o ausencia de sus bloqueantes específicos. Posteriormente, se determinó la activación de las ERK, la acumulación de monofosfato de inositol (InsP1) y producción de AMPc, GMPc, NO y proteínas. Se demostró que la AM es capaz de activar a las ERK, la producción de GMPc y NO a través de la estimulación del receptor AM1, y del AMPc a través de los tres subtipos de receptores de AM, lo que apoya que en el cerebelo la AM ejerce acciones a través de la activación de las vías NO/GMPc, AC/AMPc y/o ERK, lo cual sugiere la existencia de un sistema adrenomedulinérgico funcional en el cerebelo de la rata.
Palabras claves: AM, cerebelo, señalización.
Summary
Adrenomedullin (AM) is a ubiquitous peptide. In brain, AM is expressed in several localized regions, including the cerebellum. AM signals through several pathways. Little is known about the signaling pathways associated to AM receptor in cerebellum. Therefore, we assessed the signaling pathways mediating AM action in rat cerebellum vermis, as well the receptor involved. For this purpose, male Sprague Dawley rats were sacrificed, the cerebellar vermis was dissected under stereomicroscopic control and the tissue was stimulated in vitro with AM, in the presence or absence of specific blockers of AM receptor subtypes: AM22-52 or CGRP8-37. ERK activation was assayed by western blot. inositol monophosphate (Ins1), cGMP and cAMP accumulation was determined by radioimmunoassay. NO was determined spectrophotometrically. Our findings demonstrate that in cerebellum, AM increased cAMP and cGMP production, NO accumulation and ERK activation. These effects are mediated through the activation of AM1 receptor, since AM22-52 blunted AM action, meanwhile AM increase of cAMP production is also mediated through stimulation of AM2 and CGRP receptors. These results indicate that in cerebellum AM excets its effects through several signaling pathways such NO/cGMP, AC/cAMP and/ or ERK suggesting the presence of a functional adrenomedullinergic system in cerebellum.
Keywords: AM, cerebellum, signaling pathways.
Recibido: 20/10/2013 Aceptado: 21/11/2013
Introducción
La adrenomedulina (AM) es un péptido de 52 residuos de aminoácidos perteneciente a la familia de los péptidos de la calcitonina que fue aislado por primera vez en el feocromocitoma humano19. La AM es un péptido ubicuo, pues tanto el péptido como su ARNm han sido encontrados en varios tejidos como la aurícula y ventrículo cardíaco, aorta, pulmón, riñón, páncreas, intestino delgado, hígado, testículo y músculo10,20,38; además se ha evidenciado AM en la circulación, orina, saliva, fluido cerebroespinal y amniótico30.
La AM ejerce sus acciones principalmente a través de su unión con tres subtipos de receptores, el receptor del péptido relacionado al gen de la calcitonina tipo 1 (CGRP1), el receptor de AM tipo 1 (AM1) y tipo 2 (AM2). El CGRP1 está formado por el receptor similar al receptor de calcitonina (CRLR) y la proteína que modifica la actividad del receptor tipo 1 (RAMP1); por su parte, el complejo CRLR/ RAMP2 y CRLR/RAMP3 constituyen los receptores de AM, denominados AM1 y AM2 respectivamente8,23.
La AM inicialmente fue caracterizada como un péptido hipotensor19; sin embargo, han sido muchas las acciones descritas para la AM; pues promueve la proliferación celular, apoptosis, migración, inflamación, angiogénesis, inhibición de la secreción de endotelina, inhibición de la ingesta de agua y sal1,2,23.
Uno de los mecanismos de acción a través del cual actúa la AM y por el cual fue descubierto fue a través de su capacidad de elevar los niveles de adenosina monofosfato cíclico (AMPc)19. En diferentes tipos celulares como plaquetas, células de músculo liso vascular, endoteliales, tubulares renales, mesangiales, estelares hepáticas y líneas celulares como la oligodendroglial humana KG-1C, entre otras; la AM ha demostrado elevar los niveles de AMPc 1,44,47,48.
Adicionalmente, en varios tipos de células, la AM ha demostrado activar otras vías de señalización como la fosfolipasa C (PLC), guanilil ciclasa (GC), quinasa regulada por señales extracelulares (ERK) y otras proteínas de la familia de las proteínas quinasas activadas por mitógenos (MAPK) como MAPK p38 y la proteína quinasa c-Jun NH2 terminal (JNK)13,22.
Por lo tanto, los mecanismos de señalización por los cuales la AM media sus funciones varían entre especies y lecho vascular, pero generalmente involucran al AMPc, óxido nítrico (NO) y mecanismos dependientes de calcio. Por su parte, el efecto antiapoptótico de la AM en células de miocardio ha sido relacionado con la vía fosfatidil inositol 3 quinasa (PIK3) – Akt. Finalmente en células endoteliales, la cascada de las MAPK puede ser activada por la AM6.
En el sistema nervioso central (SNC), se ha demostrado la presencia de AM y sus sitios de unión en la corteza cerebral, glándula pituitaria, bulbo raquídeo, hipotálamo y cerebelo16,27,33. En el cerebelo, la inmunoreactividad a la AM se ha apreciado en los núcleos lateral, interpósito y medial cerebelar; así como en las capas molecular, de las células de Purkinje y en la granular de la corteza cerebelar40. La presencia del sistema AM cerebelar, sugiere un posible papel de este péptido a este nivel. Sin embargo, muy pocos han sido los estudios sobre la AM en el cerebelo. Recientemente, se ha demostrado la activación de vías de señalización de la AM a este nivel. En este sentido, la presencia de la actividad de la sintasa de óxido nítrico (SON) en el cerebelo, en elementos celulares que presentan receptores para la AM, indica un posible papel de la misma en la regulación de la función celular mediante la posible generación de NO/ guanosina monofosfato cíclico (GMPc), como mediadores de los efectos de dicho péptido35. Estos hallazgos permiten inferir un papel funcional de la AM cerebelosa.
Actualmente, se conoce poco acerca de las vías de señalización que median la acción de la AM cerebelar; por lo que en el presente estudio se evaluaron las posibles vías de señalización de la AM en el vermis de cerebelo de la rata, así como los subtipos de receptores que median dicha acción.
Materiales y métodos
Animales de Experimentación
Se emplearon ratas macho Sprague-Dawley de 250 g, provenientes del Bioterio del Instituto Nacional de Higiene Dr. Rafael Rangel. Los animales fueron mantenidos en jaulas a temperatura ambiente con ciclos de 12 horas luz / oscuridad. La dieta de los animales consistió en Ratarina® y agua ad libitum. Los experimentos fueron realizados siguiendo las buenas prácticas para el manejo de animales de laboratorio32 y la aprobación del Comité de Bioterio de la Facultad de Farmacia de la UCV. Las ratas se sacrificaron por decapitación, los cerebros fueron extraídos y el vermis del cerebelo se disecó mediante microdisección bajo control estereomicroscópico y mantenido en Buffer Krebs-Ringer (KBR) burbujeado con 95% O2 y 5% CO2. Posteriormente cada muestra fue preincubada a 37ºC en presencia o ausencia de los antagonistas o inhibidores y posterior estimulación con agonista. El vermis cerebeloso fue homogenizado mediante sonicación en el buffer de lisis respectivo para cada tipo de ensayo, centrifugado a 10.000 rpm y el sobrenadante recolectado fue utilizado como muestra.
Vías de Señalización Determinación de las ERK
La determinación de la ERK total y fosforilada se realizó por Western Blot. Para lo cual el tejido estimulado con agonista (AM) en presencia y ausencia de los antagonistas fue homogeneizado en frío mediante sonicación, en Buffer de lisis para ERK (Tris Base 50 mM, 5mM EDTA, 1mM NaF, Na3VO4, Tritón X-100 1% y mezcla de inhibidores de proteasas compuesto por Pepstatina A 5μM, aprotinina 10μg/ml, leupeptina 10μM, PMSF 2mM, pH 7,4). El homogeneizado fue centrifugado a 4oC, a 10.000 rpm durante 10 minutos, para obtener el sobrenadante, el cual fue congelado a -70ºC hasta el momento de su procesamiento. Para el análisis por Western Blot, alícuotas del homogeneizado (100μg proteínas) diluidas en Laemmli fueron separadas por electroforesis en gel SDSpoliacrilamida al 10 % y transferidas a una membrana de nitrocelulosa durante 1 hora. Las membranas fueron bloqueadas con leche descremada al 10%, y posteriormente incubadas durante toda la noche a 4oC con el anticuerpo primario, anti-fosfo-ERK y anti-ERK de conejos (Cell Signaling) diluido en solución de albúmina sérica bovina al 3% en TBS-Tween al 0,1% (Dilución 1:1000). Las membranas fueron lavadas con TBS- Tween al 0,1% e incubadas con anticuerpo secundario anti conejo conjugado con peroxidasa de rábano, diluido en solución de albúmina sérica bovina al 1,5% en TBS- Tween al 0,1 % (Dilución 1:1000) durante 1 hora en agitación lenta a temperatura ambiente. Las proteínas fueron visualizadas por quimioluminiscencia (SuperSignal® West Pico Chemiluminescent Substrate) a través de películas para rayos X y cuantificadas mediante análisis densitométrico (Quantity One 1-D ®- BioRad). La expresión de la ERK fosforilada fue normalizada con la ERK total.
Determinación del Recambio de Fosfoinosítidos La hidrólisis de los fosfoinosítidos fue determinada como la acumulación de monofosfato de inositol (InsP1) en presencia de LiCl 10 Mm (11, 24). Para ello, los vermis de los cerebelos fueron marcados durante dos horas a 37°C, en 20 mL de KBR que contenía 0,5 mCi de myo-[2- 3H]-inositol (Amersham, actividad específica 18,8 Ci/mmol) gasificado continuamente con O2 (95%): CO2 (5%).
Después del marcaje, los tejidos fueron lavados en KBR fresco gasificado y transferidos a KBR que contenía LiCl 10 mM. El tejido fue transferido a tubos Eppendorf de 1,5 mL que tenían 360 μL de buffer KBR - LiCl y se incubaron por 10 minutos a 37°C con los agonistas en presencia o ausencia de los antagonistas. La reacción fue detenida mediante la adición de 100 mL de ácido tricloroacético (concentración final 6%) en frío. Los tejidos fueron sometidos a ultrasonido en hielo y centrifugados a 10.000 g durante 15 min., a 4°C. El sobrenadante se utilizó para cuantificar la acumulación del InsP1 mediante cromatografía de intercambio aniónico. Las fracciones (5 mL) que contenía el InsP1 fueron recolectadas y la radioactividad cuantificada mediante espectrometría de centelleo líquido.
Ensayo de la Guanilil Ciclasa El vermis del cerebelo fue extraído mediante microdisección bajo control estereomicroscópico y mantenido en KBR (conteniendo en mM: NaCl 125; KCl 3,5; KH2PO4 1,25; MgSO4 1,20; CaCl2 0,75; NaHCO3 25; glucosa 10 y teofilina 1,6) burbujeado con 95% O2 : 5% CO2. Para el ensayo de la activación de la GC cada vermis del cerebelo fue transferido individualmente a tubos Eppendorf conteniendo 180 μL de buffer KBR, sometiéndose a preincubación durante 10 minutos a 37ºC, en presencia o ausencia de los correspondientes antagonistas. La reacción se inició con el agregado de los agonistas (20 μL), o buffer para los controles, al medio de incubación seguidos de 10 minutos adicionales de incubación. La reacción se detuvo agregando 20 μL EDTA (166 mM, pH 7,5) y calentando a 90 ºC durante 3 min. Las muestras fueron mantenidas en hielo y posteriormente homogeneizadas mediante sonicación. Las muestras fueron congeladas a –20ºC para la posterior determinación del GMPc.
Determinación del GMPc
Se tomó una alícuota de 100 μL para la determinación del GMPc. El contenido de GMPc se cuantificó por radioinmunoensayo (RIA) por el método descrito por46, utilizando un kit comercial (AmershamÒ International plc, UK). El ensayo se fundamenta en la competencia entre el GMPc no radioactivo (muestra) y una cantidad fija del compuesto marcado, por la unión a un anticuerpo que posee alta especificidad y afinidad por el GMPc. La cantidad de GMPc radioactivo unido al anticuerpo está relacionada inversamente con la concentración de GMPc presente en la muestra.
La cantidad de GMPc se calculó utilizando una curva estándar (rango de 0 a 4 pmol/tubo). La actividad GC se reportó como pmoles de GMPc formados/10 min/mg de proteínas.
Determinación de AMPc
El contenido de AMPc se cuantificó por ensayo inmunoenzimático (ELISA), utilizando un kit comercial (Arbor Assay, USA). Para ello, se incubó 50 μL de muestra en una placa de 96 pozos cubierta con un anticuerpo para captura. Posteriormente se agregó un conjugado AMPc – peroxidasa. La reacción de unión fue iniciada con la adición de anticuerpo al AMPc. Después de 2 horas de incubación, la placa fue lavada y el sustrato añadido. La absorbancia fue leída a 450 nm. La cantidad de AMPc se calculó utilizando una curva estándar (rango de 0 a 150 pmol/mL). La producción de AMPc se reportó como pmoles de AMPc formados/10 min/mg de proteínas.
Ensayo para la determinación de la producción de NO
La producción de NO fue determinado colorimétricamente como una medida de la producción de nitrato/nitrito formado. Este ensayo consiste en determinar la acumulación de nitrito (producto final estable de la síntesis de NO) en el sobrenadante mediante la reacción de Griess7.
Determinación de las Proteínas Tisulares
Las proteínas tisulares totales fueron determinadas utilizando albúmina sérica de bovino como patrón26.
Análisis Estadístico
Los resultados fueron expresados como la media + error estándar de la media (E.E.M.). Se realizó la prueba de Shapiro-Will, para evaluar la distribución de las variables. La significancia de los resultados fue analizada mediante el análisis de varianza de una vía (ANOVA) y la prueba de Bonferroni. Un valor de p<0,05 fue considerado significativo. El análisis de los resultados y la elaboración de los gráficos se realizaron empleando el programa Graph Pad Prism versión 5.1.
Resultados
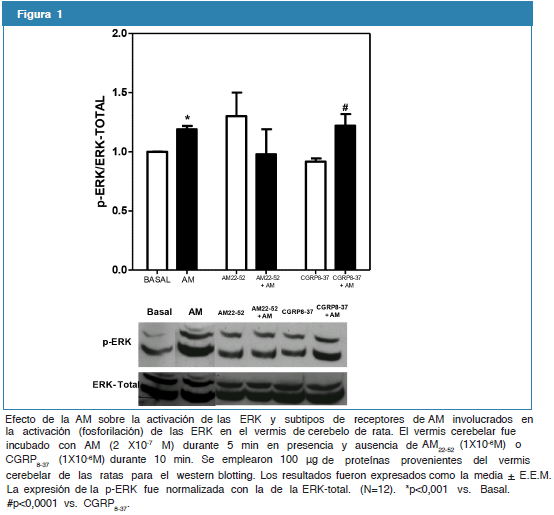
Efecto de la AM sobre la activación de las ERK en el cerebelo de la rata. Subtipos de receptores que median la acción de la AM
Se evaluó el efecto de la AM sobre la activación de las ERK en el vermis cerebelar de la rata. Como se puede apreciar, la incubación del vermis cerebelar con AM (2X10-7 M) durante 5 min, activó de manera significativa las ERK (p<0,001; N=12). De igual manera, se evaluó la posible participación de los subtipos de receptores de AM en las acciones de la AM sobre la activación de las ERK. Como se observa en la figura 1, el pretratamiento con la AM22-52, antagonista de los receptores de AM, durante 10 min, bloqueó completamente la activación de las ERK inducida por la AM en el vermis cerebelar de la rata (1,3 + 0,2 vs. 0,98 + 0,21 AM22-52 vs. AM22-52+AM). Por su parte, la adición de CGRP8-37, antagonista del receptor CGRP, no alteró la activación de las ERK inducida por la AM (0,91 + 0,02 vs. 1,22 + 0,09 CGRP8-37 vs. CGRP8-37 + AM) (N=12; *p<0,001).
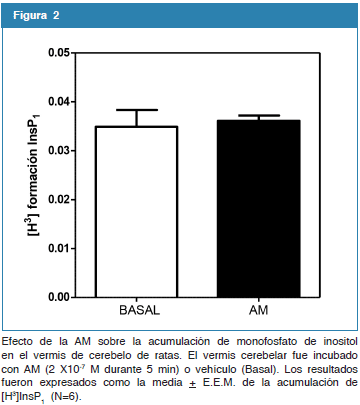
Efecto de la AM sobre la acumulación de fosfoinositoles en el vermis cerebeloso en la rata.
Se evaluó la acumulación de fosfatidilinositoles inducida por la AM en el vermis de cerebelo de la rata. Como se observa, en la figura 2 la incubación del vermis cerebelar con AM (2X10-7 M) durante 5 min, no alteró la acumulación de monofosfato de inositol cuando se compara con su basal (0,035 + 0,003 vs. 0,036 + 0,001 Basal vs. AM). (N=6).
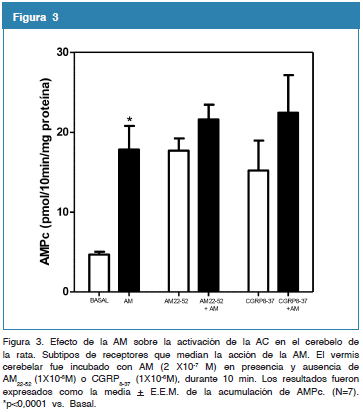
Efecto de la AM sobre la activación de la adenilil ciclasa (AC) en el cerebelo de la rata. Subtipos de receptores que median la acción de la AM.
Se evaluó el efecto de la AM sobre la activación de la AC en el vermis de cerebelo de la rata. Como se observa, en la figura 3 la incubación del vermis cerebelar con AM (2X10-7 M) durante 10 min incrementó significativamente la producción de AMPc, el pretratamiento con la AM22-52, antagonista de los receptores de AM, durante 10 min, bloqueó la acumulación del AMPc inducida por la AM en el vermis cerebelar de rata (17,70 + 1,53 vs. 21,60 + 1,84 AM22-52 vs. AM22-52+AM). De igual manera, la adición de CGRP8-37, antagonista del receptor CGRP, bloqueó la acumulación de AMPc inducido por la AM (15,22 + 3,74 vs. 22,45 + 4,71 CGRP8-37 vs. CGRP8-37 + AM) (N=7; *p<0,0001).
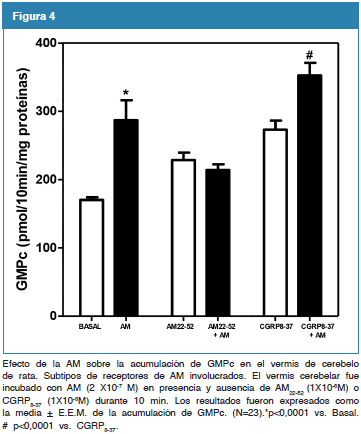
Efecto de la AM sobre la activación de la GC en el cerebelo de la rata. Subtipos de receptores que median la acción de la AM
Se evaluó el efecto de la AM sobre la activación de la GC en el vermis de cerebelo de la rata. Como se observa, en la figura 4 la incubación del vermis cerebelar con AM (2X10-7 M) durante 10 min, incrementó significativamente la acumulación del GMPc cuando se compara con su basal. De igual manera, se evaluó los subtipos de receptores de AM involucrados en los efectos de la AM sobre la acumulación del GMPc en el vermis de cerebelo de rata. Como se observa en la figura 4, el pretratamiento con la AM22-52, antagonista de los receptores de AM, durante 10 min, bloqueó la acumulación del GMPc inducida por la AM en el vermis cerebelar (228,82 + 10,91 vs. 214,00 + 8,37 AM22-52 vs. AM22-52+AM). Por el contrario, la adición de CGRP8-37, antagonista del receptor CGRP, no alteró la acumulación de GMPc inducido por la AM (273,30 + 13,09 vs. 352,80 + 18,20 CGRP8-37 vs. CGRP8-37 + AM) (N=23; *p<0,0001).
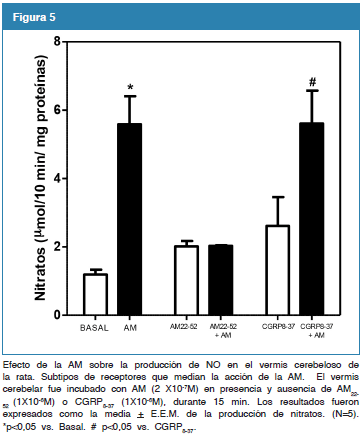
Efecto de la AM sobre la producción de NO en el vermis cerebeloso de la rata. Subtipos de receptores que median la acción de la AM.
Como se observa, en la figura 5 la incubación del vermis cerebelar con AM (2X10-7 M) durante 10 min, incrementó de forma significativa la acumulación de nitratos cuando se compara con su basal. El pretratamiento con la AM22-52, antagonista de los receptores de AM, durante 10 min, bloqueó la acumulación de nitratos inducida por la AM en el vermis cerebelar a niveles comparables a sus valores basales (2,01 + 0,16 vs. 2,03 + 0,02 AM22-52 vs. AM22-52+AM). Por el contrario, la adición de CGRP8-37, antagonista del receptor CGRP, no alteró la producción de NO inducido por la AM (2,61 + 0,85 vs. 5,61 + 0,96 CGRP8-37 vs. CGRP8-37 + AM) (N=5; *p<0,05).
Discusión
Diferentes estudios tanto a nivel central como periférico indican que una de las principales vías a través de la cual la AM ejerce sus efectos es la activación de la vía de la AC/AMPc52. Sin embargo, se sabe que la AM es capaz de activar otras vías de señalización en diversos órganos y tejidos, tales como la PLC, la GC44 y las ERK12. De igual manera, se ha demostrado que la AM es capaz de activar otros mecanismos de señalización intracelular, incluyendo los canales de potasio sensibles a ATP37.
Las ERK1/2 son proteínas serina/treonina quinasas que juegan un papel importante en la supervivencia, proliferación y diferenciación de varios tipos celulares34. Diferentes estudios muestran que las ERK1/2 están ampliamente expresadas en tejidos periféricos y centrales. A nivel del cerebelo, existe una alta distribución celular e intracelular de las ERK tanto en ratas jóvenes como adultas. De hecho, estudios de inmunohistoquímica han demostrado que las células de Purkinje, granulosas y gliales del cerebelo de la rata son inmunoreactivas a las p-ERK1/2 55.
En el SNC, algunos estudios han reportado que las MAPK a nivel central pueden cumplir un importante papel en la regulación de la presión arterial, pues Seyedabadi y col.41, demostraron que la inhibición de las MAPK en la región ventrolateral rostral del bulbo raquídeo (RVLM) es vital para el mantenimiento de los niveles tónicos de presión arterial en ratas hipertensas y normotensas. Igualmente, se ha demostrado que las cascadas de las ERK1/2 tienen importancia en la modulación de la potenciación a largo plazo en el hipocampo y es requerida para varias formas de aprendizaje y memoria. Asimismo, se ha indicado que la cascada de las ERK participa en el daño neuronal inducido por isquemia y en la generación de actividad convulsivante en cultivos de neuronas de hipocampo48.
Hasta el presente, se desconoce la vía de señalización de la AM en el cerebelo. En el presente estudio se demostró que la AM fue capaz de activar a las ERK1/2 en el vermis de cerebelo de la rata, siendo dicho efecto mediado principalmente por el receptor de AM1, ya que fue completamente bloqueado por el AM22-52, un inhibidor de los receptores específicos de la AM y no por el pre-tratamiento con CGRP8-37, un bloqueante del receptor CGRP. Nuestros hallazgos, son los primeros que describen el efecto de la AM en el SNC y están avalados por los obtenidos previamente en otros tejidos y órganos donde la AM activa a las ERK1/2. Así, Yoshimoto y col.54, encontraron que la AM activó las ERK1/2 en células de músculo liso. De igual manera, Iwasaki y col.12, encontraron que la AM estimuló la actividad de las MAPK, la expresión de c-fos y subsiguiente proliferación de células de músculo liso vascular a través de una vía dependiente de la proteína tirosina quinasa (PTK), y no a través de la vía AMPc/ PKA o a través de la vía calcio/proteína quinasa C (PKC).
Existe evidencia que indica que la AM es capaz de incrementar los niveles de calcio intracelular y activar la PKC44. De hecho, la activación de los receptores de AM en células endoteliales de bovino, provoca un incremento en la concentración de calcio intracelular y la activación de la PKC a través de la vía inositol 1,4,5 - trifosfato (IP3) y la producción de diacilglicerol44, lo que sugiere que la AM puede activar a la PLC. De igual manera, se ha demostrado que la AM es capaz de incrementar la concentración intracelular de calcio y la producción de IP3 en la línea celular humana de oligodendrogial, KG-1C48; así como en cultivo de neuronas de hipocampo donde la AM fue capaz de disminuir la concentración de calcio intracelular inducidas por alta concentración de potasio o por IP3 a través de los receptores de AM15, lo que sugiere que la AM puede suprimir la liberación de calcio de los depósitos intracelulares, sensibles a IP3, y además la AM puede bloquear la entrada externa de calcio a la célula mediada por canales de calcio dependientes de voltaje. Aún cuando la evidencia sugiere la relación de la AM con la estimulación de la vía del IP3, bajo nuestras condiciones experimentales en el vermis cerebeloso, la AM no alteró el metabolismo de los fosfoinosítidos, lo que indica que la AM no afecta la actividad de la PLC en el vermis de cerebelo de la rata. En apoyo a nuestros resultados, Iwasaki y col.,12 encontraron que la AM no provocó cambios en la producción de IP3 y de calcio intracelular en células de músculo liso vascular.
Diversos estudios han indicado que la AM es capaz de activar la vía de la SON/ GMPc44. En efecto, se ha demostrado que la AM incrementa los niveles de GMPc en células cardíacas de ratas18 y en células endoteliales de aorta de bovino, donde el incremento del GMPc inducido por la AM es dependiente del NO y es inhibido por el L-NAME44, lo que sugiere que este incremento puede mediar la acción hipotensora de la AM.
Los efectos de la AM sobre la producción de NO en el cerebro no son claros; sin embargo se ha demostrado un efecto estimulatorio directo de la AM sobre la producción de NO en células de neuroblastoma humano SK-NSH in vitro53. Igualmente, se sabe que la administración icv de AM incrementa la expresión de c-fos en el hipotálamo y tallo cerebral y activa neuronas que producen NO en los núcleos paraventricular (NPV), supraóptico (NSO) y del tracto solitario (NTS), siendo dicho efecto mediado por los receptores de CGRP14. Igualmente, la administración icv de AM causó una marcada inducción de inmunoreactividad c-fos en el NPV y en la porción dorsal de NSO, siendo este efecto dependiente de los receptores específicos de AM39. Estos hallazgos sugieren que la AM central es responsable de la activación de células neurosecretoras en los NPV y NSO del hipotálamo, a través de receptores específicos de la AM. Aún más, se sabe que la AM fue capaz de incrementar la actividad de la SON y la producción de GMPc en la eminencia media de la rata28, y la administración icv de AM en ratas, incrementó la concentración de nitratos y nitritos en el hipotálamo, así como la expresión inmunohistoquímica de la NAD(P)H diaforasa en las neuronas productoras de NO en el NPV42. Por lo tanto, la evidencia indica que el NO está involucrado en numerosas funciones fisiológicas en el SNC desempeñando un importante papel en la regulación de funciones autonómicas21,50.
El NO/GMPc podría actuar como un neurotransmisor en el cerebelo29. En este sentido, se ha encontrado alta expresión del sistema de señalización relacionado con el NO a este nivel, pues existe altos niveles de la enzima GC31 y del GMPc5 en las células de Purkinje. Por otra parte, estudios de inmunohistoquímica revelan alta expresión de la proteína quinasa dependiente de GMPc en las células de Purkinje del cerebelo25. Adicionalmente la SON y GC soluble activada por NO muestran colocalización en diversas regiones del cerebelo4,36.
Ahora bien, la coincidencia anatómica entre la SON y elementos celulares que presentan receptores para la AM en el cerebelo, sugiere un posible papel de la misma en la regulación de la función celular mediante la posible generación de NO/GMPc35. En apoyo a esto, en el presente estudio se demostró que el efecto de la AM sobre la producción de NO y GMPc cerebeloso en las ratas fue mediado por el receptor AM1, pues fue bloqueado con AM22-52. Similares hallazgos fueron reportados previamente por Pastorello y col.,35, quienes encontraron que la AM estimula la actividad de la SON cerebelosa, a través de la estimulación de su receptor específico.
Desde el descubrimiento de la AM, el AMPc fue considerado inicialmente como la principal molécula de señalización intracelular de este péptido. La AM activa la AC en células de músculo liso vascular produciendo un incremento en los niveles de AMPc; lo que sugiere que el receptor de AM está acoplado a la AC a través de una proteína G estimulatoria (Gs) sensible a toxina de cólera, que activa la proteína AC con producción de AMPc y activación de la PKA9. Adicionalmente, se ha demostrado en células KG1C, que el incremento de los niveles de AMPc inducidos por la AM es mediado por el receptor de AM y el CGRP; ya que este efecto es inhibido por antagonista de los receptores de AM y CGRP, AM22-52 y CGRP8-37 respectivamente, pero no por el antagonista del receptor de amilina, amilina-8-37,47.
La acción vasodilatadora de la AM es ejercida mediante esta vía de señalización; de hecho el AMPc es el principal segundo mensajero conocido para la vasodilatación. Por otra parte, la acción mitogénica de la AM también es ejercida mediante esta vía de señalización, ya que algunos estudios en células Swiss 3T3 y queratinocitos han demostrado que la AM incrementa la síntesis de ácido desoxirribonucleico (ADN) y la proliferación celular, siendo estos efectos bloqueados por un inhibidor de la PKA (H-89)17,51. Sin embargo, la vía AMPc/PKA es conocida como un regulador negativo del crecimiento celular; en este sentido la AM ha demostrado inhibir la síntesis de ADN en células de músculo liso vascular que crecen de manera asincrónica y suplementada con suero que contiene varios factores de crecimiento12,43. En vista de ello, se ha sugerido que el papel bi-funcional de la AM para el control del crecimiento celular depende del tipo celular y del estado del ciclo celular; ya que en células quiescientes la AM ejerce su acción mitótica mediante la vía PTK/ERK, mientras que la AM ejerce su acción antimitogénica mediante la vía AMPc/PKA en células que crecen asincrónicamente43.
La vía de señalización AMPc/PKA de la AM ha sido postulada como el principal mecanismo de transducción de la AM para sus efectos biológicos, sin embargo, no es la única vía de señalización. A pesar de que los efectos cardiovasculares de la AM tales como la vasodilatación y el inotropismo positivo generalmente se acompañan de elevación del AMPc, hay pocos estudios que indican que tales acciones son bloqueadas tanto por inhibidores de la PKA o por antagonistas del AMPc. Por lo tanto, se ha sugerido que las acciones pleiotrópicas de la AM (crecimiento celular, migración y apoptosis) son independientes de la vía AMPc/PKA.
En relación al vermis cerebeloso, nuestros resultados demuestran la participación de la vía de la AC en la acción de la AM, ya que ésta fue capaz de incrementar la producción tisular de AMPc, siendo dicho efecto mediado por los tres subtipos de receptores de AM: AM1, AM2 y CGRP ya que fue totalmente inhibida por el pretratamiento in vitro con AM22-52 y CGRP8-37. Estos resultados sugieren que en el vermis cerebeloso la AM es capaz de activar la vía AC/AMPc/PKA. Aún cuando no se evaluó en forma directa la participación de la PKA en dicha señalización nuestros resultados aún no publicados demuestran que en el vermis cerebeloso el pretratamiento con PKI-6-22 -amida, un inhibidor de la PKA, fue capaz de revertir el efecto inhibitorio de la AM sobre la actividad de las enzimas antioxidantes sin afectar la acción de la ANG II, lo que apoya la posibilidad de que el efecto de la AM es mediado a través de la vía de PKA, tal y como lo han reportado otros estudios en otros tejidos3,45,54.
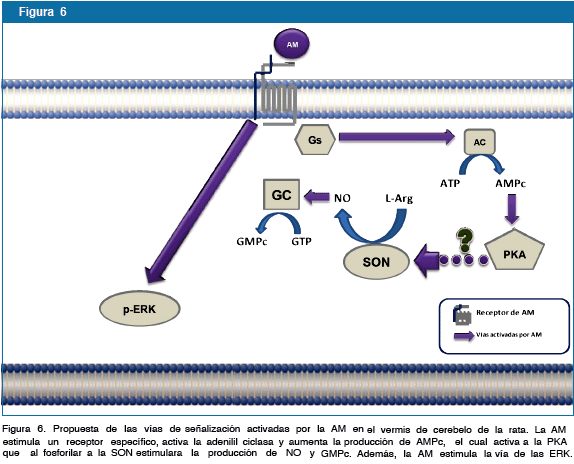
En resumen, los resultados presentados en este estudio se demuestra que la AM es capaz de activar las ERK1/2, incrementar la producción de AMPc el cual probablemente a través de la PKA estimularía la vía SON/ NO/GMPc en el vermis de cerebelo de la rata (Fig. 5). Estos hallazgos apoyan la existencia de un sistema adrenomedulinérgico cerebelar de importancia fisiológica.
Agradecimientos
Los autores agradecen al Sr. Banny Caraballo por su ayuda técnica en los experimentos. Este trabajo fue subvencionado por el Ministerio Popular de Ciencia Tecnología e Industrias, Proyecto Misión Ciencia, Sub-proyecto 7, ECCV No. 2007001585.
Lista de abreviaturas
Ácido desoxirribonucleico (ADN)
Adenilil ciclasa (AC)
Adenosina monofosfato cíclico (AMPc)
Adrenomedulina (AM)
Buffer Krebs-Ringer (KBR)
Error estándar de la media (E.E.M.)
Fosfatidil inositol 3 quinasa (PIK3)
Fosfolipasa C (PLC)
Guanilil ciclasa (GC)
Guanosina monofosfato cíclico (GMPc)
Inositol 1,4,5 - trifosfato (IP3)
Monofosfato de inositol (InsP1)
Núcleo del tracto solitario (NTS)
Núcleo paraventricular (NPV)
Núcleo supraóptico (NSO)
Óxido nítrico (NO)
Proteína G estimulatoria (Gs)
Proteína que modifica la actividad del receptor tipo 1 (RAMP1)
Proteína quinasa activada por mitógenos (MAPK)
Proteína quinasa C (PKC)
Proteína quinasa c-Jun NH2 terminal (JNK)
Proteína tirosina quinasa (PTK)
Quinasa regulada por señales extracelulares (ERK)
Receptor de AM tipo 1 (AM1)
Receptor de AM tipo 2 (AM2).
Receptor del péptido relacionado al gen de la calcitonina tipo 1 (CGRP1)
Receptor similar al receptor de calcitonina (CRLR)
Región ventrolateral rostral del bulbo raquídeo (RVLM)
Sintasa de óxido nítrico (SON)
Sistema nervioso central (SNC)
Referencias
1. Beltowski, J., Jamroz, A. Adrenomedullin – What do we know 10 years since its discovery? Pol. J. Pharmacol., 56: 5 – 27, 2004. [ Links ]
2. Cases, A., Mora-Macía, J. Adrenomedulina: un Nuevo péptido vasoactivo. Nefrología, XXI (1): 16 – 25, 2001. [ Links ]
3. Chini, E.N., Chini, C.C., Bolliger, C. Cytoprotective effects of adrenomedullin in glomerular cell injury: central role of cAMP signaling pathway. Kidney Int., 52: 917–925, 1997. [ Links ]
4. de Vente, J., Hopkins, D., Markerink-van, M., Emson, P., Schmidt, H., Steinbusch, H. Distribution of nitric oxide synthase and nitric oxide-receptive, cyclic GMP producing structures in the rat brain. Neuroscience, 87 (1): 207 – 241, 1998. [ Links ]
5. Ferrendelli, J.A. Distribution and regulation of cyclic GMP in the central nervous system. Adv. Cyclic. Nucleotide Res., 9: 453-464, 1978. [ Links ]
6. Gibbons, C., Dackor, R., Dunworth, W., Fritz-Six, K., Caron, K. Receptor Activity – modifying proteins: RAMPing up Adrenomedullin signaling. Mol. Endocrinol., 21(4): 783-796, 2007. [ Links ]
7. Green, L., Wagner, A., Glogowski, J., Skipper, P., Whisnok, J., Tannenbaum, S. Analysis of Nitrate, Nitrite and Nitrate in Biological Fluids. Anal. Biochem., 126:131-138, 1982. [ Links ]
8. Hilariret, S., Belanger, C., Bertrand, J., Laperriere, A., Food, S.M., Bouvier, M. Agonist – promoted internalization of a ternary complex between calcitonin receptor – like receptor, receptor activity – modifying protein 1 (RAMP1), and β-arrestin. J. Biol. Chem., 276: 29575-29581, 2001. [ Links ]
9. Hinson, J., Kapas, S., Smith, D. Adrenomedullin, a multifunctional regulatory peptide. Endocr. Rev., 21 (2): 138 – 167, 2000. [ Links ]
10. Ichiki, Y., Kitamura, K., Kangawa, K., Kawamoto, M., Matsuo, H., Eto, T. Distribution and characterization of inmunoreactive adrenomedullin in human tissue and plasma. FEBS Lett., 338: 6 – 10, 1994. [ Links ]
11. Israel, A., Strömberg, C., Tsutsumi, K., Garrido, M., Torres, M., Saavedra, J. Angiotensin II receptor subtypes and phosphoinositide hydrolysis in rat adrenal medulla. Brain Res. Bull., 38 (5): 441 – 446, 1995. [ Links ]
12. Iwasaki, H,, Eguchi, S., Shichiri, M., Marumo, F., Hirata, Y. Adrenomedullin as a novel growth-promoting factor for cultured vascular smooth muscle cells: role of tyrosine kinase-mediated mitogen-activated protein kinase activation. Endocrinology, 139 (8): 3432-3441, 1998. [ Links ]
13. Iwasaki, H., Shichiri, M., Marumo, F., Hirata, Y. Adrenomedullin stimulates proline-rich tyrosine kinase 2 in vascular smooth muscle cells. Endocrinology, 142 (2): 564-572, 2001. [ Links ]
14. Ji, S., Wang, Z., Li, X., He, R. Intracerebroventricular administration of adrenomedullin increases the expression of c-fos and activates nitric oxide – producing neurons in rat cardiovascular related brain nuclei. Acta Physiol. Sin., 56 (3): 328 – 334, 2004. [ Links ]
15. Ji, S., Xue, J., Wang, C., Su, S., He, R. Adrenomedullin reduces intracellular calcium concentration in cultured hippocampal neurons. Acta Physiol. Sin., 57 (3): 340 – 345, 2005. [ Links ]
16. Juaneda, C., Dumont, Y., Chabot, J., Fournier, A., Quirion, R. Adrenomedullin receptor binding sites in rat brain and peripheral tissues. Eur. J. Pharmacol., 474: 165 – 174, 2003. [ Links ]
17. Kapas, S., Brown, D., Farthing, P., Hagi-Pavli, E. Adrenomedullin has mitogenic e¡ects on human oral keratinocytes: involvement of cyclic AMP. FEBS Letters, 418: 287- 290, 1997. [ Links ]
18. Kato, K., Yin, H., Agata, J., Yoshida, H., Chao, L., Chao, J. Adrenomedullin gene delivery attenuates myocardial infarction and apoptosis after ischemia and reperfusion. Am. J. Physiol. Hear. Circ. Physiol., 285: H1506– H1514, 2003. [ Links ]
19. Kitamura, KA., Kangawa, K., Kawamoto, M., Ichiki, Y., Nakamura, S., Matsuo, H., Eto, T. Adrenomedullin: a novel hypotensive peptide isolated from human pheochromocytoma. Biochem. Biophys. Res. Commum., 192: 553 – 560, 1993. [ Links ]
20. Kitamura, KB., Sakata, J., Kangawa, K., Kojima, M., Matsuo, H., Eto, T. Cloning and characterization of cDNA encoding a precursor for human adrenomedullin. Biochem. Biophys. Res. Commun., 194:720–725, 1993. [ Links ]
21. Krukoff, T.L. Central actions of nitric oxide in regulation of autonomic functions. Brain Res. Rev., 30: 52-65, 1999. [ Links ]
22. Kurino, M., Fukunaga, K., Ushio, Y., Miyamoto, E. Activation of mitogen-activated protein kinase in cultured rat hippocampal neurons by stimulation of glutamate receptors. J. Neurochem., 65:1282– 1289, 1995. [ Links ]
23. Kuwasako, K., Cao, Y.N., Nagoshi, Y., Kitamura, K., Eto, T. Adrenomedullin receptors: pharmacological features and possible pathophysiological roles. Peptides, 25: 2003-2012, 2004. [ Links ]
24. Latinen, J., Torda, T., Saavedra, J. Cholinergic stimulation of phosphoinositide hydrolysis in the rat pineal gland. Eur. J. Pharmacol., 161: 237 – 240, 1989. [ Links ]
25. Lohmann, S., Walter, U., Miller, P., Greengard, P., De Camilli, P. Immunohistochemical localization of cyclic GMP-dependent protein kinase in mammalian brain. Proc. Natl. Acad. Sci. USA., 78(1): 653–657, 1981. [ Links ]
26. Lowry, O., Rosebrough, N., Farr, A., Randall, R. Protein measurement with the Folin phenol reagent. J. Biol. Chem., 193: 265-275, 1951. [ Links ]
27. Macchi, V., Porzionato, A., Belloni, A., Stecco, C., Parenti, A., De Caro, R. Immunohistochemical mapping of adrenomedullin in the human medulla oblongata. Peptides, 27: 1397 – 1404, 2006. [ Links ]
28. Mathison, Y., Israel, A. Señalización de la adrenomedulina en la eminenca media de la rata. Arch. Venez. Farmacol. Ter., 25 (2): 45 – 53, 2006. [ Links ]
29. Moncada, S., Higgs, A. The L-arginine-nitric oxide pathway. N. Engl. J. Med., 329 (27): 2002-2012, 1993. [ Links ]
30. Nagata, N., Kato, J., Kitamura, K., Kawamoto, M., Tanaka, N., Eto, T., Takasaki, M. Dissociation of adrenomedullin concentrations in plasma and cerebrospinal fluid in pregnant and non – pregnant women. Eur. J. Endocrinol., 139: 611 – 614, 1998. [ Links ]
31. Nakane, M., Ichikawa, M., Deguchi, T. Light and electron microscopic demonstration of guanylate cyclase in rat brain. Brain Res., 273 (1): 9-15, 1983. [ Links ]
32. NIH Guide for the care and use of animals. 1996. Institute of Laboratory Animal Resources. National Research Council. National Academy Press, Washington DC, USA. [ Links ]
33. Oliver, K., Wainwright, A., Edvinsson, L., Pickard, J., Hill, R. Immunohistochemical localization of calcitonin receptor like receptor and receptor activity – modifying proteins in the human cerebral vasculature. J. Cereb. Blood Flow Metab., 22: 620 – 629, 2002. [ Links ]
34. Otani, N., Nawashiro, H., Fukui, S., Nomura, N., Yano, A., Miyazawa, T., Shima, K. Differential activation of mitogen-activated protein kinase pathways after traumatic brain injury in the rat hippocampus. J.Cereb. Blood Flow Metab., 22: 327–334, 2002. [ Links ]
35. Pastorello, M., Díaz, E., Csibi, A., Garrido, M., Chabot, J., Quirion, R., Israel, A. Papel de la adrenomedulina cerebelosa en la hipertensión arterial. Arch. Ven. Farmacol. Ter., 26 (2): 98 – 104, 2007. [ Links ]
36. Rodrigo, J., Springall, D.R., Uttenthal, O., Bentura, M.L., Abadia- Molina, F., Riveros-Moreno, V., Martínez-Murillo, R., Polak, J.M., Moncada, S. Localization of nitric oxide synthase in the adult rat brain. Philos. Trans. R. Soc. Lond. B. Biol. Sci., 345 (1312): 175-221, 1994. [ Links ]
37. Sakai, K., Saito, K., Ishizuka, N. Adrenomedullin synergistically interacts with endogenous vasodilators in rats: a possible role of K(ATP) channels. Eur. J. Pharmacol., 359:151–159, 1998. [ Links ]
38. Sakata, J., Shimokubo, T., Kitamura, K., Nishizono, M., Iehiki, Y., Kangawa, K., Matsuo, H., Eto, T. Distribution and characterization of immunoreactive rat adrenomedullin in tissue and plasma. FEBS Letters., 352: 105 – 108, 1994. [ Links ]
39. Serino, R., Ueta, Y., Hara, Y., Nomura, M., Yamamoto, Y., Shibuya, I., Hattori, Y., Kitamura, K., Kangawa, K., Russell, J., Yamashita, H. Centrally administered adrenomedullin increases plasma oxytocin level with induction of c-fos messenger ribonucleic acid in the paraventricular and supraoptic nuclei of the rat. Endocrinology, 140: 2334 – 2342, 1999. [ Links ]
40. Serrano, J., Uttenthal, O., Martínez, A., Fernández, P., Martínez, J., Alonso, D., Bentura, M., Santacana, M., Gallardo, J, Martínez, R., Cutitta, F., Rodrigo, J. Distribution of adrenomedullin – like inmunoreactivity in the rat central nervous system by light and electron microscopy. Brain Res., 853: 245 – 268, 2000. [ Links ]
41. Seyedabadi, M., Goodchild, A., Pilowsky, P. Differential role of kinases in brain stem oh hypertensive and normotensive rats. Hypertension, 38: 1087 – 1092, 2001. [ Links ]
42. Shan, J., Krukoff, T. Distribution of preproadrenomedullin mRNA in the rat central nervous system and its modulation by physiological stressors. J. Comp. Neurol., 432: 88 – 100, 2001. [ Links ]
43. Shichiri, M., Hirata, Y. Regulation of cell growth and apoptosis by adrenomedullin. Hypertens. Res., 26: S9-14, 2003. [ Links ]
44. Shimekake, Y., Nagata, K., Ohta, S., Kambayashi, Y., Teraoka, H., Kitamura, K., Eto, T., Kangawa, K., Matsuo, H. Adrenomedullin stimulates two signal transduction pathways, cAMP accumulation and Ca(2+) mobilization, in bovine aortic endothelial cells. J. Biol. Chem., 270: 4412-4417, 1995. [ Links ]
45. Shimosawa, T., Shibagaki, Y., Ishibashi, K., Kitamura, K., Kangawa, K., Kato, S., Ando, K., Fujita, T. Adrenomedullin, an endogenous peptide, counteracts cardiovascular damage. Circulation, 105: 106-111, 2002. [ Links ]
46. Steiner, A., Parker, C., Kipnis, D. Radioimmunoassay for cyclic nucleotides. J. Biol. Chem., 247: 1106 – 1113, 1972. [ Links ]
47. Uezono, Y., Nakamura, E., Ueda, Y., Shibuya, I., Ueta, Y., Yokoo, H., Yanagita, T., Oyohira, Y., Kobayashi, H., Yanagihara, N., Wada, A. Production of cAMP by adrenomedullin in human oligodendroglial cell line KG1C: Comparison with calcitonin gene – related peptide and amylin. Brain Res. Mol., 97: 59 – 69, 2001. [ Links ]
48. Uezono, Y., Shibuya, I., Ueda, Y., Tanaka, K., Oishi, Y., Yanagihara, N., Ueno, S., Toyohira, Y., Nakamura, T., Yamashita, H., Izumi, F. Adrenomedullin increases intracellular Ca+2 and inositol 1,4,5 – triphosphate in human oligodendroglial cell line KG-1C. Brain Res., 786: 230 – 234, 1998. [ Links ]
49. Vanhoose, A., Emery, M., Jimenez, L., Winder, D. ERK Activation by G-protein-coupled receptors in mouse brain is receptor identity-specific. J. Biol. Chem., 277 (11): 9049–9053, 2002. [ Links ]
50. Wehlage, S., Smith, F. Nitric oxide and angiotensin II regulate cardiovascular homeostasis and the arterial baroreflex control of heart rate in conscious lambs. J. Renin Angiotensin Aldosterone Syst., 13 (1): 99–106, 2002. [ Links ]
51. Withers, D., Coppock, H., Seufferlein, T., Smith, D., Bloom, S., Rozengurt, E. Adrenomedullin stimulates DNA synthesis and cell proliferation via elevation of cAMP in Swiss 3T3 cells. FEBS Letters, 378:83 – 87, 1996. [ Links ]
52. Wong, P., Cheung, T., Cheung, B. Adrenomedullin and cardiovascular diseases. J. R. Soc. Med. Cardiovasc. Dis., 1: 14 – 20. [ Links ]
53. Xu, Y., Krukoff, T. Adrenomedullin stimulates nitric oxide release from SK-N-SH human neuroblastoma cells by modulating intracellular calcium mobilization. Endocrinology, 146:2295–2305, 2005. [ Links ]
54. Yoshimoto, T., Fukai, N., Sato, R., Sugiyama, T., Ozawa, N., Shichiri, M., Hirata, Y. Antioxidant effect of adrenomedullin on angiotensin II-Induced reactive oxygen species generation in vascular smooth muscle cells. Endocrinology, 145 (7): 3331-3337, 2004. [ Links ]
55. Zsarnovszky, A., Belcher, S. Spatial, temporal, and cellular distribution of the activated extracellular signal regulated kinases 1 and 2 in the developing and mature rat cerebellum. Brain Res. Dev. Brain Res., 150: 199 – 209, 2004. [ Links ]