Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT vol.34 no.4 Caracas dic. 2015
Análisis funcional de la actividad anti-tripanosoma de compuestos seleccionados
Functional analysis of trypanocidal effect of selected compounds
A. Ponte-Sucre
A. Ponte-Sucre: Laboratorio de Fisiología Molecular, Instituto de Medicina Experimental, Escuela de Medicina Luis Razetti, Facultad de Medicina. Universidad Central de Venezuela, Caracas, Venezuela, e-mail: aiponte@gmail.com
Resumen
La tripanosomiasis africana humana es una enfermedad transmitida por vectores, fatal si no se trata. La incidencia anual de pacientes solía ser muy alta, pero se ha reducido a menos de 10.000 por año. Esta declaración se esgrime para afirmar que no es necesario invertir en el desarrollo de nuevos fármacos contra la enfermedad del sueño. Sin embargo, la misma puede reaparecer, como en el pasado, cada vez más agresiva. Muy pocos compuestos están siendo analizados en entornos clínicos y la tasa de supervivencia de las moléculas es extremadamente baja; ninguno de los candidatos se encuentra en fase tres de evaluación clínica. En el marco de un proyecto multicéntrico, liderado por los Profesores Ulrike Holzgrabe y Gerhard Bringmann de la Universidad de Würzburg en Alemania, evaluamos previamente los cambios morfológicos y ultraestructurales producidos por compuestos líder sintetizados miembros de las familias estudiadas sobre Trypanosoma brucei. Los datos sugieren que las moléculas estudiadas podrían afectar el retículo endoplasmático (la bisnaftilamida biscuaternaria, 37) y la mitocondria y el cinetoplasto (la sal de N-Arylpyridinium, 88). En este trabajo determinamos si los compuestos 37 y 88 son parasitostáticos o parasiticidas, si actúan de forma sinérgica con las drogas clásicas y si afectan el estado metabólico de la célula. Nuestros resultados sugieren que 37 es parasiticida y 88 parasitostático, que ambos compuestos son sinérgicos con pentamidina y que 37 es sinérgico con eflornitina, y al igual que pentamidina y eflornitina, no altera la relación ADP / ATP o los niveles de glucosa del parásito, sugiriendo que su efecto no está asociado a la alteración del estado metabólico celular.
Palabras clave: Trypanosoma brucei, enfermedad del sueño, bisnaftilamida biscuaternaria, sal de N-Arylpyridinium, efecto metabólico, sinergismo.
Abstract
Human African Trypanosomiasis is a vector-borne disease, fatal if left untreated. The annual incidence of patients used to be outrageous, but it has dropped to less than 10,000 per year. This statement has been used to assert that it is not necessary to invest in the development of new drugs against sleeping sickness. However, the disease may return, increasingly aggressive. Only a small number of compounds are being analyzed in clinical settings and the survival rate of candidates is normally low; none of the candidates is actually in phase three evaluation.
Previously we assessed the morphological and ultrastructural changes produced by members of families of compounds synthesized within the frame of our university consortium multicenter project, led by Professor Ulrike Holzgrabe and Gerhard Bringmann, University of Würzburg, Germany on Trypanosoma brucei. The data suggested that the endoplasmic reticulum membrane systems (for the bisquaternary bisnaphthalimide 37) and the mitochondria and kinetoplast (for the N-Arylpyridinium salt 88) might be the potential organelles targeted. Herein we have determined whether these compounds are parasitostatic or parasitocydal, act synergistically with classical trypanocydal drugs and if they affect the metabolic status of the cell. Our results suggest that 37 seems to be parasitocidal while 88 seems to be parasitostatic, but that both compounds exert a synergistic effect with pentamidine, and 37 eflornithine. We further determined 37 and 88 did not alter the parasite ADP/ATP ratio or the parasite glucose levels thus indicating that they do not alter the metabolic status of the parasite.
Key words: Trypanosoma brucei, sleeping sickness, bisquaternary bisnaphthalimide, N-Arylpyridinium salt, metabolic effect, synergism.
Introducción
Unos pocos organismos son responsables de las principales enfermedades parasitarias del siglo XX y XXI. De hecho, la incidencia y el número de personas afectadas, y la desolación que estos organismos causan a los pacientes es enorme. Estos patógenos producen un ingente número de víctimas; sobre todo, pero no exclusivamente en los países en desarrollo. Entre estos organismos podemos mencionar los tripanosomas que causan la tripanosomiasis africana humana (HAT)1.
Esta es una enfermedad transmitida por vectores, fatal si no se trata. Su incidencia anual solía ser muy alta. Sin embargo, recientemente se ha reducido a menos de 10.000 casos por año2. Este hecho se esgrime para destacar que no es necesario invertir en el desarrollo de nuevos fármacos contra la enfermedad del sueño3. Sin embargo, la misma puede resurgir como lo ha hecho en el pasado, y podría volver de una forma más agresiva. Muy pocos fármacos están siendo analizados clínicamente en diversas asociaciones sin fines de lucro, así como por la denominada Iniciativa Medicamentos para Enfermedades Olvidadas (DNDi por sus siglas en inglés)4. Sin embargo, la tasa de supervivencia de los candidatos es extremadamente baja, y ninguno de los compuestos analizados se encuentra en la tercera fase de evaluación clínica5.
Basados en el hecho de que la potencia de un compuesto (que se refleja en su IC50), no necesariamente se traduce en el mejor fármaco a nivel de mercado y de que, además de la actividad que las moléculas deben tener en contra de un organismo seleccionado, sus propiedades de absorción, distribución, metabolismo y excreción (ADME) son esenciales para la selección de candidatos para estudios con animales y preclínicos6, en un trabajo anterior, y con el objetivo de perfeccionar la selección de los candidatos a estudios preclínicos, analizamos la correlación entre la actividad anti-tripanosoma de moléculas de diferentes clases estructurales con los parámetros físico-químicos de los compuestos, para delinear la relación entre la estructura química y sus funciones biológicas7. Los datos sugieren que los índices de eficiencia de ligando pueden ser útiles para comprender la relación entre la potencia y las características químicas de los compuestos. En esa oportunidad describimos una buena correlación entre los parámetros físico-químicos de los compuestos seleccionados y los de moléculas comerciales cuyas dianas son organelos específicos. Estos resultados sugieren que nuestra aproximación podría ser útil para impulsar el diseño de compuestos con buenas actividades y propiedades farmacocinéticas aceptables para todas las familias de compuestos7.
En este trabajo y a fin de profundizar en el análisis de la potencia de los compuestos líder hemos evaluado varias propiedades funcionales relacionadas con su acción sobre los parásitos. De hecho, analizamos si los mismos ejercen una función parasitostática o parasiticida, si actúan sinérgicamente con fármacos clásicos, y si afectan el estado metabólico de la célula. Nuestros resultados sugieren que los mejores candidatos 37 y 88, son, parasiticida el primero y parasitostático el segundo. Sólo 37 es sinérgico con eflornitina, ambos con pentamidina. Finalmente, 37, al igual que pentamidina o eflornitina, no altera la relación ADP / ATP del parásito o sus niveles de glucosa. Estos resultados indican que su efecto no está relacionado con la alteración del metabolismo celular.
Materiales y métodos
La descripción de los compuestos usados está resumida en un trabajo previo7. Ellos pueden ser definidos como una bisnaftilamida biscuaternaria (37) y una sal de N-Arylpyridinium (88).
Para evaluar la actividad tripanocida de los compuestos, se cultivaron formas sanguíneas monomórficas de Trypanosoma (T.) brucei (TC-221) en medio Baltz, a 37°C, 5% de CO2. El medio se suplementó con 16,7 % de suero fetal bovino inactivado por calor, 16 U ml-1 de penicilina, 16 mg ml-1 de estreptomicina y 0,0001% β-mercaptoetanol. La actividad de los compuestos se determinó mediante el ensayo de Azul de Alamar®. Brevemente, se incubó un número apropiado de tripanosomas (105 células ml-1) en placas de 96 pozos, con concentraciones crecientes de los compuestos en un volumen final de 200 ml. Después de 24 h de incubación a 37°C, 5% CO2, se añadieron 20 ml de Azul de Alamar a cada pozo; seguidamente las placas se incubaron en las mismas condiciones por 48 h y 72 h. Las placas se leyeron en un lector de ELISA (Oasys Expert 96) a una longitud de onda de 550 nm y una longitud de onda de referencia de 630 nm. La absorbancia registrada en los pozos incubados en ausencia de los compuestos determinó el 100% de crecimiento. La absorbancia resultante en cada uno de los otros pozos reflejó el crecimiento celular y su inhibición por los compuestos. Los valores de IC50 se calcularon por interpolación lineal8,9.
Para determinar la actividad parasitostática o parasiticida de los compuestos se realizó el ensayo de susceptibilidad de Azul de Alamar. Seguidamente se recogieron las células de los pozos más cercanos a las concentraciones correspondientes al IC10, IC50 e IC90 de cada compuesto. Las células se lavaron dos veces con PBS y se sembraron de nuevo en las mismas condiciones, pero sin fármacos; se incubaron durante 48 h, recibieron 20 ml de Azul de Alamar y se incubaron durante 48 h adicionales para determinar su crecimiento adicional.
Para determinar la actividad sinérgica de 37 y 88 se realizaron en paralelo curvas de susceptibilidad con Azul de Alamar para cada compuesto solo y para cada compuesto en presencia de concentraciones IC50 de pentamidina y eflornitina. Con este ensayo definimos el desplazamiento del IC50 de pentamidina y eflornitina hacia concentraciones superiores o inferiores por la acción de los compuestos utilizados.
Para determinar las posibles dianas intracelulares de 37 y 88 las células se incubaron como normalmente para los ensayos de Azul de Alamar a concentraciones de IC50 de los respectivos compuestos durante 24 h. Al finalizar la incubación las células se suspendieron a una densidad de 2.5 106 ml-1 y se incubaron con los siguientes indicadores: a. en 4 μg ml-1 Hoechst en PBS durante 5 min a temperatura ambiente para marcar el núcleo. b. en 2,5 mM MitoTracker Red durante 30 min a 37°C, 5% de CO2 para marcar la mitocondria. c. en 10 mM Lysotracker, durante 1 h a 37°C, 5% CO2, para marcar los compartimientos ácidos. d. en 10 mM Fm 464 durante 10 min a 4°C, para marcar el sistema de retículo endoplásmico.
Posteriormente las células se centrifugaron a 700 x g durante 5 min, se lavaron con PBS y se suspendieron en 200 ml de buffer para ser analizados por citometría de flujo.
Para determinar el efecto de 37 y 88 sobre el metabolismo celular los tripanosomas fueron sembrados en placas de 96 pozos en 200 ml de medio a densidades iniciales de 104 células ml-1. Las células se incubaron durante 24 h a 37°C, 5% CO2 solas o en presencia de DMSO (<1%), florizidina (Sigma 274313-1G, 100 mM), DOG (Sigma D6134-1G, 5 mM), pentamidina (Aventis, IC50), o a la IC50 de 37 y 88. Posteriormente las células se centrifugaron a 700 x g durante 5 min, se lavaron con PBS y suspendieron hasta una densidad de 1x105 células ml-1. La relación ADP / ATP y el contenido de glucosa (Sigma MAK135 ADP / ATP Ratio Kit de ensayo, Kit de ensayo de Sigma GAHK20 glucosa (HK)) se determinaron utilizando un luminómetro, a 1 s de tiempo de detección.
La relación ADP / ATP se calculó por la siguiente razón: RLUA1 - luminiscencia de ATP; RLUB – luminiscencia de ATP residual después de 10 min; RLUC - luminiscencia después de la conversión enzimática de ADP en ATP; ADP / ATP = (RLUC1-RLUB1) / RLUA1), siendo RLU la luminiscencia detectada en los canales A, B o C. Los niveles de glucosa se ensayaron en el sobrenadante de cada condición a través del ensayo de reducción de la hexoquinasa10.
Los experimentos se realizaron al menos dos veces por cuadruplicado y el análisis estadístico se llevó a cabo utilizando el software Graph Pad Prism, versión 6.
Resultados
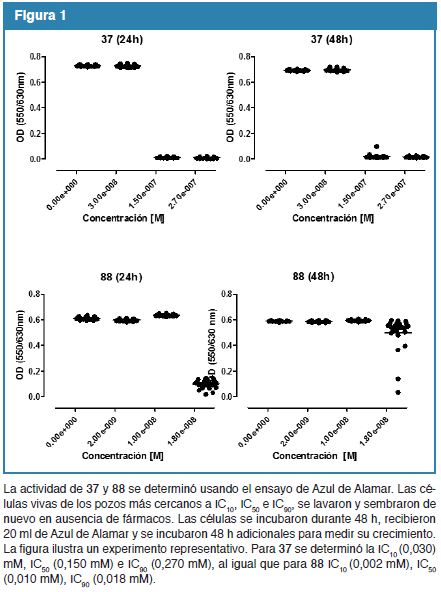
La susceptibilidad de los parásitos a los compuestos se determinó mediante el ensayo de Azul de Alamar. Seguidamente, se recogieron las células viables presentes en los pozos más cercanos a las concentraciones IC10, IC50 e IC90 para cada compuesto. Los parásitos se lavaron y sembraron de nuevo en las mismas condiciones, pero sin drogas. Las células se incubaron durante 48 h a 37°C y 5% CO2 y de nuevo se determinó su crecimiento mediante el ensayo de Azul de Alamar. Los resultados obtenidos se representan en la Fig. 1. Las células expuestas a concentraciones IC50 e IC90 de 37 no reanudan su crecimiento, incluso 48 h después de ser incubadas solas, sugiriendo que 37 podría ser parasiticida. Por el contrario, 88 presenta características de parasitostático; las células supervivientes recogidas de los pozos incubados incluso a IC90, reanudan su crecimiento al cabo de 48 h de ser incubadas solas.
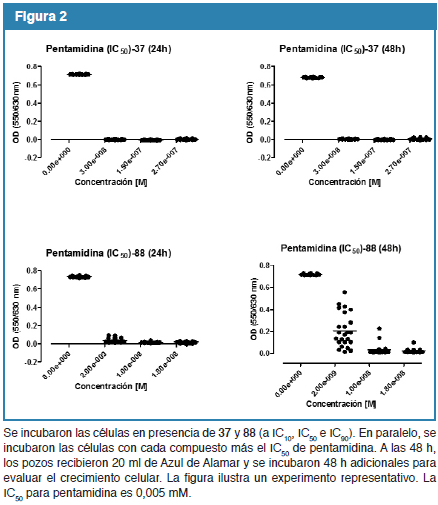
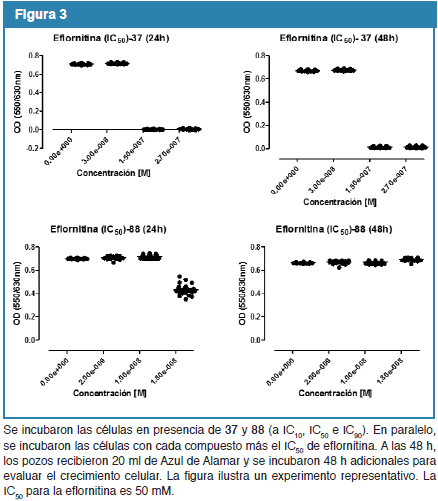
Con base a los resultados anteriores evaluamos el potencial efecto sinérgico de los compuestos con las drogas clásicas pentamidina y eflornitina. Para ello se incubaron los parásitos con 37 y 88 (a concentraciones de IC10, IC50 e IC90) solos, y para cada molécula en presencia de pentamidina (IC50, Fig. 2), o eflonitina (IC50, Fig. 3). El efecto sinérgico se demostró claramente para pentaminina y 37, ya que incluso cuando 37 se utilizó a concentraciones de IC10 en conjunto con pentamidina (IC50), las células no reanudaron su crecimiento a las 24 y 48 h de comenzado el experimento. Resultados similares se obtuvieron al utilizar 88 en conjunto con pentamidina (IC50) en las mediciones realizadas a las 24 h. Sin embargo, después de 48 h las células incubadas con pentamidina a su IC50, y 88 a su IC10, reanudaron el crecimiento hasta en un 30% del control sin droga. El efecto sinérgico también se demostró para eflornitina y 37 a las 24 y 48 h, al utilizar 37 a concentraciones de IC50. Este no fue el caso para el 88 y eflornitina (IC50), ya que incluso cuando 88 se utilizó a concentraciones IC90 las células continuaron su crecimiento.
Estudios anteriores sugieren del retículo endoplasmático es la diana celular para la bisnaftilamida bicuaternaria (37) y la mitocondria y el cinetoplasto lo son para la sal de N-Arylpyridinium (88). Para confirmar esta aseveración, utilizamos la citometría de flujo para determinar cambios en el marcaje de organelos como el núcleo, los compartimientos ácidos, la mitocondria y el cinteoplasto, y el sistema retículo endotelial en parásitos tratados con pentamidina y eflornitina, así como con 37 y 88. Los resultados sugieren que sólo se evidencia una disminución en el marcaje con Mitotracker (no significativo) en todas las condiciones, en comparación con los parásitos no tratados. Estos resultados indican que en las condiciones ensayadas este método no permite identificar de forma específica las dianas intracelulares ya que los marcajes no distinguen el efecto de los compuestos con los que trabajamos con respecto a los controles positivos (datos no mostrados).
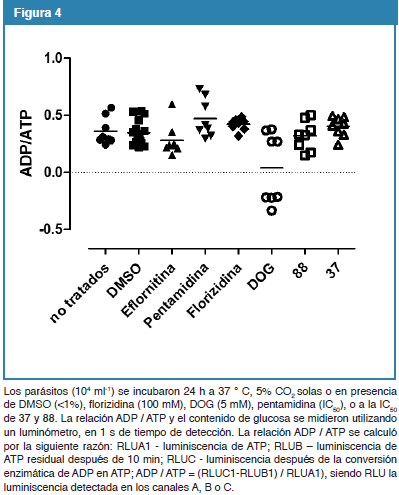
Finalmente, y a fin de evaluar si 37 y 88 alteran el metabolismo del parásito determinamos la relación ADP / ATP y los niveles de glucosa en parásitos tratados y no tratados durante 24 h con los compuestos, comparado con el efecto ejercido por las drogas clásicas pentamidina y eflornitina. La DOG (control positivo) disminuye significativamente la relación ADP/ATP de las células tratadas luego de 24 h de incubación (Fig. 4). Sin embargo, ni las drogas clásicas ni los compuestos experimentales utilizados reproducen este efecto. De igual forma, aunque la DOG, disminuye los niveles de glucosa, las drogas clásicas y los compuestos experimentales no afectan este parámetro (datos no mostrados). Estos resultados sugieren que 37 y 88 no afectan el metabolismo celular, al menos a las primeras 24 h de tratamiento.
Discusión
En este estudio profundizamos el análisis de dos compuestos líder sintetizados en el marco del consorcio liderado por los profesores Gerhard Bringmann y Ulrike Holzgrabe en la Universidad de Würzburg. Nuestro interés fue determinar si los mismos cumplen con propiedades que aumenten la probabilidad de su inclusión en ensayos con animales, preclínicos y clínicos. Específicamente evaluamos si la bisnaftilamida biscuaternaria (37) y la sal de N-Arylpyridinium (88) son parasitostáticos o parasiticidas, si actúan de forma sinérgica con las drogas clásicas pentamidina y eflornitina y si afectan el estado metabólico celular.
Nuestros resultados sugieren que 37 es parasiticida y 88 parasitostático, que ambos compuestos actúan de forma sinérgica con pentamidina y que 37 ejerce un efecto sinérgico con eflornitina; finalmente describimos que 37 y 88 no alteran la relación celular ADP / ATP o los niveles de glucosa del parásito, lo cual sugiere que su efecto no está asociado a la alteración del estado metabólico del parásito.
El ensayo de la resazurina proporciona una fotografía puntual de la susceptibilidad de los parásitos a diversos compuestos8. Aunque este ensayo permite calcular valores de IC50 reproducibles, no otorga información sobre cómo es la acción de los mismos. Nuestros resultados sugieren que 37 es parasiticida, es decir, es capaz de destruir los parásitos. Por otra parte, los ensayos sugieren que 88 es parasitostático, es decir, es capaz de detener el crecimiento de los parásitos durante el tiempo en el cual el compuesto está presente en el cultivo.
Al evaluar el potencial efecto sinérgico de los compuestos con las drogas clásicas pentamidina y eflornitina encontramos que este se evidencia al utilizar pentaminina y 37 (incluso a concentraciones IC10) y pentamidina y 88 (utilizado a concentraciones IC50, a las 24 h). El efecto sinérgico de pentamidina y 88 (a concentraciones IC50) se revierte a las 48 h; en estas condiciones las células reanudan su crecimiento hasta en un 30% del control no tratado.
El efecto sinérgico también se demostró para eflornitina y 37 (utilizado a concentraciones IC50) mas no para eflornitina y 88 (utilizado a concentraciones IC90). Estos resultados sugieren que el uso combinado de 37 y las drogas clásicas pentamidina y eflornitina podría ser beneficioso y confirman el efecto parasitostático de 88.
La pentamidina es una droga cuya diana es la mitocondria. Esta droga es efectiva incluso en las formas sanguíneas de T. brucei que no expresan una cadena respiratoria completamente funcional11. Por su parte, la eflornitina, un análogo de aminoácidos, inhibe a la ornitina decarboxilasa durante la síntesis de las poliaminas12. Estudios anteriores realizados en el marco del consorcio mencionado sugieren que la diana celular para 37 es el retículo endoplasmático, mientras la mitocondria y el cinetoplasto lo son para 88. Nuestros resultados de citometría de flujo sugieren que en los parásitos tratados con pentamidina y eflornitina, al igual que con 37 y 88 se evidencia una disminución (no significativa) en el marcaje con Mitotracker, con respecto a los parásitos no tratados. Esto no ocurre con el resto de los marcadores utilizados, específicos para compartimientos açídicos, el núcleo y el sistema retículo endotelial. Los resultados globales sugieren que en las condiciones ensayadas la citometría de flujo no parece ser un método idóneo para la identificación específica de las dianas celulares de estos compuestos. Podríamos especular que debido a que los cultivos de tripanosomas son asincrónicos, aunque sean monomórficos como es el caso que nos ocupa13, no hay una reproducción simultánea de todos los miembros de la población. La variabilidad en los estadios de crecimiento podría entonces estar enmascarando el efecto específico de los compuestos sobre los organelos diana, debido a que la población de células con la característica morfológica específica debería ser muy pequeña.
La glucosa es la fuente de energía preferencial de los tripanosomas. Estos son células que utilizan escasamente las mitocondrias para sintetizar ATP y el mecanismo preferencial de síntesis de esta fuente de energía depende de la glicólisis (en el citosol)14.
Los tripanosomas están entre el tipo de células en las que la glicólisis está activa, incluso en presencia de oxígeno. En otro tipo de células la presencia de oxígeno disminuye el flujo glucolítico y favorece la producción de ATP via la fosforilación oxidativa. Bajos niveles de oxígeno en los tripanosomas disminuyen el consumo de glucosa y altas concentraciones de oxígeno inducen la glicólisis, probablemente para inducir la proliferación. Es más, se postula que el ATP producido durante la glicolisis no se utiliza para el crecimiento del parásito; sin embargo, ya que mediante la glicólisis sólo se producen dos moléculas de ATP, estos parásitos deben mantener su relación ADP / ATP muy controlada15.
Por otra parte, las formas sanguíneas de tripanosoma no tienen una mitocondria normal sino una forma reducida de este organelo. No posee oxidasas de citocromo (pero si una oxidasa alternativa), el transporte de electrones no genera un potencial de membrana, y por lo tanto, no se utiliza para producir ATP mediante la fosforilación oxidativa. Al contrario, la ATPasa que normalmente sintetiza ATP en este compartimiento lo hidroliza con el fin de generar un potencial de membrana esencial para la importación de proteínas14.
Puesto que se ha demostrado que la inhibición del transporte de glucosa es parasiticida para T. brucei16 y para evidenciar si los compuestos 37 y 88 alteran el metabolismo parasitario y comprometen la relación celular ADP /ATP, evaluamos el efecto de ambos compuestos sobre este parámetro. Comparamos los efectos de 37 y 88 con florizidina, ya que el transporte de glucosa en las especies sanguíneas del parasito requiere iones sodio y el florizidin es un inhibidor de este tipo de transportadores en mamíferos17 y el desacoplante de la fosforilación oxidativa CCCP, puesto que se ha demostrado su efecto específico sobre los tripanosomas18.
Nuestros resultados sugieren que ni la relación ADP / ATP ni el consumo de glucosa se ven alterados por los compuestos 37 y 88 en estas condiciones, lo cual parecería evidenciar que estos compuestos no alteran el estado metabólico de la célula.
En conclusión, en este trabajo describimos que el compuesto líder (37) es parasiticida y el 88 es parasitostático. Que ambos compuestos potencian el efecto de pentamidina y 37 el de eflornitina y sugieren que su efecto no está relacionado con una alteración del metabolismo celular.
Estos resultados indican la ventaja que traería utilizar un compuesto como 37 para utilizarlo en combinación con pentamidina o eflornitina a fin de reducir los efectos adversos potenciales de estas drogas clásicas. Por otra parte sugieren que las propiedades parasitostáticas de 88, incluso a concentraciones cercanas al IC90 podrían ser explotadas para imitar el efecto de una vacunación con parasito inactivado. Esta acción inhabilitaría al parásito de continuar reproduciéndose por un tiempo, lo cual facilitaría la acción del sistema inmune.
Agradecimientos
A los miembros del consorcio SFB630 financiado por la Deutsche Forschung Gemainschaft, Alemania y a la Fundación Alejandro de Humboldt, Alemania por su apoyo financiero a APS. A Antje Fuß por su apoyo técnico en la realización de los experimentos.
Referencias
1. WHO. Research priorities for Chagas disease, human African trypanosomiasis and leishmaniasis. World Health Organ Tech Rep Ser. 2012; 975: 1–100. [ Links ]
2. Bisser S, Courtioux B. Sleeping sickness: end of the epidemic outbreak? Rev Neurol (Paris). 2012; 168: 230-8. [ Links ]
3. Stich A, Ponte-Sucre A, Holzgrabe U. Do we need new drugs against human African trypanosomiasis? Lancet Infect Dis. 2013; 13(9):733-4. [ Links ]
4. Burri C. Chemotherapy against human African trypanosomiasis: is there a road to success? Parasitology. 2010; 137(14):1987-94. [ Links ]
5. Barrett MP, Croft SL. Management of trypanosomiasis and leishmaniasis. Br Med Bull. 2012; 104:175-96. [ Links ]
6. Hou T, Wang J, Zhang W, Xu X. ADME evaluation in drug Discovery, 6. Can oral bioavailability in humans be effectively predicted by simple molecular property-based rules? J Chem Inf Model. 2007; 47:460–3. [ Links ]
7. Ponte-Sucre A, Bruhn H, Schirmeister T, Cecil A, Albert CR, Buechold C, Tischer M, Schlesinger S, Goebel T, Fuß A, Mathein D, Merget B, Sotriffer CA, Stich A, Krohne G, Engstler M, Bringmann G, Holzgrabe U. Anti-trypanosomal activities and structural chemical properties of selected compound classes. Parasitol Res. 2015; 114(2):501-12. [ Links ]
8. Mikus J, Steverding D. A simple colorimetric method to screen drug cytotoxicity against Leishmania using the dye Alamar Blue. Parasitol Int. 2000; 48(3):265-9. [ Links ]
9. Muth M, Hoerr V, Glaser M, Ponte-Sucre A, Moll H, Stich A, Holzgrabe U. Antitrypanosomal activity of quaternary naphthalimide derivatives. Bioorg Med Chem Lett. 2007; 17:1590–3. [ Links ]
10. Seyfang A, Duszenko M. Specificity of glucose transport in Trypanosoma brucei. Effective inhibition by phloretin and cytochalasin B. Eur J Biochem. 1991; 202(1):191-6. [ Links ]
11. Monzote Fidalgo L., Gille L. Mitochondria and Trypanosomatids: Targets and Drugs. Pharm Res. 2011; 28:2758-70. [ Links ]
12. Vincent IM, Creek D, Watson DG, Kamleh MA, Woods DJ, Wong PE, Burchmore RJ, Barrett M. A Molecular Mechanism for Eflornithine resistance in African Trypanosomes. PLoS Pathog 6(11): e1001204. doi:10.1371/journal.ppat.1001204. [ Links ]
13. Matthews KR, Gull K. Cycles within cycles: the interplay between differentiation and cell division in Trypanosoma brucei. Parasitol Today. 1994; 10(12):473-6. [ Links ]
14. Bringaud F, Rivière L, Coustou V. Energy metabolism of trypanosomatids: adaptation to available carbon sources. Mol Biochem Parasitol. 2006; 149(1):1-9. [ Links ]
15. Haanstra JR, Kerkhoven EJ, van Tuijl A, Blits M, Wurst M, van Nuland R, Albert MA, Michels PAM, Bouwman J, Clayton C, Westerhoff H, Bakker BM1. A domino effect in drug action: from metabolic assault towards parasite differentiation. Molecular Microbiology, 2011; 79(1): 94–108. [ Links ]
16. Haanstra JR, van Tuij A, van Dam J, van Winden W, Tielens AG, van Hellemond JJ, Bakker BM. Proliferating bloodstream-form Trypanosoma brucei use a negligible part of consumed glucose for anabolic processes. Int J Parasitol. 2012; 42(7):667-73. [ Links ]
17. Munoz-Antonia T, Richards FF, Ullu E. Differences in glucose transport between blood stream and procyclic forms of Trypanosoma brucei rhodesiense. Mol Biochem Parasitol. 1991; 47(1):73-81. [ Links ]
18. Stoppani AO, Docampo R, de Boiso JF, Frasch AC. Effect of inhibitors of electron transport and oxidative phosphorylation on Trypanosoma cruzi respiration and growth. Mol Biochem Parasitol. 1980; 2(1):3-21. [ Links ]