Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos Venezolanos de Farmacología y Terapéutica
versión impresa ISSN 0798-0264
AVFT vol.34 no.4 Caracas dic. 2015
Marcadores de resistencia en Leishmania: Susceptibilidad in vitro a drogas leishmanicidas vs retención de calceina en aislados de pacientes venezolanos con Leishmaniasis Cutánea Difusa
Resistance markers in Leishmania: in vitro drug susceptibility vs leishmanicidas calcein retention in isolated venezuelan patients with diffuse cutaneous leishmaniasis
Maritza Padrón-Nieves1 y Alicia Ponte-Sucre2
1 Cátedra de Farmacología y Toxicología. 2 Cátedra de Fisiología Humana. 1,2 Escuela Luis Razetti. Instituto de Medicina Experimental. Laboratorio de Fisiología Molecular. Facultad de Medicina. Instituto de Medicina Experimental. Facultad de Medicina. Universidad Central de Venezuela
Autor a quien se dirige la correspondencia: Maritza Padrón-Nieves. Oficina 204. Instituto de Medicina Experimental. Telf: (58-212) 605-3665. Fax: (58-212) 693-4351. Email: mpadron43@gmail.com
Resumen
La identificación de parásitos quimio-resistentes con marcadores celulares fáciles de cuantificar, no ha sido descrita en Leishmania. En este trabajo comparamos la susceptibilidad in vitro a drogas leishmanicidas vs. la retención intracelular de calceina, una medida indirecta de la actividad de los transportadores MDR1 y MRP1, en parásitos aislados de pacientes con Leishmaniasis Cutánea Difusa, con fracaso terapéutico a Glucantime. Estos hallazgos los comparamos con resultados obtenidos en especies de referencia de la Organización Mundial de la Salud. Encontramos que el ensayo de susceptibilidad a drogas leishmanicidas, es fácil, rápido y reproducible, mas no necesariamente predictivo de fenotipo quimio-resistente. Adicionalmente, la detección fluorométrica de la retención de calceina permitió diferenciar a los aislados de acuerdo a la funcionalidad de los transportadores ABC. Estos resultados sugieren que de validarse su utilidad, esta metodología podría incorporarse al esquema de diagnóstico y tratamiento de la leishmaniasis, como predictiva del éxito de la terapia leishmanicida.
Palabras clave: Leishmania, susceptibilidad a fármacos, quimio-resistencia, retención de calceina, transportador ABC.
Abstract
Chemo-resistance screening with easy to quantify cell markers has not been implemented for leishmaniasis. Herein we compared Leishmania in vitro susceptibility to classical and experimental drugs and calcein retention by parasites isolated from patients suffering Diffuse Cutaneous Leishmaniasis that failed to respond to Glucantime. The results were compared with those obtained from WHO-reference Leishmania strains. Calcein is an ABC transporter substrate and its accumulation may reflect the functionality of both MDR1 and MRP1 transporters. Our results suggest that screening of promastigote´s drug susceptibility is an easy, fast and reproducible assay that might not be predictive of a phenotype confident with chemoresistance. Moreover, theys demonstrate that calcein retention differentiates the isolates according to the functionality of the different ABC transporters. Therefore, if validated, this methodology could be included in a diagnosis and treatment scheme for leishmaniasis as predictive for successful therapy.
Key words: Leishmania, drugs susceptibility, Chemo-resistance, calcein retention, ABC transporters.
Introducción
Leishmaniasis es el término descriptor de la clínica de la enfermedad causada por Leishmania (L.), parásito intracelular obligado de las células del sistema fagocítico monocitario1. En Venezuela, la leishmaniasis cutánea (98,8% de los casos), es endémica2. Para su tratamiento, el fármaco de elección es el antimoniato de meglumina3,4 (Glucantime®, de Aventis), o la Ulamina, fabricada en Venezuela5. Su administración es intramuscular, el tratamiento es doloroso, largo y con efectos secundarios importantes. Debido a ello el éxito de la terapia puede ser limitada. Adicionalmente puede haber fracaso terapéutico en algunos pacientes, y también recidivas. Desde los años 80 en Venezuela se usa alternativamente la inmunoterapia6.
La quimio-resistencia, definida como la disminución de la eficacia del medicamento en una población previamente susceptible, es una de las causas del fracaso terapéutico en la leishmaniasis7. La misma puede ser natural o innata (L. braziliensis al ketoconazol); o adquirida, al seleccionar parásitos con características que les permiten sobrevivir en presencia de la droga, al ser expuestos reiteradamente a dosis sub-óptimas de fármacos1,8. Al igual que en células de mamíferos, en Leishmania este fenómeno implica la disminución de la acumulación celular de fármacos, debido a la sobre-expresión de transportadores ABC (por ATP Binding Cassette) responsables de la eliminación efectiva de desechos celulares, toxinas ambientales y otros xenobióticos9,10. El primer transportador ABC descrito, y el más estudiado, fue el ABCB1 (glicoproteína P, P-gp, MDR). Sus sustratos son drogas hidrofóbicas, catiónicas o neutras11. Posteriormente, fueron identificados el ABCC1 (MRP, por su siglas en inglés, Multidrug Resistance-associated Protein), para drogas aniónicas12 y el ABCG2 (MXR, Mitoxantrone Resistance Protein o BCRP, Breast Cancer Resistance Protein) para drogas hidrofóbicas11. En Leishmania, Ouellette y colaboradores13, fueron pioneros al describir el círculo H, una estructura extracromosomal que contiene genes para los transportadores ABCC; el aumento de su expresión y función está asociado a la resistencia a drogas en Leishmania.
Los mecanismos de quimio-resistencia pueden ser múltiples y no ser exclusivos para un tipo de droga. Es decir, diversos sistemas contribuirían a la preservación del fenotipo quimio-resistente. Por ejemplo, la expresión de marcadores de metaciclogénesis, y de transportadores asociados a la incorporación de nutrientes disminuye en Leishmania quimio- resistente; adicionalmente, la actividad de enzimas del metabolismo de la glucosa y los amino ácidos está alterada, al igual que los niveles de metabolitos involucrados en la homeostasis redox como pterina y tripanotiona y la actividad de la enzima dihidrofolato-reductasa / timidilato- sintetasa8. Estas alteraciones de la fisiología celular sugieren que la quimio-resistencia podría monitorearse por la determinación de marcadores celulares, tal y como fue propuesto por Croft y su grupo en 20061.
Actualmente para determinar este fenotipo en Leishmania se utiliza el modelo in vitro macrófago-amastigote. El mismo permite correlacionar la respuesta clínica a los medicamentos, con la disminución cuantitativa de la tasa de infección de los macrófagos a concentraciones crecientes de las drogas1. Sin embargo, es una técnica laboriosa y costosa, condiciones que desestimulan su aplicación clínica. Debido al aumento de la incidencia de casos de leishmaniasis con fracaso terapéutico, urge entonces identificar marcadores de resistencia sencillos y fáciles de implementar, para guiar la terapia leishmanicida.
En nuestro estudio, pionero en Venezuela, evaluamos si la acumulación de calceina diferencia a los aislados de acuerdo a la funcionalidad de los transportadores ABC, y comparamos los resultados con aquellos que determinan la susceptibilidad de los parásitos a drogas clásicas y experimentales leishmanicidas. La prueba fluorescente que utiliza calceina acetoximetilada (calceina/AM–no fluorescente) es útil para demostrar quimio-resistencia mediada por transportadores ABC en parásitos y otras células14. La calceina/AM difunde a través de las membranas celulares, es degradada por esterasas endógenas y transformada en calceina fluorescente. Los transportadores ABC expresados en la célula eliminan la calceina, la cual no se acumula en el interior celular, por lo cual disminuye la fluorescencia intracelular15. El uso de inhibidores específicos para cada tipo de transportador, permite determinar la contribución funcional de cada uno de ellos. Nuestros resultados sugieren que de validarse su utilidad, esta metodología podría incorporarse al esquema de diagnóstico y tratamiento de la leishmaniasis, como predictiva del éxito de la terapia leishmanicida.
Métodos
Se utilizaron especies de referencia, certificadas por la Organización Mundial de la Salud: Leishmania (V.) braziliensis (MHOM/BR/84/LTB300), Leishmania (L.) mexicana (MHOM/ BR/82/Bel21), Leishmania (L.) amazonensis (MHOM/BR/77/ LTB0016) y parásitos aislados de lesiones de tres pacientes con Leishmaniasis Cutánea Difusa con fracaso terapéutico de larga data, al tratamiento con Glucantime [VE2000MM, L. (L.) amazonensis; VE98MR, L. (L.) amazonensis; y VE96ZC, L. (L.) mexicana] identificados por análisis e hibridación molecular (Rodríguez N., comunicación personal). Los aislados se mantuvieron en nitrógeno líquido hasta su uso, se descongelaron según protocolos convencionales, para su crecimiento fueron sub-cultivados en medio semisólido de agarsangre/ medio glucosado bajo criterios establecidos.
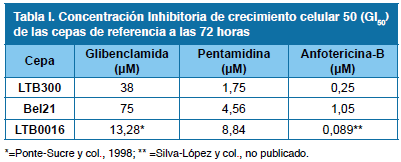
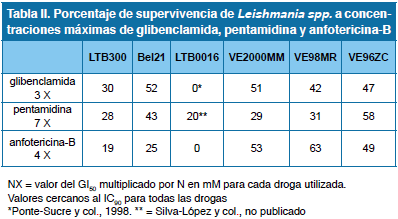
Se evaluó la susceptibilidad de los promastigotes de las especies de referencia a las drogas leishmanicidas [pentamidina (0 a 150 μM) y anfotericina-B (0 a 10 μM)] y no leishmanicidas [glibenclamida (0 a 100 μM)]. Los parásitos (1 x 107 células ml-1) se sembraron y se incubaron a temperatura ambiente (TA). La droga se añadió al segundo día; se determinó la densidad celular dosis respuesta y se estableció la GI50, parámetro propuesto por el National Cancer Institute para fijar la concentración de droga que causa 50% de inhibición del crecimiento celular. Su cálculo corrige el valor encontrado en base a la densidad celular a tiempo cero, para cada droga16. Al determinar este parámetro (GI50) para cada especie de referencia y para cada droga, calculamos el porcentaje de crecimiento de cada aislado en presencia concentraciones de 3 a 7 veces el GI50 (≈ GI90 para las especies de referencia) de pentamidina (12,5 μM), anfotericina-B (1 μM) y glibenclamida (100 μM).
Se evaluó la retención basal de calceina en alícuotas de 100 μl (4 x 108 células ml-1). Para ello se utilizó el protocolo del kit VybrantTM optimizado en el laboratorio17. Alícuotas de 100 μl (4 x 108 células ml-1 se incubaron 30 min a TA en presencia de concentrationes crecientes de ciclosporina-A y verapamil, y glibenclamida; seguidamente se incubaron 30 min a TA en oscuridad, en presencia de calceina/AM (0,25 μM); para detener la reacción, las células se centrifugaron 5 seg a 200 x g; posteriormente, se lavó la preparación con medio glucosado frío y finalmente, se resuspendieron las células en 200 μl del mismo medio. La retención de calceina fue medida como fluorescencia específica en un espectrofluorímetro Perkin Elmer Victor2 Wallac (Finlandia) a λem = 517 nm (λex = 494 nm). La glibenclamida es un inhibidor de transportadores ABCC1 (MRP1) y además de canales de potasio Ikr 17,18,19. La ciclosporina-A es un bloqueador de amplio espectro, no competitivo, preferencialmente para transportadores ABCB4 (MDR4)20,21,22. El verapamil es un inhibidor selectivo de los transportadores ABCB1 (MDR1)21,22,23. Se incluyeron dos blancos: B1: alícuota de células solas y B2: alícuota de células con etanol, DMSO y PBS, y un control: C: alícuota de células con calceina.
El análisis estadístico de los datos se realizó con los programas Microsoft Excel 2002® y Graph-Pad Prism5®. Los valores se presentan como la media ± el error estándar de al menos tres experimentos realizados por duplicado.
Resultados
Inicialmente establecimos la susceptibilidad in vitro de las especies de referencia estudiadas. Para ello determinamos la GI50 para glibenclamida, anfotericina-B y pentamidina. En la Tabla I se listan los valores de GI50 obtenidos 72 h luego de añadir cada droga. Los resultados demuestran que las especies de referencia son más susceptibles a anfotericina- B que a pentamidina, como drogas leishmanicidas clásicas y confirman que glibenclamida es un agente leishmanicida moderado; adicionalmente, sugieren que la GI50 es un indicador confiable de la susceptibilidad diferencial de los promastigotes a los compuestos.
Seguidamente se determinó el efecto de concentraciones cercanas al GI90 para las especies de referencia (tres y siete veces mayor al GI50 de las drogas utilizadas) sobre el crecimiento de los parásitos. Los datos se resumen en la Tabla II. Al comparar la supervivencia de las especies con la de los aislados se obtuvieron las siguientes series de susceptibilidad; para pentamidina (LTB0016 > LTB300 = VE2000MM = VE98MR > Bel21 > VE96ZC) y anfotericina-B (LTB0016 >> LTB300 > Bel21 >> VE96ZC = VE2000MM > VE98MR), como agentes leishmanicidas clásicos, y para glibenclamida (LTB0016 >> LTB300 > VE98MR > VE96ZC > VE2000MM = Bel21). Estos datos demuestran que los aislados de los pacientes estudiados son menos susceptibles a las altas concentraciones de las drogas ensayadas, que las especies de referencia, con una supervivencia cercana, o superior al 50%, excepto en el caso de VE98MR y VE2000MM ensayados con pentamidina.
Para determinar si la evaluación de la acumulación basal de calceina, nos permitía llegar a conclusiones similares, en base a la expresión funcional de los transportadores ABC, evaluamos este parámetro en los aislados de pacientes con fracaso terapéutico al Glucantime en condiciones control (sin drogas) y en presencia de inhibidores como verapamil, ciclosporina-A y glibenclamida. La retención basal en todos los casos fue de 301 a 382 unidades arbritarias de fluorescencia.
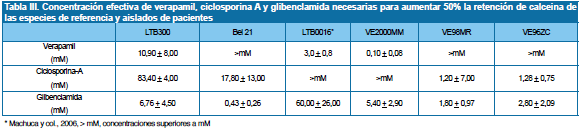
La Tabla III resume las concentraciones efectivas (CE50, expresadas en μM) necesarias para aumentar en un 50% la acumulación de calceina en las especies y aislados. Glibenclamida aumentó la acumulación de calceina en todos los casos. La serie de susceptibilidad fue: Bel21 > VE98MR > VE96ZC > VE2000MM > LTB300 >> LTB0016. Nuestros resultados no se deben a la inhibición de canales de potasio Ikr por la glibenclamida17,18, ya que en experimentos realizados con genisteina (0,02 a 10 μM) a concentraciones en las cuales este compuesto sólo actúa sobre canales de potasio y no sobre MDR1, MRP1 o ABCG217 encontramos que la genisteina (datos no mostrados) no aumentó el porcentaje de retención de calceina en ninguna de las especies, demostrando que la glibenclamida actuó bloqueando transportadores MRP1. Por su parte, verapamil y ciclosporina-A, a las concentraciones utilizadas (hasta mM), aumentaron la acumulación de calceina sólo en algunas especies y aislados. La susceptibilidad para verapamil fue: (VE2000MM > LTB0016 >LTB300 >>>>> Bel21, VE98MR, VE96ZC) y para ciclosporina-A (VE96ZC = VE98MR > Bel21 > LTB300 >>>>> LTB0016, VE2000MM).
Discusión
El aumento de la incidencia de casos de leishmaniasis con fracaso quimioterapéutico resalta la urgencia de seleccionar marcadores de resistencia útiles para identificar parásitos con este fenotipo. En nuestro estudio, pionero en Venezuela, comparamos la susceptibilidad a drogas leishmanicidas de aislados de pacientes con fracaso terapéutico a Glucantime, con la capacidad de los aislados de acumular calceina, substrato de los transportadores ABC y su sensibilidad a inhibidores específicos de los mismos.
Los aislados VE2000MM y VE98MR fueron identificados como L. amazonensis, mientras que VE96ZC lo fue como L., mexicana (Dra. Noris Rodriguez, comunicación personal). Debido a ello en nuestro estudio se compararon los resultados obtenidos con los de las especies de referencia correspondientes. Se incluyó L. braziliensis LTB300 como control negativo.
La susceptibilidad in vitro de las especies de referencia a dos agentes leishmanicidas (anfotericina-B y pentamidina), y a una sulfonilurea (glibenclamida) fue similar a la encontrada previamente24,25. Adicionalmente, nuestros datos demuestran que los aislados fueron en general menos susceptibles a anfotericina- B y glibenclamida que sus especies homólogas, con un porcentaje de supervivencia cercano o superior al 50%, a altas concentraciones de las drogas. Por su parte, con pentamidina, sólo el aislado VE96ZC tuvo un porcentaje de supervivencia superior a 50% a altas concentraciones de la droga. Estos resultados indican que la susceptibilidad a drogas en promastigotes es un método fácil, rápido y reproducible, más no necesariamente predictivo de fenotipo quimio-resistente. Sin embargo, la validación de estos hallazgos en un mayor número de aislados es más que deseable.
Seguidamente comparamos la acumulación de calceina entre los aislados de pacientes y las especies de referencia. Adicionalmente evaluamos su modulación por inhibidores competitivos como verapamil, ciclosporina-A y glibenclamda. Este ensayo es válido como medida indirecta de la funcionalidad de los transportadores MDR y MRP en muchos tipos celulares8,26. Los aislados difieren en su comportamiento con LTB300; es por ello que esta especie no será incluida en el siguiente análisis.
Rautio y colaboradores27 han definido la fortaleza de los inhibidores de transportadores ABC como alta (A, con IC50 < de 1 μM), media (M, con IC50 1μM < 15 μM) y baja (B, con IC50 > de 15 μM)27. Este análisis además permite establecer el tipo de transportadores preferencialmente expresado en un tipo celular, al utilizar inhibidores selectivos, tal y como se realizó en este trabajo. Basados en nuestros resultados concluimos entonces que, ciclosporina-A es un inhibidor tipo B para el aislado VE2000MM y para LTB0016 (insensibles a la droga hasta niveles mM); y es un inhibidor tipo M para los aislados VE96ZC y VE98MR. Como ciclosporina-A es un inhibidor selectivo de transportadores MDR4, podemos concluir que los mismos deben estar medianamente expresados en VE96ZC y VE98MR (sensibles a la droga entre 1 y 15 μM). Para estos mismos aislados, verapamil es un inhibidor tipo B (insensibles a la droga hasta niveles mM). Sin embargo, es un inhibidor tipo A para el aislado VE2000MM y tipo M para LTB0016. Como verapamil inhibe preferencialmente transportadores MDR1, podemos concluir que los mismos no estén expresados o no son funcionales en VE96ZC y VE98MR, mas si en VE2000M. Verapamil y ciclosporina-A son inhibidores tipo B para Bel21, sugiriendo que esta cepa no expresa (o no son funcionales) ni MDR1 ni MDR4. Finalmente, acorde con la clasificación presentada, glibenclamida es un inhibidor tipo A para Bel21, B para LTB0016, y M para los aislados. Estos datos sugieren la expresión funcional de transportadores MRP1 en los aislados, susceptibles a concentraciones de glibenclamida entre 1 y 15 μM, más no así en LTB0016, tal y como había sido demostrado anteriormente17.
En conclusión, en este trabajo Encontramos diferencias al comparar la susceptibilidad y la expresión de transportadores ABC de los aislados de pacientes con las especies de referencia. Nuestros resultados sugieren que (a) el ensayo de susceptibilidad en promastigotes de Leishmania es fácil, rápido y reproducible, y podría ser predictivo de la resistencia a antimoniales, (b) la evaluación de la acumulación de calceina como ensayo cualitativo de la expresión y/o funcionalidad de los diversos transportadores ABC podría ser un marcador celular interesante de continuar evaluando por lo cual, es imperativo la validación de estos hallazgos en un mayor número de aislados.
AGRADECIMIENTOS
Al Consejo de Desarrollo Científico y Humanístico, Universidad Central de Venezuela (UCV), PI 09-00-7115-2008, PG 09-007378-2008; Programa de Asistencia a Eventos ICC-09-0022-2012. Coordinación de Investigación de la Facultad de Medicina UCV, CI-ADM-134/2009 y Fundación Alejandro de Humboldt, Alemania, por los financiamientos recibidos. Los parásitos fueron donados por la Dra Noris Rodríguez, Instituto de Biomedicina, Universidad Central de Venezuela (UCV) y por el Dr. Lee Schnurr, Universidad de Jerusalén.
Referencias
1. Croft SL, Sundar S, Fairlamb AH. Drug resistance in leishmaniasis. Clin Microbiol Rev 2006; 19: 111-26. [ Links ]
2. Rodríguez N, De Lima H, Aguilar CM, et al. Molecular epidemiology of cutaneous leishmaniasis in Venezuela. Trans R Soc Trop Med Hyg 2002; 96: S1/105-09. [ Links ]
3. Zerpa O, Ulrich M, Borges R, et al. Epidemiological aspects of human and canine visceral leishmaniasis in Venezuela. Rev Panam Salud Publica. 2003; 13:239-45. [ Links ]
4. Navarro P, Colmenares LA, Rosales R, Postalian A, Coraspe V, Silva S. Tratamiento de la leishmanisis tegumentaria americana con meglumina. Informed 2009; 11: 73-78. [ Links ]
5. Vázquez de Ricciardi L. Terapéutica antileishmania: revisando el pasado, el presente y el futuro. Gac Med Caracas 2009; 117: 93-111. [ Links ]
6. Convit J, Castellanos PL, Rondón A, Pinardi M, Ulrich M, Castes M, Bloom B, Garcia L. Inmunotherapy versus Chemotherapy in localised cutaneous leishmaniasis. Lancet 1987; 1: 401-05. [ Links ]
7. World Health Organziation. Control of the leishmaniasis. Technical report series. 949. Geneva, 2010 [ Links ]
8. Ponte-Sucre A. Physiological consequences of drug resistance in Leishmania and their relevance for chemotherapy. Kinetoplastid Biol Dis 2003; 28: 2-14. [ Links ]
9. Blackmore CG, Mc Naughton PA, vanVen HW. Multidrug transporters in prokaryotic and eukaryotic cells: physiological functions and transport mechanisms. Mol Membr Biol 2001; 18: 97-103. [ Links ]
10. Leslie E, Deeley R, Cole S. Multidrug resistance proteins: role of P-glycoprotein, MRP1, MRP2 and BCRP (ABCG2) in tissue defense. Toxicol. Appl Pharmacol 2005; 204: 216-237. [ Links ]
11. Higgins CF. Multiple molecular mechanisms for multidrug resistance transporters. Nature 2007; 446: 749-57. [ Links ]
12. Cole SP, Bhardwaj G, Gerlach JH, et al. Overexpression of a transporter gene in multidrug-resistant human lung cancer cell line. Science 1992; 258: 1650-54. [ Links ]
13. Ouellette M, Fase-Fowler F, Borst P. The amplified H circle of methotrexate-resistant Leishmania tarentolae contains a novel P-glycoprotein gene. EMBO J 1990; 9: 1027- 33. [ Links ]
14. Essodaïgui M, Broxterman HJ, Garnier-Suillerot A. Kinetic analysis of calcein and calcein-acetoxymethylesterv efflux mediated by the multidrug resistance protein and P-glycoprotein. Biochemistry 1998; 37: 2243-50. [ Links ]
15. Essodaïgui M, Frezard F, Moreira ES, et al. Energy-dependent efflux from Leishmania promastigotes of substrates of the mammalian multidrug resistance pumps. Mol Biochem Parasitol 1999; 100: 73-84. [ Links ]
16. National Cancer Institute. Special Concentration Parameters GI50, TGI, and LC50. 2011. consultado el 01-04-2011. Disponible en: http://dtp.nci.nih.gov/docs/compare/comparemethodology.html [ Links ]
17. Machuca C, Rodríguez A, Herrera M, et al. Metabolic adaptations induced by resistance to an ABC transporter blocker glibenclamide in Leishmania amazonensis. Exp Parasitol 2006; 114:1-9. [ Links ]
18. Inagaki N, Gonoi T, Clement JP 4th, et al. Reconstitution of IKATP: an inward rectifier subunit plus the sulfonylurea receptor. Science. 1995; 270:1166-70. [ Links ]
19. Haskó G, Deitch HA, Németh ZH, et al. Inhibitors of ATP-Binding Cassette Transporters Suppress Interleukin-12 p40 Production and Major Histocompatibility Complex II Up-Regulation in Macrophages. J. Pharmacol Exp Ther 2001; 301: 103-110. [ Links ]
20. Qadir M, OLoughlin KL, Fricke SM, et al. Cyclosporin A is a broad-spectrum multidrug resistance modulator. Clin Cancer Res. 2005; 11: 2320-6. [ Links ]
21. Couture L, Nash JA, Turgeon J. The ATP-Binding Cassette Transporters and Their Implication in Drug Disposition: A Special Look at the Heart. Pharm Rev 2006; 58:244- 258. [ Links ]
22. Bansal T, Jaggi M, Khar RK, et al. Emerging Significance of Flavonoids as P-Glycoprotein Inhibitors in Cancer Chemotherapy. J Pharm Pharmaceut Sci 2009; 12:46-78. [ Links ]
23. Natera S, Machuca C, Padrón-Nieves M, et al. Proficiency of drug-resistant parasites. Int J Antimicrobioal Agents 2007; 29: 637-42. [ Links ]
24. Lunardi F, Guzela M, Rodrigues AT, et al. Trypanocidal and leishmanicidal properties of substitution-containing chalcones. Antimicrob Agents Chemother. 2003; 47: 1449- 51. [ Links ]
25. Lima NMF, Correia CS, León LL, et al. Antileishmanial activity of lapachol analogues. Mem Inst Osw Cruz 2004; 99: 757-61. [ Links ]
26. Golstein PE, Boom A, van Geffel J, Jacobs P, Masereel B, Beauwens R. P-glycoprotein inhibition by glibenclamide and related compounds. Pflugers Arch 1999; 437: 652-60. [ Links ]
27. Rautio J, Humpreys J, Webster L., et al. In vitro P-glycoprotein inhibition assays for assesment of clinical drug interaction potential of new drug candidates: A recommendation for probe substrates. Drug Metab and Disp 2006; 34:786-792. [ Links ]