Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Facultad de Medicina
versión impresa ISSN 0798-0469
RFM v.24 n.1 Caracas mar. 2001
PAPEL PATOGÉNICO DE LOS FIBROBLASTOS EN LA MEMBRANA SINOVIAL DE PACIENTES CON ARTRITIS REUMATOIDE
CM López-Benítez1, FA Pláceres U1, EJ Alonzo1 y MA Rodríguez B1. 1
RESUMEN
Desde un punto de vista patogénico la membrana sinovial de pacientes con artritis reumatoide combina dos procesos mutuamente relacionados: 1. Un proceso inflamatorio crónico, de base autoinmune, caracterizado por el predominio de linfocitos T del fenotipo cooperador/inductor (CD4+), y 2. Un proceso proliferativo del tejido sinovial, denominado pannus, en el cual participan sinoviocitos de estirpe mielomonocítica, los monocitos/macrófagos y sinoviocitos de estirpe mesenquimal, los fibroblastos. Esta última subpoblación celular muestra un fenotipo transformado, y es probablemente responsable del desarrollo incontrolado del pannus, contribuyendo junto a los monocitos/macrófagos a la invasión y destrucción del cartílago y hueso articular. En este artículo se revisan las evidencias que indican trastornos en la regulación de la activación y proliferación de los sinoviocitos tipo fibroblasto en pacientes con artritis reumatoide y se plantea la hipótesis de una posible disregulación funcional de estas células debido a alteraciones en sus mecanismos de señalización post-membrana. La identificación de defectos funcionales a este nivel podría abrir posibilidades terapéuticas novedosas, basadas en la corrección, por métodos farmacológicos, de las posibles alteraciones en la respuesta de los fibroblastos a estímulos ambientales en la sinovial reumatoide.
Palabras Claves: Artritis reumatoide, Fibroblastos, Pannus, Señalización intracelular.
ABSTRACT
Inflammatory process, of an autoimmune basis, predominantly driven by T lymphocytes of the cooperative/inductor phenotype (CD4+), and 2. A proliferative process of the synovial membrane, termed pannus, with two participating cell types, monocytes/macrophages (synoviocytes of myelomonocytic lineage) and fibroblasts (synoviocytes of mesenchimal origin). The latter cell population shows a transformed phenotype and it is probably involved in the unchecked pannus growth. They contribute along with monocytes/macrophages, to the unrelated invasion and destruction of articular cartilage and subchondral bone. In this article we discuss the reported evidences of abnormalities in the regulation of activation and proliferation of rheumatoid fibroblasts and formulate a hypothesis of potential defects in post-receptor signaling of these cells as the basis for their disregulated functional response. The identification of critical abnormalities in fibroblast post-receptor signaling cascades may lead to the development of alternative treatment modalities in patients with rheumatoid arthritis.
Key Words: Rheumatoid arthritis, Fibroblasts, Pannus, Signal transduction.
__________________
Introducción
La artritis reumatoidea (AR) es una enfermedad inflamatoria crónica de origen autoinmune y de etiología desconocida, que afecta aproximadamente el 1% de la población general(1). Histológicamente se caracteriza por hiperplasia invasiva de la membrana sinovial, neoangiogénesis y un infiltrado de células mononucleares que conduce a la destrucción articular progresiva(1,2,3). Aunque es considerada una enfermedad de las articulaciones, puede exhibir una variedad de manifestaciones extra-articulares, por lo que puede considerarse una enfermedad sistémica(1). La membrana sinovial es el asiento primario del proceso inmunopatogénico en la AR. Este tejido contiene células que se cree pueden servir como fuente de antígenos para el ataque del sistema inmunitario o de blanco para agentes infecciosos disparadores de la enfermedad(1,3). La membrana sinovial se compone de una capa interna o íntima sinovial y una capa externa o subíntima. En condiciones normales contiene fibras de colágeno, elastina y varios tipos celulares que incluye sinoviocitos, mastocitos, histiocitos y un escaso infiltrado de células mononucleares(1,2).
Entre los sinoviocitos se identifican dos tipos celulares de morfología y linaje distintos, los sinoviocitos tipo macrófagos (tipo A) y los sinoviocitos tipo fibroblastos (tipo B o FLS, del inglés fibroblast–like synoviocytes)(4). Los sinoviocitos tipo macrófago representan las células principales tanto en la íntima normal como en la reumatoidea. Los marcadores principales de estas células son las moléculas CD14, CD68 y el receptor Fc de inmunoglobulina (FcR). Los FLS tienen una apariencia morfológica de fibroblastos, poseen la maquinaria estructural para sintetizar y secretar proteoglicanos, citocinas, metabolitos del ácido araquidónico y metaloproteinasas(4,5,6,7,8). En la íntima sinovial estas células expresan una variedad de receptores de superficie tales como receptores de trombina(8), del factor de crecimiento derivado de plaquetas (PDGF-
a y b)(9), del factor de crecimiento de fibroblastos (FGFRs del inglés, Fibroblast Growth Factor Receptors), de citocinas como interleucina 1 (IL-1) y el factor de necrosis tumoral alfa (TNF-a), del ácido hialurónico (CD44), de moléculas de adhesión como la ICAM-1 y de integrinas b1 (que incluyen receptores de fibronectina y VCAM-1) e integrinas b3(4).Los receptores de moléculas de adhesión son expresados en la íntima sinovial reumatoidea en cantidades mayores que en el tejido sinovial normal, lo que probablemente ayuda al anclaje de estás células a la matriz extracelular. Igualmente hay una expresión incrementada de estas moléculas en el tejido endotelial de las vénulas poscapilares lo que acelera el influjo de otras células inflamatorias hacia el tejido sinovial reumatoideo(4). A su vez los linfocitos T se organizan en agregados, predominando los linfocitos T de memoria, CD4+ CD45RO+ y se distribuyen en focos alrededor de macrófagos, células endoteliales y células dendríticas(1).
La contribución relativa de los monocitos, de las células T, las células B, y los FLS en los eventos patogénicos la de enfermedad no ha sido firmemente establecida(2,3). Los estudios de los mecanismos celulares de la AR han sido dirigidos en los últimos años hacia tres sub-poblaciones principales, las células T, que infiltran la subíntima, las células dendríticas y las células estromales sinoviales(3,10). Los linfocitos T representan un componente importante de células inflamatorias en la membrana sinovial reumatoidea, pero su contribución exacta en la patogénesis de la AR ha sido controversial, debido en parte a que importantes mediadores biológicos producidos por las células T activadas como la interleucina 2 (IL-2), la interleucina 4 (IL-4) y el interferón–gamma (IFN-
g) han sido detectados en bajos niveles en las articulaciones reumatoideas(7,11). Sin embargo, estudios recientes en los que se examinó la presencia intracelular de citocinas demostraron el predominio de células T con fenotipo Th1 en pacientes con AR(12,13). En contraste con esto hay poco desacuerdo en que los macrófagos y los fibroblastos tienen un rol preponderante en el desarrollo del pannus, tejido caracterizado por la producción abundante de citocinas, tales como IL-1, TNF-a, interleucina 6 (IL-6) e interleucina 8 (IL-8)(3,7). Los FLS a su vez responden a estas citocinas pro inflamatorias con la producción directa de enzimas con potencial degradativo del cartílago y hueso, pertenecientes a la extensa familia de las metaloproeinasas de la matriz (MMPs). Más específicamente, los FLS responden a las citocinas pro inflamatorias con producción de MMP1 (con actividad colagenasa), MMP-8 (actividad elastasa), MMP-3 (estromelisina, con actividad degradativa sobre proteoglicanos) y diversas catepsinas (actividad colagenasa)(14). Un estudio en ratones transgénicos H2-c-fos mostró el desarrollo de una sinovitis proliferativa y destructiva de tejidos vecinos en ausencia de infiltrados de células inflamatorias(15), por lo que la hiperplasia sinovial de sinoviocitos pudiera ser suficiente en la mediación del daño en las articulaciones de los pacientes con AR(10,15). Además, Plows et al demostraron que era posible la producción de artritis inducida por exposición al colágeno tipo II, en ratones deficientes en la enzima RAG-1, y por lo tanto, tienen un defecto severo en la generación ontogénica de linfocitos B y T(15,16). En otro estudio utilizando los marcadores específicos de proliferación celular PCNA/cíclina y el proto-oncogen c–myc, Qu et al demostraron la proliferación local espontánea de las células de la íntima sinovial en pacientes con AR(17). En ese mismo estudio sinoviocitos expresando las moléculas PCNA y c-myc también fueron reconocidas por el anticuerpo contra el procolágeno tipo I, pero no con el anticuerpo anti-CD68 que reconoce macrófagos, lo cual sugiere que las células que proliferan y contribuyen principalmente a la hiperplasia sinovial reumatoidea son los FLS, más que células del linaje monocito-macrofágico. El concepto que tiene mayor aceptación hoy día es que el proceso inflamatorio crónico sinovial y el desarrollo del pannus pueden ocurrir en forma desacoplada(18).
Papel de los fibroblastos sinoviales en la patogenia de la AR
Cada vez existen más evidencias que apoyan la hipótesis de que los FLS de los pacientes con AR juegan un papel crítico en la patogenia de la enfermedad. Estas células exhiben características en su fenotipo y compartimiento compatible con el de células transformadas, tales como: crecimiento independiente de anclaje, expresión incrementada de proto-oncogenes (c-myc, c-fos y p53 mutado) y una conducta invasiva. Se han identificado mutaciones somáticas en el gen de la proteína antiproliferativa p53 en sinoviocitos tipo fibroblasto, procedentes de pacientes con AR(19). Este defecto podría contribuir al patrón aberrante de proliferación incontrolada característico de las células de estos pacientes. Los FLS están directamente involucrados en el proceso destructivo del cartílago y el hueso, al expresar altos niveles de citocinas pro inflamatorias y de metaloproteinasas(4,5,6,7,11). Además, favorecen la neo angiogénesis y pueden también interaccionar con otras subpoblaciones celulares como, por ejemplo con las células T, a través de la expresión de moléculas de adhesión y con osteoclastos mediante la producción de IL–6, contribuyendo al proceso de resorción ósea(6). Los FLS son una importante fuente de la interleucina 15 (IL-15) y la interleucina 7 (IL-7) en la sinovial reumatoidea, las cuales son citocinas con actividad tipo interleucina 2 (IL-2), las cuales pueden contribuir de manera directa a la activación y expansión local de células T(7). A través de la producción de IL-8 pueden también contribuir a activar neutrófilos y macrófagos, y a amplificar el proceso inflamatorio local(6). Adicional a estos efectos en la respuesta inflamatoria celular, los FLS reumatoideos son capaces de inducir la diferenciación de células B hacia células plasmáticas(20), contribuyendo así a la producción aumentada de inmunoglobulinas y factores reumatoideos que activan el sistema del complemento y contribuyen a la perpetuación de la reacción inflamatoria local. Más aun, se ha demostrado que los FLS pueden comportarse como las células dendríticas de los folículos linfoides(21) y por lo tanto, incrementar la presentación antigénica y en consecuencia la respuesta inflamatoria celular.
La mayor parte de los recursos terapéuticos actualmente disponibles pueden inhibir la actividad de los linfocitos T o la acción periférica de algunas citocinas pro-inflamatorias como el TNF-
a o la IL-1. Ninguno tiene un efecto directo sobre los FLS, lo cual puede explicar el avance indolente del daño cartílago-hueso a pesar de la remisión del proceso inflamatorio sinovial.
Señalización post-receptor en los fibroblastos
Los factores de crecimiento son componentes cruciales para el desarrollo y la diferenciación de muchas células. La mayoría de estos factores solubles median acciones pleiotrópicas en muchos grupos celulares, al unirse y activar receptores en la superficie celular con actividad proteína tirosina quinasa (PTK)(22,23,24). Dentro de ellos, los factores de crecimiento de fibroblastos (FGFs) constituyen una familia de al menos nueve miembros, los cuales comparten homologia de 30-70% en una secuencia primaria de aminoácidos. Estos factores pueden activar diferentes subtipos de receptores específicos (FGFR), dependiendo de su capacidad para unirse con alta afinidad a cada uno de ellos. Se han descrito cuatro variantes del FGFR denominados FGFR del 1 al 4, con una estructura general común(23) caracterizada por poseer un dominio extracelular que une al ligando, una región transmembrana y una porción citosólica que posee un dominio catalítico tirosina quinasa(25,26).
Los efectos biológicos del FGF se producen como resultado de la transmisión de señales intracelulares iniciado por la unión del FGF a los FGFR. El enlace del FGF al receptor conduce a su dimerización, lo que parece ser un requisito para la activación del dominio con actividad intrínseca de tirosina quinasa e induce la transfosforilación de los monómeros del receptor. Los sitios de fosforilación en tirosina sirven como lugares de anclaje por su unión con alta afinidad a diversos substratos celulares que poseen los dominios SH2 (SH del inglés, src homology domain). Estos dominios están presentes en moléculas claves para la señalización post-receptor tales como fosfolipasa C gamma 1 (PLC
g-1) y diversas moléculas adaptadoras como el FRS2 (del inglés, FGF receptor substrato 2), CrK, NcK y Grb2. Estas moléculas se enlazan para transmitir señales a partir del receptor, generando una cascada de eventos de fosforilación a través de diversas rutas como la de las MAPK quinasas (del inglés Mitogen–activated Protein Kinase) (Figura 1). La actividad de por lo menos tres factores de transcripción como AP-1, NF-kB y STATS es regulada por la vía de las MAPK quinasas(26). La actividad de AP-1 puede ser estimulada por varias señales extra-celulares que incluyen citocinas y factores de crecimiento, y es determinante en inducción de activación de genes de citocinas y de metaloproteinasas(27). El resultado final de la señalización coordinada en cascada es la transcripción de genes y la consiguiente respuesta biológica(23,26).Figura 1: Rutas de señalización a través del receptor específico para el factor de crecimiento de fibroblastos.

Fibroblastos reumatoideos: ¿Un problema de señalización ?
Anormalidades en la regulación de la transmisión de señales a partir del receptor FGF posiblemente están implicados en la transformación de los FLS de la sinovial reumatoidea. En otras palabras, la señalización intracelular alterada por defectos en la estructura o función de las moléculas que engranan la cascada de señalización, podría modificar el funcionamiento y la regulación normal de los FLS en la sinovial reumatoidea. Al comportarse como células transformadas, los FLS pueden ser agresores autónomos en este tejido y responder poco a los recursos terapéuticos actualmente disponibles. Hasta los momentos el mecanismo íntimo responsable de esta transformación no esta definido. Nuestro grupo se ha planteado que los FLS presentes en la membrana sinovial de pacientes con AR podrían tener un defecto de los mecanismos de regulación de su proliferación y actividad funcional, debido a anormalidades en los mecanismos de señalización intracelular. Estas alteraciones en los mecanismos que regulan la transmisión de señales de la membrana al núcleo podrían alterar salidas fisiológicas de estas células como la apoptosis, deprivando a la membrana sinovial de un potencial mecanismo de regulación negativa del crecimiento celular. Sobre la base de esta hipótesis hemos comenzado a evaluar eventos de señalización tempranos que ocurren luego la unión del FGF–2, a sus receptores correspondientes en los FLS de pacientes con AR, y a compararlos con los que suceden en fibroblastos de pacientes con osteoartritis. En esta artropatía, los fibroblastos no muestran evidencias de transformación anormal. En la Figura 2 mostramos un experimento representativo de la fosforilación en tirosina en condiciones basales y luego de estimulación a través del FGF-2 en fibroblastos obtenidos de un paciente con osteoartritis. Estos son los eventos bioquímicos más tempranos que ocurren luego del ligado del FGF por sus receptores específicos. A partir de allí iremos examinando la secuencia de eventos de señalización más dístales, hasta la ruta de las MAPKs y la activación del factor de transcripción AP-1 (Figura 1). El develar posibles alteraciones en las rutas de señalización de la membrana al núcleo en FLS de pacientes con RA podría abrir las puertas para el diseño de estrategias terapéuticas más racionales, que permitirán incidir de manera más específica y con menos efectos tóxicos sobre esta, hasta ahora intocable, subpoblación celular.
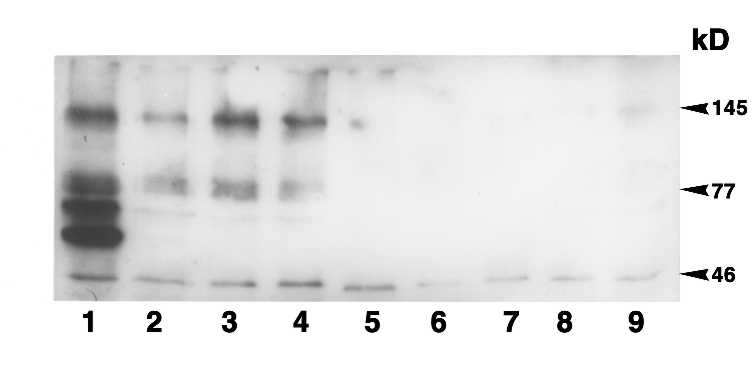
Experimento representativo de la inducción de fosforilación en tirosina de sustratos con pesos moleculares de 180-,170- y 65-kDa (cabeza de flechas), luego de la estimulación in vitro con dosis crecientes de FGF básico humano a concentraciones de 0 (carril 2), 10 (carril 3), 100 (carril 4) y 400 unidades (carril 5), durante 15 minutos. La especificidad de la respuesta se demuestra por el efecto inhibitorio de la genísteina (un inhibidor específico de tirosina cinasas) en cultivos preincubados con este compuesto, a la concentración de 160 mg/ml, 15 minutos antes de la estimulación con FGF básico (carriles 6-9). Los fibroblastos fueron obtenidos de un paciente con osteoartritis de rodilla.
AGRADECIMIENTOS
A la Sra. Mayra Mayora por su eficiente apoyo secretarial, a la Dra. Ana M. Blasini por la revisión del manuscrito y al equipo de cirujanos que nos proveen para este proyectos con la membrana sinovial de los pacientes. Financiado por proyecto CONICIT G-97000808.
REFERENCIAS BIBLIOGRÁFICAS
1. Firestein GS: Rheumatoid synovitis and pannus. In Textbook of Rheumatology. Four Edition, Editado por J. Klippel, P Dieppe. ST Louis, Mosby. 1997. [ Links ]
2. Hasunuma T, Kato T, Nishioka K. Molecular mechanisms of immune response, synovial proliferation and apoptosis in rheumatoid arthritis. Springer Sem Immunopathol. 1998; 20: 4–52. [ Links ]
3. Harris ED, Jr. Rheumatoid arthritis: pathophysiology and implications for therapy. N Engl J Med. 1990; 322: 1277–89. [ Links ]
4. Firestein GS. Invasive fibroblast–like synoviocytes in rheumatoid arthritis. Passive responders or transformed aggressors? Arthritis Rheum. 1996; 39: 1781–90. [ Links ]
5. Shin H, Kitajima I, Nakajima T, Shao Q, Tokioka T, et al. Thrombin receptor-mediated signals induce expression of interleukin-6 and granulocyte colony stimulating factor via NF-kB activation in synovial fibroblasts. Ann Rheum Dis. 1999; 58: 55–60. [ Links ]
6. Kontny E, Grabowska A, Kowalczewski J, Kurowska M, Janicka I, et al. Taurine chloramine inhibition of cell proliferation and citokine production by rheumatoid arthritis fibroblast–like synoviocytes. Arthritis Rheum. 1999; 42: 2552–60. [ Links ]
7. Harada S, Yamamura M, Okamoto H, Morita Y, Kawashima M, et al. Production of interleukin–7 and interleukin–15 by fibroblast–like synoviocytes from patients with rheumatoid arthritis. Arthritis Rheum. 1999; 42: 1508-16. [ Links ]
8. Schulze WC, Freudiger D, Petrow P, Seyfert C, Zacher J, et al. Characterization of collagenase 3 (matrix metalloproteinase 13) messenger RNA expression in the synovial membrane and synovial fibroblasts of patients with rheumatoid arthritis. Arthritis Rheum. 1999; 42: 1517 – 27. [ Links ]
9. Ohba T, Takase Y, Ohhara M, Kasukawa R. Thrombin in the synovial fluid of patients with rheumatoid arthritis mediantes proliferation of synovial fibroblast- like cells by induction of platelet derived growth factor. J Rheum. 1996; 23: 1505-11. [ Links ]
10. Imamura F, Aono H, Hasunuma T, Sumida T, Tateishi H, et al. Monoclonal expansion of synoviocytes in rheumatoid arthritis. Arthritis Rheum. 1998; 41:1979 – 86. [ Links ]
11. Chen E, Keystone Ec, Fish E. Restricted cytokine expression in rheumatoid arthritis. Arthritis Rheum. 1993; 36: 901-10. [ Links ] y
12. Kusaba M, Honda J, Fukuda T, Oizumi K. Analysis of type–1 and type-2 T cells in synovial fluid and peripheral blood of patients with rheumatoid arthritis. J Rheum. 1998; 25: 1466-71. [ Links ]
13. Dolhain R, Heiden A, Haar N, Breedveld F, Miltenburg M. Shift toward T lymphocytes with a T helper 1 cytokine- secretion profile in the joint of patients with rheumatoid arthritis. Arthritis Rheum. 1996; 39: 1961- 69. [ Links ]
14. Hauselman HJ. Mechanisms of cartilage destruction and novel non-surgical therapeutic strategies to retard cartilage injury in rheumatoid arthritis. Curr Opin Rheumatol. 1997; 9: 241-250. [ Links ]
15. Shiozawa S, Tanaka Y, Fujita T, Tokuhisa T. Destructive arthritis without lymphocyte infiltration in H2-c-fos transgenic mice. J Immunol. 1992; 148: 3100-4. [ Links ]
16. Plows D, Kontogergos G, Kollias G. Mice lacking mature T and B lymphocytes develop arhritis after immunization with type II collagen. J Immunol. 1999; 162: 1018-1023. [ Links ]
17. Qu Z, Hernández García C, O´Rourke L, Planck S, Kohli M. Local proliferation of fibroblast–like synoviocytes contributes to synovial hiperplasia. Arthritis Rheum. 1994; 37:212 – 20. [ Links ]
18. Van der Berg W. Joint inflammation and cartilage destruction may occur uncoupled. Springer Sem Immunopathol. 1998; 20: 149-164. [ Links ]
19. Han Z, Boyle DL, Shi Y, Green DR, Firestein GS. Dominant negative p53 mutations in rheumatoid arthritis. Arthritis Rheum. 1999; 42: 1088-1092. [ Links ]
20. Dechanet J, Merville P, Durand I, Baucherau J, Miossec P. The ability of synoviocytes to support terminal differentiation of activated B cells may explain plasma cell accumulation in rheumatoid synovium. J Clin Invest. 1995; 95: 456-463. [ Links ]
21. Lindhout E, van Eijk M, van Pel M, Lindeman J, Dinant HJ, de Groot C. Fibroblast-like synoviocytes from rheumatoid arthritis patients have intrinsic properties of follicular dendritic cells. J Immunol. 1999; 162: 5949-5956. [ Links ]
22. Ullrich A, Schelssinger. Signal transduction by receptor with tyrosine kinase activity. Cell. 1990; 61: 203-12. [ Links ]
23. Klin T P, Claesson–Welsh L. Signal transduction by fibroblast growth factor receptors. Frontiers Bioscience. 1999; 4: 165–77. [ Links ]
24. Mohammadi M, Dikic I, Sorokin A, Burqess W.H, Jake M, et al. Identification of six novel autophosphorylation sites on fibroblast growth factor receptor 1 and elucidation of their importance in receptor activation and signal transduction. Mol Cell Biol. 1996; 16: 977 – 989. [ Links ]
25. Mohammadi M, Honegger A, Rotin M, Bellot F, et al. A tyrosine–phosphorylated carboxy terminal peptide of the fibroblast growth receptor (Flg) is a binding site for the SH2 domain of phospholipase g-1. Mol. Cell. Biol. 1991; 5068–5078. [ Links ]
26. Firestein GS, Mannig A. Signal transduction and transcription factors in rheumatoid disease. Arthritis Rheum. 1999; 42: 609 – 621. [ Links ]
27. Asahara H, Fujisawa K, Kobata T, Hasunuma T, Maeda T. et al. Direct evidence of high DNA binding activity of transcription factor AP-1 in rheumatoid arthritis synovium. Arthritis Rheum. 1997; 40:912-18. [ Links ]













