Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Facultad de Medicina
versión impresa ISSN 0798-0469
RFM v.25 n.1 Caracas ene. 2002
CLONAMIENTO MOLECULAR DE LAS ASAS INTRACELULARES DE LOS RECEPTORES MUSCARÍNICOS m2 y m3 IMPLICADAS EN LA INTERRACCIÓN CON PROTEÍNAS G EN EL MÚSCULO LISO TRAQUEAL DE BOVINO.
GA Bruges¹, A Borges², R González de Alfonzo² ³, I Lippo de Bécemberg² ³ y M Alfonzo² ³.
1. Postgrado de Farmacología, Facultad de Farmacia.
2. Sección de Biomembranas, Instituto de Medicina Experimental.
3. Cátedra de Patología General y Fisiopatología, Escuela de Medicina "Luis Razetti".
RESUMEN:
En el músculo liso traqueal de bovino (MLTB) se ha propuesto una vía de señalización celular asociada con la actividad de una guanililciclasa de membrana plasmática (GCm) la cual se encuentra regulada por dos subtipos de receptores muscarínicos (mAChRs), m2 y m3 acoplados a proteínas G de manera opuesta. El objetivo del presente estudio fue la identificación de las secuencias primarias de las regiones intracelulares de los receptores muscarínicos implicadas en la interacción con las proteínas G que regulan a esta GCm. El cDNA del MLTB fue usado para la amplificación de las regiones intracelulares de los subtipos m2 y m3 utilizando oligonucleótidos cebadores específicos. Los productos de amplificación fueron identificados en geles de agarosa y posteriormente secuenciados, encontrándose un 99% de similitud con las secuencias obtenidas del bGen Data Bank de los mAChRs en cerebro de bovino. Este es el primer clonamiento molecular para los mAChRs presentes en MLTB y sugiere posibles similitudes con el cerebro de bovino en relación a la interacción receptor/proteína G.
Palabras Clave: Receptores muscarínicos, Guanililciclasa, Músculo liso.
ABSTRACT:
Two muscarinic receptors subtypes (mAChRs), m2 and m3, have been reported to regulate in opposite ways the activity of a membrane-bound guanylyl cyclase (GCm) via G-proteins in bovine tracheal smooth muscle (BTSM). The present study was undertaken to identify the primary sequences from intracellular loops of mAChRs subtypes from BTSM involved in the interaction with these G-proteins. cDNA from BTSM was used to amplify via RT-PCR, by using specific primers, the intracellular regions of m2 and m3 involved in the interaction with G-proteins. Amplification products for m3 and m2 loops were readily identified in agarose gel electrophoresis. Sequences for these loops were almost identical (99%) those found in bovine brain m2 and m3 mAChRs. This is the first molecular cloning of m2 and m3 mAChRS for BTSM. These results suggest the existence of similar mAChRs/G-proteins interactions in bovine airways.
Key Words: Muscarinic receptors, Smooth muscle, Guanylyl cyclase.
Introducción
Las evidencias farmacológicas sugieren la existencia de cuatro subtipos de receptores muscarínicos (M1-M4) sobre la base de los perfiles de afinidad de los antagonistas selectivos(1). Los receptores muscarínicos son miembros de la superfamilia de receptores acoplados a proteínas G. Basado en el análisis de sus secuencias nucleotídicas han sido identificados cinco subtipos los cuales se acoplan preferenciamente a la inhibición de la adenililciclasa (m2 y m4) o la estimulación del ciclo del fosfatidil inositol (PI) (m1, m3 y m5)(2,3). Sin embargo, han sido identificadas otras vías de señalización asociadas a la activación de estos receptores en el músculo liso de las vías aéreas de bovino(4). En dicho se ha encontrado una actividad de guanililciclasa de membrana plasmática (GCm) la cual se encuentra regulada recíprocamente por la activación de dos subtipos de receptores muscarínicos: Un subtipo m3 el cual activa a la GCm por medio del acoplamiento a una proteína GA, insensible a PTX y sensible al péptido mastoparán y un subtipo m2 el cual inhibe a la GCm vía una proteína GI sensible a PTX(4).
Materiales y Métodos
Preparación del ARN y Transcripción Inversa: El ARN total del músculo liso traqueal fue extraído según el procedimiento de Chomczynski y Sacchi(5). La transcripción inversa fue desarrollada a partir de 2 mg de ARN, 200 mg de cebador oligodT12-18 por 50 min a 42oC usando 200 U de la Transcriptasa Inversa Superscript II® (GIBCO BRL) en un volumen final de 20 ml (50 mM Tris-HCl, pH 8,3; KCl 40 mM; MgCl2 6 mM, DTT 1mM y DNTPs [Deoxinucleotidos trifosfatos] 1mM. La mezcla de reacción fue incubada a 70oC por 10 min. para inhibir la transcripción inversa y se incubó por 20 min. a 37oC con 100 U de RNasa H para eliminar el ARN unido al cDNA.
Identificación por PCR de las asa intracelulares i2 e i3 de los receptores muscarínicos m2 y m3: Los siguientes oligonucleótidos fueron diseñados para la amplificación para la amplificación de las siguientes regiones intracelulares de los receptores muscarínicos m2 y m3:
i2m3AChR (correspondientes a los nucleótidos 454 – 639; tamaño estimado del producto: 169 bp)
Oligonucleótido "sentido":
5’-AAGGATCCCTCCGTCATGAACCTTCT-3’
Oligonucleótido "antisentido":
5’-CCGAATTCCAAAGTATTGCCAGAACAAGATG-3’
i3m3AChR (correspondiente a los nucleótidos 740 – 1473, tamaño estimado del producto: 733 bp)
Oligonucleótido "sentido":
5’-GAGGATCCTGACTATTTTTATACTGGAGGATC-3’
Oligonucleótido "antisentido":
5’-CCGAATTCTTTCTTCTCCTTGATGAGGGA-3’
i3m2AChR (correspondiente a los nucleótidos 745 – 1456, tamaño estimado del producto: 688 bp)
Oligonucleótido "sentido":
5’-CCTCTAGAGGTGATCATCATGACTGTGCTATA-3’
Oligonucleótido "antisentido":
5’-CCGAATTCCCAAGTGATGATGAAAGCCAA-3’
GGATCC: Sitio de reconocimiento para BamHI, GAATTC: Sitio de reconocimiento para EcoRI,
TCTAGA: Sitio de reconocimiento para XbaI.
El producto de la reacción de transcripción inversa (2ml) fue amplificado usando un termociclador GeneAmp 2400® (Perkin Elmer) en un volumen total de 50 ml de una solución que contenía 250 mM dNTPs, MgCl2 2,5 mM, Tris-HCl 10 mM (pH 8,8), KCl 50 mM, 100 ng de los oligonucleótidos cebadores sentido y antisentido y 0,25 U de Taq DNA polimerasa. Las condiciones de PCR fueron: 0,5 min de desnaturalización a 94oC, 0,5 min de "annealing" a 55oC y 0,5 min de extensión del cebador a 72oC. La amplificación fue desarrollada por 35 ciclos, excepto para el i3m3AChR (40 ciclos). Posteriormente la mezcla de reacción fue calentada a 72oC por 7 min. Los productos amplificados fueron separados en geles de agarosa del 1 al 2% en TAE (Tris-Acetato-EDTA) a 125 V por 1,5 h. Posteriormente fueron visualizados con 0,5 mg/ml de bromuro de etidio. Estos productos fueron clonados en el vector pUC18 y secuenciados por el método de Sanger(6) en el Servicio de Secuenciación y Análisis de Acidos Nucleicos, IVIC (CeSAAN).
Resultados y Discusión
El tamaño de los productos de PCR de las asas intracelulares de los receptores muscarínicos presentes en el MLTB fue analizado en geles de agarosa visualizados por transiluminación ultravioleta con bromuro de etidio (Fig. 1). El tamaño de estos productos coincide con el predicho por el análisis de secuencias de estas porciones intracelulares para estos receptores.
En el análisis de las secuencias de las regiones citoplasmáticas del mAChR subtipo m3 se encontró un 99% de similitud con los receptores m3 de cerebro de bovino (UO8286) y un 95% con los receptores de humano. El asa i2 del receptor m3 es de particular interés debido a que su secuencia esta ampliamente conservada entre la mayor parte de los receptores de siete dominios transmembrana acoplados a proteínas G (DRYFSITRPLTYRAKRTTKR, 490 – 550).
El asa i3 de los receptores muscarínicos representa el determinante estructural primario que dicta el acoplamiento selectivo a las proteínas G(2). Las secuencias de las porciones N-terminal y C-terminal del receptor m3 fueron respectivamente MTILYWRIYKETEK y MSLIKEKKAAQTLSA, estas regiones se encuentran implicadas en el reconocimiento y activación de proteínas G(6,7,8).
Con relación al receptor m2 se encontró un alto grado de similitud (99%) con el reportado para el receptor de glándula adrenal de bovino. La porción C-terminal del asa i3 de este receptor (PPSPGKEGDPDRS) difiere significativamente con respecto al receptor m2 humano sugiriendo posibles diferencias en las proteínas G que se acoplan a estos receptores.
Figura 1: Identificación por RT-PCR de las asa intracelulares de los subtipos de receptores muscarínicos m2 (i3m2) y m3 (i2m3 e i3m2).
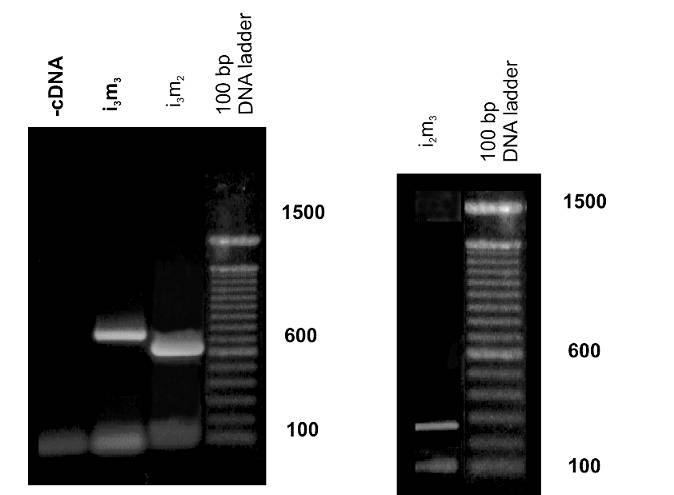
Los ensayos de RT-PCR fueron desarrollados con primers específicos. Los productos amplificados fueron separados en geles de agarosa: (a) 1,5%, i3m2 e i3m3 y (b) 2% i2m3. El tamaño de los productos amplificados fue: 170 bp (i2m3); 730 bp (i3m3) y 680 bp (i3m2).
Conclusiones
1. En este estudio se presenta por primera vez el clonamiento parcial de dos subtipos de receptores muscarínicos presentes en músculo liso de las vías aéreas de bovino. El conocimiento de estas secuencias permitirá una mayor profundización en las vías de señalización intracelular descritas para este músculo.
2. La secuencia nucleotídica de las regiones intracelulares i2 e i3 del receptor m3 del músculo liso traqueal de bovino fue significativamente similar a la encontrada en cerebro de bovino, lo que sugiere posibles similitudes en la interacción con proteínas G del mismo subtipo.
3. La secuencia nucleotídica del asa i3 del receptor m2 del músculo liso traqueal de bovino fue diferente en aquellos residuos del extremo final del asa i3 con respecto al receptor m2 de humano. La importancia de esta diferencia es desconocida y debe ser evaluada.
Agradecimientos
Financiado por los proyectos: CDCH 09-33-4853-2001 (RGA) y CONICIT S1-97000116 (RGA). Este trabajo forma parte de la Tesis Doctoral del E.G. Gustavo Bruges en el Postgrado de Farmacología de la Facultad de Farmacia. U.C.V.
Referencias bibliográficas
1. Caulfield MP. Muscarinic receptors, characterization, coupling and function. Pharmacol. Ther. 1993; 58: 319-379. [ Links ]
2. Hulme EC, Birdsall NJM and Buckley NJ. Muscarinic receptor subtypes. Annu. Rev. Pharmacol. Toxicol. 1990; 30: 590-593. [ Links ]
3. Simon MI, Strathmann MP, Gautam N. Diversity of G-proteins in signal transduction. Science 1991; 252: 802-808. [ Links ]
4. Alfonzo MJ, Lippo de Bécemberg IL, Sanchez de Villarroel SS, Napoleón de Herrera VN, Misle AJ and González de Alfonzo RG. Two opposite signal transducing mechanisms regulate a G-protedin-coupled guanylyl cyclase Arch. Biochem. Biophys. 1998; 350: 19-25. [ Links ]
5. Chomczynski P and Sacchi N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Anal. Biochem. 1987; 162: 156-159. [ Links ]
6. Sanger F. Determinating of nucleotide sequences in DNA. Science 1981; 214: 1205-1210. [ Links ]
7. Lameh J, Philiph M, Sharma YK, Moro O, Ramachandram J and Saede WJ. Hm1 muscarinic cholinergic receptor internalization requires a domain in the third cytoplasmatic loop. J. Biol. Chem. 1992; 267: 13406-13412. [ Links ]
8. Wess J. Molecular basis of muscarinic acetylcholine receptor function. Trends Pharmacol. Sci. 1993; 14: 308-313. [ Links ]













