Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Facultad de Medicina
versión impresa ISSN 0798-0469
RFM v.25 n.1 Caracas ene. 2002
S Sánchez de V2, L Guerra de G2, A Borges2, R González de A2, I Lippo de B1,2 y M Alfonzo1,2.
RESUMEN:
En las membranas plasmáticas de la fracción P2, obtenida del fraccionamiento subcelular de las vías aéreas de bovino, está presente una guanililciclasa (GC) sensible a agentes muscarínicos y a inhibición por NaCl, este último efecto está mediado a través de una proteína G sensible a toxina pertussis. Al evaluar el efecto del ANP y CNP sobre esta GC, se encontró que los péptidos estimulan la actividad basal de la enzima y revierten el efecto inhibitorio del NaCl; indicando estos resultados la presencia de GC-A y GC-B en el sistema, y la existencia de una proteína G inhibitoria interviniendo en la regulación de esta enzimas. El mastoparán estimula el efecto del ANP y CNP sobre estas GCs, sugiriendo que en la regulación de estas enzimas interviene una proteína G activadora, a través de la cual media su efecto el mastoparán.
Palabras Clave: Guanililciclasa-proteína G-mastoparán.
ABSTRACT:
In the plasma membranes obtained by fractionation of smooth muscle bovine airways, a guanylyl cyclase activity has been described which is subjected to regulation by muscarinic agonists and inhibited by NaCl. This latter effect is mediated through a Pertussis Toxin-sensitive G-protein. It was found that natriuretic peptides ANP and CNP were able to stimulate basal GC activity and reverse the NaCl inhibitory effect. These results indicate that both GC-A (ANP sensitive) and GC-B (CNP sensitive) are present in the bovine trachealis and that an inhibitory G-protein regulates their functioning. The wasp venom derived peptide mastoparan was also shown to enchance the ANP and CNP effect on GC activity, but was not able to reverse the NaCl inhibitory effect. These data is indicative of the presence of a stimulatory G-protein in bovine airways through which mastopara exerts its effect on GC activity.
Key Words: Guanylyl cyclase-G protein- natriuretic peptides.
INTRODUCCIÓN
Las guanililciclasas (GCs) [GTP pirofosfato liasas (E.C.4.6.1.2] son enzimas citoplasmáticas y asociadas a las membranas que catalizan la conversión de GTP a GMPc, un segundo mensajero intracelular(1). Las GCs particuladas incluyen los receptores para los péptidos natriuréticos, tales como la GC-A, activada por el péptido auricular (ANP) y cerebral (BNP), y la GC-B estimulada por el péptido tipo C (CNP)(2,3). El efecto de la activación muscarínica sobre los procesos de contracción-relajación del músculo liso de las vías aéreas, está ligada a un incremento en los niveles de GMPc(4), y en los últimos años ha aumentado el interés en el estudio del papel que desempeña el GMPc producido por la GC particulada en estos procesos. En fracciones de membranas plasmáticas (P2) aisladas del músculo liso traqueal de bovino (MLTB), está presente una GC (dependiente de Mn2+) sensible a agentes muscarínicos, cuya actividad está dualmente regulada a través de receptores muscarínicos (mAchRs) del sub-tipo M3, asociados a una proteína G insensible a la toxina pertussis (PTX), y del sub-tipo M2, asociados a una proteína G sensible a sales de cloruros y a PTX, dichos receptores median la activación y la inhibición respectivamente, de los niveles de GMPc en este sistema(5,6). El mastoparán (MAS), un tetradecapéptido catiónico (Ile-Asn-Leu-Lys+-Ala-Leu-Ala-Ala-Leu-Ala-Lys+-Lys+-Ile-Leu), obtenido del veneno de las avispas, al enlazarse en la bicapa lipídica, adopta una conformación que mimetiza el dominio de los receptores donde ocurre el enlazamiento con las proteínas G. Diversos estudios han demostrado que el MAS acelera el intercambio de GDP/GTP e incrementa la actividad GTP-ásica de algunas proteínas G purificadas tales como Gi y Go(7,8).
En este trabajo presentamos resultados parciales relacionados con la regulación de la GC del MLTB a través de las proteínas enlazadoras de GTP; con esta finalidad, estudiamos el efecto de los péptidos natriuréticos ANP-28 y CNP-22 sobre la actividad basal de esta GC, así como la actividad de la enzima en presencia de agentes que actúan sobre las proteínas G, tales como el GTPgS y el mastoparán.
MATERIALES Y MÉTODOS
La fracción P2 es obtenida a partir del fraccionamiento subcelular del MLTB, realizado de acuerdo al protocolo descrito previamente(1). La fracción microsomal (P), se somete a una centrifugación diferencial en gradiente discontínuo de sacarosa (0.3-1.28 M) a 80.000 x g x 60 minutos, obteniendose las fracciones: P1 (fracción liviana de membranas plasmáticas) en la interfase 0.3-0.82M, P2 (fracción pesada de membranas plasmáticas) en la interfase 0.82-1.28 M. La fracción P2 presenta los valores mas elevados de actividad específica de guanililciclasa, resultado que justifica la selección de esta fracción de membranas para realizar el presente estudio. La actividad de la GC se determinó de acuerdo al método descrito por Lippo de B, et al(6).
RESULTADOS Y DISCUSIÓN
En la Figura 1 se representa la actividad de la GC de la fracción P2 en función de la concentración de CNP-22, puede observarse que el péptido estimula la actividad basal de la GC de una manera dependiente de la concentración, en ausencia y presencia de la sal, y así mismo, que el péptido revierte el efecto inhibidor que ejerce el NaCl sobre la enzima. Un efecto similar al CNP-22, ejerce el ANP-28 sobre la actividad de esta GC, tal como indican los resultados mostrados en la Figura 2. Los resultados de la Figura 3 muestran que el MAS estimula significativamente la actividad basal de la GC presente en las membranas plasmáticas de la fracción P2, en ausencia y presencia de NaCl respectívamente, pero no revierte la inhibición ejercida por la sal, sugiriendo este resultado la participación de una proteína G estimuladora en ambas condiciones. La especificidad del efecto del MAS se comprobó estudiando la actividad de la GC en presencia de los análogos del MAS: MAS-7 y MAS-17 (resultados no mostrados); en presencia del MAS-7, un análogo mas potente que el MAS, a una concentración de 1x10-4 M, incrementa la actividad basal de la GC 4 y 6 veces en presencia y ausencia de NaCl respectívamente, mientras que el análogo inactivo del MAS, el MAS-17 fue incapaz de modificar la actividad basal de la enzima en ambas condiciones. En la Tabla 1 se muestran los resultados obtenidos al estudiar el efecto del GTPgS y MAS sobre la actividad de la GC de la fracción P2 en presencia de CNP-22 y ANP-28, puede observarse que MAS potencia de manera sinérgica la acción del CNP y ANP sobre la actividad basal de la enzima, mientras que el GTPgS estimula la actividad basal de la enzima, pero potencia muy poco la acción de estos péptidos.
Figura 1: Efecto del CNP-22 sobre la actividad GC de la fracción P2 del MLTB. 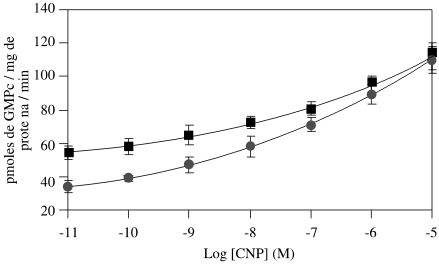
La actividad de la enzima (10-15 mgr de proteína) se determinó en ausencia (¦) y presencia de NaCl 0.2 M (*), GTP 200 mM, sistema regenerante de GTP, durante 5 minutos a 37ºC. La cantidad de GMPc se estimó por RIE. Cada valor representa el promedio de 3 experimentos ± el error estándar realizado por triplicado.
Figura 2: Efecto del ANP-28 sobre la actividad GC de la fracción P2 del MLTB.
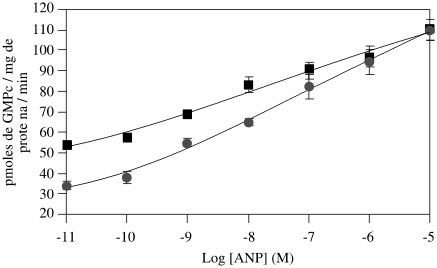
La actividad de la enzima (10-15 mgr de proteína) se determinó en ausencia (¦) y presencia de NaCl 0.2 M (*), GTP 200 mM, sistema regenerante de GTP, durante 5 minutos a 37°C. La cantidad de GMPc se estimó por RIE. Cada valor representa el promedio de 3 experimentos ± el error estándar realizado por triplicado.
Figura 3: Efecto del Mastoparán sobre la actividad de GC de la fracción P2 del MLTB.
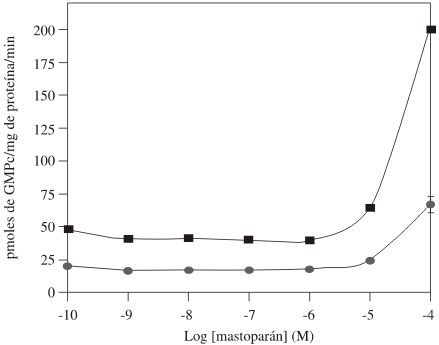
La actividad de la enzima (10-15 mgr de proteína) se determinó en ausencia (¦) y presencia de NaCl 0.2 M (*), GTP 200 mM, sistema regenerante de GTP, durante 5 minutos a 37ºC. La cantidad de GMPc se ensayó por RIE. Cada valor representa el promedio de 3 experimentos ± el error estándar realizado por triplicado.
Tabla 1: Efecto del GTPgS y MASTOPARÁN sobre la actividad basal de la GC del MLTB en presencia de ANP-28 y CNP-22
| Actividad de GC como pmoles de GMPc/ mg de proteína/min | ||||
| Péptido | Basal | GTPgS | MAS | MAS+GTP gS |
| - | 55 ± 3 | 87 ± 4 | 141 ± 8 | 128 ± 8 |
| ANP-28 | 90 ± 8 | 105 ± 6 | 206 ± 9 | 189 ± 10 |
| CNP-22 | 88 ± 4 | 100 ± 5 | 213 ± 11 | 190 ± 8 |
La actividad de la GC (10 a 12
mgr de proteína) se determinó en presencia de GTP 200 mM, MnCl2 3mM, sistema regenerador de GTP, MAS 50 mM, GTPgS 100 mM, ANP-28 y CNP-22 10-6M, durante 5 minutos a 37ºC. La cantidad de GMPc se estrimó por RIE. Los resultados representan el promedio de tres experimentos realizados por triplicado ± el error estándar.CONCLUSIONES
Los péptidos natriuréticos ANP-28 y CNP-22, estimulan la actividad de la GC de la fracción P2 de una manera dependiente de la concentración, indicando que la GC-A y GC-B están presentes en las vías aéreas de bovino. Así mismo, los péptidos revierten la inhibición ejercida por el NaCl sobre la actividad basal de la enzima, el cual está mediado a través de una proteína G sensible a PTX, este efecto sugiere que esta proteína G interviene en la regulación de estas guanililciclasas. La estimulación ejercida por el MAS sobre la actividad de la GC del MLTB, en ausencia y presencia de NaCl, sugiere que tal efecto está mediado a través de una proteína G activadora. Los resultados mostrados sugieren la participación de proteínas G estimuladoras e inhibidoras comprometidas en la regulación de las GC-A y GC-B presentes en las membranas del MLTB.
AGRADECIMIENTO
Financiado por proyectos CDCH 09.33.4119.98(SSU), CONICIT S1-097000116 (RGA) y CDCH 09.33.4764-2000 (ILB)
REFERENCIAS BIBLIOGRÁFICAS
1. Chinkers M. Signal Transduction by Guanylyl Cyclases. Annu. Rev. Biochem. 1991; 60: 553-75. [ Links ]
2. Schultz S and Waldman SA. The Guanylyl Cyclase Family of Natriuretic Peptide Receptors. Vitamins and Hormones. 1999; 57: 123-151. [ Links ]
3. Wilkins M, Nunez D and Wharton J. The natriuretic peptide family: turning hormones into drugs. Journal of Endocrinology. 1993; 137: 347-359. [ Links ]
4. Guerra de G, Misle A, Pacheco G, Napoleón de HV, González de AR. Lippo de BI and Alfonzo M. Effects of 1H-[1,2,4]Oxadiazolo[4,3-a]quinoxalin-1-one(ODQ) and NW(6)-Nitro-L-arginine methyl ester (NAME) on cyclic GMP levels during muscarinic activation of tracheal smooth muscle. Biochem Pharmacol. 1999; 58: 563-569. [ Links ]
5. Alfonzo M, Becemberg I, Villarroel S, Herrera V, Misle A and Alfonzo R. Two Opposite Signal Transducing Mechanisms Regulate a G-protein-Coupled Guanylyl Cyclase. Archives of Biochemistry and Biophysics. 1998; 350: 19-25. [ Links ]
6. Bécemberg I, Adjounian M, Sánchez de VS, Peña de AE, Gonzalez de AR and Alfonzo M. G-.protein sensitive Guanylyl Cyclase Activity associated with Plasma Membranes. Archives of Biochemistry and Biophysics. 1995; 324(2) 20: 209-215. [ Links ]
7. Weingarten R, Ransnas L, Mueller H and Bokoch G. Mastoparan interacts with the Carboxyl Terminus of the alfa Subunit of Gi. The Journal of Biological Chemistry . 1990; 263(19): 11044-11049. [ Links ]
8. Higashijima T, Burnier J and Ross E. Regulation of Gi and Go by Mastoparan, Related Amphiphilic Peptides, and Hydrofobic Amines. The Journal of Biological Chemistry. 1990; 265(24): 14176-14186. [ Links ]













