Revista del Instituto Nacional de Higiene Rafael Rangel
versión impresa ISSN 0798-0477
INHRR v.38 n.2 Caracas dic. 2007
Actividad de Glutatión Peroxidasa y Fibrosis Pulmonar: Papel de la Asociación N-Acetilcisteína-Trimetazidina en un Modelo Experimental con Paraquat.
Yalitza Aular1,2,3, Yolima Fernández1, Aldo Reigosa 3, Glenda Landaeta1, Rosalia Sutil1,2
1 Maestría en Toxicología Analítica. Facultad de Ciencias de la Salud. Universidad de Carabobo.
2 Departamento de Farmacología. Escuela de Medicina. Facultad de Ciencias de la Salud. Universidad de Carabobo.
3 Centro de Investigaciones Médicas y Biotecnológicas de la Universidad de Carabobo (CIMBUC). Facultad de Ciencias de la Salud. Universidad de Carabobo.
Autor de Correspondencia: Dra. Yalitza Aular, Maestría en Toxicología Analítica. Departamento de Farmacología. Facultad de Ciencias de la Salud. Universidad de Carabobo. Teléfonos: 0416- 640 94 27. ydaular@uc.edu.ve
RESUMEN
Diversos autores han mostrado que el estrés oxidativo provocado por el paraquat genera precursores fibrogénicos, resultando la fibrosis pulmonar (FP), por lo tanto, la valoración de actividad de glutatión peroxidasa (AGPx) podría ser de utilidad para indicar un posible de desarrollo de FP luego de la intoxicación con paraquat. Se han empleado numerosos tratamientos para controlar y prevenir esta condición, sin embargo, estos no han sido concluyentes. Por lo que se decidió evaluar el efecto de la asociación N-acetilcisteina (NAC)-Trimetazidina (TMZ) sobre la AGPx y la FP, en un modelo experimental con ratas intoxicadas con paraquat, utilizando 60 ratas machos divididas en 8 grupos: 1 (control negativo), 2 (control positivo, recibieron 11mg/kg de Paraquat IP), 3 (pretratados con 39 mg/kg NAC VO), 4 (tratados con 39 mg/kg NAC VO), 5 (pretratados con 5 mg/kg TMZ VO), 6 (tratados con 5 mg/kg TMZ VO), 7 (pretratados con NAC-TMZ VO), 8 (tratados con NAC-TMZ VO). Los resultados mostraron: la AGPx en los grupos 3, 4, 8 se mantuvo similar al grupo 1 y con cambios significativos (P<0.05) con relación al grupo 2, en cuanto a la FP en el grupo 8 se observó una disminución con respecto al grupo 4. Se Concluye que la asociación NAC-TMZ mantiene la AGPx y previene la FP.
Palabras Clave: Intoxicación, paraquat, fibrosis, estrés oxidativo.
ABSTRACT
Diverse authors have shown that oxidative stress caused by the paraquat generates precursory fibrogenic, being the lung fibrosis (FP), therefore, the valuation of activity of glutathione peroxidase (AGPx) could be useful to indicate a possible development of FP after the paraquat intoxication. Numerous treatments have been used to control and to prevent this condition, however, these have not been conclusive. For that we decided to evaluate the effect of the association N-acetilcysteine (NAC)-Trimetazidine (TMZ) on the AGPx and the FP, in an experimental model with rats intoxicated with paraquat, using 60 rats males divided in 8 groups: 1 (negative control), 2 (positive control, received 11mg/kg of Paraquat IP), 3 (pre-treated with 39 mg/kg NAC VO), 4 (treated with 39 mg/kg NAC VO), 5 (pre-treated with 5 mg/kg TMZ VO), 6 (treated with 5 mg/kg TMZ VO), 7 (pre-treated with NAC-TMZ VO), 8 (treated with NAC-TMZ VO). The results showed: the AGPx in the groups 3, 4, 8 stayed like to the group 1 and with significant changes (P <0.05) with relationship to the group 2, as for the FP in the group 8 a decrease was observed with regard to the group 4. It can be concluded that the association NAC-TMZ maintains AGPx and prevents FP.
Key Words: Intoxication, paraquat, fibrosis, oxidative stress.
INTRODUCCIÓN
El paraquat (PQ), es un herbicida biperidilo (1.1 dimetil-4,4 biperidilo) introducido comercialmente en 1962, muy ampliamente utilizado en agricultura (1) debido a su rápida desactivación en contacto con el suelo (2). Sin embargo, su intoxicación es letal con muy pequeñas dosis del producto, llegando a mortalidad del 100% de los casos (3,4), debido a la falla de múltiples órganos. Sus manifestaciones inicialmente son vómitos, diarrea y pérdida de peso, producto de la acción deletérea del PQ en la etapa aguda de intoxicación (5). Diversos autores (6,7,8) han mostrado que el PQ induce fibrosis pulmonar en humanos, monos, perros y ratas. El daño celular es debido a la producción de radicales libres como el anión superóxido (O2-), los cuales se oxidan y se convierten en peróxidos (H2O2), estos van a provocar la peroxidación lipídica de las membranas celulares que conlleva a la muerte celular. Para contrarrestar los efectos oxidantes de los radicales libres, el organismo cuenta con un sistema de defensa antioxidante que interactúa con las especies reactivas de oxígeno para mantener el equilibrio prooxidante/antioxidante y así protegerse de los riesgos que conllevan el estrés oxidativo (9). Este sistema está constituido por antioxidantes exógenos: vitaminas A, E, C betacarotenos, y endógenos: Superóxido dismutasa (SOD), catalasa (CAT) y Glutatión peróxidasa (GPx) (10).
La GPx es una enzima que evita la oxidación de los lipoperóxidos, reduciéndolos en presencia de Glutatión, de acuerdo a la siguiente reacción (11):
H2O2 GPx c 2H2O
ó + 2GSH
ó + GSSG
LOOH GPx p L-OH
A través de los años se han utilizado diferentes modalidades de tratamiento para prevenir la fibrosis pulmonar (12), tales como: inhibidores de la enzima convertidora de la angiotensina (13), vitaminas E y C, antiinflamatorios (14). Además, se ha hecho énfasis en los antioxidantes para combatir la generación de especies reactivas de oxígeno producidos por el PQ (15).
En este sentido la N-acetilcisteína (NAC), estimula la síntesis de Glutatión (GSH), agente reductor en el metabolismo del H2O2, en una reacción catalizada por la GPx, reduciendo efectivamente los radicales libres y otros oxidantes (16).
La trimetazidina (TMZ), además del efecto antiinflamatorio (migración y acción de los polimorfonucleares), protege el hidrogenion del Nicotiamida Adenín Dinucleótido reducido (NADH) permitiendo la reacción reversible NAD ![]() NADH y el consiguiente mantenimiento de la cadena oxidativa respiratoria mitocondrial, contribuyendo en la disminución de la producción de especies reactivas de oxígeno (17).
NADH y el consiguiente mantenimiento de la cadena oxidativa respiratoria mitocondrial, contribuyendo en la disminución de la producción de especies reactivas de oxígeno (17).
En el presente estudio, se evalúa el efecto de la asociación de NAC-TMZ sobre el peso, la Actividad de glutatión peróxidasa (AGPx) y la fibrosis pulmonar en un modelo experimental con PQ en ratas.
MATERIALES Y MÉTODOS
Tipo de Investigación.
Está basada en un estudio básico de tipo experimental, de nivel explicativo.
Muestra
Se utilizaron 60 ratas machos Sprague Dawley, con peso corporal entre 270-350 g de peso, suministradas por el Bioterio Central de la Facultad de Ciencias de la Salud de la Universidad de Carabobo, las mismas se mantuvieron en el Bioterio del Departamento de Farmacología de la Escuela de Medicina de la Universidad de Carabobo, en jaulas adecuadas para su especie e identificadas con tarjetas correspondientes al tratamiento, condiciones de luz, humedad y temperatura, siguiendo lo establecido en las Normas para Manejo y Cuidados de Animales (18); alimentados con Ratarina® (Protinal) y agua acidificada con ácido clorhídrico 0,1N (19) ad libitum.
Los animales se dividieron al azar en 8 grupos:
Grupo 1: Control Negativo: 6 Ratas a las que sólo se les administró por vía oral solución fisiológica al 0,9% en volumen equivalente a sustancia en estudio y no recibieron ningún tratamiento.
Grupo 2: Control Positivo: 6 Ratas a las que se les administró por vía intraperitoneal una dosis única de 11 mg/Kg. Peso de PQ (Gramoxone ®) (15), no recibieron ningún tratamiento.
Grupo 3: 8 Ratas a las que se les administró 39mg/Kg. peso de NAC (Fluimucil®) por vía oral (20) (pre tratamiento), 10 días antes de la intoxicación con 11mg/Kg. peso de PQ, luego de la intoxicación se continuó el tratamiento por 21 días.
Grupo 4: 8 Ratas a las que se les administró 11mg/Kg. peso de PQ e inmediatamente 39 mg/Kg. peso de NAC por vía oral por 21 días.
Grupo 5: 8 Ratas a las que se les administró 5mg/Kg. peso de TMZ (Vastarel ®) vía oral (21) (pre tratamiento), 10 días antes de la intoxicación con 11mg/Kg. peso de PQ, luego de la intoxicación se mantuvo el tratamiento por 21 días.
Grupo 6: 8 Ratas a las cuales se les administró 11mg/Kg. peso de PQ por vía intraperitoneal e inmediatamente 5mg/Kg. peso de TMZ vía oral por 21 días.
Grupo 7: 8 Ratas a las que se les administró 39 mg/Kg. peso de NAC por vía oral y 5 mg/Kg. peso de TMZ vía oral (pre tratamiento), 10 días antes de la intoxicación con 11mg/Kg. peso de PQ, luego de la intoxicación se continúa el tratamiento por 21 días.
Grupo 8: Ratas a las que se les administró 11mg/Kg. peso de PQ e inmediatamente 39 mg/Kg. peso de NAC por vía oral y 5 mg/Kg. peso de TMZ vía oral por 21 días.
Procedimiento
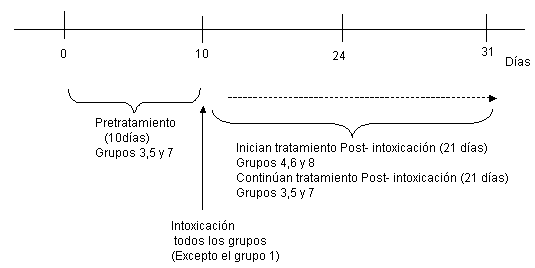
El día cero (0) de investigación se inició el pre tratamiento por 10 días a los grupos 3, 5 y 7; los grupos 1, 2, 4, 6 y 8 solo recibieron solución fisiológica durante ese periodo. El día 10 de experimentación se administró por vía intraperitoneal 11 mg/Kg de peso de PQ a los grupos del 2 al 8. Los grupos 4, 6 y 8 iniciaron tratamiento por 21 días y se continúa el tratamiento correspondiente hasta el día 31 de experimentación a los grupos 3, 5 y 7. (22).
Recolección de datos
Los días 0, 10, 21 y 31 de experimentación se extrajeron de la vena de cola (18), previo ayuno de 12 horas, 2 ml de sangre y se colocaron en tubo con EDTA para la determinación de AGPx.
Todos los animales en estudio fueron pesados semanalmente, siempre a la misma hora para evitar errores.
Durante el periodo experimental, se realizó reporte de la sobrevida dos veces al día de todos los grupos en estudio, cuando se observaba el deceso de algún animal se procedía a realizar la extracción de los pulmones y se conservaban en formol al 10%. El día 31 de experimentación fueron sacrificados los animales que sobrevivieron, utilizando la técnica de dislocación cervical (23).
Técnicas Histológicas
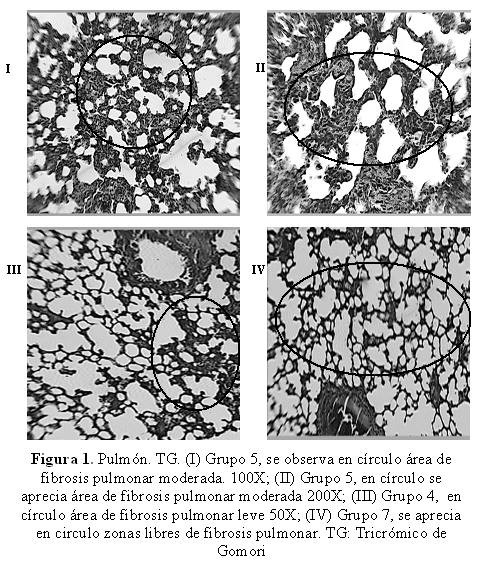
Fueron obtenidas muestras de la porción media de cada lóbulo de ambos pulmones de todos los animales en estudio, los cortes fueron fijados en solución de formol al 10%. Se procesaron siguiendo las técnicas convencionales histológicas para microscopia de luz mediante: fijación, deshidratación, inclusión en parafina, cortes de 0,5 micras de espesor y finalmente coloración con Tricrómico de Gomori para fibras colágenas (24). Todos los cortes fueron examinados y reportados como presencia e intensidad de la fibrosis pulmonar, de acuerdo con la siguiente escala: I: leve(cuando el contenido de fibras colágenas en los septum alveolares ocupó menos del 5 por ciento de la superficie del corte histológico), II: moderada(cuando ocupó mas del 5 y menos del 90 por ciento de la superficie del corte histológico), III: severa(cuando ocupó mas del 90 por ciento de la superficie del corte histológico).
Determinación de A GPx
Para la determinación en plasma de la AGPx , se utilizó el método de Flohé y Günzler (25), cuyo fundamento se basa en cuantificar el cambio en la absorbancia a 340nm causado por la oxidación del NADPH. Definiendo una unidad de la enzima como la cantidad de enzima que genera la oxidación de 1.0 µM de NADPH a NADP por minuto a 37 º C. Para ello, se colocó en una microcubeta 500µl de buffer fosfato (pH 7.0), 100µl de la muestra, l00 µl plasma adicionar, 100 µl de glutation reductasa (0,24 U), 100 µl Glutatión reducido (10mM). La mezcla es preincubada por 10 min a temperatura ambiente, luego 100 µl de una solución de 150 NADPH es añadida, el consumo de NADPH es independiente de H2O2 es monitoreada por 3 min. La reacción se iniciará con la adición de 100 µl de H2O2, y el descenso en la absorción a 340nm es monitoreado por 5 min.
Análisis Estadístico
Los resultados se expresaron como media ± desviación estándar, valores absolutos y porcentajes, tabulados y analizados con el paquete estadístico SPSS versión 12.0, utilizando ANOVA y Test de Tukey.
RESULTADOS
Los valores promedios de la AGPx durante el periodo experimental se muestran en la tabla 1, observándose que los grupos 1, 3, 4 y 8 no se evidenciaron cambios significativos en la AGPx. Los grupos 2 (control positivo) y 5 (TMZ sola, previo a la intoxicación con PQ), presentaron disminución significativa de la AGPx para el día 24 y el 31 de experimentación en el grupo 5.
Tabla 1. Valores promedio de Actividad de Glutatión peróxidasa de los grupos experimentales.
|
| Actividad de Glutatión peróxidasa U/ml. x min. | |||
| Grupo | Día 0 (Basal) | Día 10 | Día 24 | Día 31 |
| 1 (n=6) | 26,3±9 | 27±8.5 | 24±8.5 | 24±8.5 |
| 2(n=6) | 27±10 | 30±9 | 12±4*10 | ---- |
| 3 (n=8) | 32.5±10 | 32.7±7.4 | 17±1.4 | 18.5±3.5 |
| 4(n=8) | 36.7±12 | 32±10 | 29±10 | 23±3.5 |
| 5(n=8) | 37±10 | 31.7±13 | 18.6±2**B | 13.6±1.5**B, 10,*& |
| 6(n=8) | 31±10 | 32.7±11 | ---- | ---- |
| 7(n=8) | 31±10 | 33.6±15 | 17.5±2 | 17.2±5*10 |
| 8(n=8) | 30±9 | 31±8 | 26±8.9 | 22±7 |
Control n = 6-Experimentales n=8
**B:p<0.01 con respecto a la basal; *10: p<0.05 con respecto al día 10; *&: p<0.05 con respecto al control negativo el día 31 de experimentación.
Valores X±DS. 1: control negativo, 2: control positivo, 3: NAC pre intoxicación, 4: NAC post intoxicación, 5: TMZ pre intoxicación, 6: TMZ post intoxicación, 7: NAC y TMZ pre intoxicación, 8: NAC y TMZ post intoxicación.
Los animales de todos los grupos experimentales mostraron aumento de peso corporal durante las dos primeras semanas de experimentación, con disminución no significativa del mismo para la tercera semana en los grupos 2, 5, 7 y 8. A partir de la cuarta semana comienza la recuperación de peso en los grupos, continuando el aumento hasta el final del estudio (Tabla 2).
Tabla 2. Valores promedio de peso de los grupos experimentales.
|
Peso (g) | ||||||
| Grupos (n inicial) | Semana 0 | Semana 1 | Semana 2 | Semana 3 | Semana 4 | Semana 5 |
| 1(n=6) | 322±19.96 | 355±17.10 | 375±21.91 | 390±50.39 | 402±52.35 | 418±43.18 |
| 2(n=6) | 326±32.71 | 344±43.22 | 368±52.48 | 348±13.44 | --- | --- |
| 3(n=8) | 302±24.95 | 321±26.43 | 350±27.73 | 364±36.76 | 399±32.52 | 416±34.64 |
| 4(n=8) | 290±13.69 | 316±26 | 317±15.20 | 329±1.44 | 343±16.26 | 368±14.14 |
| 5(n=8) | 324±20.30 | 354±13.86 | 364±13.51 | 347±38.55 | 374±22.53 | 390±16.40 |
| 6(n=8) | 283±13.36 | 293±19 | 306±20.83 | 312±6.88 | --- | --- |
| 7(n=8) | 369±36.62 | 371±37.03 | 383±40.65 | 375±45.69 | 391±41.30 | 397±39.45 |
| 8(n=8) | 275±19.02 | 287±19.49 | 298±21.64 | 287±19.49 | 312±16.73 | 329±17.74 |
Valores X±DS. 1 control negativo, 2: control positivo, 3: NAC pre intoxicación, 4: NAC post intoxicación, 5: TMZ pre intoxicación, 6: TMZ post intoxicación, 7: NAC y TMZ pre intoxicación, 8: NAC y TMZ post intoxicación.
Con relación a la fibrosis pulmonar, como se muestra en la Tabla 3, los animales del grupo 3 (pretratados con NAC) que sobrevivieron hasta el final de periodo experimental no presentaron fibrosis pulmonar, el mismo comportamiento mostraron los grupos 7 y 8, a los cuales se asoció como pre y post tratamiento la NAC y TMZ.
Tabla 3. Presencia e Intensidad de la Fibrosis Pulmonar
| Grupo | Sobrevivientes (n final día 31) | Presencia e intensidad de Fibrosis Pulmonar | |
| Presente | Ausente | ||
| 1(n=6) | 6 | 6 | |
| 2(n=6) | 0 | No Aplica | |
| 3(n=8) | 3 | 0 | 3 |
| 4(n=8) | 2 | (1)I | 1 |
| 5(n=8) | 3 | (2)II | 1 |
| 6(n=8) | 0 | No aplica | |
| 7(n=8) | 4 | 0 | 4 |
| 8(n=8) | 4 | 0 | 4 |
Escala 0 a III; 0 = sin alteraciones, I= leve, II= moderada, III= severa.
1 control negativo, 2: control positivo, 3: NAC pre intoxicación, 4: NAC post intoxicación, 5: TMZ pre intoxicación, 6: TMZ post intoxicación, 7: NAC y TMZ pre intoxicación, 8: NAC y TMZ post intoxicación.
Con relación a la fibrosis pulmonar, como se muestra en la Tabla 3, los animales del grupo 3 (pretratados con NAC) que sobrevivieron hasta el final de periodo experimental no presentaron fibrosis pulmonar, el mismo comportamiento mostraron los grupos 7 y 8, a los cuales se asoció como pre y post tratamiento la NAC y TMZ.
En la figura 1- I y II, se observa fibrosis pulmonar moderada (aumento del contenido de fibras colágena, en septum alveolar), ésta abarcó mas del 5 y menos del 90 por ciento de la superficie del corte histológico y la presentaron 2 de animales del grupo 5 (TMZ, pre intoxicación) que sobrevivieron hasta el día 31 de experimentación. La figura 1-III muestra fibrosis pulmonar leve, es decir, el contenido de fibras colágenas en los septum alveolares ocupo menos del 5 por ciento de la superficie del corte histológico), la cual fue presentada por 1 de los animales sobrevivientes del grupo 4 (NAC, post intoxicación).
DISCUSIÓN
La determinación de la AGPx a todos los animales en estudio durante el período experimental reveló que en los grupos 3, 4 y 8 se mantuvieron los valores de la AGPx de manera semejante al grupo control negativo, lo que pudiera ser consecuencia de la administración de la NAC sola o asociada a TMZ, lo cual contribuyó a mantener el balance antioxidante y protector (26), lo que puede estar parcialmente relacionado con la capacidad de la GPx de eliminar especies reactivas que surgen por la presencia del PQ, lo cual coincide con otros investigadores (11,2,27), quienes han señalado que el PQ es un compuesto capaz de provocar formación de especies reactivas del oxígeno (28), se induce la peroxidación lipídica (29) y depleción del NADPH, produciéndose disminución de la AGPx, así como la de otras enzimas antioxidantes. Esta disminución está estrechamente relacionada con la depleción NADPH. La administración de NAC representa una alternativa favorable, ya que es una molécula que proporciona grupos – SH ( g glutamil cisteinil glicina) el agente redox más importante, pudiendo funcionar como cofactor de sistemas antioxidantes enzimáticos (glutatión peroxidasa) e interactuar directamente con los radicales O2. -- y OH , agente reductor en el metabolismo del H2 O2, disminuyendo efectivamente los radicales libres y otros oxidantes (27). Además la TMZ al proteger el hidrogeno del NADH favorece el mantenimiento de la cadena oxidativa respiratoria mitocondrial, contribuyendo en la disminución de la producción de especies reactivas de oxígeno (17).
En el presente estudio, los animales de todos los grupos experimentales (tabla 2) mostraron descenso del peso la tercera semana de experimentación con recuperación y aumento del mismo hasta el final del período experimental, este comportamiento es similar al observado por Chen y Lua (5) en un estudio para evaluar la toxicidad pulmonar de PQ en ratas y probablemente es debido a que durante la tercera semana se evidenciaron los efectos deletéreos del PQ y la administración del NAC y TMZ favoreció la recuperación del peso en las semanas subsiguientes.
Esta investigación reveló que los grupos 3 y 5 tratados con NAC y TMZ respectivamente, previo a la administración de PQ, mostraron una sobrevida similar. Sin embargo, la presencia de fibrosis pulmonar moderada en dos de los tres sobrevivientes del grupo 5, sugiere una mayor capacidad de la NAC pre tratamiento para prevenir la fibrosis pulmonar. Resultados similares a los del presente estudio, han sido reportados en una investigación (30), donde se evaluó los efectos de la NAC y la metilprednisolona sobre el daño pulmonar de la intoxicación por PQ en ratas, mostrando una reducción significativa del porcentaje de fibras colágenas indicativas de fibrosis pulmonar en el grupo que se administró NAC.
Es bien conocido que una estrategia terapéutica para aumentar la actividad antioxidante y prevenir o disminuir el daño tisular es el uso intravenoso u oral de la NAC, un precursor del glutatión y se ha demostrado que la administración de NAC aumenta los niveles de glutatión en el pulmón, mejorando o previniendo la fibrosis pulmonar (31).
En relación a los grupos 4 y 6 respectivamente, a los cuales se administró NAC y TMZ posterior a la intoxicación por PQ, se observó que el grupo 6 presentó un comportamiento semejante al grupo 2 (control positivo) en contraste con el grupo 4, en el cual la sobrevida fue mayor.
Estos hallazgos concuerdan con lo reportado por Lugo y col. (15) en un estudio experimental para evaluar el rol de Carboximetilcisteína (un análogo de la NAC) y la TMZ como antioxidantes alternativos.
Es posible que la menor capacidad protectora de la TMZ cuando fue administrada como terapia única, sea debido a que es un antioxidante indirecto, no interactúa directamente con los radicales libres sino que aumenta la actividad de enzimas como la GPx plasmática, que disminuye la formación de especies reactivas (32).
La asociación NAC - TMZ pre y post administración de PQ, mantuvo la AGPx, aumentó la sobrevida y previno la fibrosis pulmonar, probablemente al producirse un efecto sinérgico por la administración conjunta de los fármacos, que contribuyó a aumentar el estatus antioxidante, contrarrestando así la formación de radicales libres de oxígeno, responsables de la peroxidación lipídica y la fibrosis pulmonar.
La NAC ejerce su efecto antioxidante, gracias a que en un proceso metabólico es convertida en cisteína, la cual estimula la síntesis del glutatión. Este último desempeña un papel nucleofílico en forma conjugada con diversos compuestos como el PQ, adicionalmente actúa como agente reductor en el metabolismo del peróxido de hidrógeno u otros compuestos hidroperóxidos orgánicos en una reacción catalizada por la GPx (16), que sumado a la capacidad antioxidante de la TMZ, al aumentar la actividad de enzimas antioxidantes como GPx plasmática, disminuye la formación de especies reactivas de oxígeno (32), además la TMZ presenta cierta actividad contra la reacción inflamatoria, produce depleción de neutrófilos e inhibe la infiltración de leucocitos (17), que probablemente contribuyó al efecto protector contra la fibrosis pulmonar.
Los resultados obtenidos permitieron corroborar la elevada letalidad del PQ y la avidez de este herbicida por el tejido pulmonar, lo cual ha sido demostrado en humanos y animales (8,33), así la presente investigación mostró que la administración de NAC y su asociación con TMZ previno la fibrosis pulmonar en las ratas intoxicadas por PQ.
En consecuencia, se concluye que la asociación NAC- TMZ mantiene la AGPx y previene la fibrosis pulmonar sugiriendo un efecto protector de estos fármacos sobre el daño oxidativo inducido por PQ.
AGRADECIMIENTO:
Este trabajo forma parte del proyecto financiado por Consejo de Desarrollo Científico y Humanístico de la Universidad de Carabobo (CDCH – U.C.), bajo el N° 2005-0003.
REFERENCIAS BIBLIOGRAFÍCAS
1. Silva M, Valdivia P. Paraquat poisoning: An experimental model o dose-dependent acute lung injury due to surfactant dysfunction. Braz J Med and Bio Res. 1996; 31: 445 – 450. [ Links ]
2. Sae-Yong Hong, Jong-Oh Yang, Eun-Young Lee, Zee-Won Lee. Effects of N-acetyl-L-cysteine and Glutathione on Antioxidant Status of Human Serum and 3T3 Fibroblasts. J Korean Med Sci. 2003; 18: 649-654. [ Links ]
3. Camacho J, Díaz A, Riquez M, Jurado B, Jiménez J, Quesada J. Poisoning by organophosphates and Paraquat: a propos 14 cases. Rev. Clin. Esp. 1995; 195:623-626. [ Links ]
4. López A, Rivero C, Galban C, Mariño A, Piñeiro N, Ferrer E. Envenenamiento por Paraquat y hemoperfusión con carbón activado. An. Med. Interna (Madrid). 2002; 19 (6): 310-312. [ Links ]
5. Chen CH, Lua A. Lung Toxicity of paraquat in the rat. J Tox Env Health, 2000; 59: 477-487. [ Links ]
6. Murray R, Gibson J. A comparative study of Paraquat intoxication rats, guinea pigs, and monkeys. Exp. Mol. Pathol. 1972; 17: 317-325. [ Links ]
7. Hampson E, Pond S. Ultrastructure of canine lung during the proliferative phase of Paraquat toxicity. Br. J. Exp. Pathol.1998; 69: 57-68. [ Links ]
8. Satomi Y, Tsuchiya W, Miura D, Kasahara Y, Akahori F. DNA Microarray Análisis of Pulmonary Fibrosis three months after exposure to Paraquat in rats. J Tox Sci, 2006; 31 (4): 345-355. [ Links ]
9. Elejalde G. Oxidación entre la vida y la enfermedad. An Med. Interna (Madrid). 2001; 18:1-4. [ Links ]
10. Venereo JR. Daño oxidativo, radicales libres y antioxidantes. Rev Cubana Med Milit. 2002; 31 (2): 126-133. [ Links ]
11. Cisneros E, Balboa J, Céspedes E. Enzimas que participan como barreras fisiológicas para eliminar los radicales libres: III. Glutatión peroxidasa. Rev Cubana Invest Biomed. 1997; 16 (1): 10-15. [ Links ]
12. Ghazi-Khansari M, Mohammadi-Karahani A, Sotoudeh M, Mokhtary P, Pour-Esmaeil E, Maghsoud S. Antifibrotic effect of captopril and enalapril con Paraquat, induced lung fibrosis in rats. J Appl Toxicol. 2007; 27(4): 342-349. [ Links ]
13. Ghazi-Khansari M, Nasiri G, Honarjoo M. Decreasing the oxidant stress from paraquat in isolated perfused rat lung using captopril and niacin. Arch Toxicol. 2005 Jun; 79(6):341-345. [ Links ]
14. Shahar E, Keidar I, Hertzeg E, Barzilay Z. Effectiveness of vitamin E and colchicine in amelioration of paraquat lung injuries using an experimental model. Isr J Med Sci. 1989; 25: 92-94. [ Links ]
15. Lugo NV, Pascuzzo C, Maradei I, Ramírez M, Sosa M, Agüero R, et al. Prolonged survival after experimental paraquat intoxication: Role of alternative antioxidants. Vet Hum Toxicol. 2002 February; 44 (1): 40-41. [ Links ]
16. Suntres Z. Role of antioxidants in Paraquat toxicity. Toxicology. 2002; 180: 65-77. [ Links ]
17. Tellier P. Trimetazidina: Del efecto citoprotector a la eficacia antiisquemica. Antiox Calid Vid [en línea] 1999 Octubre [Fecha de acceso 15 de Junio de 2004]. URL Disponible en: http://www.antioxidantes.com.ar. [ Links ]
18. Van Zutphen L, Baumans V, Beynen A. Procedimientos experimentales. En: Van Zutphen L, Baumans V, Beynen A. Principios de la Ciencia del Animal de Laboratorio. Una contribución al empleo y cuidado humanitario de los animales y a la calidad de los resultados experimentales. Granada, España: Edición Especial ELSEVIER; 1999. p. 331-351. [ Links ]
19. Duran DJ. Introducción a la ciencia de los animales de laboratorio. Universidad de los Andes;1998. [ Links ]
20. García J, Frontado C, Tilac C, Rendón C, Brewster F, González A, et al. Intoxicación moderada a severa por paraquat tratada con esteroides e inmunosupresores. Datos preliminares. Med Intern (Caracas). 2000; 16 (3). [ Links ]
21. Lugo NV, Maradei I, Ramírez M, Sosa M, Pascuzzo C. Uso de Trimetazidina en la intoxicación por paraquat en ratas. Act Cient Venez. 1999; 50 (2): 243. [ Links ]
22. Aular Y. Fernández Y. Landaeta G, Sutil R, Muñoz M, Oviedo R. Efecto de la asociación Vitamina C-Trimetazidina en la sobrevida de ratas intoxicadas por paraquat. Rev Toxicol. 2005; 22 (Suplemento 1) Exp 12. Edición en Internet. [ Links ]
23. E.A . Laboratory Animals. Recomendaciones para la Eutanasia de los animales de experimentación. (30), 1996. [ Links ]
24. García R. Coloraciones para fibras colágenas y elásticas del tejido conjuntivo. En García R. Manual de Laboratorio Clínico Diagnóstico. Anatomía patológica. España: McGraw-Hill; 2001: p. 181-183. [ Links ]
25. Flohé L, Günzlen W. Assay of glutatione peroxidase. En: Sidney, P; Colowik Kaplan. S/N. Methdos in Enzimology . New York: Academic Press 1972; (12): p.105-109. [ Links ]
26. Castelo E, Segovia J, Escudero J, Olmedilla B, Granado F, Blas C, et al. Daño por isquemia – reperfusion durante el transplante cardiaco experimental. Evaluación del papel citoprotector de la trimetazidina. Rev Esp Cardiol. 2005; 58 (8): 941-950. [ Links ]
27. Sierra M, Guzman-Grenfell A, Olivares I, Torres Y, Hicks J. Participación de las especies reactivas del oxigeno en las enfermedades pulmonares. Rev Inst nal Enf Resp Mex. 2004; 17 (2): 135-148. [ Links ]
28. Wong O, Fing HT, Kam CW. Cases series of paraquat poisoning in Tuen Mun Hospital Hong Kong. J Emerg Med. 2006; 13 (3): 155-160. [ Links ]
29. Candan F, Alagozlu H. Captopril inhibits the pulmonary toxicity of paraquat in rats. Hum Exp Toxicol. 2001;20(12):637- 641. [ Links ]
30. Choi TH, Jo KH, Oh DR, Kim SK. Effect N-acetylcysteine AC and methylprednisolone on lung injury. J Korean Soc Emerg Med. 2001; 12(3):214-221. [ Links ]
31. Sánchez C. Alteraciones oxidativas en el pulmón. Act Med Colombiana. 2001; 26 (6): 193-199. [ Links ]
32. Tikhaze AK, Lankin VZ, Zharova EA, Kolycheva SV. Trimetazidine as indirect antioxidant. Bull Exp Biol Med. 2000; 130 (10): 951-953. [ Links ]
33. Lin JL, Lin-Tan DT, Chen KH, Hnang WH. Repeated pulse of methylprednisolone and cyclophosphamide with continous dexametasone therapy for patients with severe Paraquat poisoning. Crit Care Med. 2006; 34(2):368-373. [ Links ]












 uBio
uBio