Revista del Instituto Nacional de Higiene Rafael Rangel
versión impresa ISSN 0798-0477
INHRR v.40 n.1 Caracas ene. 2009
Influencia de la radiación gamma como método de esterilización sobre el polímero poli VPAVG (Valina-Prolina-Alanina-Valina- Glicina).
Influence of gamma radiation as a sterilization method on polymer poli VPAVG (Valine- Proline- Alanine-Valine-Glicine)
Adriana C Rincón A1, Rocío Herrero V2, José Rodríguez C3, Matilde Alonso4, Irene Molina M2
1 Dpto. Farmacia Galénica, Facultad de Farmacia y Bioanálisis, Universidad de Los Andes, Mérida - Venezuela. Teléfonos: (0274) 2403535. adrianar@ula.ve.
2 Dpto. Farmacia y Tecnología Farmacéutica, Facultad de Farmacia, Universidad Complutense de Madrid, Madrid - España. rociohv@farm.ucm.es.
3 Dpto. Física de la Materia Condensada, E.T.S.I.I., Universidad de Valladolid, Valladolid-España.
4 Dpto. Química Analítica, E.U.P., Universidad de Valladolid, Valladolid-España.
RESUMEN
El polímero poli (VPAVG) pertenece a la familia de materiales bioelásticos derivados de la elastina y ha demostrado poseer cualidades óptimas para la formación de sistemas de cesión controlada, así como una biocompatibilidad aceptable en determinados tejidos. Las formulaciones preparadas a partir del biomaterial deben ser estériles, si se pretende administrar por una vía que implique ruptura de barreras biológicas. Por lo anterior, resulta esencial conocer el comportamiento del polímero y sus formulaciones frente al proceso de esterilización empleado. El objetivo de este trabajo fue, por tanto, evaluar la influencia de la radiación gamma como método de esterilización sobre las ca - racterísticas físicas del poli (VPAVG) y de las partículas for - madas con éste. En cuanto al polímero, no se apreciaron diferencias en su apariencia física antes y después de la esterilización. Sin embargo, las partículas obtenidas a partir del poli (VPAVG) y posteriormente esterilizadas experimentaban cambios en su morfología. En cuanto al tamaño de las partículas, se determinó que las obtenidas con polímero esterilizado presentaban cierta tendencia a formar agregados de menor tamaño que los encontrados con el polímero sin esterilizar. Se concluyó que el biomaterial ensayado y las formulaciones eran susceptibles a las radiaciones gamma como método de esterilización final, proponiéndose recurrir a otro tratamiento que garantice su esterilidad final.
Palabras clave: Método de esterilización, polímero poli VPAVG (valina-prolina-alanina-valina-glicina), radiación gamma, valina, prolina, alanina, glicina, materiales bioelásticos.
ABSTRACT
The poli polymer (VPAVG) belongs to the family of bioelastic materials derived from elastin, and it has showed the best qualities for the creation of systems of controlled cession, as well as an acceptable biocompatibility in certain tissues. If any preparation made from this biomaterial has to be administered in any way that implies the rupture of biological barriers, the preparation must be sterile. By this means, it is essential to know the behaviour of this polymer and its formulations, facing the sterilization process being used. The objective of this research was learn the influence of gamma radiation as a sterilization method over the physical characteristics of poli (VPAVG) and the particles formed by it. As the polymer, we did not observe any differences in physical appearance before and after sterilization. Particles formed by the polymer (VPAVG) and sterilized after, experimented changes in their morphology. As the size of the particles, we observed that those obtained with the sterilized polymer showed a tendency to form smaller aggregates than those found with the non-sterilized polymer. We concluded that the essayed biomaterial and its formulations were susceptible to gamma radiations as final sterilization method, proposing to use another treatment to guarantee the final sterile condition.
Key words: Sterilization Method, Polymer Poli (VPAVG) (Valine-Proline-Alanine-Valine-Glicine), Gamma Radiation, Valine, Pro line, Alanine, Glicine, Bioelastic Materials.
Recibido: 16 de octubre de 2007 / Aprobado: 26 de mayo de 2008
INTRODUCCIÓN
La elastina es la proteína extracelular responsable de la elasticidad de diversos tejidos, debido a su capacidad de extenderse y contraerse1. Posee una estruc tura prima ria caracterizada por la secuencia repetitiva de aminoácidos (Aa), entre los que se incluyen valina-pro linaglicina- valina-glicina (VPGVG), alanina-prolina-glicinavalina- glicina-valina (APGVGV), valina-prolina– glicina– fenilalanina – glicina– valina– glicina– alanina–glicina (VPGFGVGAG) y valina-prolina-glicina-glicina (VPGG)2,3, siendo la secuencia más frecuente la correspondiente al pentapéptido VPGVG, que puede repetirse hasta cincuenta veces en una simple molécula4.
La capacidad de esta proteína de autoagregarse, junto con las magnificas propiedades físicas y mecánicas que presenta, han permitido la búsqueda y el desa rrollo de materiales bioelásticos basados en la elastina1. En virtud de ello surgen materiales que constituyen familias de copolímeros proteicos sintéticos, basados en los modelos de las propiedades estructurales de las proteínas5. Estos polímeros sintéticos son susceptibles de responder a determinados estímulos y han sido diseñados para modular su respuesta de tal forma que sufran disolución o agregación en función de las condiciones del entorno. Inicialmente se les denomino sensibles a estímulos, pero pronto se utilizó el términó inteligentes con el fin de equipararlos en propiedades con su equivalente natural que les había servido de inspiración6.
POLÍMEROS SEMEJANTES A LA ELASTINA: POLI (VPAVG)
Los polímeros derivados de la elastina (ELPs) se caracterizan por estar constituidos de secuencias repetidas de monómeros integrantes de ésta, que son consideradas bloques de construcción debido a su sor prendente repetición, con poca o ninguna variación2. Urry y sus colaboradores han sido los pioneros en la síntesis y aplicación de este nuevo grupo de polímeros, que se caracterizan por presentar la llamada temperatura inversa de transición (Tti)7. En virtud de esta propiedad, cuando el polímero se encuentra en presencia de agua y a una temperatura por debajo de la temperatura crítica (temperatura de transición Tti), sus cadenas permanecen desordenadas o relativamente extendidas,
es decir completamente hidratadas8. De hecho, se considera que por debajo de la Tti, el polímero es soluble en medio acuoso. Por el contrario, cuando el polímero se encuentra expuesto a temperaturas superiores a la Tti , sus cadenas hidrofóbicas se pliegan y se agregan mediante un proceso de ordenación intramolecular, por el que adoptan una estructura secundaria helicoidal ordenada, denominada hélice β, seguida de un proceso de autoorganización intermolecular7.
En esta contracción dirigida por el aumento de la temperatura del entorno, el material es capaz de realizar un trabajo mecánico, que puede ser aprovechado cuando el sistema está adecuadamente diseñado. Por lo tanto, esta captación de agua podría ser aprovechada para incluir fármacos en solución, antes del proceso de autoagregación.
La naturaleza de los agregados resultantes puede variar, desde discretas nanopartículas hasta fibras poliméricas, en función de la arquitectura del copolímero10. En virtud de lo anterior, es importante resaltar que la adecuada sustitución de los monómeros de aminoácidos, por otros naturales o modificados, puede ser utilizada para magnificar la respuesta natural de esta familia de polímeros, obteniéndose así un mejor aprovechamiento de esta propiedad11.
Hasta el momento se han sintetizado una gran variedad de polímeros de este tipo, sin embargo, el más representativo de esta familia lo constituye el poli (VPGVG) [valina-prolina-glicina-valina-glicina], propuesto por Urry12 como material cabeza de serie para explicar sus propiedades elásticas13,14. Además, estos polímeros presentan importantes características termorreversibles15,16, y un gran potencial para convertir energía térmi ca en provechoso trabajo mecánico17. Estos pentapéptidos se caracterizan también por ser solubles en agua en todas las proporciones por debajo de su temperatura de transición y cuando son expuestos a la radiación g (dosis de 20 Mrad)18, las cadenas se en trecruzan y tiene lugar la formación de una matriz elas tómera, que exhibe propiedades mecánicas muy semejantes a las de la propia elastina natural19.
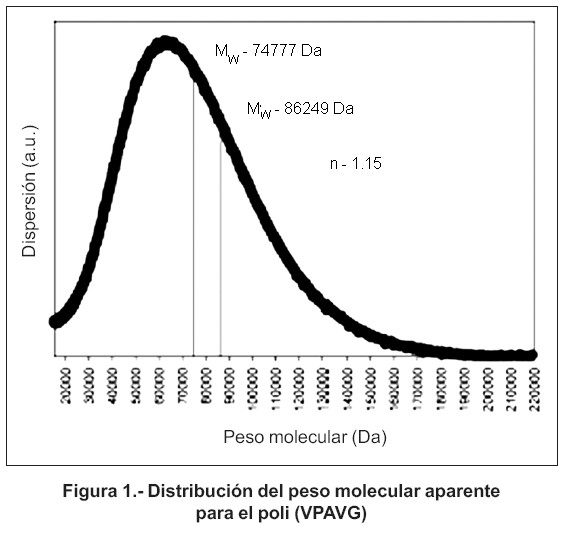
Dentro de esta familia de polímeros se encuentra el polímero utilizado en esta investigación, denominado poli (VPAVG) (valina - prolina – alanina - valina – glicina). La diferencia con respecto al monómero cabeza de serie [poli (VPGVG)] estriba en la sustitución del tercer aminoácido del pentapéptido por alanina. Esta sustitución de glicina por alanina no modifica las propiedades termomecánicas y de biocompatibilidad, que caracterizan a esta familia. El poli (VPAVG) es un polipéptido que puede ser considerado predominantemente hidrofóbico, debido a las características que presentan sus aminoácidos constituyentes, principalmente la valina y la prolina20. Además, resulta de gran importancia destacar que, en estudios realizados acerca de la sustitución de la alanina (A) por la glicina (G) en la tercera posición de la secuencia peptídica, se observa una variación en la respuesta mecánica del material, que va desde un comportamiento elástico a una deformación plástica. La síntesis del polímero poli (VPAVG) utilizado en el desarrollo de este trabajo, ha sido química. Su caracterización se ha rea lizado mediante resonancia magnética nuclear (RMN), análisis de aminoácidos y métodos cromatográficos. Presenta un peso molecular (Mw) de 86.249 Da y una polidispersión (n) de 1,15. La distribución del peso molecular aparente queda reflejada en la figura 121.
Con este material, al igual que con los derivados per tenecientes a esta familia de polímeros, se pueden construir sistemas sólidos, basándose en las propiedades termomecánicas que los caracterizan y anteriormente comentadas.
El método de preparación de las matrices o agregados, a partir de estos polímeros se lleva a cabo por enfriamiento (T°C < Tti) y posterior calentamiento (T°C > Tti) de soluciones acuosas del material. En efecto, mediante la adecuada elección de concentración del polímero, temperatura y tiempo, es posible obtener nano y micropartículas, que no son otra cosa que agregados de tamaños definidos9. Estos agregados formados tienen suficiente masa o volumen para ser separados del solvente por centrifugación22 y, debido a que el proceso de transición es reversible, el polímero puede ser completamente redisuelto, cuando la temperatura sea inferior a su temperatura de transición23.
Estas partículas o agregados también pueden ser cargadas con sustancia activa. Teóricamente, cualquier clase de fármaco puede ser incorporado en la matriz de los polímeros. En general, el peso molecular de los polímeros, el tamaño de las micro o nanopartículas obtenidas y las propiedades hidrofílicas o hidrofóbicas del fármaco, determinarán la velocidad y el período de liberación de éste, desde el sistema24.
Recientemente, este polímero ha sido caracterizado como formador de partículas de cesión controlada de fár macos7 y se ha comprobado su tolerancia in vitro e in vivo, por vía subcutánea e intraocular25, vías éstas que necesitan indispensablemente condición de esterilidad.
La esterilidad es un factor crítico para los sistemas de administración parenteral, prefiriéndose un proceso de esterilización final del producto, a la fabricación en condiciones asépticas26. La adecuada selección de un método de esterilización es fundamental para garantizar la estabilidad del producto. Hace algunos años aparecieron los primeros trabajos referentes a la utilización del método basado en la radiación ionizante con rayos gamma, para la esterilización de microesferas preparadas a partir de polímeros derivados del ácido láctico y glicólico destinadas a uso parenteral27. Los rayos gam ma tienen una alta capacidad de penetración y la dosis necesaria para lograr la esterilización se encuentra comprendida entre 25 y 40 kGy. Una gran cantidad de ma teriales son compatibles con la esterilización por radiaciones gamma, por lo que es ampliamente aceptado como método de esterilización para materiales poliméricos, dentro de los que se incluyen polietileno, poliestéres, poliestirenos, polisulfóxidos y policarbonatos28. Este tipo de esterilización es el método utilizado habitualmente para productos sanitarios termolábiles y el más idóneo para este tipo de formulaciones, principalmente, por su alto poder de penetración, baja reactividad química, bajos niveles de residuos, pequeños cambios de tem peratura en la muestra y las pocas variables a controlar. Sin embargo, se ha comprobado que en algunos polímeros, como los derivados de los ácidos láctico y glicólico, las dosis que garantizan la esterilidad de un producto farmacéutico (25 kGy, dosis de sobreesterilización descrita por la Farmacopea Española29 y la Farmacopea de Los Estados Unidos30) genera una disminución significativa de su peso molecular y, por tanto, afecta considerablemente las propiedades del producto final. Este problema parece haber sido solventado mediante la utilización de bajas temperaturas durante el tiem po de exposición de las formulaciones preparadas a partir del ácido poli (lácticocoglicólico) (PLAGA) a la radiación gamma, con resultados óptimos para formulaciones de microesferas de ganciclovir 31, aciclovir32 e ibuprofeno33.
No obstante, cada vez que este proceso de esterilización es aplicado a una nueva formulación, es necesario evaluar sus efectos, pues puede inducir cambios estructurales que modifiquen la cesión del principio activo y que supondrían un riesgo en su administración. A todo esto hay que añadir las propiedades físico-químicas de la sustancia activa que pueden ser alteradas también, tras ser expuestas a la radiación.
MATERIALES Y MÉTODOS
Materias primas utilizadas en la elaboración de las formulaciones
En el desarrollo de esta investigación se utilizó el biopolímero denominado poli (valproalavalgli) sintetizado en el Departamento de Física de la Materia Condensada de la Universidad de Valladolid por el Dr. J.C. Rodríguez Cabello y col.
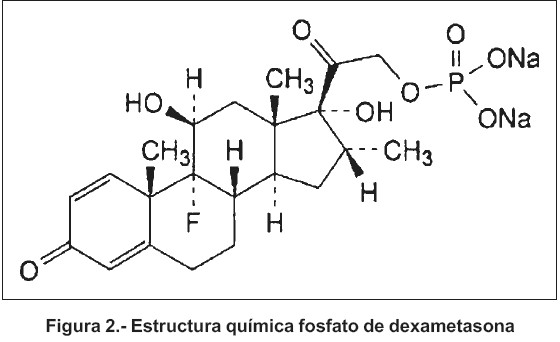
Como fármaco, aunque no incorporado en esta inves tigación dentro de las partículas, se empleó el Fosfato de Dexametasona (DMP) suministrado por Sigma- Aldrich (St. Louis, MO). La elección de esta sustancia activa se fundamentó en que ésta se encuentra presente en un gran número de formas farmacéuticas de uso parenteral y ha sido utilizada con este polímero en otros estudios7.
Entre las características más importantes a destacar del fosfato de dexametasona, se citan:
Fórmula estructural29
Fórmula empírica29 : C22H28 FNa2O8P
Peso molecular29: 516,4
Descripción:
Polvo blanco o casi blanco, muy higroscópico, fácilmente soluble en agua, poco soluble en alcohol, prácticamente insoluble en cloroformo y en éter29.
Para la preparación de las formulaciones y la cuantificación de la sustancia activa, se utilizaron los siguientes disolventes: agua destilada y desionizada ultrapura (milli Q), solución acuosa de buffer fosfato, solución acuosa de 0,01 M de KH2PO4 y metanol grado HPLC.
Técnica de preparación de partículas o agregados
La formación de las partículas se realizó mediante la precipitación del polímero en solución acuosa. En primer lugar, se pesaron cantidades determinadas de polímero con el fin de conseguir distintas concentraciones. Posteriormente, se llevó a cabo la adición de un volumen de 0,5 ml. de disolvente (solución buffer fosfato). La dispersión obtenida se introdujo en la nevera a 4 °C y se mantuvo durante 1 hora. Una vez disuelto el polímero, se introdujo la muestra en un baño termostatizado con agitación (Clifton Shaking Bath) a 37 °C, es decir, a una temperatura superior a la de transición del polímero (Tti= 30°C), manteniéndose en agitación durante 10 minutos. La separación de las partículas obtenidas se llevó a cabo por centrifugación (18,000 xg durante 45 minutos a 33 °C) en centrífuga Hettich zentrifugen (EBA 12R, Alemania). Una vez separadas, éstas se almacenaron protegidas de la luz en un desecador con sílica gel, y, a vacío y temperatura ambiente, hasta su posterior evaluación7
En el siguiente esquema (1) se recoge el proceso de elaboración de las partículas.
Esterilización y caracterización de las materias primas y formulaciones seleccionadas
El aseguramiento de la esterilidad en las formulaciones, así como la determinación de la influencia del proceso sobre sus características, constituyó el principal objetivo de este estudio. Se prefirió llevar a cabo la esterilización final de la formulación, pues supone mayores ga rantías que el trabajar en condiciones asépticas. En tre los métodos empleados para la esterilización de preparados farmacéuticos se ha elegido la radiación gamma, también utilizada, habitualmente, en la esterilización de productos sanitarios27 y polímeros29. Los criterios utilizados para su selección fueron evitar tanto el uso de temperaturas elevadas que pudieran dañar la estruc tura del material, como los posibles residuos derivados de la ex posición al óxido de etileno. También, este método presenta ventajas importantes como son: alto poder de penetración, baja reactividad química, bajos niveles de residuos, pequeños cambios de temperatura en la muestra y pocas variables a controlar.
Para realizar el proceso se acondicionaron las muestras, previamente pesadas, en viales de vidrio que fueron sellados con tapón de goma y cápsula de aluminio. En estas condiciones las muestras se enviaron a la Unidad de Esterilización por Rayos Gamma (Aragogamma, S.A., Barcelona), donde se sometieron a radiación gamma generada por fuentes de isótopos radioactivos de Cobalto-60, empleando una dosis de radiación de 2,5 Mrad (25 kGy), descrita por la Farmacopea Americana (USP) como dosis de esterilización efectiva30.
Este proceso de esterilización se realizó sobre muestras de polímero, fosfato de dexametasona y formulaciones seleccionadas de concentraciones de 20 y 30 mg/ml de polímero poli (VPAVG).
Polímero poli (VPAVG)
Una vez esterilizadas las muestras se llevaron a cabo distintos ensayos, tales como morfología y análisis de rayos X. Las técnicas y las condiciones aplicadas para la evaluación se describen más adelante.
Fosfato de dexametasona
El fosfato de dexametasona fue evaluado por medio de cromatografía líquida de alta resolución (HPLC) antes y después de la esterilización, con el fin de determinar su posible degradación tras la radiación gamma.
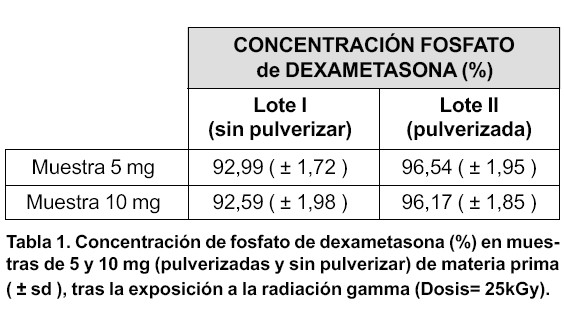
Con el objeto de conseguir similitud en el tamaño de partículas para el fosfato de dexametasona como material sólido pulvurulento y como posible principio activo incorporado en las micropartículas7, se sometieron a esterilización dos muestras diferentes de fármaco en estado sólido: materia prima sin pulverizar y pulverizada. Se dividieron las muestras a ensayar en dos lotes. El lote I estuvo formado por muestras de 5 y 10 mg de fosfato de dexametasona sin pulverizar, mientras que el lote II lo constituían muestras de igual cantidad (5 y 10 mg), pero pulverizadas.
Una vez esterilizadas las muestras se procedio a su disolucion con fase movil hasta obtener una concentracion final de 100 g/ml. A continuacion se cuantifico el contenido de fosfato de dexametasona bajo las condiciones cromatograficas que se resenan a continuacion:
Equipo: Cromatografo Gilson, detector Gilson UV/ visible 118, bomba Gilson 305. Columna: Lichrospher 100 teknokroma, RP 18, 25 cm x 4 mm, relleno 5 mm. Fa se movil: KH2PO4 0,01 M : Metanol (50:50). Flujo: 1 ml/min. l : 254nm. Volumen de inyeccion: 20 ml. Temperatura: ambiente.
Formulaciones seleccionadas
Las formulaciones seleccionadas fueron aquellas preparadas a partir de concentraciones iniciales de polímero poli (VPAVG) de 20 y 30 mg/ml, con las siguientes características:
– Obtenidas a partir del material estéril
– Resultantes del polímero sin esterilizar y posteriormente esterilizadas.
Finalmente fueron objeto de los correspondientes ensayos de caracterización de las partículas, que se describen a continuación.
Técnicas utilizadas para la caracterización de las materias primas y partículas obtenidas
Microscopia electrónica (morfología)
La morfología del biomaterial y de las formulaciones se determinó por microscopia óptica y electrónica de barrido. Para la observación por microscopia óptica se utilizo un microscopio óptico (zeiss, modelo polarización), y se empleó luz polarizada paralela y nicoles cruzados. La evaluación por microscopia electrónica se realizó a través de un microscopio electrónico de barrido (SEM, Jeol, JSM-6400, Tokio, Japón) y se llevó a cabo en el C.A.I. Centro de Microscopia Electrónica Luis Bru, de la Universidad Complutense de Madrid.
Antes de cada ensayo, la muestra se recubrió previamente con una fina película de oro en un evaporador catódico (Polaron, Alemania).
Análisis de difracción de rayos X
El ensayo de difracción de rayos X ha sido utilizado por diversos autores para la caracterización del polímero poli (VPGVG) y de otros péptidos derivados39.
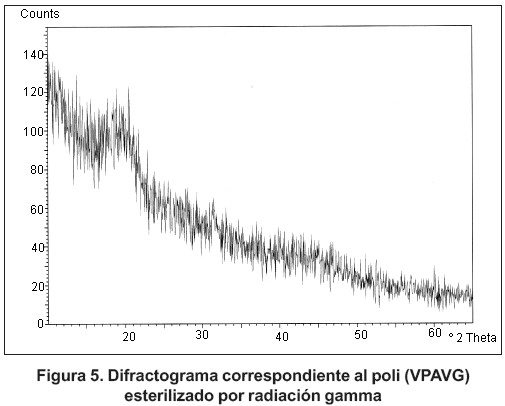
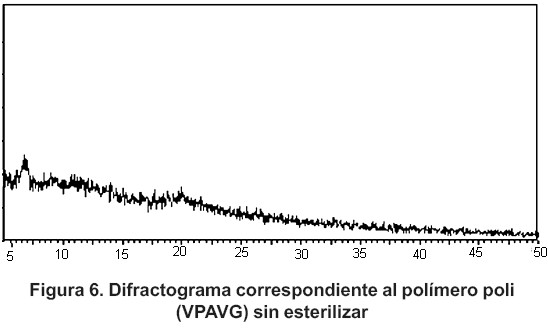
Los análisis de difracción de rayos X se han llevado a cabo utilizando un diafráctometro automático de polvo (Philips X Pert MPD), en configuración q - 2q, en el rango angular 5 – 40° 2q, tamaño de paso 0,04° 2q y tiempos de conteo de 1 segundo por paso. Este ensayo se realizó en el C.A.I. Difracción de Rayos X, de la Uni versidad Complutense de Madrid.
En estas condiciones se ensayó el polímero poli (VPAVG) antes y después del proceso de esterilización.
Tamaño de las partículas
La evaluación del tamaño de las partículas se llevó a cabo por espectroscopía de correlación fotónica, mediante un equipo Nanosizer N4 (Coulter, Francia), que mide las variaciones que experimenta la intensidad de la radiación dispersada por una suspensión de par tículas, cuando se le hace incidir un haz de luz monocromático procedente de un láser. Para la determinación del tamaño de las partículas se prepararon las diferentes muestras de acuerdo con la técnica anteriormente descrita, con la única excepción de mantener las partículas en suspensión sin proceder a su centrifugación. En todos los ensayos y previamente a la lectura de las muestras, éstas fueron sometidas a agitación, en un agitador vortex, durante 1 minuto. Se evaluó el tamaño de los agregados formados a partir de diferentes concentraciones acuosas (20 y 30 mg/ml) de polímero estéril y sin esterilizar.
Este ensayo se llevó a cabo en el Departamento de Farmacia y Tecnología Farmacéutica de la Universidad de Alcalá de Henares.
Valoración del fosfato de dexametasona
Técnica de cromatografía líquida de alta resolución (HPLC)
Para estudiar la posible degradacion del fosfato de dexametasona durante el proceso de esterilizacion, se ha puesto a punto el metodo de valoracion por HPLC descrito por Das Gupta35.
Las condiciones de trabajo han sido descritas anteriormente. Esta tecnica se valido de acuerdo con los criterios de linealidad, exactitud y precision, en el intervalo de concentraciones de 50 a 200 mg/ml de fosfato de dexametasona en fase movil.
RESULTADOS Y DISCUSIóN
Polímero poli (VPAVG)
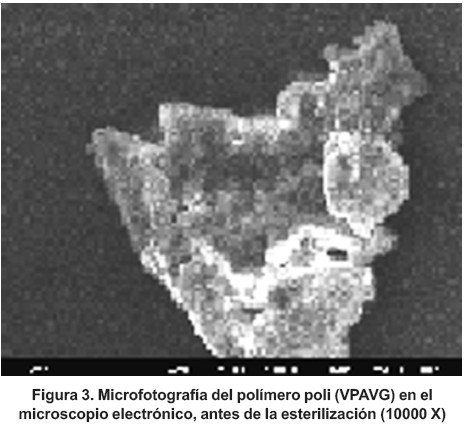
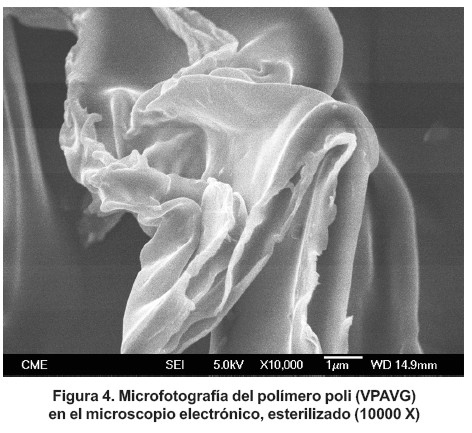
Las características morfológicas del poli (VPAVG) fueron evaluadas, por microscopia electrónica, antes (figura 3) y después (figura 4) de haber sido sometido al proceso de esterilización. En la microfotografía, el material se presenta como un material amorfo. Como puede observarse en la figura 3, no se aprecian diferencias con las obtenidas para el polímero después de la esterilización (figura 4).
El análisis de difracción de rayos X para el polímero expuesto a las condiciones de esterilización (figura 5) refleja un comportamiento amorfo, igual que el observado en las muestras del polímero sin esterilizar (figura 6).
Fosfato de dexametasona como materia prima, tras la esterilización
El efecto directo de la radiación gamma sobre el posible principio activo (fosfato de dexametasona), también fue evaluado. Los resultados obtenidos se recogen en la tabla 1, donde se observa cómo, en todos los casos, la concentración de sustancia activa experimenta un descenso significativo (p < 0,046).
Asimismo, aunque no se encontraron diferencias entre las muestras esterilizadas con distinta cantidad de materia prima (p > 0,40), la degradación observada resultó ser significativamente superior para el fármaco sin pulverizar (p <0,042). Esta diferencia entre ambos lo tes puede atribuirse a la formación de aglomerados en el lote pulverizado, lo que disminuiría la superficie de exposición del fármaco. La influencia entre la superficie de producto expuesta y el efecto de la radiación ha sido ya descrita por otros autores en microesferas de ácido poli (lácticocoglicólico) sometidas a la misma dosis de radiación empleada en este trabajo36.
Formulaciones seleccionadas
Aunque se continúan ensayando métodos de obtención biotecnológica de polímeros bioelásticos, la síntesis del poli (VPAVG) empleada en este trabajo ha sido química, con una fase final de exposición a la radiación gamma.
El período empleado para la obtención de cada lote ha sido de seis meses, por lo que las cantidades suministradas para llevar a cabo nuestro estudio han sido bastante limitadas. Estos hechos nos han impedido utilizar un diseño experimental que nos habría permitido seleccionar una formulación óptima. Por esta razón,y en función de los resultados obtenidos en estudios preeliminares, las preparaciones elegidas para el estudio de esterilización fueron las obtenidas a partir de una concentración inicial de 20 y 30 mg/ml de poli (VPAVG) sin esterilizar y esterilizado.
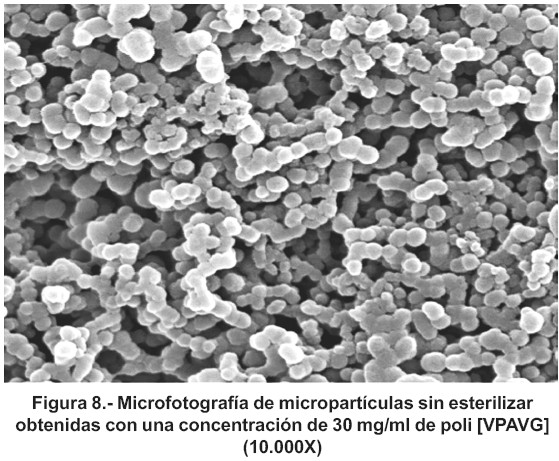
Las micropartículas elaboradas con estas concentraciones y posteriormente esterilizadas por radiación gamma, fueron evaluadas al microscopio electrónico de barrido. A modo de ejemplo se presenta la microfotografía obtenida para la formulación de 30 mg/ml de poli (VPAVG) [figura 7].
En ambos casos (20 y 30 mg/ml) la morfología de los agregados fue diferente a la obtenida antes del proceso (figura 8). La diferencia estriba principalmente en su distribución, pues cuando son sometidas las partículas al proceso de esterilización, aparecen como una masa continua que, probablemente, es consecuencia de una fusión de las mismas producida por el aumento de temperatura durante el proceso de esterilización ya que, a diferencia de otros estudios, éste se realizó sin proteger las muestras de la temperatura. Este fenómeno ya ha sido descrito anteriormente para micropartículas preparadas a partir del ácido (lácticocoglicólico)36. Además, no hay que olvidar que la radiación puede formar entrecruzamiento y modificar las características del material, que alterarían, de igual modo, la morfología de las partículas.
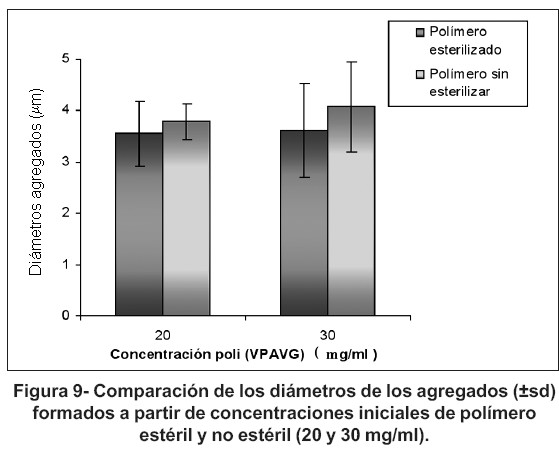
Para el estudio del tamaño de los agregados formados a partir del polímero esterilizado se han utilizado soluciones acuosas de 20 y 30 mg/ml de concentración. Aunque se manifiesta cierta tendencia a la formación de agregados de menor tamaño que los encontrados con el polímero sin esterilizar (figura 9), esta disminución no resulta estadísticamente significativa en ninguno de los dos casos estudiados (p = 0,342 y p = 0,334, respectivamente). No obstante, no se puede descartar que la radiación gamma utilizada en el proceso de esterilización produzca alguna alteración del polímero, ya que además, se ha detectado en los agregados obtenidos del polímero esterilizado cierta predisposición a formar, con el tiempo, restos floculados (reversibles) de mayor tamaño.
CONCLUSIONES
1. El poli (VPAVG), al ser esterilizado con radiación gamma continúa mostrándose en el análisis de rayos X, como una sustancia amorfa; no obstante en las partículas obtenidas con este polímero estéril y aquellas que aun siendo elaboradas con polímero sin esterilizar pero que fueron esterilizadas posteriormente, presentaron importantes diferencias morfológicas con respecto a las obtenidas de polímero sin esterilizar y exentas de cualquier proceso de esterilización final.
2. Con respecto al tamaño de las partículas obtenidas con el polímero estéril y sin esterilizar, no se detectaron diferencias significativas entre ellas; sin embargo se observó que en los agregados obtenidos del polímero esterilizado existía cierta predisposición a formar, con el tiempo, restos floculados (reversibles) de mayor tamaño, por lo que no se descarta la presencia de alguna alteración en el polímero debido a la radiación gamma.
3. El fosfato de dexametasona es degradado por la radiación gamma empleada a dosis de sobreesterilización.
4. Tanto el biomaterial como las partículas ya formadas son susceptibles a la radiación gamma como método de esterilización. Por tanto, se debe acudir a otro método que garantice su esterilidad final.
5. Se propone la realización de ensayos más específicos sobre el polímero poli (VPAVG) con el fin de demostrar la evidente alteración de éste ante el método de esterilización utilizado.
REFERENCIAS BIBLIOGRÁFICAS
1. Bellingham C, Keeley FW. Self-oredered polymerization of elastin-based biomaterials. Current opinion in solid state and materials science, 2004; 8: 135-139. [ Links ]
2. Sandberg LB, Leslie JG, Leach CT, Álvarez VL, Torres AR, Smith DW. Elastin covalent structure as determined by solid phase amino acid sequencing. Pathol Biol; 1985; 33(4): 266-276. [ Links ]
3. Yeh H, Ornstein-Goldstein N, Indik z, Sheppard P, Anderson N, Rosenbloom JC, Cicila G, Yoon KG, Rosenbloom J. Sequence variation of bovine elastin messenger –RNA due to alternative splicing. Collagen Relat Res; 1987; 7: 235-247. [ Links ]
4. Reiersen H, Clarke AR, Rees AR. Short elastin-like peptides exhibit the same temperature-induced structural transitions as elastin polymers: implications for protein en gineering. J Mol Bio; 1998; 283: 255-264. [ Links ]
5. Tamburro AM, Guantieri V, Scopa A, Drabble JM. Polypeptide models of elastin: CD and NMR studies on synthetic poly (X-Gly-Gly). Chirality; 1991; 3: 318-323. [ Links ]
6. Rodríguez Cabello JC. Los polímeros de bioingeniería molecular: nuevos polímeros inteligentes y bioactivos. Archivos de la Sociedad Española de Oftalmología. 2001; 5. [ Links ]
7. Herrero-Vanrell R, Rincón AC, Alonso M, Reboto V, Molina-Martínez IT, Rodríguez-Cabello JC. Self-assembled particles of an elastin-like polymer as vehicles for controlled drug release. Journal of Controlled Release, 2005; 102: 113-122. [ Links ]
8. Urry DW. Molecular machines: how motion and other functions of living organism can result from reversible chemical changes. Angew Chem Int Ed Engl; 1993; 32: 819-841. [ Links ]
9. Urry DW. Bioelastic materials as chemomechanically transducing (smart) matrices for drug delivery. En: Gebelein CG et al, editores. Cosmetic and pharmaceutical applications of polymers. New York: Plenum Press; 1991. [ Links ]
10. Wright ER, Conticello VP. Self-assembly of block copolymers derived from elastin-mimetic polypeptide sequences. Adv Drug Delivery Reviews; 2002; 54 (8): 1057-1073. [ Links ]
11. Rodríguez-Cabello JC, Alonso M, Guiscardo L, Reboto V, Girotti A. Amplified photoresponse of a p-phenylazobenzene derivative of an elastin-like polymer by a-cyclodextrin: the amplified Δtt mechanism. Adv Mater; 2002; 14(16): 1151-1154. [ Links ]
12. Goodman M, Arad O. Depsipeptide analogues of elastin re peating sequences: conformational analysis. Bio polymers; 1990; 29: 1651-1668. [ Links ]
13. Urry DW. Entropic elastomeric force in protein structure function. Int J Quant Chem Quant Biol Symp; 1987; 14: 261-280. [ Links ]
14. Urry DW. Free energy (chemomecanical) transduction in elastomeric polypeptides by chemical potential modulation of an inverse temperature transition. Int J Quant Chem Quant Biol Symp; 1988; 15: 235 -245. [ Links ]
15. Urry DW, Harris DR, Long MM, Prasad K. Polyte tra peptide of elastin: Temperature-correlated elastomeric force and structure development. Int J Peptide Protein Res; 1986; 28: 649-660. [ Links ]
16. Tamburro AM, Guantieri V, Gordini DD. Synthesis and structural studies of a pentapeptide sequence of elastin: Poly (Val-Gly-Gly-Leu-Gly). Journal of Biomolecular Structure and Dynamics. 1992; 10(3): 441-454. [ Links ]
17. Kurkova D, Kriz J, Schmidt P, Dybal J, Rodríguez-Cabello JC, Alonso M. Structure and dynamics of two elastin-like po lypentapeptides studied by NMR spectroscopy. Biomacromolecules, 2003; 4: 589-601. [ Links ]
18. Urry DW, Haynes B, zhang H, Harris RD, Prasad KU. Mechanochemical coupling in synthetic polypeptides by modulation of an inverse temperature transition. Proc Natl Acad Sci Biophysics; 1988; 85: 3407-3411. [ Links ]
19. Urry DW, Okamoto K, Harris RD, Hendrix CF, Long MM. Biochemistry, 1976; 15: 4083-4089. [ Links ]
20. Hong M, Isailovic D, Mc Millan RA, Conticello VP. Structure of an elastin-mimetic polypeptide by solid-state NMR chemical shift analysis. Biopolymers, 2003; 70: 158-168. [ Links ]
21. Reguera J, Lagarón JM, Alonso M, Reboto V, Calvo B, Rodríguez-Cabello JC. Termal behavior and kinetic analy sis of the chain unfolding and refolding and of the concomitant nonpolar solvation and desolvation of two elas tin-like polymers. Macromolecules, 2003; 36: 8470- 8476. [ Links ]
22. Haider M, Megeed z, Ghandehari H. Genetically engineered polymers: status and prospects for controlled release. Journal of Controlled Release, 2004; 95: 1-26. [ Links ]
23. Urry DW. Physical chemistry of biological free energy transduction as demonstrated by elastic protein-based polymers. J. Phys. Chem. B; 1997; 101(51): 11007-11028. [ Links ]
24. Ogura Y. Biodegradable polymers for ophthalmic drug delivery. Archivos de la Sociedad Española de Oftal mología. 2001; 10. [ Links ]
25. Rincón AC, Molina Martínez IT, De las Heras B, Alonso M, Baílez C, Rodríguez-Cabello JC, Herrero-Vanrell R. Biocompatibility of elastin-like polymer poly (VPAVG) microparticles: In vitro and in vivo studies. J. Biomed. Mater. Res; Part A. 2006; 78(2): 343-351. [ Links ]
26. Herrero-Vanrell R, Refojo MF. Microesferas biodegradables para administración intraocular de fármacos. Archivos de la Sociedad Española de Oftalmología, 2001; 76(4): 203-4. [ Links ]
27. Sintzel MB, Merkli A, Tabatabay C, Gurny R. Influence of irradiation sterilization on polymers used a drud carriersa review. Drug Dev. Ind. Pharm; 1997; 23: 857-879. [ Links ]
28. Davis JR (editor). Hanbook of Materials for Medical Devices. ASM International; 2003. [ Links ]
29. Real Farmacopea Española. 2° edición. Ministerio de Sanidad y Consumo. Madrid; 2002. p 450. [ Links ]
30. United States Pharmacopeia 26- National formulary 21. The United States Pharmacopeial Convention, Inc. Rockville, MD. 2003. p 2436. [ Links ]
31. Herrero-Vanrell R, Ramírez L, Fernández-Carbadillo A, Refojo MF. Biodegradable PLGA microspheres loaded with ganciclovir for intraocular administration: Encapsulation technique, in vitro release profiles and sterelization process. Pharm Research; 2000; 17(10): 1323-1328. [ Links ]
32. Martínez-Sancho C, Herrero-Vanrell R, Negro S. Study of gamma irradiation effects on aciclovir poly (D-L-lactic-coglycolic) acid microspheres for intravitreal administration. Journal Controlled Release, 2004; 99: 41-52. [ Links ]
33. Fernández Carballido A, Herrero-Vanrell R, Molina-Martínez I, Pastoriza P. Sterilised ibuprofen loaded poly (D-L-lactic-co-glycolic) microspheres for intraarticular administration: Effect of l-irradiation and storage. Journal Microencapsulation, 2004; 21(6): 653-665. [ Links ]
34. Cook WJ, Einspahr H, Trapane TL, Urry DW, Bugg CE. J. Am. Chem. Soc; 1980; 102: 5502-5505. [ Links ]
35. Das Gupta V. Quantitative Dexamethasone and Dexame thasone Sodium Phosphate Determinations in Pharma ceu tical Dosage Forms by High Pressure Liquid Chormatography. Journal of Pharmaceutical Sciences, 1979; 68(7):926-28. [ Links ]
36. Montanari L, Constantini M, Ciranni Signoretti E, Valvo L, Bartolomei M, Fattibene P, Onori S, Faucitano A, Conti B, Genta I. Gamma irradiation effects on poly(DL-lactide-coglycolide) microspheres. J Controlled Release; 1998; 56: 219-229. [ Links ]












 uBio
uBio